がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
774)高用量メラトニン治療(その1):低酸素誘導因子-1(HIF-1)阻害作用
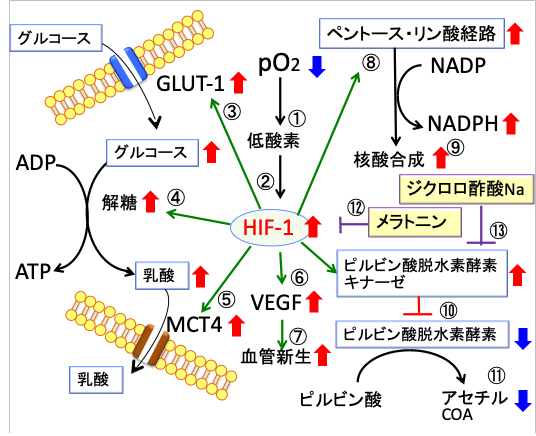
図:酸素分圧(pO2)が低下して低酸素になると(①)、低酸素誘導因子-1(HIF-1)の発現が亢進する(②)。HIF-1はグルコースを取り込むGLUT-1(③)と解糖系酵素(④)と乳酸を排出するMCT4(⑤)の発現を亢進し、細胞質での解糖系でのグルコース代謝を促進する。HIF-1は血管内皮細胞増殖因子(VEGF)の産生を増やし(⑥)、血管新生を亢進する(⑦)。HIF-1はペントース・リン酸経路を亢進し(⑧)、NADPHと核酸の合成を促進する(⑨)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進してピルビン酸脱水素酵素の活性を阻害し(⑩)、アセチルCoAの産生を低下させ、ミトコンドリアでの代謝を抑制する(⑪)。メラトニンはHIF-1の活性化を阻害する(⑫)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する(⑬)。その結果、メラトニンとジクロロ酢酸ナトリウムの併用はがん細胞のワールブルグ効果(好気的解糖)を抑制し、グルコース代謝を正常化する。
774)高用量メラトニン治療(その1):低酸素誘導因子-1(HIF-1)阻害作用
【がん細胞ではミトコンドリアでの酸素呼吸が低下している】
正常細胞とがん細胞ではエネルギー産生の状況に大きな違いがあります。正常細胞ではミトコンドリアで酸素を使って効率的にエネルギー(ATP)を産生しているのに対して、がん細胞では酸素が十分に存在する状況でもミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)は抑制され、細胞質における解糖系によるATP産生が亢進しています(下図)。

図:解糖系ではグルコース(ブドウ糖)1分子当たり2分子のATPが産生される(①)。ミトコンドリアで酸素を使った酸化的リン酸化ではグルコース1分子当たり32分子のATPが産生される(②)。がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸の産生が増えている(③)。取り込まれたグルコースは核酸や脂肪酸やアミノ酸の合成にも利用される(④)。がん細胞では、酸素が十分に利用できる状況でも、ピルビン酸からアセチルCoAへの変換が阻害され、ミトコンドリアでのTCA回路と酸化的リン酸化によるATP産生は低下している(⑤)。このようながん細胞の代謝の特徴をワールブルグ効果あるいは好気的解糖と言う。
このがん細胞における解糖系の亢進は90年以上前にドイツのオットー・ワールブルグ(Otto Warburg、1883年~1970年)により発見され、一般にワールブルグ効果と呼ばれています。酸素が存在する条件でも解糖系が亢進しているので、好気的解糖とも言います。
オットー・ワールブルグ博士のグループは1923年頃から、「がん組織では、ミトコンドリアでの酸化的リン酸化が低下し、酸素がある状態でも解糖系でのエネルギー産生が主体である」という現象について一連の論文を発表しています。
このワールブルグ効果は、様々なメカニズムで、がん細胞の増殖や生存に有利に働いています。
ワールブルグ博士自身は、ミトコンドリアにおける酸化的リン酸化の機能欠損が細胞のがん化の原因だと考えていました。しかし、その後の研究で、多くのがん細胞においてミトコンドリアの機能自体は障害されていないことが明らかになっています。
そこで、がん細胞が解糖系を好む理由とそのメカニズムの解明が、がん研究における重要なテーマになっています。様々ながん遺伝子の異常や活性化が、がん細胞のワールブルグ効果の成り立ちに関与していることが明らかになっています。
がん細胞のワールブルグ効果を成立させる最も重要な因子が低酸素誘導因子-1(HIF-1)だと考えられています。
ワールブルグ効果に中心的に関わっている低酸素誘導因子-1 (HIF-1)の活性阻害、グルコース取り込みの阻害、HIF-1を活性化するシグナル伝達系の阻害、HIF-1による遺伝子発現誘導の阻害などによってがん細胞のワールブルグ効果を阻害する治療法ががん治療法として有効であることが明らかになっています。
【低酸素になると低酸素誘導因子-1の発現が亢進する】
2019年のノーベル医学生理学賞は、「細胞の低酸素応答の仕組みの解明」に貢献した米英の3人の科学者が受賞しました。
低酸素は低酸素誘導因子-1(Hypoxia Inducible Factor-1: HIF-1)という転写因子を活性化します。このHIF-1は何百という遺伝子の発現を亢進し、細胞は低酸素に適応できるようになります。このHIF-1の発見とその活性化の機序を解明した功績です。
HIF-1は、がん治療の重要なターゲットとなっています。がん細胞の特徴的な代謝異常であるワールブルグ効果を根本で制御しているのがHIF-1だからです。がん細胞におけるHIF-1活性の阻害が、がん細胞の増殖抑制と細胞死誘導に有効であることが明らかになっています。
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。
酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase )と呼ばれる2つのタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。
HIFのαサブユニットにはHIF-1α、 -2α、 -3α、βサブユニットにはHIF-1β、-2β、-3βのそれぞれ3種類が知られていますが、低酸素誘導因子として中心になっているのはHIF-1αとHIF-1βであるため、HIF-1をHIFの同義語として使用しています。
HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリル・ヒドロキシラーゼにより水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。
VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
プロリル・ヒドロキシラーゼは酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリル・ヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。
安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮増殖因子(VEGF)、造血因子エリスロポイエチンなど多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(下図)。

図:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
HIF-1はグルコースを取り込むGLUT-1の発現を亢進し、解糖系酵素の発現を亢進します。一方、ピルビン酸脱水素酵素キナーゼの発現を亢進してピルビン酸脱水素酵素の活性を阻害し、ミトコンドリアの酸化的リン酸化を抑制します。つまり、HIF-1の活性亢進がワールブルグ効果を引き起こしていると言えます。

図:酸素分圧(pO2)が低下して低酸素になると(①)、低酸素誘導因子-1(HIF-1)の発現が亢進する(②)。HIF-1はグルコースを取り込むGLUT-1(③)と解糖系酵素(④)と乳酸を排出するMCT4(⑤)の発現を亢進する。HIF-1は血管内皮細胞増殖因子(VEGF)の産生を増やして血管新生を亢進する(⑥)。ペントース・リン酸経路を亢進し(⑦)、NADPHと核酸の合成を促進する(⑧)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進し(⑨)、ピルビン酸脱水素酵素の活性を阻害し、アセチルCoAの産生を低下させ、ミトコンドリアでの代謝を抑制する(⑩)。つまり、HIF-1は解糖系を亢進し、ミトコンドリアの酸化的リン酸化を抑制してワールブルグ効果を促進する。
【がん細胞では低酸素でなくてもHIF-1が恒常的に活性化している】
がん細胞の代謝の特徴は、酸素が十分に利用できる状況でも、酸素を使わない解糖系が亢進し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されていることです。つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。
このような代謝の特徴の根本的なメカニズムは、がん細胞では酸素濃度とは関係なく、恒常的にHIF-1が活性化しているためです。つまり、がん細胞では恒常的に低酸素シグナルがオンになっているということです。その理由は、がん細胞で活性化されているmTORやSTAT3がHIF-1の産生を促進するからです。
がん細胞の増殖シグナル伝達系であるPI-3キナーゼ/Akt/mTORC1シグナル伝達系においてmTORC1はHIF-1のタンパク質の産生(mRNAからタンパク質の翻訳)を促進します。また、増殖因子やサイトカインで活性化されるSTAT3という転写因子はHIF-1遺伝子の転写を亢進します。
mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1タンパク質の産生を増やします。
一方、STAT(signal transducer and activator of transcription;シグナル伝達兼転写活性化因子)は、様々な増殖因子やサイトカインを中心とする細胞外からの刺激によって活性化されたJAKなどのチロシンキナーゼによってリン酸化を受けると2量体を形成し、核内に移行してさまざまな遺伝子の発現を誘導します。
STAT転写ファミリーには7種類が存在しますが、特にSTAT3はほとんどすべての固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっています。
STAT3はHIF-1の遺伝子発現(転写)を促進することが知られています。つまり、がん細胞で活性が亢進しているmTORC1とSTAT3はHIF-1タンパク質の産生量を相乗的に高めることが報告されています(下図)。
HIF-1αタンパク質の発現量が増えても、HIF-1αの分解に関与するプロリル・ヒドロキシラーゼやVHL(von Hippel-Lindau)タンパク質が正常に働けばHIF-1の活性亢進を抑制できますが、がん細胞ではプロリル・ヒドロキシラーゼやVHLの発現低下や遺伝子変異によってHIF-1αの分解過程に異常を起こしていることも多いことが報告されています。

図:増殖刺激や遺伝子変異などによってがん細胞で恒常的に活性が亢進しているSTAT3(シグナル伝達兼転写活性化因子)はHIF-1遺伝子の転写(mRNAの産生)を促進し、mTORC1はリボソームの生合成を促進するS6Kを活性化してHIF-1タンパク質の合成を促進する。
急速に増大するがん組織の中で、がん細胞は常に低酸素と低栄養による細胞死の危険にさらされています。そこで、低酸素や低栄養による細胞死を起こさないようにするメカニズムとしてがん細胞はHIF-1活性を高めています。これは、HIF-1活性が亢進しているほど、がん細胞は低酸素や低栄養で生存できる(死ににくい)ということを意味しています。
HIF-1はピルビンン酸脱水素酵素キナーゼ(下図のPDK:ピルビン酸脱水素酵素を阻害する)の発現を促進してピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへの変換)の活性を低下させ、さらにピルビン酸から乳酸への嫌気性解糖系に働く乳酸脱水素酵素(LDH)の発現を促進する作用があります。
つまり、HIF-1はピルビン酸からアセチルCoAへの変換を阻害してTCA回路と酸化的リン酸化での代謝を抑制し、ピルビン酸から乳酸の変換を亢進します。さらに、HIF-1は腫瘍特異的なピルビン酸キナーゼ-M2の発現を促進し、解糖系の途中におけるグルコース代謝産物から核酸や脂肪酸やアミノ酸の合成を促進する作用(ペントースリン酸経路の亢進)もあります。
また、HIF-1はがん幹細胞の幹細胞として能力を維持させる作用、上皮-間葉移行や細胞接着因子の遺伝子発現を誘導する作用、VEGFを介する血管新生によりがん細胞の遠隔転移を促進する作用なども知られています。
つまり、HIF-1活性が亢進するとグルコースの取込みと解糖系とペントースリン酸経路が亢進し、ミトコンドリアでの酸化的リン酸化の活性が抑制され、さらに、血管新生が促進され、乳酸の産生が増えると免疫細胞が抑制され、結合組織の分解も促進されて転移や浸潤が起こりやすくなるので、HIF-1活性が高いがんほど予後が悪いと言えます。(下図)

図:低酸素誘導因子(HIF-1)によって発現誘導や活性亢進される因子を図中の黄色地で赤字で示している。HIF-1はグルコース・トランスポーター(GLUT)の量を増やしてグルコースの取込みを増やす。ヘキソキナーゼ(HK)の量を増やして解糖系を亢進しグルコース-6-リン酸脱水素酵素(G6PD)を増やしてペントース・リン酸経路を活性化する。乳酸脱水素酵素(LDH)の量を増やしてピルビン酸から乳酸への変換を促進し、ピルビン酸脱水素酵素キナーゼ(PDK)を誘導してピルビン酸脱水素酵素を阻害して、ピルビン酸からアセチルCoAへの変換を阻害してミトコンドリアでの酸化的リン酸化を抑制する。乳酸を細胞外に排出するモノカルボン酸トランスポーター-4(MCT4)や血管新生を促進する血管内皮細胞増殖因子(VEGF)の発現を誘導する作用もある。これらの作用によって、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化を抑制され、血管新生や免疫抑制や結合組織の分解などによって、増殖や浸潤や転移が促進される。
がん細胞でもミトコンドリアでの酸化的リン酸化は正常細胞と同じレベルくらいには起こっています。しかし、がん細胞に取り込まれたグルコースの多くは解糖系で代謝され、物質合成に必要な中間代謝産物を多く作り出しています。
ミトコンドリアの呼吸鎖での酸素を使ったATP産生は必然的に活性酸素の産生を増やします。酸化ストレスは、増殖や転移を抑制するので、がん細胞は増殖や転移を促進するために、ミトコンドリアでの呼吸を抑えていると考えられています。
HIF-1(低酸素誘導因子-1)は解糖系を亢進し、ミトコンドリアでの酸化的代謝を抑制するので、がん細胞の増殖や転移を促進するというメカニズムです。
したがって、HIF-1の発現や活性化を抑制する方法はがん治療に役立ちます。
【メラトニンは低酸素誘導因子-1の活性化を阻止する】
HIF-1α誘導性のVEGF発現誘導をメラトニンが阻害することが多くの研究で示されていますが、その分子メカニズムに関しては幾つかの説があります。
他の多くの抗酸化剤と異なり、メラトニンには脳や様々な末梢組織の細胞の細胞膜に受容体が存在します。すなわち、メラトニンには、受容体に依存性の作用と非依存性の作用が知られています。
メラトニンには受容体とは非依存性の機序で、腎臓がん細胞において、HIF-1αの分解を促進してタンパク量を減らし、血管新生阻害作用を示すことが報告されています。
このHIF-1αとVEGFの発現を抑制するメラトニンの作用は、主に受容体非依存性の抗酸化作用が関連しています。抗酸化作用によって、メラトニンはHIF-1αたんぱく質の分解を促進します。
メラトニンはフリーラジカルを消去することによって、活性酸素によるPHD酵素の不活性化(PHD酵素の二価鉄イオンを酸化することによって)を阻止し、HIF-1αの分解を亢進してHIF-1αの量を減らします。すなわち、メラトニンはHIF-1αのmRNA量には影響せず、HIF-1αの核への移行を阻止し、HIF-1αとそのco-activatorであるCBPとp300の相互作用を阻害します。
VEGF遺伝子のプロモーター領域のHREにおいて、HIF-1αとコアクチベーターの結合を阻害する作用も知られています。
メラトニンには免疫増強作用やがん細胞の直接的な抑制作用がありますが、がん細胞のHIF-1αの分解を促進してワールブルグ効果と血管新生を阻害する効果もメラトニンの抗腫瘍効果のメカニズムとして重要です。
内皮増殖因子(VEGF)の産生を抑制して血管新生を阻害する可能性も指摘されています。以下のような論文があります。
Melatonin as an angiogenesis inhibitor to combat cancer: Mechanistic evidence.(がんと戦うための血管新生阻害剤としてのメラトニン:メカニズム的証拠)Toxicol Appl Pharmacol. 2017 Nov 15;335:56-63.
【要旨】
松果体から産生されるインドラミンであるメラトニンは、さまざまな身体機能に関与し、抗腫瘍作用などの多様な生物学的活性を有することが示されている。血管新生阻害は、メラトニンがその抗腫瘍効果を発揮するメカニズムの1つある。
血管新生の増加は腫瘍進行の主な特徴であり、したがって血管新生阻害はがん治療における重要なステップである。
メラトニンは、がん細胞への栄養素と酸素供給を標的にするためにさまざまなメカニズムで作用している。転写レベルでは、低酸素誘導因子-1α(HIF-1α)およびその制御下にある遺伝子、例えば血管内皮増殖因子(VEGF)は、血管新生の阻害のためのメラトニンの主な標的である。
メラトニンは、HIF-1αの核内への移行を妨げ、それによってVEGFの発現を妨げ、また血管新生関連遺伝子の発現に関与するHIF-1α、リン酸化-STAT3およびCBP / p300複合体の形成も妨げる。
メラトニンの血管新生抑制作用はまた、VEGFR2の活性化および発現を阻害する作用も関与している。
さらに、メラトニンのその他の血管新生抑制メカニズムには、内皮細胞遊走と浸潤と脈管形成の阻害が含まれる。
本研究では、メラトニンによって媒介される血管新生阻害の経路と、in vitroとin vivoの両方における様々な種類のがんにおける原因となる血管新生阻害のメカニズムを検討した。
この論文では、メラトニンが転写因子の低酸素誘導因子-1α(HIF-1α)の活性化を阻止し、血管内皮増殖因子(VEGF)の産生を阻害して血管新生阻害作用を発揮することを報告しています。
【メラトニンはHIF-1を阻害するメカニズムでワールブルグ効果を正常化する】
メラトニンは様々なメカニズムで抗腫瘍効果を発揮します。メラトニンががん細胞の解糖系を抑制し、ミトコンドリアでの酸化的リン酸化を促進して、ワールブルグ効果を是正する効果が報告されています。以下のような総説論文があります。
Anti-Warburg Effect of Melatonin: A Proposed Mechanism to Explain its Inhibition of Multiple Diseases(メラトニンの抗ワールブルク効果:複数の疾患の抑制を説明するために提案されたメカニズム)Int J Mol Sci. 2021 Jan 14;22(2):764.
【要旨】
グルコースはすべての細胞にとって不可欠な栄養素であるが、その代謝は細胞の表現型に依存する。通常、細胞質における解糖の産物であるピルビン酸はミトコンドリアに輸送され、ピルビン酸脱水素酵素複合体によって不可逆的にアセチル補酵素A(アセチルCoA)に変換される。
しかし、一部の病的細胞では、ピルビン酸脱水素酵素キナーゼによるピルビン酸脱水素酵素複合体の阻害により、ミトコンドリアへのピルビン酸の輸送がブロックされる。この代謝の変化は好気性解糖(ワールブルク効果)と呼ばれ、固形腫瘍や他の病的細胞で一般的に見られる。
ミトコンドリアの酸化的リン酸化から好気性解糖への切り替えは、ATPの迅速な生成と、細胞の増殖に必要なヌクレオチドを提供するペントースリン酸経路の活性化により、病的細胞に利点をもたらす。
グリコリティックス(glycolytics)と呼ばれる分子は、好気性解糖を阻害し、細胞をより健康的な表現型に変換する。グリコリティックスは、低酸素誘導因子-1α(HIF-1)を阻害することによってピルビン酸脱水素酵素複合体の阻害を取り除き、ピルビン酸のアセチルCoAへのミトコンドリア内変換を可能にする。
メラトニンは、病変細胞をより健康な表現型に変換するグリコリティックスである。ここでは、グリコリティックスとしてのメラトニンの機能が、さまざまな病気の抑制におけるメラトニンの作用を説明することを提案する。つまり、メラトニンの基本的な作用は、細胞の代謝系を変更することである。
以下の総説論文も同じ研究グループ(Department of Cell Systems and Anatomy, UT Health San Antonio, San Antonio, TX, USA)からの論文です。
Melatonin inhibits Warburg-dependent cancer by redirecting glucose oxidation to the mitochondria: a mechanistic hypothesis.(メラトニンは、グルコース酸化をミトコンドリアに向け直すことにより、ワールブルグ依存性がんを阻害する:メカニズム的仮説)Cell Mol Life Sci 77(13), 2527–2542 (2020)
【要旨の抜粋】
いくつかの動物実験モデルで、メラトニンががん細胞の発生と進行と転移を阻止する作用を持つことが示されている。がん細胞に共通する代謝の特徴としてワールブルグ効果(好気的解糖)がある。ワールブルグ効果によってがん細胞の高い代謝要求に必要なATPを細胞質内での解糖で産生し、がん細胞の増殖を促進し、細胞死を回避し、転移を促進する。
グリコリティックス(glycolytics)と呼ばれる分子は、がん細胞における好気性解糖を阻害し、正常細胞と同様にミトコンドリアにおける酸化的リン酸化によってATPを産生するように代謝を変化させる。その結果、グリコリティックスはがん細胞の増殖を阻害する。
メラトニンはグリコリティックス(glycolytics)の作用を有し、ミトコンドリアでピルビン酸からアセチルCoAへの変換を妨げる酵素(ピルビン酸脱水素酵素キナーゼ)の発現を抑制するというメカニズムによって、がん細胞の回答を阻害する作用を持つ可能性がある 。
メラトニンはがん細胞の増殖活性と転移能を低下させ、容易にアポトーシスを起こすようにする。
メラトニンは正常細胞のミトコンドリアで合成されるが、アセチルCoAはメラトニン合成の律速酵素であるアリルアルキルアミン-N-アセチルトランスフェラーゼ(arylalkylamine-N-acetyltransferase)に必要であり、がん細胞ではアセチルCoAが低下しているため、がん細胞のミトコンドリアではメラトニンの合成能力は低下している。
メラトニンがグルコース酸化を細胞質からミトコンドリアに切り替える作用は、がん細胞の抗がん剤感受性をメラトニンが高めることの理由を説明している。
この論文の著者は米国テキサス州のサン・アントニオ(San Antonio)のテキサス大学ヘルスサイエンス・センター(University of Texas Health Science Center)の研究者らのグループです。
この論文で出てくる「グリコリティックス(glycolytics)」と言うのはこの研究者らが作った用語のようです。解糖(glycolysis)から派生した造語のようです。
このグリコリティックス(glycolytics)と言うのは、「がん細胞における好気性解糖(ワールブルグ効果)を阻害し、正常細胞と同様にミトコンドリアにおける酸化的リン酸化によってATPを産生するように代謝を変化させる物質」と定義されています。
つまり、がん細胞の好気性解糖(ワールブルグ効果)を是正して、がん細胞の増殖を抑え、死滅させるような物質です。
メラトニンがグリコリティックス(glycolytics)の作用を持つと言うのが、この論文の趣旨です。
メラトニンは正常細胞のミトコンドリアで合成されます。アセチルCoAはメラトニン合成の律速酵素であるアリルアルキルアミン-N-アセチルトランスフェラーゼ(arylalkylamine-N-acetyltransferase)に必要です。
がん細胞ではピルビン酸をアセチルCoAに変換するピルビン酸脱水素酵素の活性が阻害されているため、アセチルCoAの産生が減少し、がん細胞のミトコンドリアではメラトニンの合成能力は低下しています。
メラトニンがグルコース酸化を細胞質(解糖)からミトコンドリア(酸化的リン酸化)に切り替える作用は、がん細胞内でのメラトニンの産生を高め、HIF-1の活性を阻害し、ワールブルグ効果の是正に寄与する可能性があります。

図:グルコースは解糖によってピルビン酸に分解され(①)、乳酸に変換される(②)。ピルビン酸はミトコンドリアに入ってピルビン酸脱水素酵素(③)によってアセチルCoAに変換され(④)、TCA回路で代謝され(⑤)、NADHとFADH2に捕捉された水素がミトコンドリア内膜の呼吸鎖(電子伝達系)に渡されて(⑥)、ATPが産生される(⑦)。このとき、ミトコンドリア内では活性酸素の産生も増える(⑧)。アセチルCoAはメラトニン合成の律速酵素であるアリルアルキルアミン-N-アセチルトランスフェラーゼ(arylalkylamine-N-acetyltransferase)に必要(⑨)。N-アセチルセロトニンはアセチルセロトニン・メチルトランスフェラーゼ(acetylserotonin methyltransferase)でメラトニンが生成される(⑩)。メラトニンは活性酸素種を消去する(⑪)。低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼ(PDK)の発現を亢進し、PDKはピルビン酸脱水素酵素の活性を阻害する(⑫)。メラトニンはHIF-1の発現を抑制する作用がある(⑬)。したがって、ミトコンドリアの活性化とメラトニンの補充はがん細胞のワールブルグ効果を是正して、がん細胞の増殖を抑える効果が期待できる。
【ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する】
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)の2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから使用されています。
前述のようにがん細胞ではHIF-1の活性亢進によってピルビン酸脱水素酵素キナーゼの活性が亢進し、ピルビン酸脱水素酵素の活性が低下し、ピルビン酸からアセチルCoAへの変換が阻止されているため、ミトコンドリアでのエネルギー産生が低下しています。
そこで、ジクロロ酢酸ナトリウムでがん細胞のピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、乳酸の産生が抑えられます。さらに、酸化的リン酸化の過程で活性酸素の産生が増え、酸化ストレスの増大によってがん細胞を死滅できるという作用機序が報告されています。(図)。

図:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して(①)、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので(②)、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素の活性を高め(③)、R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働き(④)、ピルビン酸脱水素酵素の活性を高めてピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する(⑤)。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増え、乳酸産生が減少し、アポトーシスが起こりやすくなって、抗がん剤感受性が亢進する(⑥)。
がん細胞では活性酸素の発生を減らして死ににくくするために、ミトコンドリアでの酸化的リン酸化を抑制しています。ジクロロ酢酸ナトリウムでがん細胞のミトコンドリアでの代謝を促進して活性酸素の産生を増やすと抗がん剤で死にやすくなります。ジクロロ酢酸ナトリウム単独でもがん細胞が死滅することが培養細胞や動物実験で明らかになっています。
ミトコンドリアでの活性酸素の産生量を増やしたくらいでがん細胞が本当に死滅するのかという疑問が出るかもしれませんが、ミトコンドリアは細胞の重量の10%以上を占めるくらい大量に存在するので、ミトコンドリアで一斉に酸化的リン酸化が亢進すれば細胞を死滅させることができると考えられています。
培養がん細胞や動物移植腫瘍を用いた実験でジクロロ酢酸ナトリウムの抗腫瘍作用は証明されています。臨床試験でも有効性が報告されており、がんの代替医療では利用する患者さんが増えています。
ジクロロ酢酸が抗がん剤耐性を減弱することが多く報告されています。例えば、以下のような報告があります。
Suppression of pyruvate dehydrogenase kinase-2 re-sensitizes paclitaxel-resistant human lung cancer cells to paclitaxel.(ピルビン酸脱水素酵素キナーゼ-2の抑制は、パクリタキセル耐性ヒト肺がん細胞をパクリタキセル感受性にする)Oncotarget. 2017 Apr 10;8(32):52642-52650.
【要旨】
治療開始後の初期の臨床的効果は顕著であっても、パクリタキセルで治療された大部分の肺がん患者は、最終的にはパクリタキセルに耐性になる。ピルビン酸脱水素酵素キナーゼ-2(PDK2)は、解糖および酸化的リン酸化の重要な調節因子であり、その発現は様々な腫瘍において増加する。本研究では、生化学および同位体追跡法を用いて、肺がん細胞におけるパクリタキセル耐性の機序におけるPDK2の役割を調べた。
パクリタキセルに感受性の肺がん細胞に比べて、パクリタキセル耐性肺がん細胞ではPDK2の発現亢進が認められた。
siRNAを用いたPDK2遺伝子の発現抑制は、パクリタキセル耐性肺がん細胞のパクリタキセルに対する感受性を増加させた。PDK2発現抑制によるパクリタキセル耐性肺がん細胞への作用は、酸化的リン酸化の亢進よりも解糖の減少として認められた。
PDK2の特異的阻害剤のジクロロ酢酸とパクリタキセルを併用すると、パクリタキセル耐性肺がん細胞の生存率に相乗的な阻害効果を示した。
これらの結果は、パクリタキセルによるPDK2の発現誘導が、肺がん細胞のパクリタキセル耐性の獲得の重要な機序として働くことを示している。これらの結果は、パクリタキセルに耐性を獲得した肺がん患者の治療において、PDK2の阻害が有効である可能性を示している。
人間の場合、ジクロロ酢酸ナトリウムは1日体重1kg当たり10〜15mgを水に溶解して服用します。ピルビン酸脱水素酵素が活性化すると、この酵素の補因子であるビタミンB1とR体αリポ酸を消耗するのでビタミンB1とR体αリポ酸の補充が副作用予防と効果増強に必要です。

図:αリポ酸にはR体とS体という2種類の光学異性体(鏡像異性体)が存在する。体内で生成されるαリポ酸はR体のみで、S体は天然には存在しない。しかし、αリポ酸を人工的に合成するとR体50%、S体50%のラセミ体ができる。ピルビン酸脱水素酵素を活性化する作用はR体のみで、逆にS体のαリポ酸はピルビン酸脱水素酵素の活性を阻害する。したがって、ジクロロ酢酸でミトコンドリアを活性化するときにはR体αリポ酸でなければならない。
【メラトニンの大量投与によるがん治療】
メラトニンには抗酸化作用や免疫増強作用があり、抗老化作用や寿命延長効果も報告されています。かなり大量に服用しても副作用はほとんど起こりません。
私自身、1日に40mgから60mgを数年前から毎日服用していますが、副作用は経験しません。その作用機序から1日100mg以上のメラトニン大量投与が、進行がんの治療に効果がでる可能性は高いと思います。
実際に1日100mg程度のメラトニンが進行がんの治療に使用されています。
文献では、1日1グラムのメラトニンを30日服用しても副作用は出ないと報告されています。
リンパ球を刺激する作用があるため、自己免疫疾患(慢性関節リュウマチなど)や悪性リンパ腫や白血病など免疫細胞の腫瘍の場合は、メラトニンの服用は病気を悪化させる可能性があるため使用できません。血液凝固を抑える作用があるため、血液凝固に異常がある場合や、ワーファリンのような血液凝固を阻害する薬を服用中は注意が必要です。
血圧を低下させる作用があるため、降圧剤を服用中は注意して服用します。
これらの点に注意していれば、副作用はほとんど無く、がん治療にメラトニンの使用はメリットが高いと言えます。がん治療には1日1回、就寝前に10〜40mgを目安に服用します。
副作用がほとんどないので、1日100mg以上の高用量のメラトニンの投与も検討されています。高用量のメラトニンでがん細胞のHIF-1活性を十分に低下させれば、がん細胞の増殖を抑制できる可能性があります。
進行がんの治療にメラトニン大量投与とジクロロ酢酸ナトリウムの併用を試してみる価値はあります。
| « 773)COVID-19... | 775)高用量メ... » |



