がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
748)オールトランス・レチノイン酸はイソメラーゼPin1の活性を阻害して抗腫瘍作用を発揮する
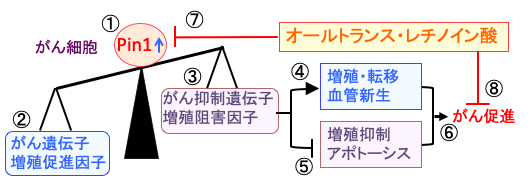
図:がん細胞はイソメラーゼPin1活性が亢進し(①)、がん遺伝子/増殖促進因子の活性が高く(②)、がん抑制遺伝子/増殖阻害因子の活性が低下している(③)。このバランスの破綻はがん細胞の増殖・転移や血管新生を促進し(④)、増殖抑制とアポトーシスのメカニズムを阻害する(⑤)。その総合作用でがん細胞の増殖や悪性化を促進する(⑥)。オールトランス・レチノイン酸はPin1活性を阻害し(⑦)、がん細胞の増殖・進展を抑制する(⑧)。
748)オールトランス・レチノイン酸はイソメラーゼPin1の活性を阻害して抗腫瘍作用を発揮する
【タンパク質は翻訳後の様々な修飾で機能が変化する】
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称です。
レチノイドは生体内では活性型であるオールトランス・レチノイン酸(All-trans retinoic acid :ATRA)として細胞核内の受容体に結合して、その生理作用を発揮します。
つまり、オールトランス・レチノイン酸(ATRA)は核内受容体に作用して、遺伝子発現に作用して様々な作用を発揮します。
さらにATRAがイソメラーゼのPin1の活性を阻害する作用で抗腫瘍効果を発揮することが注目されています。この作用はATRAが酵素タンパク質に直接作用して酵素活性を阻害するという作用です。
このイソメラーゼPin1の働きを理解するためには、まずタンパク質の翻訳後修飾について理解する必要があります。
タンパク質は細胞内のリボソームで作られます。DNAからメッセンジャーRNA(mRNA)が作られ(転写)、このmRNAに転写された遺伝情報をトランスファーRNA(tRNA)を用いて、対応するアミノ酸を連結することで、タンパク質を合成します。
mRNAのコドン(3文字の塩基配列)によってアミノ酸の種類が決まります。合成されたタンパク質は様々な修飾や折りたたみを経て正しい機能をもつタンパク質に成熟します。

図:リボソーム内では、mRNAに転写された遺伝情報をトランスファーRNAを用いて解読し、対応するアミノ酸を連結することで、タンパク質を合成する。mRNAのコドン(3文字の塩基配列)によって連結されるアミノ酸の種類が決定する。アミノ酸の鎖から成るタンパク質が合成された後、折り畳みや翻訳後修飾が行われて、成熟したタンパク質となる。
タンパク質折り畳みは小胞体で行われます。小胞体は真核生物の細胞内小器官の一つで、一重の生体膜に囲まれた板状あるいは網状の膜系の器官です。細胞質を横断するようにして核膜までつながる袋状の膜構造によって構成されます。
小胞体は、その構造と機能によって、2つに分けられます。一つは粗面小胞体 と呼ばれ、小胞体膜の細胞質側にリボソームが付着しています。粗面小胞体は、主にタンパク質合成に関与します。
もう一方は滑面小胞体と呼ばれ、リボソームが付着していない小胞体です。滑面小胞体は、酵素およびその代謝産物の貯蔵を行います。
リボソームで合成された膜タンパク質や分泌タンパク質は、小胞体内やゴルジ体で「タンパク質の折り畳み」や、糖鎖の結合などたんぱく質の翻訳後修飾を受けて正しい機能を発揮できるたんぱく質として完成します。

図:細胞核の中でDNA上の遺伝子からRNAポリメラーゼや転写因子の働きによってmRNA(メッセンジャーRNA)が生成される過程を転写という(①)。リボソームではmRNAの情報に基づき、アミノ酸が順番に結合してタンパク質が生成され、これを翻訳という(②)。翻訳後のポリペプチド鎖(③)は小胞体で3次元的に折り畳まれて、機能を発揮する(④)。小胞体には、リボソームが付着した粗面小胞体と付着していない滑面小胞体がある(⑤)。
タンパク質はアミノ酸が複数結合した直鎖状の分子で、可能な立体構造は無数に存在しますが、細胞内では熱力学的に最も安定な立体構造を自発的にとります。このようにタンパク質が機能するために特定の立体構造に折り畳まれることを「タンパク質折り畳み(Protein Folding)」と言います。
20種類のアミノ酸は側鎖の違いによって個々の性質を持ちます。その性質の一つに、水になじみやすい親水性のアミノ酸と、水になじみにくい疎水性のアミノ酸があります。この親水性と疎水性という性質がタンパク質の3次構造の決定に重要な要素になります。
タンパク質には親水性のアミノ酸が密に存在している部分と、疎水性のアミノ酸が多数集まっている部分が混在しています。この場合、細胞内は水分で満たされているため、疎水性アミノ酸の多い部分はタンパク質の内部に折り込まれ、親水性のアミン酸の多い部分は外側に集まるような力が働いて、ある程度は自然に安定的な3次元構造に折り畳まれるのです。
多くのタンパクやペプチドはさらに様々な化学修飾を受けます。これは翻訳後修飾と呼ばれます。
例えば、リン酸化や糖鎖付加、ジスルフィド(S-S)結合の形成の他にメチル化、イソプレニル化などの化学修飾や、酵素による切断などが知られています。
ジスルフィド結合(S-S結合)はシステインが持っているイオウ原子(S)同士が共有結合します。
タンパク質の3次元構造は、このジスルフィド結合と、疎水性アミノ酸同士が集合する性質による疎水性相互作用、アミノ酸が持つ水素原子間の相互作用(水素結合)、アミノ酸側鎖のプラスとマイナスの電気的な引力や斥力からなる静電的相互作用などによって、構造が安定化されます。
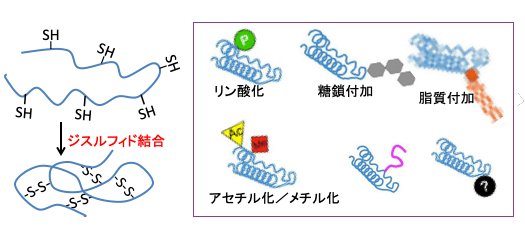
図:ポリペプチドが折り畳まれるとシステインのSH基の間でジスルフィド結合(S-S結合)による共有結合で立体構造がより強固なものになる。多くのタンパク質はさらに、リン酸化、糖鎖付加、脂質付加、アセチル化、メチル化などの翻訳後修飾を受けることによって機能を持つようになる。これらは小胞体膜表面や小胞体内腔やゴルジ体で行われる。
【ペプチジルプロリルイソメラーゼ(PPIase)Pin1はタンパク質の翻訳後修飾に関与するシス-トランス異性体の生成に関与する】
分子式は同じで、構造式や立体配置が異なる為に物理的または化学的性質が異なる物質が2つまたはそれ以上存在するとき、これらの化合物を互いに異性体と呼びます。異性体には以下のような種類があります。

環式化合物で環を平面構造と考えたとき,置換基の環平面に対する相対位置で生じる立体異性体を,シス-トランス異性体といいます。二重結合の部位でもシス・トランス異性体が起こります。
シスとはこちら側という意味で,トランスとは反対側という意味です。

レチノイドのAll-trans-RA (ATRA) と 9-cis-RA (9C-RA)も異性体の関係にあります。分子式は同じで、原子の結合状態や立体配置が違うために異なる性質を示します。
レチノイドは炭化水素鎖を基本骨格としており、炭素が水素で飽和している場合はまっすぐな構造をしますが、水素で飽和していない二重結合(CH=CH)の部分で構造が変わります。
すなわち、炭素間に二重結合がある所で曲がる時に、「シス型」と「トランス型」という2種類の構造を取ります。「シス(cis)は「同じ側」「近い方」、トランス(trans)は「反対側」「遠い方」というような意味の接頭辞です。
つまり、二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並びます。シス型の2重結合のところで炭化水素の鎖は曲がります。(下図)

ATRAと9-cis-RAはどちらもレチノイン酸受容体(RAR)のリガンドになりますが、レチノイドX受容体(RXR)のリガンドになるのは9-cis-RAのみです。
レチノイン酸受容体(RAR)とレチノイドX受容体(RXR)には、それぞれのリガンドが入り込んで結合するポケット状の構造があるのですが、RARのリガンド結合ポケットにはATRAと9C-RAの両方のレチノイドが納められますが、RXRのリガンド結合ポケットには9C-RAしか納められなくて、ATRAははみ出すからRXRのリガンドとはなれないからです。
タンパク質はアミノ酸の疎水性な親水性などの物理的性状に依存して自発的に折り畳まれると初めは考えられてきました。しかし、現在では多くのタンパク質がさまざまなタンパク質性の因子によって、折り畳みを助けられていることがわかっています。
そのようなメカニズムの一つにペプチジルプロリルイソメラーゼ(PPIase)のPin1というタンパク質が知られています。
Pin1はプロリン(Pro)残基の前にあるSer/Thr残基のリン酸化を認識してプロリンペプチド結合のシス/トランス立体構造変化を触媒します。
タンパク質中のアミノ酸はペプチド結合でつながっており、この結合はほとんどの場合トランス型になっています。例外的に、プロリンとそのN端側のアミノ酸間のペプチド結合に関しては、シス型とトランス型の両方をとることができます。このシス・トランス構造の変化(プロリン異性化)を引き起こすのに必要な活性化エネルギーは20kcal/molと比較的高いため,触媒する酵素が必要となります。プロリン異性化酵素(peptidylprolyl isomerase;PPIase)はこの異性化を触媒する酵素です。
Pin1は他のPPIaseと異なり、プロリン前のアミノ酸がセリンまたはスレオニンであり、かつリン酸化されている必要があります。すなわちPin1は標的蛋白質のリン酸化状態に依存して結合するという特徴を持ちます。
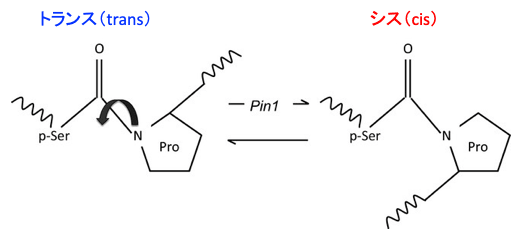
図:ペプチジルプロリルイソメラーゼのPin1は、プロリン(Pro)のN側のアミノ酸がセリンまたはスレオニンで、このセリンやスレオニンがリン酸化されていた場合(p-Ser)、トランス(Trans)型構造をシス(Cis)型に変更する。
Pin1の作用でタンパク質のプロリンの部分でトランス型からシス型に変換することで標的蛋白質の安定性や局在性や活性の変化などが認められます。
Pin1の標的蛋白質として現在までに多数の蛋白質が報告されており、代表的なものとしてTauと細胞周期関連因子(CyclinD1など)が挙げられます。そのため、Pin1とアルツハイマー病やがんとの関連を検討した報告が多いのですが、最近では、糖尿病、非アルコール性脂肪性肝炎、骨粗鬆症など幅広い疾患との関係が報告されています。
【Pin1 はがんの進行を促進する】
一般的に、Pin1は腫瘍の進行を促進し、Pin1の活性亢進はがん患者の予後不良と関連します。 Pin1は、正および負のフィードバックメカニズムを通じて、50を超える発がん性タンパク質および増殖因子を活性化し、さらに少なくとも20の腫瘍抑制因子および増殖抑制タンパク質を抑制することが示されています(下図)。

図:一般的に、Pin1はがん遺伝子で活性化され(①)、がん抑制遺伝子で不活性化されている(②)。一方、Pin1は50以上のがん遺伝子や増殖促進因子の発現を促進し(③)、20以上のがん抑制遺伝子あるいは増殖抑制因子の発現を抑制する(④)。【Source: Cell Death & Disease volume 9, Article number: 883 (2018)のFig.2】
乳房、前立腺、肺、卵巣、胃、食道、子宮頸部、脳の腫瘍および黒色腫を含むほとんどの腫瘍において対応する正常組織と比較して、Pin1の過剰発現および/または活性化が認められています。In vitroで培養された腫瘍細胞株におけるPin1の発現もまた、正常細胞株におけるそれよりも有意に高いことが報告されています。
Pin1遺伝子のノックダウンは、in vitroおよびin vivoの両方でがん細胞の増殖を阻害し、がん細胞のアポトーシスを引き起こします。さらに、Pin1を標的とする阻害剤が有意な抗がん効果を有することが示されています。
さらに、Pin1を標的とする阻害剤が有意な抗がん効果を有すること多くの研究で示されています。 これらの阻害剤には、オールトランスレチノイン酸(ATRA)や三酸化ヒ素(ATO)などが含まれます。
Hanahan DとWeinberg RAはがんの特徴として以下の10項目を挙げています。
- 持続的な増殖シグナル
- 増殖抑制シグナルへの不応答
- アポトーシスの回避
- 無制限の複製能
- 継続的な血管新生
- 代謝リプログラミング
- 免疫系からの回避
- ゲノム不安定性と変異
- 腫瘍促進性炎症
- 浸潤と転移
Pin1が様々なレベルで多くのシグナル経路の制御異常を引き起こし、この10項目のがん細胞の特徴の全てに関与していることが指摘されています。
例えば、Pin1はVEGFの発現を促進することにより血管新生を誘導します。Pin1は、増殖シグナル伝達系を活性化し、増殖抑制シグナル経路を不活性化することにより、がん細胞の増殖を促進します。 Pin1は、NOTCH1、TGF-β、β-カテニン、BRD4を調節することにより、移動と浸潤を促進します。Pin1は、抗アポトーシスタンパク質の活性を高め、アポトーシス促進因子を抑制することにより、腫瘍細胞のアポトーシスを阻害します。

図:Pin1は大多数のがんで高度に発現しており、細胞のがん化と悪性進展に関与する複数の経路および要因を調節不全にすることに関与している。Hanahan D と Weinberg RAが提唱する10種類のがんの特徴の全てにPin1は関与している。【Source: Cell Death & Disease volume 9, Article number: 883 (2018)のFig.3】
Pin1の過剰発現と活性亢進はがん促進因子とがん抑制因子のバランスをがん促進の方向に誘導する作用があります。(下図)

図:がん細胞はイソメラーゼPin1活性が亢進し(①)、がん遺伝子/増殖促進因子の活性が高く(②)、がん抑制遺伝子/増殖阻害因子の活性が低下している(③)。このバランスの破綻はがん細胞の増殖・転移や血管新生を促進し(④)、増殖抑制とアポトーシスのメカニズムを阻害する(⑤)。その総合作用でがん細胞の増殖や悪性化を促進する(⑥)。
【オールトランス・レチノイン酸はPin1を阻害して抗腫瘍作用を示す】
Pin1はオールトランス・レチノイン酸の重要なターゲットであることが報告されています。以下のような報告があります。
Active Pin1 is a key target of all-trans retinoic acid in acute promyelocytic leukemia and breast cancer(活性化したPin1は、急性前骨髄球性白血病および乳がんにおけるオールトランスレチノイン酸の重要な標的である)Nat Med. 2015 May; 21(5): 457–466.
【要旨】
ユニークなイソメラーゼのであるPin1は、複数の腫瘍タイプにおける発がん性シグナル伝達経路の重要な調節因子である。しかしながら、現時点で利用可能なPin1阻害剤は、必要な特異性と十分な有効性を欠いている。
メカニズムベースのスクリーニングを使用して、急性前骨髄球性白血病(PML)の治療に有効で、そのメカニズムがまだ解明されていないオールトランスレチノイン酸(ATRA)が、 Pin1活性部位の基質のリン酸およびプロリン結合ポケットに直接結合することにより、がん細胞に特異的に活性Pin1を選択的に分解することを明らかにした。
ATRAによって誘発されるPin1活性阻害は、融合がん遺伝子PML-RARαを分解し、細胞および動物モデルとヒト患者の急性前骨髄急性白血病を治療する。
ATRAによって誘発されるPin1活性阻害は、多くのPin1基質がん遺伝子およびがん抑制因子に作用することにより、ヒト細胞および動物モデルにおけるトリプルネガティブ乳がん細胞の増殖も阻害する。したがって、ATRAはPin1によって制御される複数のがん駆動経路を同時にブロックする。これは、攻撃的で薬剤耐性のある腫瘍を治療するための魅力的な特性である。
プロリン異性化酵素 Pin1は、多彩な標的タンパク質のリン酸化セリン/リン酸化スレオニンとプロリンの結合部位を含む配列に結合して、プロリンのシス‐トランス異性化を行うことで、標的タンパク質の機能を制御する酵素です。
Pin1発現や活性を阻害すると、幹細胞特性の維持に必要なNanog・KLF4・Oct4といった転写因子の発現が抑制され、がん幹細胞特性を消失できます。
以下のような報告もあります。
Arsenic targets Pin1 and cooperates with retinoic acid to inhibit cancer-driving pathways and tumor-initiating cells.(ヒ素はPin1を標的とすることで、レチノイン酸と協調して難治性乳がんの発がん経路およびがん幹細胞の生存増殖を阻害する)Nat Commun. 2018 Aug 9;9(1):3069.
【要旨】
三酸化ヒ素(ATO)とオールトランス型レチノイン酸(ATRA)との併用療法により致死性の急性前骨髄球性白血病を確実かつ安全に治療することができるが、それらの作用機序はいまだ十分に解明されてはいない。
ATRAは、発がん性シグナル伝達ネットワークの主要な制御因子であるプロリン異性化酵素Pin1を標的とすることで、白血病、乳がんおよび肝がんに抑制的に働く。
本研究では、ATOがPin1を標的とし、ATRAと協調して強力な抗がん作用を発揮することを証明した。
ATOはPin1を阻害および分解し、Pin1の活性部位に非共有結合することでその発がん性機能を抑制する。ATRAは、アクアポリン9の発現誘導を介してATOの細胞内への取り込みを増加させる。
患者由来の同所異種移植モデルを含むin vitroおよびin vivoモデルにおいて、臨床的に安全な用量でATOおよびATRAは互いに協調してPin1を分解して多数の発がん経路を遮断することで、トリプルネガティブ乳がんの増生やがん幹細胞の増殖を阻害することが明らかにされた。
タンパク質のリン酸化およびリン酸化後のイベントが細胞シグナル伝達経路で重要な役割を果たしています。Pin1はリン酸化された基質を異性化し、細胞周期、細胞増殖、細胞運動性、アポトーシスなどのさまざまな細胞プロセスに関与しています。 Pin1の調節不全は、細胞の運命に幅広い影響を及ぼし、さまざまな病気の発生と発症に密接に関係しています。
ほとんどの場合、Pin1は、タンパク質またはシグナル伝達経路全体を調節する分子タイマーまたはスイッチとして機能します。
Pin1が高発現しているがん患者は予後が悪いので,Pin1の阻害剤は抗がん剤として期待されています。
【ATRAはPin1を阻害して乳がんのタモキシフェン耐性を阻止する】
以下のような報告があります。
Targeting Pin1 by All-Trans Retinoic Acid (ATRA) Overcomes Tamoxifen Resistance in Breast Cancer via Multifactorial Mechanisms.(オールトランス・レチノイン酸(ATRA)によるPin1の標的化は、多因子メカニズムを介して乳がんのタモキシフェン耐性を克服する)Front Cell Dev Biol. 2019; 7: 322.
Published online 2019 Dec 6. doi: 10.3389/fcell.2019.00322
【要旨】
乳がんは世界中の女性に最も多く発症している腫瘍であり、約70%の患者がエストロゲン受容体陽性である。これらの乳がん患者では、エストロゲン受容体拮抗薬であるタモキシフェンに対する耐性が、がん治療の妨げとなっている。
ペプチジル-プロリルイソメラーゼPin1は、乳がんで顕著に過剰発現しており、タモキシフェン耐性に関与している。
ここでは、タモキシフェン耐性乳がんの治療において、Pin1阻害作用のあるオールトランスレチノイン酸(ATRA)を使用して、Pin1阻害による効果を検討する。
タモキシフェン耐性のヒト乳がん細胞株と再発患者の腫瘍組織でPin1の発現更新を認めた。 Pin1の過剰発現は、エストロゲン受容体ERαのS118(N末端から118番目のセリン)のリン酸化を増加させ、ERαタンパク質を安定化した。
ATRA処理は、Pin1遺伝子のノックダウンと同様な効果を示し、Pin1ノックダウンの効果に似たATRA処理は、タモキシフェン耐性細胞のERα分解を促進した。
さらに、ATRAまたはPin1ノックダウンは、ERK1 / 2およびAKT経路の活性化を減少させた。
ATRAはエストロゲン受容体ERαの核発現と転写活性も低下させた。
重要なことに、ATRAはin vitroでタモキシフェン耐性ヒト乳がん細胞の細胞生存率と増殖を阻害した。
徐放性ATRA錠は、in vivoでのタモキシフェン耐性ヒト乳がん異種移植片の増殖を抑制した。
結論として、ATRAによるPin1活性阻害は、タモキシフェン耐性に関与する多因子メカニズムを同時に抑制することにより、タモキシフェン耐性乳がんの増殖を抑制する。これは、攻撃的で内分泌抵抗性の腫瘍を治療するための魅力的な戦略を示している。
乳がんのタモキシフェン治療の際に、オールトランス・レチノイン酸を併用する価値はありそうです。
【オールトランス・レチノン酸は肝細胞がんのソラフェニブ治療の効果を高める】
進行した肝細胞がんに対して抗がん剤治療が試されていますが、肝臓がんは抗がん剤が効きにくいがんであって、症状の改善や延命効果において、有効性が確立されたものはほとんどありません。
大規模な臨床試験で有効性を示し、世界で唯一、肝臓がんに承認された薬剤として「ネクサバール(一般名:ソラフェニブ)」という分子標的薬があります。ネクサバールは血管新生阻害作用などによって抗腫瘍効果を発揮します。
しかし、ネクサバールの大規模臨床試験では、3ヶ月程度の延命効果があるに過ぎないので、十分な効果とは言えません。ソラフェニブの治療効果を高める方法が求められていますが、オールトランス・レチノイン酸(ATRA)がソラフェニブの効果を増強することが報告されています。以下のような報告があります。
Inhibition of the prolyl isomerase Pin1 enhances the ability of sorafenib to induce cell death and inhibit tumor growth in hepatocellular carcinoma(プロリル・イソメラーゼPin1の阻害は、肝細胞がんにおける細胞死を誘導し、腫瘍増殖を阻害するソラフェニブの高腫瘍効果を強化する)Oncotarget. 2017 May 2;8(18):29771-29784.
【要旨の抜粋】
ソラフェニブは、進行した肝細胞がんに対して有効性が証明されている唯一の治療法であるが、その総合的な臨床的有効性はそれほど高く無い。したがって、ソラフェニブの治療効果を高める方法は主要な課題になっている。
プロリル・イソメラーゼPin1は、がん細胞の発生に関与する多くの経路を調節している。特に、Pin1はHBV陽性HCC患者の約70%で過剰発現しており、肝細胞がんの発生過程に関与している。しかしながら、肝細胞がんに対するソラフェニブの抗腫瘍効果に対するPin1の役割は不明である。
この研究では、ソラフェニブがPin1 のmRNAおよびタンパク質の発現を低下することを発見した。
これは、おそらくRb / E2F経路によるPin1転写の阻害によるものと考えられる。
重要なことに、Pin1ノックダウンは肝細胞がんで細胞死を誘発するソラフェニブの能力を強力に増強した。これは、Pin1ノックダウンがFbxw7の安定化とMcl-1の不安定化につながるという発見によってさらに裏付けられた。
さらに、がん細胞の活性化Pin1の活性を阻害し、最終的にPin1の分解を誘導するオールトランスレチノイン酸(ATRA)も、少なくとも部分的にカスパーゼ依存的に肝細胞がんに対するソラフェニブ誘導性細胞死を増強した。
さらに、マウス異種移植モデルにおいて、ソラフェニブによるPin1の減少効果と、肝細胞がんの腫瘍増殖を阻害する能力を、ATRAは相乗的に増強した。
まとめると、これらの結果は、ソラフェニブの抗腫瘍効果のメカニズムとしてPin1の阻害作用が重要であることを示し、Pin1阻害剤が肝細胞がんに対するソラフェニブの治療効果を高める新しいアプローチを提供することも示唆している。
ソラフェニブ(ネクサバール)の大規模臨床試験では、何も治療しない人(対照群)の平均生存期間が7.9ヶ月に対してネクサバール治療群では平均生存期間が10.7ヶ月でした。つまり、現時点で進行肝臓がんに最も有効とされているネクサバールでも、3ヶ月程度の延命効果があるに過ぎません。(下図参照)

ネクサバール治療によって肝臓がんが縮小するのは5%以下、がんの増大速度が遅くなるのが60%程度という結果です。
しかし、この薬には特有の不快な副作用が高頻度に発生します。
皮膚症状として手足症候群(手や足の皮がむける)が55.2%、発疹が40.7%、脱毛36.6%、高血圧27.6%、下痢35.2%、食欲不振14.5%、倦怠感15.9%などと報告されています。
このような副作用は進行した肝硬変では強く出やすいため、進行した肝硬変を伴う肝臓がんの治療にはネクサバール治療のメリットが無いと考える専門家も多いようです。他に治療法がないので、仕方なく実施しているのが実情です。
この臨床試験の結果が出た時、「ネクサバールで肝がん生存期間が44%延長:バイエル薬品」というような記事がネットに出ていました。確かに、全生存期間がプラセボが7.9ヶ月でネクサバール群が10.7ヶ月なので、44%の延長は間違い無いのですが、3ヶ月の延命で、しかもかなり強い副作用に苦しむので、あまり有用性はないと思います。
しかし、他に治療法がなければソラフェニブ(ネクサバール)治療も仕方ありません。その際に、ATRAを併用すると生存期間を延ばせるかもしれません。
| « 747)FoxO3aを... | 749) 脂肪肉腫... » |



