がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
899) オールトランス・レチノイン酸(ATRA)の分化誘導作用(その1):イトラコナゾールとの相乗効果

図:ビタミンA(レチノール)はTransthyrenin(TTR)とレチノール結合タンパク(Retinol Binding Protein: RBP)と結合して血中に存在し(①)、細胞膜のSTRA6(Stimulated by Retinoic Acid 6)という受容体を介して細胞内に入る(②)。細胞内では細胞内レチノール結合タンパク(Cellular Retinol Binding Protein: CRBP)に結合し(③)、レチノール脱水素酵素によってレチナール(レチナールアルデヒド)に変換され(④)、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(ATRA)に変換される(⑤)。ATRAはイソメラーゼで9-シス・レチノイン酸(9-cis RA)に変換される(⑥)。ATRAはレチノイン酸受容体(RAR)に結合し(⑦)、9-cis RAはレチノイドX受容体(RXR)に結合して(⑧)標的遺伝子のレチノイン酸応答配列に結合して遺伝子転写を促進する。その結果、がん幹細胞の分化誘導、アポトーシスの誘導、細胞増殖抑制などの抗腫瘍効果を発揮する(⑨)。ATRAはチトクロームP450酵素のCYP26で分解される(⑩)。CYP26の発現はATRAで誘導される(⑪)。イトラコナゾールはCYP26の活性を阻害する(⑫)。したがって、イトラコナゾールはATRAの遺伝子発現誘導作用を増強する。
899) オールトランス・レチノイン酸(ATRA)の分化誘導作用(その1):イトラコナゾールとの相乗効果
【細胞分化は逆行できる】
私たちの体は、一つの受精卵が分裂して分かれた胚細胞が、神経細胞や心筋細胞や肝細胞や皮膚細胞など異なった機能を持つ細胞に分化していきます。「分化」というのは、単一あるいは同一であったものが、複雑化したり、異質化したりしていく現象で、未熟な胚細胞が異なった機能をもった細胞に成熟する過程が細胞分化です。

図:受精卵が胚盤胞となり、胚細胞は幹細胞となり、幹細胞から様々な細胞に分化する。
一般的に細胞分化は不可逆だと考えられていました。皮膚細胞や神経細胞や心筋細胞などへ最終分化した細胞は、分化後の細胞に必要な遺伝子以外の遺伝子の塩基配列がメチル化などのメカニズムで発現ができなくなり遺伝情報を失うためと考えられていました。
しかし、皮膚などの体細胞に少数の因子を導入し、培養することによって、様々な組織や臓器の細胞に分化する能力とほぼ無限に増殖する能力をもつ人工多能性幹細胞(iPS細胞)が、2006年に京都大学の山中伸弥教授の研究グループによって作成されました。
つまり、皮膚などに最終分化した細胞にある遺伝子を導入することで、あらゆる生体組織に成長できる万能な細胞を作れることが証明されたのです。
これは、最終分化した細胞を、多能性を持つ幹細胞の状態に初期化する、つまり「細胞分化は逆行ができる」ことを示しています。
このiPS細胞(人工多能性幹細胞)に他の体細胞への分化を誘導する因子(分化誘導因子)を加えて培養すると心筋細胞や肝細胞など他の体細胞に分化させることができます。(下図)。

図:受精卵が胚細胞になり(①)、未熟な胚細胞が増殖と細胞分化を繰り返して体が完成する(②)。個体の体細胞(例えば皮膚の線維芽細胞)を採取し(③)、幾つかの多能性誘導因子(④)を加えて細胞培養すると、多能性を持ったiPS細胞(人工多能性幹細胞)が作成できる(⑤)。iPS細胞に他の体細胞への分化を誘導する因子を加えて培養すると心筋細胞や肝細胞など他の体細胞の分化誘導できる(⑥)。体細胞からiPS細胞への変換は「細胞分化の逆行」を実現したことになる。
タイムマシンで過去に戻るような「物理的な時間の巻き戻し」は不可能ですが、体を若返らせるような「生物学的な時間の巻き戻し」は可能だと考えられています。病気になっても治療によって元の元気な以前の状態に戻ることができます。トレーニングで筋力や持久力を若い時代のレベルに戻すことができれば、生物学的な時間を巻き戻したことになります。
【がん細胞を正常細胞に再分化できる】
がん細胞の病理組織分類で分化度というのがあります。分化の程度によって高分化、中分化、低分化、未分化と分けます。一般的に、分化度の高いがん細胞ほど増殖が遅く、転移が少なくおとなしいがんと言えます。「分化度が高い」というのは、「より正常細胞に近い」ということを意味するからです。低分化や未分化のがん細胞はより悪性度が高いがん細胞です。
「がん細胞の分化を誘導する」というのは、がん細胞を正常細胞に近づけて、悪性度を低下させる方法です。
iPS細胞は皮膚細胞などに最終分化した細胞を未分化な幹細胞の状態に先祖返りさせた細胞です。細胞を初期化してiPS細胞を作る時に導入される多能性誘導因子(いわゆる山中因子)というのは、Oct3/4、Sox2、Klf4、c-Mycの四つです。最終分化した体細胞にこの4種類の遺伝子を導入するとiPS細胞(人工多能性幹細胞)を作成できます。このiPS細胞に他の体細胞への分化を誘導する因子を加えて培養すると心筋細胞や肝細胞など他の体細胞の分化誘導できます。
同様にがん幹細胞に分化誘導因子で処理すると、がん細胞の特性を失った正常な細胞、あるいは幹細胞特性を失った成熟がん細胞に誘導できると考えられます。(図)。

図:最終分化した体細胞に多能性誘導因子(①)を導入すると多能性を持ったiPS細胞(人工多能性幹細胞)が作成できる(②)。iPS細胞に他の体細胞への分化を誘導する因子を加えて培養すると心筋細胞や肝細胞など別の体細胞の分化誘導できる(③)。正常細胞(組織幹細胞)に遺伝子変異が蓄積して(④)、がん幹細胞が発生する(⑤)。がん幹細胞に分化を誘導する因子で処理すると、正常細胞あるいは腫瘍形成能力を失った成熟がん細胞に分化誘導できる(⑥)。
【転写因子が遺伝子発現を調節する】
体を構成する細胞は分化により形態や機能が異なっても、すべて同じ遺伝情報を持っています。遺伝子(遺伝情報を担う構造単位で、通常1つのタンパク質を作り出すことができる)の情報は細胞の核の中にある染色体のDNA(デオキシリボ核酸)に書き込まれています。
一つの細胞核に含まれる染色体の一組をゲノムといい、ヒトの場合1ゲノムは46個(22対の常染色体と1対の性染色体)の染色体があります。1ゲノム中には合計約30億塩基対の塩基配列情報が記録されており、これに含まれる遺伝子の数は22000個程度であることが明らかになっています。
DNAの遺伝情報は、まずRNAポリメラーゼによってメッセンジャーRNA(mRNA)に転写され、さらにmRNAからリボソームでタンパク質に翻訳されます。DNAにはプロモーターやエンハンサーといった転写を制御する領域があり、この領域に結合して遺伝子の転写を促進したり抑制したりするタンパク質を転写因子と言います。つまり、転写因子というのは遺伝子発現を制御する機能を持つタンパク質です。
転写因子は単独で機能する場合もありますが、他のタンパク質と複合体を形成して転写活性を実行する場合もあります。
このようにして、遺伝子(DNA)の情報がメッセンジャーRNAに転写され、さらにタンパク質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います。

図:細胞の遺伝情報は核の中の染色体に記録されている(①)。遺伝子の本体はデオキシリボ核酸(DNA)で、一つの細胞には46個の染色体があり、合計で約30億塩基対の塩基配列情報がDNAに記録されている(②)。遺伝子DNAがメッセンジャーRNA(mRNA)に転写されてタンパク質が作られるためには、RNAポリメラーゼや転写因子などの転写を促進する複数の因子が遺伝子の転写調節領域に結合する必要がある(③)。mRNAはリボソームでタンパク質に翻訳されてタンパク質が生成される(④)。このようにして遺伝子情報からmRNAとタンパク質が合成されて細胞の構造や機能に変化が生じる過程を「遺伝子発現」という(⑤)。
【遺伝子発現を調節する核内受容体とリガンド】
ホルモン(甲状腺ホルモンやステロイドホルモンなど)や脂溶性ビタミン(ビタミンAやビタミンD)や体内で生成される生理活性物質(脂肪酸やプロスタグランジンなど)によって遺伝子発現が調節される場合の転写因子として「核内受容体」というタンパク質があります。
核内受容体というのは、細胞核にあって、ホルモンなどが結合することでDNAの転写を調節している受容体タンパク質です。
核内受容体はリガンドが結合すると、構造の変化を起こして転写因子としての活性を持ちます。
リガンド(ligand)というのは、特定の受容体(レセプター)に特異的に結合する物質のことです。
核内受容体群は,1つの原初遺伝子から分子進化した遺伝子スーパーファミリーを形成しており,そのメンバーはヒトゲノム解読の結果,48種存在すると推定されています。
ステロイドホルモンやビタミンAやビタミンDが特定の遺伝子の発現を調節できるのは、これらが特定の核内受容体への結合を介して、そのリガンド依存的な転写制御を発揮するからです。
核内受容体には、リガンドが結合していないときに細胞質にいるものと細胞核にいるものの2種類があります。前者はリガンドが結合すると核内に移行して遺伝子の転写調節領域に結合します。このクラスに分類される受容体としては、グルココルチコイド、アンドロゲン、プロゲステロン、エストロゲンなどの受容体があります。
後者はリガンド結合には関係なしに核内に局在し、核内でリガンドが結合すると、構造の変化が起こり、標的遺伝子の転写を活性化します。甲状腺ホルモン、オールトランス・レチノイン酸、9-シスレチノイン酸、ビタミンDなどの受容体があります。
いずれにしても、体内の様々な生理活性物質がリガンドとして特定の受容体に結合することによって遺伝子発現が調節されることになります。
また、単なる栄養素と思われていた脂肪酸や、胆汁酸などの代謝産物も核内受容体に結合し、遺伝子転写を制御していることが明らかになっています。
リガンドと同じ働きをする薬をアゴニスト(agonist)、リガンドの働きを阻害する薬をアンタゴニスト(antagonist)と言います。つまり、核内受容体のアゴニストやアンタゴニストは特定の遺伝子の発現を調節する薬になります。

図:核内受容体にリガンドが結合すると受容体の構造に変化が起こり、核内に移行して遺伝子の転写調節領域に結合し、転写を調節する。
【がん細胞の分化を誘導する転写因子の活性化】
細胞の増殖や分化に関連した遺伝子を調節している転写因子を活性化することによって、細胞の増殖抑制や分化を制御できる可能性が指摘されています。
例えば、レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称です。レチノイドは生体内では活性型であるAll-trans retinoic acid (ATRA:オールトランス・レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイドによって発現が調節される遺伝子は細胞の分化や増殖や死(アポトーシス)の制御に重要は働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
Peroxisome Proliferator-activated Receptor (PPAR:ペルオキシソーム増殖因子活性化受容体)もレチノイド受容体と同じく核内受容体の一種です。
細胞内のペルオキシソームの増生を誘導する受容体として発見され、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群です。PPARを活性化する物質は高脂血症や糖尿病の薬として古くから使用されていますが、これらの薬が一部のがん細胞に対して分化誘導やアポトーシス誘導などの抗腫瘍効果を示すことが報告されています。
ビタミンDも核内受容体に作用して遺伝子発現を調節することによって効果を発揮します。ビタミンD はレイチノイドやPPARのリガンドとの相乗効果がありますが、これはビタミンDの核内受容体がレチノイドX受容体(RXR)やPPARとヘテロ2量体を形成して転写因子として作用するからです。
レチノイド受容体やPPARやビタミンD受容体を刺激してがん細胞の分化を誘導し、増殖抑制やアポトーシス誘導を引き起こすことが一部のがんで可能であることが示されています。
【ビタミンAは遺伝子の発現を調節する】
ビタミンAは別名をレチノール(retinol)と言い、脊椎動物の発生過程、細胞分化、生殖、視覚、免疫系の調節などに重要な働きを行っている脂溶性ビタミンです。
レチノールは細胞内で代謝されてレチノイン酸に変換され、レチノイン酸が細胞核内の受容体に結合することによって遺伝子発現を誘導して様々な作用を発揮します。レチノイン酸によって細胞分化や増殖に関連する500以上の遺伝子が誘導されると言われています。
ベータカロテンは体内でビタミンAに変換されます。ベータカロテンやビタミンA(レチノール)は食品から摂取され、レチノールは肝臓で貯蔵されて必要に応じて血中に放出され、血清濃度は1~2μMの範囲で維持されています。
細胞内に取り込まれたレチノールはまずレチノール脱水素酵素によってレチナールアルデヒド(レチナール)に変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid:ATRA)になり、イソメラーゼで9-シス・レチノイン酸(9-cis RA)になります。ATRAと9-cis RAが遺伝子発現に関与します。(下図)

図:ベータカロテンとビタミンA(レチノール)は食品から摂取される。レチノールはレチノール脱水素酵素によってレチナールに変換され、さらにレチナールアルデヒド脱水素酵素によってオール・トランス・レチノイン酸(All-Trans Retinoic Acid: ATRA)になり、さらに9-シス・レチノイン酸(9-cis RA)になる。ATRAはレチノイン酸受容体(RAR)に結合し、9-cis RAはレチノイドX受容体(RXR)に結合し、レチノイン酸応答配列に結合して標的遺伝子の発現を誘導する。レチノイドによって誘導される遺伝子は細胞分化やアポトーシスの誘導や、細胞増殖を抑制する働きに関与するので、がん細胞の増殖を抑制する方向で働く。
【レチノイドは細胞分化を誘導する】
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称で、生体内では活性型であるAll-trans retinoic acid (ATRA:オール・トランス・レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイン酸の核内受容体には、レチノイン酸受容体(retinoic acid receptor: RAR)とレチノイドX受容体(retinoid X receptor: RXR)があり、それぞれα、β、γのサブタイプが存在します。
これらの受容体はリガンドの結合刺激によりホモ二量体(RAR-RARやRXR-RXR)を形成しますが、RXRはRXRとのホモ二量体だけでなく、RARやPPARやビタミンD受容体(VDR)などの核内受容体とのヘテロ二量体(RAR-RXR、PPAR-RXR、VDR-RXRなど)も形成します。
「ホモ」は「同じ」、「ヘテロ」は「異なる」という意味で、同じ受容体が2つ並ぶのがホモ二量体で、異なる2種類の受容体が並ぶのがヘテロ二量体です。
そして、これらの二量体は標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列やレチノイドX応答配列、ペルオキシソーム増殖因子応答配列、ビタミンD応答配列などに結合することによって、様々な標的遺伝子の発現を調節しています。
異性体の関係にあるAll-trans-RA (ATRA) と 9-cis-RA (9C-RA)は2つともRARのリガンドになりますが、RXRのリガンドとなるのは9C-RAのみです。異性体とは分子式は同じで、原子の結合状態や立体配置が違うために異なる性質を示す化合物です。
レチノイン酸受容体(RAR)とレチノイドX受容体(RXR)には、それぞれのリガンドが入り込んで結合するポケット状の構造があるのですが、RARのリガンド結合ポケットにはATRAと9C-RAの両方のレチノイドが納められますが、RXRのリガンド結合ポケットには9C-RAしか納められなくて、ATRAははみ出すからRXRのリガンドとはなれないからです。
レチノイドは炭化水素鎖を基本骨格としており、炭素が水素で飽和している場合はまっすぐな構造をしますが、水素で飽和していない二重結合(CH=CH)の部分で構造が変わります。
すなわち、炭素間に二重結合がある所で曲がる時に、「シス型」と「トランス型」という2種類の構造を取ります。「シス(cis)は「同じ側」「近い方」、トランス(trans)は「反対側」「遠い方」というような意味の接頭辞です。
つまり、二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並びます。シス型の2重結合のところで炭化水素の鎖は曲がります。(下図)
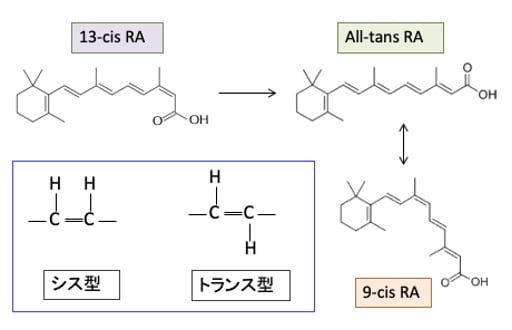
All-trans-RAは全ての不飽和炭化水素鎖がトランス型になっているレチノイン酸で、9-cis-RAというのは9番目の炭素のところでシス型の構造になっているレチノイン酸という意味です。
この構造の違いによって分子式(C20H28O2)は同じでも立体的な大きさに違いが生じるので、RARとRXRの2つの受容体のリガンド結合部位への親和性が異なるということです。
レチノイドによって発現が調節される遺伝子は、細胞の分化や増殖や死(アポトーシス)の制御に重要な働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
例えば、レチノイン酸の二重結合がすべてトランス型になったall-trans retinoic acid(ATRA)は急性前骨髄球性白血病の特効薬になっています。急性前骨髄球性白血病は白血球に分化する途中の骨髄細胞が腫瘍化した白血病で、オールトランスレチノイン酸によって途中で止まった分化を誘導することによって増殖能を失わせ、死滅させることができるのです。
難治性にきびの治療に用いられている13-cisレチノイン酸(イソトレチノイン)は、体内でAll-trans レチノイン酸に変換されて効果を発揮します(下図)。All-trans レチノイン酸は9-cis レチノイン酸に変換します。これらのレチノイドは単独では抗腫瘍効果は弱いのですが、他の治療との組合せで抗腫瘍効果が高まることが報告されています。

図:ビタミンAの体内における活性本体であるAll-trans retinoic acid(ATRA)はレチノイン酸受容体(RAR)に結合するとホモ二量体を形成し、標的遺伝子のプロモーター領域にあるレチノイン酸応答配列(RARE)に結合して遺伝子転写のスイッチをオンにする。ATRAの異性体である9-cis retinoic acidはレチノイン酸受容体(RAR)の他にレチノイドX受容体(RXR)にも結合して、ホモ二量体やヘテロ二量体を形成して細胞核内の受容体に結合して標的遺伝子の転写を誘導して生理機能を発揮する。13-cis retinoic acid(イソトレチノイン)はプロドラッグであり、細胞内でAll-trans RAに変換されて、同様の遺伝子発現の調節を行う。
【イトラコナゾールはオールトランス・レチノイン酸の分化誘導作用を増強する】
イトラコナゾールは、水虫等の白癬菌症、口腔や食道カンジダ症等に広く使用されている真菌治療薬です。
真菌のステロール生合成経路においてラノステロールから エルゴステロールを生成する cytochrome P450 14a-demethylase (P45014DM)という酵素を阻害します。エルゴステロールは真菌細胞膜の主成分であるため、エルゴステロールが生成されないと細胞膜を作れないので真菌は死滅します。
イトラコナゾールには強力な血管新生阻害作用が報告されています。さらに、哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)シグナル伝達系阻害作用、ヘッジホッグシグナル伝達系の阻害作用、Wntシグナル伝達系阻害作用、コレステロールの細胞内輸送を阻害する作用、ミトコンドリアのVDAC1(電位依存性陰イオンチャネル)の働きを阻害する作用など多彩なメカニズムでの抗がん作用が報告されています。

図:イトラコナゾールは多彩にメカニズムで抗がん作用を発揮する。
オールトランス・レチノイン酸(ATRA)で誘導される遺伝子の中に、ATRAを分解する薬物代謝酵素のチトクロームP450酵素のCYP26(CYP26A1とCYP26B1)があります。つまり、ATRAを投与しても、ATRAを分解するCYP26A1の発現を誘導するので、ATRAの効果が減弱します。
イトラコナゾールはCYP26を阻害する作用があります。
ATRAとビタミンD3とフェノフィブラートなどを使ったがん細胞の分化誘導療法は、ATRAを分解する酵素が誘導されるため、十分な効果が得られません。
そこで、最近はATRAを分解するCYP26A1とCYP26B1の阻害剤を併用することが検討されています。 この目的でイトラコナゾールを併用することは試してみる価値があります。(トップの図)
| « 898)がん細胞... | 900) オールト... » |



