がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
626) がん細胞のストレスを亢進するがん治療(その1):2-デオキシグルコースとメトホルミン
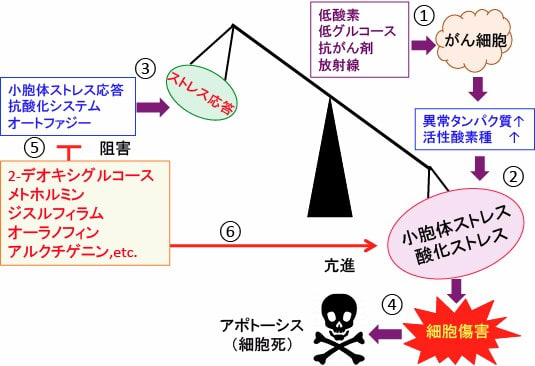
図:がん組織内ではがん細胞は低酸素や低グルコースによるストレスを受け、さらに抗がん剤や放射線もがん細胞にダメージを与える(①)。その結果、がん細胞は異常タンパク質や活性酸素種の産生増加と蓄積によって、小胞体ストレスと酸化ストレスを受ける(②)。これに対して、がん細胞は小胞体ストレス応答や抗酸化システムやプロテアソームにおけるタンパク質分解(オートファジー)などのメカニズムで細胞内ストレスに対して応答して、生存を維持しようとする(③)。このバランスが崩れて、小胞体ストレスおよび酸化ストレスが増強すると、細胞傷害の増大によって細胞死(アポトーシス)が起こる(④)。2-デオキシグルコース、メトホルミン、ジスルフィラム、オーラノフィン、アルクチゲニンは小胞体ストレス応答や抗酸化システムやオートファジーを阻害することによってストレス応答を阻害する(⑤)。さらに、異常タンパク質や活性酸素の蓄積を亢進して小胞体ストレスと酸化ストレスを亢進する(⑥)。がん細胞内のストレスを増強し、ストレス応答による恒常性維持機構を破綻させると、がん細胞を死滅できる。
626) がん細胞のストレスを亢進するがん治療(その1):2-デオキシグルコースとメトホルミン
【固形がんが抗がん剤に効きにくい理由】
白血病は抗がん剤治療が良く効きますが、胃がんや膵臓がんや肺がんなどがん細胞の塊を作る固形がんには、抗がん剤はあまり効きません。白血病はがん細胞(白血病細胞)が血液中に浮遊して増殖しているので、培養細胞と同じように抗がん剤が良く効きます。
固形がんが抗がん剤に抵抗性を示す理由は多数ありますが、その一つが、がん組織における微小環境の存在です。
がん患者の血液中のがん細胞を培養したり、切除したがん組織からがん細胞を採取して培養して、抗がん剤感受性を検査する方法がありますが、この方法でがん細胞が感受性を示す抗がん剤を見つけて使用しても、あまり効果はでません。培養細胞の条件と、体内での塊を作るがん組織中のがん細胞とは性質がかなり異なるからです。
がん組織内では間質細胞(線維芽細胞、炎症細胞、免疫細胞など)や細胞外マトリックスやコラーゲンなどの結合組織の存在が、抗がん剤を効きにくくしています。
例えていうなら、原っぱに出て来た少数の兵士を弓矢や鉄砲で全滅するのは簡単ですが、強固な石垣や城壁で守られた強固な城に大軍で立てこもっている敵は、簡単には攻め落とせないのと似ています。

図:がん組織にはがん細胞だけでなく、マクロファージなどの炎症細胞、リンパ球などの免疫細胞、結合組織を産生する線維芽細胞、血管やリンパ管、細胞外マトリックスなどが間質を構成してる(①)。これらの間質による「がん組織の微小環境」はがん細胞の増殖を支持する働きを担っており、抗がん剤抵抗性の理由の一つになっている(②)。平地にいる少数の兵士を鉄砲や弓矢で全滅することは容易であるが、強固な城に大軍で立て篭った敵を攻め落とすのは非常に難しいのと似ている。
がん細胞は解糖系が亢進し、乳酸と水素イオン(プロトン)の産生が増え、がん組織は酸性化しています。このがん組織の酸性化は、がん細胞の浸潤や転移や結果新生を促進し、抗がん剤抵抗性を亢進し、免疫細胞の働きを抑制します。
さらに、がん組織における栄養飢餓(低グルコース)や虚血や低酸素は酸化ストレスや小胞体ストレスを亢進し、それに対してがん細胞は様々なメカニズムのストレス応答システムを発動して抵抗性を高めます。
すなわち、抗酸化システムや小胞体ストレス応答を亢進し、異常タンパク質をプロテーソームで分解するオートファジーの機序によって抗がん剤抵抗性を高めます。
細胞は弱いストレスを受けると、ストレス耐性を獲得することが知られています。
たとえば、脳組織を30分間虚血にすると虚血の部分の神経組織は、タンパク質の変性が起こって死滅します。しかし、この実験の2日前に5分間だけ虚血にすると、30分間の虚血に対する細胞死に耐性を獲得します。
つまり、弱いストレスを事前に与えると、細胞はストレスタンパク質を作って蓄積しているので、強いストレスに耐性を獲得するのです。熱ストレスやその他のストレスでも同様な現象が起こります。
がん細胞は、このようなストレス応答を利用して、抗がん剤や放射線治療に対する抵抗性を獲得しています。
これが、がん組織からフリーになったがん細胞を培養して抗がん剤感受性試験を行なっても、あまり意味が無いことの理由です。がん組織内の強いストレス下のがん細胞と、単層の培養細胞では、ストレス抵抗性の能力レベルが違うのです。
がん組織における抗がん剤耐性のメカニズムをターゲットにすれば、多くの抗がん剤治療の効き目を高めることができます。

図:がん細胞は解糖系が亢進し(①)、解糖によって産生された水素イオンは液胞型プロトンATPアーゼ(V-ATPases)やモノカルボン酸輸送体(MCT)などによって細胞外に放出される。その結果、がん細胞の外はプロトン(水素イオン)が蓄積して酸性化する(②)。がん組織(細胞外)が酸性化すると、がん細胞の浸潤・転移が促進され、血管新生の亢進、抗がん剤耐性、免疫細胞の活性抑制などが引き起こされる。固形がんのがん組織は栄養飢餓や虚血や低酸素によって(③)、酸化ストレスや小胞体ストレスが亢進し(④)、それに対抗して、抗酸化システムや小胞体ストレス応答やタンパク質分解(オートファジー)によってストレス応答を亢進している(⑤)。その結果、がん細胞は抗がん剤にも耐性となる(⑥)
【細胞はストレスを受けるとストレスに対する抵抗性を高めるメカニズムが存在する】
細胞には様々なストレスに対抗するメカニズムが存在します。その一つが、熱ショックタンパク質やストレスタンパク質や分子シャペロンと言われるタンパク質群です。
熱ショックタンパク質(Heat Shock Protein: HSP)とは、細胞が高い温度(40℃以上)にさらされるなどストレスを受けると誘導されてくるタンパク質です。熱によるタンパク質の変性を抑制して細胞を保護する作用があります。
熱ショックタンパク質は熱だけでなく、グルコース飢餓や虚血や低酸素、活性酸素種による酸化ストレスなどでも誘導されることが分り、細胞が異常なタンパク質を作り出すような病的状態において誘導されるタンパク質ということでストレスタンパク質と呼ばれるようになりました。
さらに、このストレスタンパク質は、折畳み不全の異常なタンパク質の折畳みを正常化する作用があることから「分子シャペロン」と呼ばれるようになりました。シャペロンというのは、社交界にデビューする若いレディにドレスを着せ、舞踏会場まで連れて行く「介添え役」の女性を示すフランス語です。
分子シャペロンとストレスタンパク質は働きとしてはほとんど同じです。平常時に作られて、タンパク質の折り畳みを助ける機能をしているものが分子シャペロンで、ストレス下に速やかに誘導されるものをストレスタンパク質と呼んでいます。
栄養飢餓や虚血や低酸素などのストレスによって小胞体に折畳み不全の異常タンパク質が増える状態を小胞体ストレスと言います。これに対して細胞は分子シャペロンのGRP78という分子シャペロンを増やしたり、タンパク合成を抑制したり、異常タンパク質の分解を促進するなどの方法で小胞体ストレスを軽減するメカニズムを発動します。これを小胞体ストレス応答と言います。
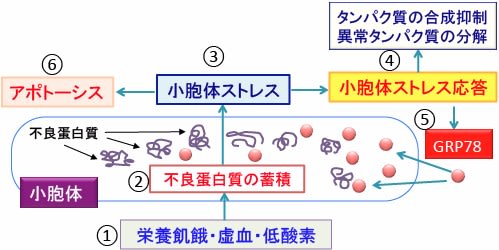
図:栄養飢餓(グルコース枯渇)や虚血や低酸素が起こると(①)、折り畳みに異常をきたした不良タンパク質が小胞体に蓄積する(②)。これを『小胞体ストレス』という(③)。小胞体ストレスに対して細胞はタンパク質の合成を抑制したり、異常タンパク質の分解を促進して小胞体ストレスを軽減する小胞体ストレス応答を引き起こす(④)。さらに、分子シャペロンのGRP78の発現を誘導して、異常タンパク質の折り畳みを助けて、小胞体ストレスを軽減する(⑤)。しかし、強い小胞体ストレスが長期に及ぶと、細胞はアポトーシスによる細胞死を起こす(⑥)。
さらに細胞には、抗酸化酵素や解毒酵素の発現を誘導することによって、活性酸素や有毒物質による害から細胞自身を守る手段や仕組みが備わっています。
例えば、細胞内で活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンやチオレドキシンなどの抗酸化物質の合成を高めたりして、活性酸素の害(酸化ストレス)を軽減しようとします。
放射線治療も抗がん剤治療も活性酸素の産生を高めます。しかし、がん細胞は細胞に備わった抗酸化システムを利用して酸化ストレスを軽減し、酸化還元バランスを維持し、細胞死から免れようとします。
また、グルタチオンSトランスフェラーゼ(GST)などのフェースII(第2相) 解毒酵素と言われる代謝酵素は、様々な発がん物質や有害物質を無毒化する作用があります。
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、これらの活性酸素消去酵素や抗酸化物質(グルタチオンやチオレドキシン)やフェースII解毒酵素が細胞内に誘導され(遺伝子発現が増えたり産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2(Nuclear factor erythroid 2-related factor 2)という転写因子です。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質です。
抗酸化酵素やグルタチオンの産生に関する酵素やフェース2解毒酵素の遺伝子の発現調節領域には、抗酸化反応エレメント(antioxidant response element:ARE)という領域があって、この部分にNrf2が結合するとこれらの遺伝子の転写が促進されるのです。
(下図)。

図:Keap1-Nrf2システムは酸化ストレスや有害物質に対する防御機構において重要な役割を担っている。転写因子のNrf2は細胞質でKeap1によって分解が促進されることによって活性が抑制されている(①)。酸化ストレスが加わると、Keap1の構造が変化してNrf2から離れ、フリーになったNrf2が核内に移行して(②)、抗酸化酵素や解毒酵素の遺伝子の上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合し(③)、これらの遺伝子の発現を亢進する(④)。その結果、放射線や抗がん剤に対する抵抗性が亢進する(⑤)。放射線や抗がん剤は、活性酸素の産生を高め(⑥)、細胞の酸化傷害を引き起こして、細胞増殖を抑制し、細胞死を誘導する(⑦)。酸化ストレスを軽減するために転写因子のNrf2の活性を亢進し、スーパーオキシド・ディスムターゼ(SOD)やカタラーゼやグルタチオン・ペルオキシダーゼなどの活性酸素消去酵素やグルタチオンやチオレドキシンなどの抗酸化物質の産生を高めて、活性酸素による害(酸化ストレス)を軽減している(⑧)。この抗酸化システムの亢進によって、がん細胞は放射線や抗がん剤に抵抗性になる。
【ストレスが強く長期に及ぶと、細胞はアポトーシスを誘導する】
細胞の死は生体の死とも似ています。細胞も生体も困難な状況やストレスが起こると、それを軽減し耐えるような応答が起こって、細胞や生体は恒常性を維持して生きようと必死に抵抗します。
しかし、ストレスの状況が強く長期に及ぶと、恒常性維持機能や抵抗力も限界を迎えて、死(アポトーシス)を選びます。
がん細胞は、正常な細胞に比べてストレスの多い状況で生きています。それは、低酸素や低グルコースや異常タンパク質の蓄積や活性酸素の産生増加などによって細胞内でストレスの高い状況が起こっているのです。
ストレスの代表が小胞体ストレスや酸化ストレスです。
この小胞体ストレスと酸化ストレスをがん細胞に特異的に高めることによってがん細胞を選択的に死滅させようという治療法が注目されています。
小胞体ストレスと小胞体ストレス応答は極めて複雑なので、次回解説します。ここでは、様々なストレスで細胞内で折り畳み不全の異常タンパク質が増えて細胞にストレスを引き起こすことを「小胞体ストレス」と言い、小胞体ストレスを軽減するための細胞応答が「小胞体ストレス応答」とだけ理解しておいて下さい。

図:細胞は様々なストレスや細胞傷害によって(①)恒常性維持機構が破綻すると死滅する(②)。これに対して、小胞体ストレス応答や抗酸化システムやプロテアソームにおけるタンパク質分解(オートファジー)などのメカニズムで細胞内ストレスに対して応答し(③)、恒常性を維持することによって生存を保っている(④)。がん細胞は低酸素や低グルコースや異常タンパク質の蓄積や活性酸素の産生増加によってストレスや細胞傷害を受けている(⑤)。これに対してがん細胞は小胞体ストレス応答や抗酸化システムやプロテアソームの働きなどでストレスを軽減しているが、これらの阻害すると(⑥)、細胞内ストレスの増強によって細胞死が誘導される(⑦)。
抗がん剤治療や放射線治療は、がん細胞に小胞体ストレスや酸化ストレスを高めて死滅させます。これに対して、がん細胞や小胞体ストレス応答や抗酸化システムを亢進して、対抗します。
このがん細胞の抵抗(小胞体ストレス応答や抗酸化システム)を阻害すると、抗がん剤治療や放射線治療の効果を高めることができます。

図:抗がん剤や放射線照射はがん細胞に小胞体ストレスや酸化ストレスを高める(①)。これに対して、がん細胞は小胞体ストレス応答や抗酸化システムやプロテアソームによるタンパク質分解(オートファジー)などのメカニズムで抵抗するが、これらのストレス応答をがん細胞に選択的に阻害することもできる(②)。ストレス応答を阻害するとがん細胞の細胞傷害が亢進し(③)、アポトーシス(細胞死)を誘導できる(④)。
【Nrf2はがん細胞のストレス抵抗性獲得に重要な働きを担っている】
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、活性酸素消去酵素や抗酸化物質(グルタチオンやチオレドキシン)やフェースII解毒酵素が細胞内に誘導され(遺伝子発現が増えたり産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2という転写因子です。
ヒトの肺がんなど多くの固形腫瘍でNrf2機能の異常亢進が見つかっています。そして、Nrf2の活性が高いと治療に抵抗性で予後が不良であることが報告されています。
Nrf2は解毒酵素、抗酸化タンパク質、薬剤排出トランスポーターなどの遺伝子を統括的に活性化することにより、がん細胞の抗がん剤耐性と放射線耐性をもたらします。
さらに、Nfr2はグルコースやグルタミンの代謝を変化させて細胞増殖に有利な同化反応を促進します。
Nrf2はがん細胞のペントースリン酸経路を活性化して、核酸とNADPHの産生を増やすことで細胞増殖を亢進します。NADPHはグルタチオンの合成にも必要です。
多くのがん細胞では、酸化ストレスの有無とは関係なくNrf2の発現量と活性が亢進しています。その理由は、RASやMYCなどのがん遺伝子がNrf2を活性化しているからです。
Nrf2の活性を抑制するKeap1の遺伝子変異によってNrf2が活性化する場合も見つかっています。
恒常的に安定化したNrf2は酸化ストレスや抗がん剤/放射線治療に対する抵抗性を増強し、さらに積極的に細胞増殖を促進することになります。
抗がん剤治療や放射線治療によって活性酸素が増えると、がん細胞はさらにNrf2の量を増やして抵抗性を獲得してきます。
このようにNrf2の活性化はがん細胞が治療に対する抵抗性を獲得するメカニズムとして重要です。したがって、がん細胞のおけるNrf2の機能阻害は、抗がん剤治療の有効な戦略となります。
【小胞体ストレスもNrf2を活性化する】
転写因子のNrf2は酸化ストレスによって活性化し、抗酸化酵素や解毒酵素の発現を亢進します。
このNrf2が小胞体ストレスによっても活性化されることが最近報告されています。小胞体ストレスは次回詳しく解説しますが、折り畳みが不完全な異常タンパク質が小胞体に蓄積して細胞にストレスが生じることです。この小胞体ストレスがNrf2を活性化するということです。以下のような報告があります。
ROS-independent ER stress-mediated NRF2 activation promotes warburg effect to maintain stemness-associated properties of cancer-initiating cells(活性酸素種に依存しない小胞体ストレスを介するNRF2活性化はワールブルグ効果を促進し、がん起始細胞の幹細胞の特徴を維持する)Cell Death & Disease, volume 9, Article number: 194 (2018)
【要旨】
がん起始細胞(Cancer-initiating cells)は腫瘍の発生や進展や治療抵抗性において重要な役割を担っている。さらに、酸化還元状態の恒常性維持(redox homeostasis)はがん幹細胞の調節に重要である。
以前の研究において、細胞内活性酸素種レベルの低いがん細胞(ROSLow cells)ががん起始細胞の機能を強化していることを明らかにした。しかしながら、がん起始細胞に特徴的な代謝については多くは不明であり、さらなる研究が必要である。この研究では、がん起始細胞が解糖系への依存が高く、これが幹細胞の性質の維持に重要であることを明らかにした。
次に、抗酸化システムの制御に重要な働きを担っているNRF2が、がん起始細胞内の活性酸素種のレベルと低い状態に維持していることを明らかにした。
我々はさらに、NRF2の活性化ががん起始細胞の幹細胞の特性の維持に必要であることを明らかにした。
活性酸素種レベルの低い細胞(ROSLow cells)においては、NRF2の活性化は、解糖系酵素をコードする遺伝子の転写を直接活性化するだけでなく、ピルビン酸脱水素酵素キナーゼ1(PDK1)を直接活性化してピルビン酸からアセチルCoAへの変換を阻害してTCA回路を阻害する。その結果、ワールブルグ効果を促進する。
活性酸素種に非依存性の小胞体ストレス経路(GRP78/p-PERK/NRF2経路)が、がん起始細胞の代謝シフト(ワールブルグ効果)と幹細胞特性の維持に関与することが確認された。
最後に、p-PERK(リン酸化PERK)とp-NRF2(リン酸化NRF2)の同時発現は、臨床転帰(予後)と有意に関連していた。
我々のデータは、活性酸素種による酸化ストレスとは無関係に、NRF2が、幹細胞の活性酸素種の低レベル状態の維持、およびがん幹細胞の性質の維持に関与し、その結果、がん患者の臨床転帰(予後)に有意に関連することを示している。
NRF2活性化を阻害する方法は、がん起始細胞をターゲットにする有望な治療法になる可能性がある。
がん起始細胞(Cancer-initiating cells)もがん幹細胞(cancer stem cell)も同義です。両方とも、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。がん幹細胞ではNRF2の発現が亢進し、酸化ストレスを低いレベルに抑えて死ににくくし、がん幹細胞の性状の維持に重要な役割を担っていることを示しています。この論文をまとめると以下のようになります。

図:PERK(PKR-like endoplasmic reticulum kinase)といキナーゼはGRP78と結合して小胞体膜に存在する(①)。栄養飢餓や虚血や低酸素によって折り畳み不全の不良蛋白質が産生される(②)。小胞体に不良タンパク質が蓄積する状況を小胞体ストレスという(③)。GRP78は分子シャペロンで、折り畳み不全タンパク質の折り畳みを正常化し、これは小胞体ストレス応答の一つになる(④)。GRP78が小胞体ストレス応答に対応するために不良蛋白質と結合すると、PERKはフリーになり、二量体を形成して自己リン酸化する(⑤)。リン酸化したPERKはNRF2をリン酸化し(⑥)、リン酸化したNRF2は遺伝子の抗酸化剤応答配列ARE(antioxidant response element)に結合して(⑦)、抗酸化酵素や解糖系酵素の遺伝子の発現を亢進し、ペントース・リン酸経路や分子シャペロン発現を亢進し、ミトコンドリアでの酸化的リン酸化を抑制する(⑧)。これらの応答は、ワールブルグ効果(解糖系の亢進とミトコンドリアでの酸化的リン酸化の抑制)とがん幹細胞の性状の維持を促進する(⑨)。がん細胞におけるNRF2活性の亢進はがん患者の予後不良と関連する(⑩)。
小胞体膜貫通型キナーゼであるPERKは、小胞体ストレスを感知すると二量体(ダイマー)やオリゴマーを形成し、自己リン酸化によって活性化します。活性化したPERKは翻訳開始因子の一つであるeIF2α(eukaryotic initiation factor 2α)をリン酸化します。このリン酸化によってeIF2αは翻訳開始複合体を形成することができず、結果として細胞内のmRNAの翻訳が抑制され、全般的にタンパク質の翻訳が抑制されます。
活性酸素種の発生はミトコンドリアが主です。がん細胞ではミトコンドリアでの酸化的リン酸化を抑制することによって活性酸素種の産生を抑えています。そのため、がん細胞はグルコースの取込みを亢進し、解糖系が亢進しています。これをワールブルグ効果と言います。
NRF2の活性がワールブルグ効果と関連することが知られています。つまり、NRF2の活性亢進はワールブルグ効果を亢進します。
また、NRF2活性はがん幹細胞で亢進しています。NRF2は活性酸素のレベルを低下させ、ワールブルグ効果を促進して、がん幹細胞の自己複製能などの幹細胞の性状の維持に重要な働きを担っているということです。
したがって、解糖系の阻害やNRF2の活性阻害はがん幹細胞の増殖を阻止できます。
実際、解糖系とNRF2活性を阻害する2-デオキシグルコース(2-DG)はがん幹細胞の性状のマーカー(OCT4とCD44)の発現を抑制します。
この論文では、NRF2の活性は、活性酸素種による酸化ストレスとは無関係にGrp78/p-PERKシグナル伝達系で直接活性化されることを報告しています。
【2-デオキシ-D-グルコースとメトホルミンはがん細胞特異的にNrf2活性を阻害する】
Nrf2の転写活性を介した抗酸化酵素や解毒酵素の発現にはグルコースの供給が必要であるという報告があります。
Glucose availability is a decisive factor for Nrf2-mediated gene expression.(グルコースの供給がNrf2を介した遺伝子発現のための決定的な要因である)Redox Biol. 2013 Jun 21;1(1):359-65.
この論文では、スルフォラファンでNrf2を活性化する方法や、Nrf2を阻害するKeap1遺伝子を機能欠損させる方法(遺伝子ノックアウト)でNrf2の活性を亢進する方法で実験しています。
Nrf2を活性化するとグルコースの取込みが増え、ペントースリン酸経路でのNADPHの産生が増えることが示されています。
そして、グルコースの供給や取込みを阻害するか、あるいはペントースリン酸経路を阻害してNADPHの産生を阻害すると、Nrf2を介した遺伝子発現が抑制され、抗酸化酵素や解毒酵素の発現が抑制されることが示されています。
つまり、ケトン食や2−デオキシグルコースなどで、がん細胞におけるグルコースの取込みやペントースリン酸経路を抑制する方法は、グルコースの取込みが亢進しているがん細胞に選択的にNrf2の活性を阻害できる可能性があります。
メトホルミンががん細胞のNrf2活性を抑制して抗腫瘍作用を示すことが明らかになっています。以下のような報告があります。
Metformin inhibits heme oxygenase-1 expression in cancer cells through inactivation of Raf-ERK-Nrf2 signaling and AMPK-independent pathways.(メトホルミンはRaf-ERK-Nrf2 シグナル伝達系とAMPK非依存的経路の阻害によってがん細胞のヘムオキシゲナーゼ-1を阻害する)Toxicol Appl Pharmacol. 2013 Sep 1;271(2):229-38.
ヘムオキシゲナーゼ-1は、ヘム(heme)をビリベルジン(biriverdin)と一酸化炭素(CO)と遊離鉄(Fe)に分解する酵素です。ビリベルジン(緑色の色素)は、ビリベルジン・リダクターゼ(biriverdin reductase)により、ビリルビン(bilirubin:黄疸の時の黄色の色素)に分解されます。このヘム分解により産生れるビリベルジンとビリルビンには強力な抗酸化作用があり、酸化ストレスによる細胞傷害を抑制します。
メトホルミンはRaf-ERKシグナル伝達系を抑制しNrf2の発現量を減らす効果があることを報告しています。
五環系トリペルペノイドのウルソール酸(Ursolic acid)は白花蛇舌草や夏枯草などの抗がん作用のある生薬に含まれています。このウルソール酸がNrf2を阻害するという報告があります。
Ursolic acid sensitizes cisplatin-resistant HepG2/DDP cells to cisplatin via inhibiting Nrf2/ARE pathway(ウルソール酸はNrf2/ARE経路を阻害することによってシスプラチン耐性HepG2/DDP細胞をシスプラチン感受性にする)Drug Des Devel Ther. 2016 Oct 25;10:3471-3481.
この論文では、ウルソール酸が肝臓がん細胞のシスプラチン耐性を阻止して、シスプラチンに対する感受性を高めることを報告しています。
ウルソール酸とシスプラチンの併用は、肝臓がん細胞の活性酸素の産生を高め、細胞周期をG0/G1で停止し、ミトコンドリア膜電位を低下させ、アポトーシスを誘導しました。
さらに、Nrf2の発現を抑制し、Nrf2によって転写が促進される遺伝子の発現低下が認められました。
以上の結果から、ウルソール酸はNrf2/ARE(/antioxidant response element)経路を阻害するメカニズムで、肝臓がん細胞のシスプラチン耐性を阻止するという結論です。
ウルソール酸は白花蛇舌草(フタバムグラの全草)、夏枯草(シソ科ウツボグサの花穂)、大棗(クロウメモドキ科ナツメの果実)、女貞子(モクセイ科トウネズミモチの果実)、連翹(モクセイ科レンギョウの果実)、枇杷葉(バラ科ビワの葉)、柿蔕(柿のヘタ)などに多く含まれます。
つまり、2-デオキシグルコースやメトホルミンやウルソール酸を含む生薬を使った漢方薬はNrf2の阻害によって、がん細胞のストレス抵抗性を阻止できるかもしれません。

図:放射線照射や抗がん剤はがん細胞の活性酸素の産生を高め(①)、細胞増殖抑制や細胞死誘導を引き起こす(②)。がん細胞はNrf2の活性を亢進し(③)、活性酸素消去酵素や抗酸化物質の産生を増やすことによって活性酸素種を消去し、酸化ストレスを軽減している(④)。2-デオキシ-D-グルコース(2-DG)とメトホルミンとウルソール酸はNrf2の活性を阻害する作用が報告されている(⑤)。
【2-デオキシ-D-グルコースはがん細胞に小胞体ストレスを引き起こす】
がん細胞の性質は多様で不均一ですが、ほとんどのがん細胞に共通しているのは、エネルギー産生(ATP産生)をミトコンドリアにおける酸素呼吸(酸化的リン酸化)ではなく、細胞質における解糖系に依存していることです。これはワールブルグ効果(Warburg effect)として知られています。
解糖系阻害剤の一つが、代謝されないグルコース類縁物質の2-デオキシ-D-グルコース(2-DG)です。
2-DGはグルコースと同じトランスポーター(輸送担体)で取り込まれるので、細胞内の取込みの段階でグルコースの拮抗阻害剤として作用します。
細胞内では、ヘキソキナーゼによってリン酸化されて、2-デオキシグルコース-6リン酸(2-DG-6リン酸)に変換されますが、この2-DG-6リン酸は解糖系の先の代謝系には進めない(ヘキソキナーゼの先の解糖系酵素で代謝できない)ので、細胞内に蓄積します。
蓄積した2-DG-6リン酸は解糖系酵素のヘキソキナーゼとグルコースリン酸イソメラーゼをフィードバックで阻害する作用があり、取り込まれたグルコースの解糖系やペントースリン酸回路での代謝を阻害し、ATPやNADPHや核酸の産生を低下させます。
さらに、2-DGはタンパク質のN-グリコシル化(N-glycosylation)を阻害するので小胞体ストレスを誘導します。(2-DGがタンパク質のO-結合型Nアセチルグルコサミンの除去を阻害する作用もあることは515話で紹介)

図:2-デオキシ-D-グルコース(2-DG)はグルコース(ブドウ糖)の2位のOHがHに変わっているグルコース類縁物質で、グルコースと同様にグルコーストランスポーター(GLUT1)によって細胞内に取り込まれる(①)。ヘキソキナーゼで2-DG-6リン酸(2-DG-6-PO4)になるが、それから先の解糖系酵素では代謝できないので細胞内に蓄積する(②)。蓄積した2-DG-6リン酸はヘキソキナーゼをフィードバック的に阻害するので、グルコースの解糖系での代謝を阻害してATP産生を阻害する(③)。2-DGはペントースリン酸経路(PPP: Pentose Phosphate Pathway)を阻害して核酸合成を阻害する(④)。さらにNADPHの産生を低下させ、抗酸化力を低下させて酸化ストレスを高める(⑤)。2-DGは小胞体でのタンパク質のN-グリコシル化(糖鎖の結合による修飾)を阻害し、折り畳みの不完全な異常タンパク質(unfolded protein)を増やして小胞体ストレスを引き起こす(⑥)。酸化ストレス亢進に対して、がん細胞はチオレドキシンやグルタチオンなどの抗酸化システムを亢進して細胞死に抵抗性を示す(⑦)。小胞体ストレスに対しては、シャペロンタンパク質の合成亢進などの小胞体ストレス応答を亢進して、細胞死に抵抗性を示す(⑧)。
2-デオキシグルコースとメトホルミンの他にも、ジスルフィラムとオーラノフィンはプロテアソームの阻害や、抗酸化システムの阻害などで小胞体ストレスを増強します(573話参照)。
ゴボウシ(牛蒡の種)に含まれるアルクチゲニンは、グルコース枯渇下でがん細胞に小胞体ストレスを引き起こします(298話、311話参照)。
すなわち、2-デオキシグルコース、メトホルミン、ジスルフィラム、オーラノフィン、アルクチゲニンの組合せは、小胞体ストレス応答や抗酸化システムやオートファジーを阻害することによってストレス応答を阻害します。さらに、異常タンパク質や活性酸素の蓄積を亢進して小胞体ストレスと酸化ストレスを亢進します。
これらを組み合せてがん細胞内のストレスを増強し、ストレス応答による恒常性維持機構を破綻させると、がん細胞を死滅できます(トップの図)。
| « 625) Wnt/βカ... | 627) がん細胞... » |



