がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
491)ケトン体治療(その1):生理的ケトーシス
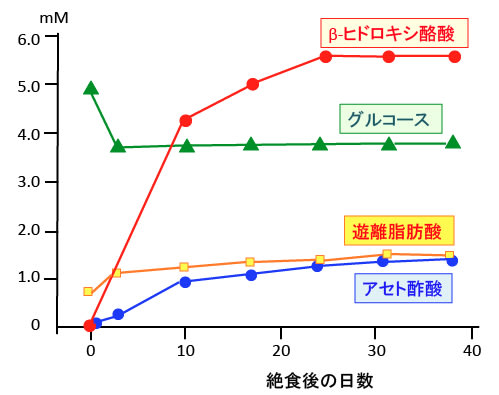
図:肥満者に40日間の絶食を行った場合のβ-ヒドロキシ酪酸、アセト酢酸、グルコース(ブドウ糖)、遊離脂肪酸の血中濃度の推移を示す。絶食で起こる生理的ケトン症(ケトーシス)ではケトン体(β-ヒドロキシ酪酸+アセト酢酸)の血中濃度は6~8mM(mmol/L)程度を上限にしてそれ以上は増えないので酸性血症(アシドーシス)にはならない。(出典:N Eng J Med. 282: 668-675, 1970年)
491)ケトン体治療(その1):生理的ケトーシス
【グルコース(ブドウ糖)と脂肪酸を燃焼してエネルギーを産生する】
血液中には血糖として空腹時で70~110mg/dl(4~6 mmol/L)の濃度でグルコース(ブドウ糖)が存在します。体内では糖質はグリコーゲンとして貯蔵されており、必要に応じてグリコーゲンが分解してグルコースを血中に放出することによって血糖を維持しています。グリコーゲンはグルコースが多数結合したもので、主に肝臓や筋肉に貯蔵されています。
グリコーゲンは、動物の体内でエネルギーを一時的に保存しておくための物質で、脂肪に比べると利用しやすいかわりに、短時間で枯渇する欠点を持っています。
一方、脂肪は体積当たりのエネルギー量が糖質より大きく、長期的なエネルギーの保存に適した物質と言えます。
絶食すると体内に蓄積されたグリコーゲンは半日から1日くらいで無くなってしまいますが、血糖を維持する必要があるので、グルカゴンというホルモンの働きで、ピルビン酸や乳酸や一部のアミノ酸など糖質以外の物質からグルコースを産生します。これを糖新生と言い、肝臓と腎臓で行われます。
(Cahillの論文では、絶食時に肝臓で60%、腎臓で40%のグルコースが作られると記述されている)
食事からの糖質の補充がなければ、体に蓄えられている脂肪を分解してエネルギー(ATP)を産生するようになります。
脂肪は1分子のグリセロール(グリセリン)と3分子の脂肪酸が結合した構造をしています。糖質の貯蔵が枯渇すると体内の脂肪細胞に貯蔵された脂肪が脂肪分解酵素(リパーゼ)の働きでグルセロールと遊離脂肪酸に分解され、血液に入って他の組織に運ばれます。
グリセロールは肝臓で代謝され、糖新生によってグルコースに変換されます。一方、脂肪酸は筋肉や肝臓や心臓など他の臓器・組織の細胞に運ばれ、そのミトコンドリアで分解(酸化)されてエネルギーを産生します。脂肪酸がエネルギーを産生するために燃焼する反応をβ酸化と言います。
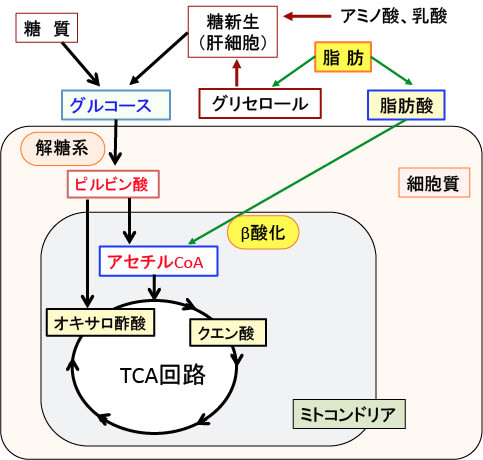
図:食事中の糖質はグルコース(ブドウ糖)に分解されて細胞質の解糖系でピルビン酸になり、ミトコンドリアでアセチルCoAに変換されてTCA回路で代謝される。脂肪は脂肪酸とグリセロールに分解され、グリセロールは肝臓で糖新生によってグルコースに変換されてエネルギー源になる。脂肪酸はミトコンドリアでβ酸化によって分解されてアセチルCoAになってTCA回路で代謝される。乳酸や一部のアミノ酸も糖新生の材料になってエネルギー源となる。
β酸化(ベータさんか)とは脂肪酸を酸化して脂肪酸アシルCoA(fatty acyl-CoA; 脂肪酸と補酵素Aのチオエステル)を生成し、そこからアセチルCoAを取り出す代謝経路のことです。脂肪酸アシルCoAのβ位において段階的な酸化が行われることからβ酸化と名付けられました。
β酸化は4つの反応の繰り返しから成り、反応が一順するごとにアセチルCoAが1分子生成され、最終生産物もアセチルCoAとなります。生成されたアセチルCoAはTCA回路(クエン酸回路、クレブス回路)に送られ、酸化的リン酸化を経てATP産生に使われます。動物細胞では脂肪酸からエネルギーを取り出すための重要な代謝経路です。脂肪酸のβ酸化はミトコンドリアで行われます。

図:脂肪酸の分解(β酸化)はミトコンドリアで行われ、アセチルCoAが産生される。長鎖脂肪酸はカルニチンが無いとミトコンドリアに入れないが、中鎖脂肪酸はカルニチンの助けなしにミトコンドリアに運ばれ、β酸化で代謝される。
【グルコースが枯渇した状況で脂肪酸が燃焼するとケトン体が産生される】
通常は、細胞が必要なエネルギー(ATP)は、グルコース(ブドウ糖)がピルビン酸とアセチルCoAを経てTCA回路(クエン酸回路)で代謝され、さらに酸化的リン酸化によって産生されます。
一方、脂肪酸からエネルギーを産生する場合は、脂肪酸が分解(β酸化)されてアセチルCoAになり、このアセチルCoAがミトコンドリアのTCA回路で代謝されてATPを作り出します。
脂肪酸の酸化で作られるアセチルCoAの多くはTCA回路(クエン酸回路)に入りますが、絶食時などグルコースの供給が少ない状況ではアセチルCoAをTCA回路で処理する時に必要なオキサロ酢酸が不足するためTCA回路が十分に回りません。そのためTCA回路で処理できなかった過剰のアセチルCoAは肝臓でケトン体の合成に回されます(図)。
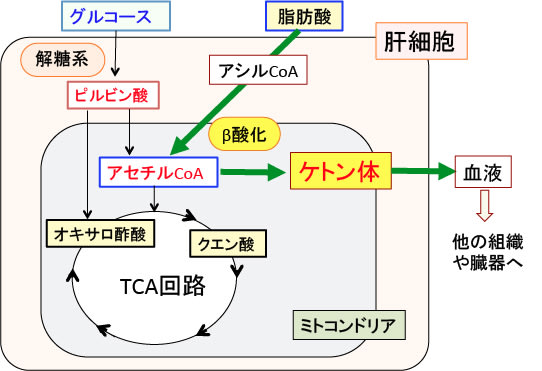
図:TCA回路の最初のステップはアセチルCoAとオキサロ酢酸が結合してクエン酸になる反応で、オキサロ酢酸はピルビン酸からできるので、グルコース(ブドウ糖)が枯渇した条件では、アセチルCoAはケトン体合成へ振り分けられる。ケトン体は肝細胞から血液で他の組織や臓器に運ばれて、その細胞のミトコンドリアで代謝されてエネルギー源となる。
肝細胞では、脂肪酸が分解されてできたアセチルCoAの一部はアセトアセチルCoAになり、3-ヒドロキシ-3-メチルグルタリル-CoA(HMG-CoA)を経てアセト酢酸が生成され、これは脱炭酸によってアセトンへ、還元されてβ-ヒドロキシ酪酸へと変換されます。
このアセト酢酸、βヒドロキシ酪酸、アセトンの3つをケトン体と言います(図)。
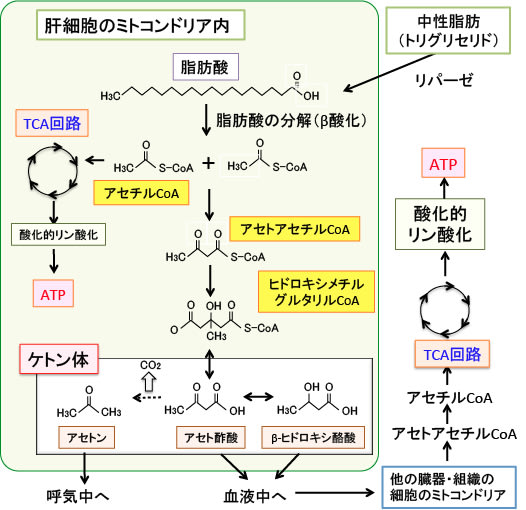
図:グルコースが枯渇した状態で脂肪の摂取を増やすと、肝臓では脂肪酸のβ酸化が亢進されて生成されたアセチルCoAはケトン体の産生に振り分けられる。アセト酢酸とβ-ヒドロキシ酪酸は血液を介して他の組織や細胞に運ばれて、アセチルCoAに変換されてTCA回路でATP産生に使用される。
ケトンは R−C(=O)−R'の構造式で表される有機化合物です。酸素と二重結合している炭素の両脇が炭素である化合物をケトンと言います。β-ヒドロキシ酪酸はケトン基を持っていない(ケトン基が還元されて水酸基になっている)ので、正確にはβ-ヒドロキシ酪酸はケトンとは言えませんが、ケトンのアセト酢酸に変換されて代謝されるので、ケトン体に含められています(図)。

図:グルコースの供給が少ない状況では、肝臓では脂肪酸の燃焼(β酸化)で産生されたアセチルCoAからアセト酢酸の合成が亢進する。アセト酢酸は脱炭酸によってアセトンへ、還元されてβヒドロキシ酪酸へと変換される。このアセト酢酸、βヒドロキシ酪酸、アセトンの3つをケトン体と言う。β-ヒドロキシ酪酸はケトン基を持っていないので正確にはケトンとは言えないが、アセト酢酸と相互に変換されるのでケトン体に含まれている。
ケトン体は肝臓(ケトン体を利用する酵素が無い)と赤血球(ミトコンドリアが無い)以外の細胞でエネルギー源として利用されます。
脂肪酸と違ってケトン体は水溶性であるため、特別な運搬蛋白質の助けがなくても肝臓からその他の臓器(心臓や筋肉や腎臓や脳など)に効率よく運ばれ、細胞内でケトン体は再びアセチル-CoAに戻され、TCA回路で代謝されてエネルギー源となります。
この際、エネルギー産生に使われるのはアセト酢酸のみで、β-ヒドロキシ酪酸はアセト酢酸に変換されて初めてエネルギー代謝に使用され、アセトンはエネルギー源にはならず呼気から排出されます(下図)。
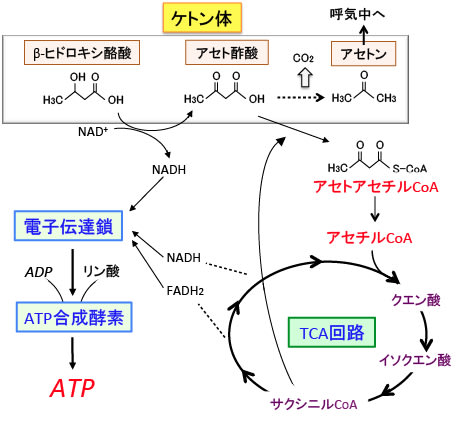
図:肝臓で生成されたケトン体(アセト酢酸とβ-ヒドロキシ酪酸)は肝臓以外の組織の細胞に運ばれミトコンドリアのTCA回路と電子伝達系でATP産生に使われる。すなわち、βヒドロキシ酪酸からアセト酢酸への変換時とTCA回路での反応でNADHやFADH2に捕捉された電子は電子伝達鎖で受け渡され、最終的にATP合成酵素によってATPが合成される。
【血液中のケトン体が増えた状態をケトーシス(ケトン症)と言う】
70kgの普通の体型の成人で、体脂肪は12kg程度、グリコーゲンの貯蔵は肝臓に100g以下、筋肉に400g以下です。体内のグリコーゲン貯蔵は最大で500g以下です。500gのグリコーゲンは2000キロカロリーに相当します。従って、通常は一日の絶食によって肝臓と筋肉のグリコーゲンは消費されてしまいます。
そのまま何も食事を摂取しないでグリコーゲンが枯渇すると、グルカゴンが分泌され、インスリンは減少して、脂肪組織から脂肪酸が遊離し、筋肉組織でエネルギー源として利用され、肝臓では脂肪酸からケトン体が産生されます。
通常、朝起きたときのケトン体のレベルは0.1~0.3mMです。
食後には減少します。
ケトン体(主にβヒドロキシ酪酸)の濃度は、24時間の絶食で0.3~0.5mM(mmol/L)、2~3日間の絶食で1~2mMと増えていきます。
血液中にケトン体が増えている状態をケトーシス(ケトン症)と言います。
通常は血中のブドウ糖濃度は4~5 mmol/L(mM)程度に対して、ケトン体の血中濃度は0.3mmol/L(mM)以下と極めて低値です。しかし、絶食すると数日で増え始め、10日くらいするとブドウ糖濃度を超え、脳の神経細胞もケトン体が主なエネルギー源になります。
絶食時にケトン症が起こるのは、脳の神経細胞にエネルギー源を供給するための生理的な現象で、生理的ケトーシスと言います。生理的ケトーシスという用語はTCA回路(クエン酸回路)の発見で1953年にノーベル生理学・医学賞を受賞したハンス・クレブスが最初に用いています。
【長期間の絶食ではケトン体は6~8mMくらいに上昇する】
断食療法が多くの病気の治療や健康増進に有効であることは経験的に知られていますが、その作用機序の一つが脂肪の燃焼とケトン体の産生にあります。ケトン体には様々な健康作用が明らかになっています。
絶食して2~3日後にはケトン体のβ-ヒドロキシ酪酸は血中濃度が1~2mM(mmol/L)程度に増え、7~10日後にはβ-ヒドロキシ酪酸の血中濃度はは4~5mMくらいまで増えます。20日間以上の絶食では6~7mMくらいに増えます。(トップの図参照)
アセト酢酸を含めた総ケトン体量としては7~8mM程度まで上昇します。人によっては血中総ケトン体濃度が10mMくらいまで上がる人もいるようですが、これは肝臓でのケトン体産生能と組織での消費のバランスによるためです。
しかし、肝臓での産生能に限界があるのと、他の組織でエネルギー源として使用されるため、無制限には上昇しません。
長期の絶食でも通常はケトン体濃度は6~8mM程度であり、この濃度であれば酸性血症(アシドーシス)にはなりません。
通常の血液のpH(水素イオン指数)は7.4です。ケトン体のアセト酢酸とβ-ヒドロキシ酪酸は酸性が強いので、ケトン体が血中に多くなると血液や体液のpHが酸性になります。
しかし、血液には緩衝作用があるので、長期の絶食で起こりうる6~8mM程度の血中ケトン体濃度では、酸性血症(アシドーシス)にはなりません。
1型糖尿病でインスリンの働きが無い状態で脂肪の分解が進むと、血糖は300mg/dl以上、血中ケトン体濃度は25mM以上になり、血液は酸性(pHが7.3以下)になります。
このようにケトン体が増えて血液や体液が酸性になった状態をケトアシドーシス(ketoacidosis)と言います。
1型糖尿病におけるケトアシドーシスは病的なケトン症で、適切な治療を行わないと死に至ります。
一方、長期の絶食によるケトン症は生理的なケトン症(生理的ケトーシス)であり、全く病的な問題は起こしません。むしろ健康作用の方が多く指摘されています。
糖尿病性ケトアシドーシスでは高血糖と20mM以上の高ケトン血症によって生命が危険な状態になりますが、絶食やケトン食による生理的なケトン血症ではアシドーシスにはならないのです(表)。
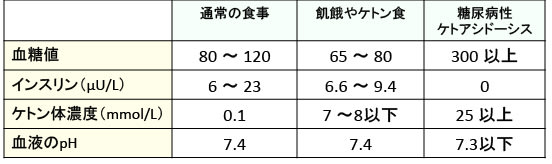
表:糖尿病生ケトアシドーシスはインスリンが分泌されない状況で発症し、血糖値は300 mg/dL以上になりケトン体の血中濃度は25mmol/L(25mM)以上になって血液のpHは7.3以下になってアシドーシス(酸性血症)になる。一方、飢餓やケトン食では血糖値は正常範囲に維持され、ケトン体濃度は8mmol/L(8mM)を超えることは無い。ケトン体が8mmol/L以下の場合は、血液の緩衝作用によって血液が酸性になることはない。(出典:Int J Environ Res Public Health. 11(2):2092-2107, 2014)
ケトン体は肝細胞と赤血球(ミトコンドリアが無い)を除く全ての細胞で利用でき、日常的に産生されています。
糖質を普通に摂っている人での血中ケトン体(アセト酢酸とβヒドロキシ酪酸の合計)の基準値は26~122μmol/Lです。絶食すると数日で血中ケトン体は基準値の30~40倍もの高値(1~6mmol/Lのレベル)になりますが、インスリンの作用が保たれている限り安全です。
一時的に酸性血症(アシドーシス)になることもありますが、血液の緩衝作用によって直ぐに正常な状態に戻ります。
つまり、ケトン体の上昇が怖いのは、インスリンの作用不足がある糖尿病の場合で、糖尿病性ケトアシドーシスはインスリン作用の欠乏を前提とした病態です。断食や糖質制限に伴うケトン体産生の亢進の場合は生理的であり、インスリン作用が正常であれば何の問題もないと言えます。
【胎児や新生児はケトン体をエネルギー源にしている】
妊娠すると子宮内に胎盤という器官が形成されます。胎児は胎盤を介して母体から栄養や酸素を受け取ります。胎盤の内側には臍帯があり胎児につながっており、胎盤の外側には絨毛といわれる細い糸状組織が密生していて、これが子宮の壁に根のように入り込んでいます。胎児は絨毛を通して母親の血液から酸素と栄養を受け取っています。
宗田マタニティクリニック院長の宗田哲男先生は、胎児や新生児の血液中のケトン体の濃度が高く、絨毛にはケトン体が2000μmol/L(2mM)以上の高濃度で存在することを明らかにしています。そして、絨毛(胎盤)でコレステロールや中性脂肪からケトン体が産生されていることを発見しています。
これは、子宮内で胎児はブドウ糖ではなくケトン体を主なエネルギー源にしていることを示しており、宗田先生は「ケトン体を使ったエネルギー代謝が人間の本来の代謝である」と言っています。(「ケトン体は人類を救う;光文社新書」)
氷河期に入った約250万年前から人類の食事から糖質が減少し、この低糖質食に適応するため人類の代謝系が遺伝的に変化したと思われます。
胎児の成長には莫大なエネルギーが必要です。低糖質の食事で胎児の発育をブドウ糖に頼っていては、恐らく胎児の生存には不利で遺伝的に淘汰されたと思われます。そこで、脂肪を代謝してできるケトン体を利用した代謝系で胎児を発育させるように進化したのかもしれません。
また、宗田先生は、妊婦はインスリン抵抗性が高くなって糖尿病になりやすく、その場合はインスリンを使うのではなく糖質制限をするべきだと言っています。
インスリンは食事から吸収されたブドウ糖を血中から早く消失させる作用がありますが、食事からの糖質摂取量が少ない状況では、血中からブドウ糖が早く消失すると脳の働きや胎児の発育に支障をきたします。少ない血糖を脳や胎児に多く確保するために、インスリンの標的組織である筋肉や脂肪組織や肝臓でのインスリンの働きを弱める体質、すなわちインスリン抵抗性の体質を持つ方が生存に有利になります。
妊娠時にインスリン抵抗性がさらに強くなるのは、人類が長く低糖質の食事で進化してきたことと関連しているのかもしれません。
【ケトン体は絶食時の脳のエネルギー源となる】
ケトン体は、グルコース(ブドウ糖)が枯渇したときに、脳にエネルギー源を供給するために肝臓で作られます。多くの細胞はグルコースが無くても脂肪酸を分解してエネルギーを産生できます。しかし、脳の神経細胞は例外です。
脂肪酸は血液脳関門(血液と脳脊髄液との間の物質交換を制限する機構)を通過できないため、神経細胞は脂肪酸をエネルギー源として利用できないからです。
ケトン体は水溶性で細胞膜や血液脳関門を容易に通過し、骨格筋や心臓や腎臓や脳など多くの臓器に運ばれ、これらの細胞のミトコンドリアで代謝されてブドウ糖に代わるエネルギー源として利用されます。特に脳にとってはグルコースが枯渇したときの唯一のエネルギー源となります。
(482話参照)
血中のケトン体濃度が上昇するに比例して、脳のエネルギー産生におけるケトン体の依存度は増えます。
たとえば、2~3日間の絶食で達する1.5mMのケトン体濃度では、脳のエネルギー産生の18%がケトン体に依存します。8日間の絶食で達する5mMでは脳が消費するエネルギーの60%がケトン体由来になります。20日間以上の絶食で達せられる7mMでは、60%以上がケトン体由来になります(下表)。

表:血中ケトン体濃度による、脳のエネルギー産生におけるケトン体依存の割合。(出典:J. Lipid Res. 2014. 55: 1818-1826)
脳におけるケトン体の働きについては482話で詳しく解説しています。
血液脳関門を構成し、神経細胞に栄養素を供給する働きをしているアストロサイトは脂肪酸を分解し、ケトン体を産生していることが知られています。
肝臓だけではケトン体産生が間に合わないので、脳のアストロサイトや妊娠時には胎盤でもケトン体の産生が起こっているようです。これもケトン体が体の生存に重要な働きを行っている根拠と言えます。
【ケトン体の健康作用が注目されている】
狩猟採集を行っていた時代には、飢餓状態において貯蔵脂肪が盛んに燃焼し日常的にケトン体が多く産生されていました。
現代人はケトン体が出ないような食生活になっています。これが多くの病気を引き起こしている可能性が指摘されています。
絶食で産生されるケトン体はブドウ糖以上に安全で、エネルギー源として有用な正常な代謝産物であることが明らかになっています。
さらに最近の研究によって、細胞のシグナル伝達や遺伝子発現の調節や抗炎症作用や抗酸化作用などの様々な有用な働きが明らかになり、顕著な減量効果、老化予防や寿命延長効果、がんやアルツハイマー病などの難病の治療にも有効であることが報告されるようになりました。
ケトン体は19世紀中頃に糖尿病性ケトアシドーシスの患者の尿に大量に含まれることから最初に見つかったので、「ケトン体は脂質の不完全な酸化によって生成される毒性のある不必要な代謝産物である」とこの時代の医師の多くが認識していました。
しかし、20世紀のはじめになると、「ケトン体は、飢餓時や食事からの糖質や糖原性アミノ酸の供給が不足したときに、肝臓で脂肪酸から産生される正常な代謝産物で、肝臓以外の組織で容易にエネルギー源として利用される」ことが明らかになりました。
さらに、1920年代にはケトン体の産生を増やす高ケトン食が、小児の薬剤抵抗性てんかんの治療に極めて有効であることが明らかになりました。
1967年には、長期間の絶食や飢餓時に脳のエネルギー源としてグルコースに代わってケトン体が使用されることが明らかになりました。それまでは脳のエネルギー源はグルコースのみと考えられていたのです。現在では、脳はグルコースよりケトン体を好んで使用することが明らかになっています。
1990年代に入ると、食事によってケトン体の産生を高めるケトン食が、グルコースの利用障害のある神経疾患の治療に有効であることが明らかになります。
さらに、パーキンソン病やアルツハイマー病などの脳では、ミトコンドリアの機能異常によって、エネルギー産生が低下していることが多くの研究で明らかになっています。
ケトン体はミトコンドリアでATP産生に効率よく利用され、さらに、神経細胞をフリーラジカルの害から守る作用があるので、ケトン食がパーキンソン病やアルツハイマー病やその他の神経変性疾患の治療に有効であることが報告されるようになりました(468話)。
近年では、ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素の阻害作用によって遺伝子発現に作用してストレス抵抗性の増強や抗老化や寿命延長の効果を発揮することや(322話)、炎症を引き起こすNLRP3インフラマソームの活性を阻害することによって抗炎症作用を示す作用(471話)、細胞膜の受容体を介して細胞機能に影響する作用(472話)などが明らかになっています。βヒドロキシ酪酸が様々な老化性疾患を予防し、寿命を延ばす効果も指摘されるようになってきました。(467話)。
そして、サプリメントとしてケトン体を補充する治療法も検討されるようになってきました。米国では既に、βヒドロキシ酪酸のサプリメントが販売されています。
(銀座東京クリニックでも販売しています。詳しくはこちらへ)
つまり、発見された当時は「毒性のある不要な代謝産物」と思われていたケトン体が、実際は、極めて多彩で有用な働きを発揮する代謝産物であることが判明したのです。
1型糖尿病で発生する糖尿病性ケトアシドーシスではケトン体は25mmol/L以上に上昇し、血糖も300mg/dL以上に増加して酸性血症(アシドーシス)になります。
しかし、飢餓や絶食や低糖質高脂肪食で起こるケトン症ではケトン体は6~8mmol/Lを上限にしてそれ以上は増えません(人によってはもう少し増える人もいるようです)。
肝臓におけるケトン体の産生能に限界があるのと、他の組織でエネルギー源として盛んに利用されるので、ある一定以上は増えないのです。
絶食で上昇するケトン体が体に悪いという考えは完全に間違いです。
絶食で体内に増えるケトン体が有毒であるのであれば、狩猟採取で食糧を得ていた氷河時代の人類が生き延びることはできなかったはずです。
ケトン体が有毒な代謝産物であれば、このような不都合な代謝は進化の過程で淘汰されてきたはずです。むしろ、飢餓を生き延びるために進化の過程で獲得した代謝系と考えるのが妥当です。
その理由の一つは、動物の中で絶食時にケトン体の生成が最も増えるのが人間だからです。
熊は冬眠している間は絶食状態で体脂肪が燃焼していますが、4~5ヶ月絶食している間もケトン体は0.5mM以上に増えないと報告されています。
猿も人間ほどケトン体は上昇しません。イルカはどんな状況でもケトン体は増えません。
人間は体が使うエネルギーの20%くらいを脳が使っています。他の動物は5%以下です。
絶食したときに、脳が小さい動物はケトン体を作らなくでも肝臓や腎臓の糖新生だけで脳のエネルギーを十分に賄えるからです。
しかし、脳が大きく進化した人間の場合は、糖新生だけでは脳のエネルギーを満たせない状態になったので、ケトン体を懸命に作るように進化したと考えられています。
つまり、エネルギー消費量が大きくなった脳を飢餓時に守るために、ケトン体が作られるようになったのです。ケトン体は人類の生存に重要は働きを担っているというのが真実なのです。
| « 490)メトホル... | 492)ケトン体... » |



