がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
468)ケトン食が認知症を改善するこれだけの根拠
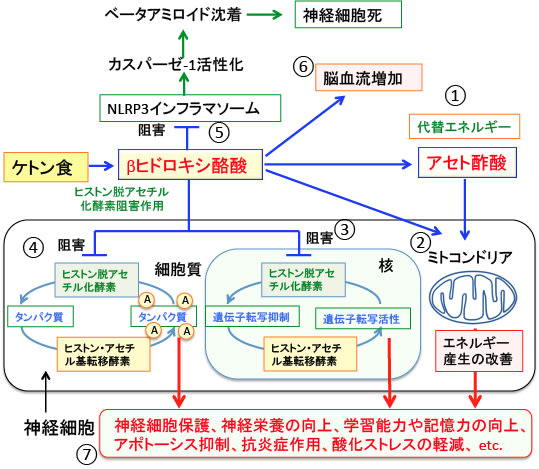
図:①ケトン体のβヒドロキシ酪酸はアセト酢酸に変換されてグルコースの代替エネルギー源となる。②ケトン体は神経細胞のミトコンドリアを増やし、ミトコンドリア機能を正常化してミトコンドリアにおける活性酸素の産生を減らし、酸化ストレスを軽減する。③βヒドロキシ酪酸はクラス1ヒストン脱アセチル化酵素阻害作用があり神経細胞の核のヒストンアセチル化を亢進して、学習機能や認知機能を高める。④非ヒストンタンパクのアセチル化も神経機能の働きを高め、細胞死を抑制する方向で働く。⑤βヒドロキシ酪酸はアルツハイマー病の原因となるベータアミロイドの沈着を引き起こすNLRP3インフラマソームの活性を阻害する。⑥βヒドロキシ酪酸は脳血管を拡張し脳血流を良くする作用がある。⑦このような様々な機序が総合的に作用して、ケトン体の産生を高めるケトン食はアルツハイマー病やハンチントン病などの神経変性性疾患に対して治療効果を発揮し、さらに学習機能や認知機能を高める効果がある。
468)ケトン食が認知症を改善するこれだけの根拠
【認知症は様々な原因で発症する】
老化に伴って物覚えが悪くなるということは多くの高齢者が経験しています。これは脳の神経細胞が加齢とともに減少し、脳の萎縮が少しづつ進行するからです。老眼や難聴(聴力低下)と同じような老化に伴う生理的な機能低下です。
病的な原因によって記憶力や知能の低下する病気を「認知症」と言います。いったん正常に発達した知能が、脳の後天的な障害によって脳の働きが低下して、記憶や知能に障害をきたす病気です。
この認知症を引き起こす原因として最も多いのがアルツハイマー病(アルツハイマー型認知症)です。その他、脳梗塞などの脳血管障害、パーキンソン病、ハンチントン病など様々な原因によって認知症は発症します。
アルツハイマー型認知症は、脳の記憶に関係する部分(海馬、頭頂葉や側頭葉)に異常なタンパク質であるベータアミロイドタンパク質が蓄積して発症します。
その結果、脳の神経細胞が徐々に壊れてしまい、脳が萎縮していく病気です。65歳以上の高齢の方で多く発症する病気ですが、若くして発症する場合もあります。
認知症は進行すると仕事や日常生活に支障をきたすだけでなく、人格が崩壊し、人間としての尊厳が失われる点で非常に悲惨な病気です。認知症と診断されることは、本人だけでなく家族にとっても大きな精神的かつ経済的な負担になります。人口の高齢化とともに認知症の患者は年々増え続けており、社会的な問題にもなっています。最近の調査では、65歳以上の15%、約460万人が認知症と推計されています。
アルツハイマー病やハンチントン病など認知症を引き起こす原因の多くで、まだ有効な治療法は確立していません。いくつかの薬は使用されていますが、症状の緩和や進行を遅らせる程度で、その効果には限界があります。開発中の薬は多くありますが、特効薬ができるのはかなり先のようです。
認知症が比較的若年で発症する場合もあります。アルツハイマー型認知症は遺伝的素因の関与も知られています。すなわち、親族にアルツハイマー型認知症の患者がいる場合、発症リスクが上昇することが指摘されています。例えば、50~54歳に本症を発症した身内がいる場合、本症を早期発症する危険は約20倍に上るというデータもあります。
【認知症は年齢調整した有病率でも増えている】
認知症患者の増加は人口の高齢化だけによるものではないようです。人口構成の影響を排除した年齢調整した統計でも認知症の有病率は増加しています。つまり、同じ年齢で比較しても認知症の発生が増加しているのです。
年齢調整(age-adjusted)というのは、基準となる集団の年齢構成(基準人口)に合わせて補正した値で、年齢調整した(同じ年齢構成と仮定して計算した)数値を比較することによって、高齢化などの年齢構成の変化の影響を取り除くことができます。
脳梗塞などの脳血管性の認知症は微増ですが、アルツハイマ−病が急増していることが指摘されています。例えば、1985年から2005年の間にアルツハイマー病の年齢調整有病率が3倍以上に増えているというデータがあります。
その理由として糖尿病の増加が最も関連していると言われています。糖尿病がアルツハイマー病の強い危険因子であることが明らかになっています。
糖尿病は1960年代くらいまでは極めて稀な病気でしたが、現在では5人に一人が糖尿病と言われるくらいに増えています。(下図)
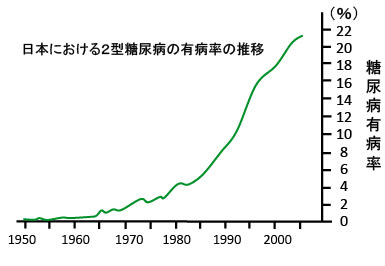
糖尿病はがんの発生率も高めます。さらにアルツハイマー病の発症を促進する要因であることも明らかになっています。
高血糖や糖尿病は様々なメカニズムで認知症の発症を促進します。
高血糖/糖尿病は脳動脈硬化を進展させ、脳梗塞や潜在的脳虚血を引き起こして血管性認知症の原因になります。
グルコースはタンパク質を糖化し、終末糖化産物(AGE)を増やし、酸化ストレスを高めます。
さらに、高インスリン血症がアルツハイマー病発症に関わることが指摘されています。
アルツハイマー病は脳にベータアミロイドといタンパク質が凝集して老人班を形成し、神経細胞を破壊することで発症しますが、インスリンはベータアミロイドの分泌を促進し、その分解を阻害することが報告されています。その結果、脳内にベータアミロイドが過剰に沈着して神経細胞の傷害を引き起こすと考えられています。
インスリン分泌は糖尿病になる前の糖代謝異常の段階で最も高くなります。つまり、糖尿病を含む糖代謝異常の状態は、脳にベータアミロイドが沈着しやすい状態だと言えます。
したがって、糖質摂取を減らす糖質制限はインスリン分泌を減らすというメカニズムだけでも、認知症の予防に良いことが理解できます。
通常、がんとアルツハイマー病の間にはトレードオフの関係があることが知られています。つまり、この2つの疾患の間には、一方になりやすい人はもう一方になりにくいというトレードオフの関係が知られています。(331話参照)
しかし、この例外が糖尿病患者です。糖尿病患者はがんもアルツハイマー病も多いのが明らかになっています。がんも糖尿病もグルコースとインスリンがリスクを高める点で共通しているからです。

図:がん細胞は日頃から細胞分裂を行っている組織から発生する。遺伝子変異の蓄積によって細胞分裂の制御ができなくなるとがん細胞になる。神経細胞は細胞分裂しないので、細胞増殖の制御異常でがん化することは無い。しかし、再生できないので、ダメージによって変性や細胞死によって数が減少すると、アルツハイマー病などの神経変性疾患が発症する。がんとアルツハイマー病は共通のリスク要因が多いが、この2つの疾患の間には、一方になりやすい人はもう一方になりにくいというトレードオフの関係が知られている。糖尿病の場合は、がんとアルツハイマー病の両方のリスクを高め、カロリー制限とケトン食はこの両方のリスクを低下させる。
【認知症は食事や生活習慣で予防や治療できる】
身内に認知症がいる場合は、認知症を予防することを実践することが大切です。たとえば、魚の油に含まれるドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)、野菜や果物などビタミン・ミネラルやポリフェノールの多い食品の摂取は認知症の発症率を低下させることが知られています。逆に白米など糖質の多い食事は認知症のリスクを高めます。
地中海食はアルツハイマー型認知症の発症率を減らすことが報告されています。野菜や魚の多い食事がアルツハイマー型認知症の発症を減らす可能性が指摘されています。
肥満や糖尿病やメタボリック症候群は動脈硬化を促進して脳血管障害の発症リスクを高めます。
糖尿病やメタボリック症候群がアルツハイマー型認知症の発症率を高めることも報告されています。肥満や糖尿病やメタボリック症候群はカロリー制限や糖質制限など適切な食事で改善できます。ケトン食はこれらの疾患を短期間に改善することが多くの臨床試験で確認されています。
福岡県久山町の住民を対象に行われている疫学調査の「久山町研究」でも、糖尿病が脳血管性とアルツハイマー型の両方の認知症の危険因子であることが示され、最近の認知症の急増は糖尿病患者が増えていることが要因になっていると指摘されています。
久山町の追跡調査では、牛乳・乳製品や大豆製品・豆腐、野菜などを多く食べ、ご飯や酒類が少ない食事パターンが脳血管性とアルツハイマー型の両方の認知症の発症リスクを半分程度に低下させることが明らかになっています。また、運動も認知症の発症リスクを低下させます。
さらに、ケトン体を増やすケトン食が、アルツハイマー病や脳血管障害やパーキンソン病やハンチントン病など神経変性疾患の改善に有効であることが明らかになっています。
ケトン食は、糖質を極端に制限した状態で脂肪酸の燃焼を促進させることによってケトン体を産生する食事です。ケトン食は糖尿病やメタボリック症候群の病状を顕著に改善する効果がありますが、ケトン体自体に神経細胞の働きを高めることが報告されています。
【ケトン食はアルツハイマー病の治療に有効】
ケトン体は脳神経のエネルギー代謝を改善し、活性酸素や炎症から神経細胞を保護する作用があるので、ケトン食はアルツハイマー病やパーキンソン病や脳卒中等を原因とする脳神経細胞障害の進行抑制にも利用されています。ケトン食が認知障害の改善に有効であることが臨床試験で示されています。
例えば、軽度の認知障害のある23人(男性10人、女性13人:平均年齢70.1±6.2)を対象に、高糖質食と低糖質食の2群に分けて6週間の食事療法を行った研究があります。(Neurobiol Aging 33(2):425.e19 – 425.e27, 2012年
)
実験の結果、低糖質食のグループでは、言語記憶能力の統計的有意な改善を認め、さらに、体重、腹囲、空腹時血糖、空腹時インスリン値の統計的有意な減少が認められました。
記憶力の変化は、摂取カロリーやインスリン値や体重とは相関を認めませんでしたが、血中ケトン値は記憶力の改善と正の相関が認められました。つまり、ケトン体の濃度が高いほど記憶力が良くなったということで、食事性のケトーシスが認知障害を改善するという結果です。
この研究の結果は、アルツハイマー病の発症リスクの高い軽度認知障害をもつ高齢者に対して、6週間という短期間の食事(低糖質食)の介入だけで記憶力の改善ができることを示しています。
認知障害の改善の作用機序として、ケトン体による抗炎症作用や神経細胞のエネルギー代謝の改善作用などが示唆されています。
神経細胞の主なエネルギー源はブドウ糖ですが、アルツハイマー病などの認知症では神経細胞のブドウ糖の取込みや代謝に異常が起こっているためにエネルギー産生の低下が認められます。ケトン体はブドウ糖に代わってエネルギー源となるため、神経細胞の働きを良くすると考えられています。
高齢ラットを使った実験でもケトン体が認知機能を高めることが報告されています。(Adv Exp Med Biol 662: 71-75, 2010年)
この報告では、高齢ラットを2群に分けて、標準的な餌とケトン食の餌で3週間飼育し、ラットの認知機能をT-迷路法や物体認識テストなどで認知機能を測定しています。ケトン食で飼育した群の方が認知機能が良かったという結果がえられています。食事によるケトン症が神経変性疾患の改善に効果があることを示しています。
米国では中鎖脂肪酸トリグリセリド(中鎖脂肪酸中性脂肪)のカプリル酸トリグリセリドがアルツハイマー病の治療に有効な医療食として認可されています。カプリル酸(caprylic acid)は炭素数8個の中鎖脂肪酸(分子式はC8H16O2)です。
中鎖脂肪酸はケトン体の産生を増やします。
アルツハイマー病あるいは軽度の認知障害をもった20人の成人を対象にして、日を改めて中鎖脂肪酸を摂取した場合とプラセボを摂取した場合で、認知力を比較した研究が報告されています。中鎖脂肪酸を投与すると90分後には血中のβヒドロキシ酪酸のレベルが著明に上昇し、この時点で認知機能を測定しています。その結果、ケトン体の量が多いほど、認知機能の改善が認められました。
つまり、「アルツハイマー病の患者に中鎖脂肪酸を投与すると記憶力の改善が認められ、その改善の程度はβヒドロキシ酪酸のレベルと相関する」という結論です。(Neurobiol Aging. 25(3):311-4. 2004年)
神経細胞はグルコース(ブドウ糖)とケトン体しかエネルギー源として利用できないのですが、アルツハイマー病ではグルコースの取り込みや利用に障害があり、そのため中鎖脂肪酸を摂取してケトン体の産生を増やすと神経組織のエネルギー産生が改善して症状が良くなると考えられています。その他にも、遺伝子発現調節作用の関与や、抗炎症・抗酸化・抗アポトーシスの機序による神経細胞保護作用なども関与していると考えられています(後述)。
また、βヒドロキシ酪酸が脳血管を拡張し脳血流を増やすことによって認知機能を高める効果も報告されています。
以上のように、ケトン体自体に神経をダメージから守る作用があり、さらに抗炎症作用などによって神経変性性疾患の治療に効果を発揮するということです。脳卒中(脳出血や脳梗塞)、パーキンソン病、筋萎縮性側索硬化症などにも効果があることが報告されています。
【ケトン食は難治性てんかんや自閉症にも有効】
ケトン食はてんかんの治療法として開発されました。てんかん発作が絶食によって減少することは古くから知られており、「脂肪を多く糖質の少ない食事をと摂れば、絶食と同等の効果が得られる」という考えのもとに、1920年代にメイヨークリニックのRussel Wilder博士がケトン食療法(ketogenic diet)を発案しました。このケトン食が難治性てんかんに有効であることは数多くの臨床試験で証明され、その有効性と安全性は確立されています。
その他、自閉症にも効果があることを示す臨床試験の結果も報告されています。自閉症は、先天性の脳機能障害などによって、社会性や他者とのコミュニケーション能力に困難が生じる病気です。
30人の自閉症の子供(4歳~10歳)を4週間のケトン食+2週間普通食の6週間のサイクルで6ヶ月間治療を行っています。自閉症の症状の程度は小児自閉症評定尺度という方法で評価しています。
6ヶ月間の30人中18人(60%)で自閉症の症状が改善したと報告されています。小児自閉症評定尺度で12ユニット以上の著明な改善を2例、8~12ユニットの平均的改善が8例、2~8ユニットの軽度の改善が8例に見られたと報告されています。この臨床試験は予備的な段階ですが、自閉症の治療にケトン食が効果がある可能性が示唆されています。(J Child Neurol 18(2)/113-8, 2003年)
以上のように、ケトン食は高齢者や子供にも安全に行われる食事療法です。中鎖脂肪酸トリグルセリド(中鎖脂肪酸中性脂肪, MCTオイル )を使うとケトン体の産生量を増やすことができます。この中鎖脂肪酸は未熟児や手術後の栄養補給にも利用されています。つまり、中鎖脂肪酸トリグリセリドを多く摂取するケトン食(中鎖脂肪ケトン食)は安全で簡単に実施できるケトン食と言えます。
最近物忘れがひどくなったと思っている方や、家族歴などでアルツハイマー病などの認知症のリスクの高い人や、既に認知症にかかっている人は、ケトン食を実践する価値はあると言えます。
【ケトン食は様々な神経変性性疾患に効果が期待できる】
西洋医学は「病気は薬で治すもの」と考えています。食事で治すという発想はほとんどありません。糖尿病はアルツハイマー病のリスクファクターであり、糖質制限やケトン食がアルツハイマー病の治療や予防に効果が期待できます。
しかし、まだ臨床的な研究が少ないためか、ほとんど注目されていません。ケトン食が認知力を高めるという実験結果や軽度認知障害にケトン食が有効という小規模な臨床試験の結果がある程度です。しかし、若年性のアルツハイマー病など悲惨な病気に罹っている人は試してみる価値はあると思います。他の有効な方法が無いからです。
ケトン食はアルツハイマー型認知症だけでなく、様々な神経変性疾患に対する有効性が示唆されています。ケトン体自体に神経をダメージから守る作用があり、さらに抗炎症作用などによって神経変性性疾患の治療に効果を発揮する可能性があるからです。
脳卒中(脳出血や脳梗塞)、パーキンソン病、筋萎縮性側索硬化症、ハンチントン病などにも効果があることが報告されています。
神経変性疾患とは、様々な原因により脳内の様々な部位で神経細胞が病的に死滅してしまうために生じる疾患の総称です。 疾患ごとに障害を受けやすい神経細胞の種類がある程度決まっており、障害される神経細胞の働きにより疾患の症状が決まります。
アルツハイマー型認知症は記憶を担当する神経細胞(海馬など)の障害であり、筋萎縮性側索硬化症(ALS)は運動を担当する神経細胞(運動ニューロン)の障害です。パーキンソン病は運動を調節する神経細胞のうちドーパミン神経の障害で、脊髄小脳変性症は運動を調節する神経細胞のうち小脳などの障害です。
ハンチントン病(ハンチントン舞踏病)は、大脳中心部にある線条体尾状核の神経細胞が変性・脱落することにより進行性の不随意運動(舞踏様運動)、認識力低下、情動障害等の症状が現れる常染色体優性の遺伝病です。
ケトン食は元来は難治性てんかんに対する食事療法として開発され、その有効性は確立されています。アルツハイマー病に関しては、臨床試験でその有効性が強く示唆されています。まだ動物実験のレベルですが、筋萎縮性側索硬化症やハンチントン病やパーキンソン病などの神経変性疾患の治療効果も示唆されています。筋萎縮性側索硬化症やハンチントン病はまだ有効な治療法が無い難病ですが、中鎖脂肪ケトン食を試してみる価値はありそうです。
また、認知障害を予防したり、記憶力を高めるために中鎖脂肪ケトン食を実践する有用性はあるように思います。
【ケトン体の神経変性疾患改善作用】
前述のように、ケトン体を増やすケトン食がアルツハイマー病や脳血管障害やパーキンソン病やハンチントン病など神経変性疾患の改善に有効であることが明らかになっています。
ケトン食は、糖質を極端に制限した状態で脂肪酸の燃焼を促進させることによってケトン体を産生する食事で、糖尿病やメタボリック症候群を顕著に改善する効果がありますが、ケトン体自体に神経細胞の働きを高めることが報告されています。
ケトン体はグルコースが枯渇したときに肝臓で脂肪酸が燃焼して産生されます。
ケトン体は血液脳関門を通過し、拡散あるいはモノカルボン酸トランスポーターによって神経細胞内に入り、神経細胞のエネルギー源となります。
グルコースの代替エネルギー源となる以外に、ケトン体(特にβヒドロキシ酪酸)次のような様々なメカニズムで神経細胞を傷害から守る作用があります。
①神経細胞のミトコンドリアを増やし、ケトン体自体がエネルギー源となって神経細胞におけるエネルギー産生を増やす。
②抗炎症作用があり、さらにミトコンドリアにおける活性酸素の産生を減らし酸化障害を軽減する。
③アルツハイマー病の原因となるベータアミロイドの沈着を引き起こすNLRP3インフラマソームの活性を阻害する。
④アポトーシスの過程を阻害することによって神経細胞死を抑制する。
⑤ヒストンアセチル化を亢進して認知機能を高める。
⑥脳血管を拡張して脳血流を増やす。
このように様々な機序が報告されており、恐らく、これら全ての機序が総合的に作用して効果を発揮していると考えられます。ケトン体のミトコンドリアに対する作用とヒストンアセチル化亢進作用と抗炎症作用(インフラマソーム活性化阻害作用)についてさらに解説します。
【ケトン体はミトコンドリアを保護する】
神経細胞傷害からの細胞保護や認知機能の増強にミトコンドリアでの呼吸(酸化的リン酸化)の改善が重要であることが知られています。つまり、神経細胞のエネルギー代謝において、ミトコンドリアの機能を良くすることはアルツハイマー病などの認知症やその他の神経変性疾患の治療に有効であることが指摘されています。
経口摂取で体内でケトン体のβヒドロキシ酪酸になるβヒドロキシ酪酸メチルエステルが、ミトコンドリアを保護するメカニズムによってアルツハイマー病を改善する効果があることが報告されています。(Biomaterials. 34(30): 7552-7562, 2013年)
アルツハイマー病の発症機序としては、神経細胞のグルコース利用の低下やミトコンドリアの機能障害など様々なメカニズムが想定されています。ケトン体のβヒドロキシ酪酸やアセト酢酸はグルコースの代わりに神経細胞のエネルギー源となるので、アルツハイマー病の治療効果があることが報告されています。
βヒドロキシ酪酸はアセト酢酸に変換され、アセト酢酸からアセチルCoAができてエネルギー産生に使われます。
この研究では、βヒドロキシ酪酸の誘導体であるβヒドロキシ酪酸メチルエステルを使って、アルツハイマー病に対する効果を検討しています。βヒドロキシ酪酸メチルエステルは体内でβヒドロキシ酪酸に変化するので、βヒドロキシ酪酸を投与したのと同じことになります。
グルコースを枯渇して誘導される神経細胞のアポトーシスをβヒドロキシ酪酸メチルエステルは阻害し、アルツハイマー病の神経細胞で起こっているミトコンドリアの異常を改善して活性酸素の発生量を減らすことが実験で示されています。
アルツハイマー病のマウスを使った実験では、βヒドロキシ酪酸メチルエステルを投与したマウスはコントロール群(βヒドロキシ酪酸メチルエステルを投与しなかったアルツハイマー病マウス)よりも顕著に学習能力が良くなる結果が得られています。また、アルツハイマー病マウスの脳に沈着したアミロイド-βの量が減少していることが確認されています。
これらの結果から、βヒドロキシ酪酸は神経細胞のミトコンドリアのダメージを保護し、異常を改善することによってアルツハイマー病の改善に有効であることを報告しています。
【ケトン体はヒストンアセチル化を亢進する】
ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素を阻害することによってヒストンアセチル化を亢進することは前回(467話)解説しています。
絶食や直接βヒドロキシ酪酸を投与する方法でマウスの血中のβヒドロキシ酪酸の濃度(0.6~1.5mM)を上昇させると、腎臓など複数の臓器においてヒストンのアセチル化が増えていることが確認されています。(Science 339(6116): 211-4, 2013年)
長期間の絶食では血中のケトン体のレベルが6~8mM程度まで上昇することが報告されています。(385話参照)
中鎖脂肪酸を多く使ったケトン食ではβヒドロキシ酪酸を1~2mM程度に維持することは比較的簡単です。つまり、ケトン食で達成できるレベルのケトン体が内因性のヒストン脱アセチル化酵素阻害剤として作用することが証明されています。
ヒストンアセチル基転移酵素とヒストン脱アセチル化酵素によるヒストンのアセチル化については467話で解説していますが、ここでも簡単に解説しておきます。
高等生物のDNAは、ヒストンと呼ぶ球状のタンパク質複合体に1.65回転巻きつき、この複合体を基本単位として存在しています。ヒストンにはアセチル(CH3CO)基が結合し、ヒストンアセチル化と呼ぶ化学修飾が起こります。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素」と「ヒストン脱アセチル化酵素」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています。
一般的に、ヒストンの高アセチル化領域は遺伝子の転写が活性化しており、低アセチル化領域は転写が不活性化していることが知られています。
タンパク質のアセチル化は、ヒストンだけでなく、非ヒストンタンパク質にも起こります。アセチル化を受けるタンパク質には多数の種類が知られていますが、これらの非ヒストンタンパク質のアセチル化は、タンパク質の安定性や局在や他のタンパク質やDNAとの相互作用などに影響します。
ヒストンや非ヒストンタンパク質のアセチル化は認知機能や学習機能を高める遺伝子の発現やタンパク質の機能を高める作用が報告されています。すなわち、ヒストンアセチル化によって発現が誘導される遺伝子には、神経細胞の死を抑制したり、認知機能や学習機能を高める遺伝子が多く含まれています。さらに、アセチル化される非ヒストンタンパク質の中にも、同様に神経保護作用や神経細胞の働きを良くするものが含まれています。
以上のようにヒストン脱アセチル化酵素を阻害すると、ヒストンのアセチル化が亢進します。このヒストン脱アセチル化酵素阻害剤が認知障害の治療薬として注目されています。

図:βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害することによって、エピジェネティックな遺伝子発現調節作用によって認知機能や長期持続記憶を改善する可能性が指摘されている。アセチル化される非ヒストンタンパク質の中にも、神経保護作用や神経細胞の働きを良くするものが含まれている。
【ヒストンのアセチル化亢進は認知機能を高める】
記憶のメカニズムには神経細胞におけるヒストンのアセチル化が関与していることが最近の研究で明らかになっています。(Annu Rev Pharmacol Toxicol. 53:311-30. 2013年
)
ヒストンのアセチル化は、中枢神経系における遺伝子発現を調節しています。遺伝子の転写は長期持続性記憶において重要な役割を果たしており、一般的に、ヒストンのアセチル化は長期持続性記憶に有利に働き、一方ヒストン脱アセチル化は長期持続性記憶を妨げる働きをすることが示されています。
このヒストンのアセチル化はヒストン脱アセチル化酵素阻害剤の使用によって薬理学的に調整が可能であるため、ヒストンのアセチル化は認知力を高めるために治療のターゲットとして特に注目されています。
つまり、ヒストン脱アセチル化酵素阻害剤は、神経発達障害や神経変性疾患における認知障害の治療だけでなく、健常人に対する認知力増強の方法としても効果が期待されています。
アルツハイマー病のマウスの実験モデルを用いた研究で、神経細胞が大量に死滅した状態においても、ヒストン脱アセチル化酵素阻害剤を投与すると、シナプス形成や神経細胞の樹状突起の成長が促進され、学習機能が維持され、長期維持記憶が回復することが報告されています。
この実験結果は、神経細胞の死滅や変性が高度に起こった状況でも(つまり、認知症がかなり進行した状態になっても)、ヒストンのアセチル化とクロマチンの再形成というメカニズムによって、学習や記憶の増強に効果が期待できることを示唆しています。そして、ヒストン脱アセチル化酵素阻害剤がアルツハイマー病の治療に有効であることを強く示唆しています。
前述のように、ヒストン脱アセチル化酵素はクロマチン構造において主要な構成因子であるヒストンの脱アセチル化を行う酵素で、遺伝子の転写制御において重要な役割を果たしています。
ヒストン脱アセチル化酵素(HDAC)ファミリーの分子は現在HDAC1~11まで同定されていますが、記憶や学習に関連しているのはHDAC2であることが報告されています。
マウスのアルツハイマー病のモデルや人間のアルツマイハー病患者の脳組織にはHDAC2の発現量が増加していることが報告されています。そして、マウスのアルツハイマー病の実験モデルでHDAC2のレベルを正常化すると、高度の神経細胞変性の状態であっても認知機能が回復することが報告されています。
βヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素のHDAC1とHDAC2を阻害する事が報告されており、ヒストンのアセチル化を高めることによって認知機能や学習機能を高める効果が報告されています。
アルツハイマー病でなくても、高齢になってくると記憶力が低下します。老化に伴う短期記憶力の低下に対しても、ヒストンアセチル化酵素の阻害剤によって改善することがマウスを使った実験で示されています。
16ヶ月齢(実験用マウスの平均寿命は800~900日程度のため人間では40~50歳程度)の中年マウスは、若い(3ヶ月齢や8ヶ月齢)と比べて海馬依存的な短期記憶力が著しく低下しています。この中年マウスと若年マウスを用いて記憶実験の前後における脳内のヒストンの状態を比較しています。
若年マウスでは学習訓練後1時間でヒストンH4のリジン12(H4K12)のアセチル化が顕著に促進されたのに対し,中年マウスではそのような変化は認められませんでした。さらに、若年マウスでは訓練前後で2,229個の遺伝子発現に差があったのに対し,中年マウスではわずか6遺伝子しか差がなく、若年マウスで発現量の変化した遺伝子のうち,1,539個が記憶学習に関連することが知られている遺伝子であったということです。
つまり、年を取ると学習しても記憶遺伝子の発現が起こりにくくなっているので、学習能力が低下するということです。そして、ヒストンのアセチル化による遺伝子発現の調節が、記憶遺伝子の発現亢進に関わっています。高齢になるとこのような遺伝子発現の調節がうまくいかないので、記憶力を低下するということです。
そして、中年マウスの海馬にヒストン脱アセチル化酵素阻害剤を注入すると、学習訓練後のヒストンH4K12のアセチル化が促進され、記憶関連遺伝子の発現も誘導され,さらに学習記憶試験の成績も有意に向上したという結果を報告しています。
海馬における神経細胞のヒストンH4K12のアセチル化を促進するようなヒストン脱アセチル化酵素阻害剤を使えば、老化に伴う記憶力低下を防止することも可能という結果です。
ケトン体のβヒドロキシ酪酸にはヒストンアセチル化という作用機序の他に、抗炎症、抗酸化、抗アポトーシスなどの機序による神経細胞保護作用が報告されており、アルツハイマー病の治療に対する有効性(認知機能の回復と増強)を強く示しています。
以上のような多くの研究から、ケトン体のβヒドロキシ酪酸の血中濃度を1~2mM程度に高めるケトン食(中鎖脂肪酸を多く使うとβヒドロキシ酪酸の産生を高めることができる)はヒストン脱アセチル化酵素阻害作用や、ミトコンドリアの機能改善、グルコースの代替エネルギー源としての作用、抗炎症作用(インフラマソーム阻害作用)、脳血流改善など複数の機序でアルツハイマー病やハンチントン病などの神経変性性疾患の治療に効果が期待できると言えます。またケトン体の血中濃度を高めることは、認知機能や学習機能を高めるので、頭が良くなります。(トップの図)
【βヒドロキシ酪酸はインフラマソームの活性を抑制する】
インフラマソーム(Inflammasome)は,炎症やアポトーシスに関与するタンパク質の複合体で,炎症性カスパーゼやIL-1ファミリーのサイトカインを活性化します。インフラマソームは細菌、微生物由来毒素、生体異物、病原体関連分子パターン(PAMPs)、ダメージ関連分子パターン(DAMPs)など様々な刺激によって活性化されます。
インフラマソームは生体を異物や病原微生物から防御する自然免疫の一種ですが、2型糖尿病やアルツハイマー病や動脈硬化症や様々な自己免疫疾患など病原体の関与しない炎症性疾患の発症や進展にインフラマソームが重要な働きをしていることが明らかになっています。
このような無菌性炎症には、パターン認識受容体の一つであるNLRP3とアダプター分子ASC、カスパーゼ-1とで構成されるNLRP3インフラマソームが主として関与しています。
自然免疫機構は病原性微生物を排除するための感染防御機構ですが、過栄養摂取により生じる代謝物にも反応するために、強い炎症を引き起こして生活習慣病の発症要因になっています。
例えば、NLRP3 インフラマソームは肥満による炎症とインスリン抵抗性を引き起こすことが報告されています。肥満に伴い、マクロファージが脂肪細胞に浸潤し炎症性メディエーターを放出することによってインスリン抵抗性を引き起こしますが、NLRP3インフラマソームが脂肪細胞のカスパーゼ-1を活性して、炎症を起こすメカニズムが示されています。これは、肥満が生体にとって危険シグナルとして感知され、炎症性応答を引き起こすことを示唆しています。
アルツハイマー病の脳組織においても、NLRP3インフラマソームの活性化が起こっていることが報告されています。アルツハイマー病では、脳組織(特に海馬)におけるβアミロイドの沈着が炎症反応を引き起こし、IL-1βなどの炎症性サイトカインを活性化しています。この炎症反応にNLRP3インフラマソームが関与していることが明らかになっています。
β-ヒドロキシ酪酸にNLRP3を直接阻害する作用があることが報告されています。アルツハイマー病に対するβ-ヒドロキシ酪酸の効果には、インフラマソームの活性を抑制する作用機序も関与しているということが報告されています。
このように、βヒドロキシ酪酸は単なるエネルギー源という役割だけでなく、様々な遺伝子の発現やタンパク質の活性に影響する多機能のシグナル伝達物質と言えます。

図:ケトン体(βヒドロキシ酪酸とアセト酢酸)は、神経細胞におけるエネルギー産生の改善や抗炎症・抗酸化作用やアポトーシスを阻止する作用など様々なメカニズムによって、神経細胞を変性や細胞死から保護する作用がある。さらに、βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害することによって、エピジェネティックは遺伝子発現調節作用によって認知機能や長期持続記憶を改善する可能性が指摘されている。さらに、βヒドロキシ酪酸はアルツハイマー病の原因となるベータアミロイドの沈着を引き起こすNLRP3インフラマソームの活性を阻害して、病気の発生や進展を予防する。これらの総合的な作用によってケトン食はアルツハイマー病の認知機能の改善や病気の進行を抑制する作用が期待できる。これらの作用機序はアルツハイマー病以外の多くの神経変性疾患(パーキンソン病、筋萎縮性側索硬化症、ハンチントン病など)に対する有効性も示唆されている。
画像をクリックするとサイトに移行します。
| « 467)ケトン食... | 469)医療大麻... » |





