がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
902)がん消滅(その1):活性酸素ががん細胞を死滅する

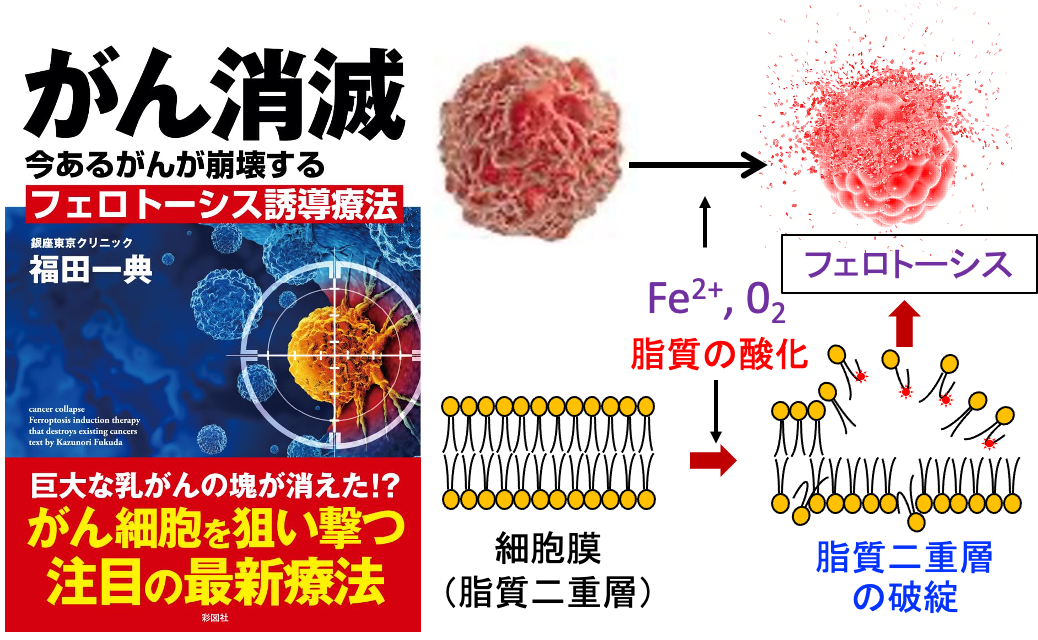
図:がん細胞は鉄の取り込みが多く、細胞内のフリーの2価鉄(Fe2+)が活性酸素の産生を増やす。鉄介在性の活性酸素の産生増加は、脂質を酸化して細胞膜の脂質二重層を破綻して、フェロトーシスの機序で細胞死を引き起こす。フェロトーシス誘導療法はがん細胞を選択的に死滅するがん治療として注目されている。
902)がん消滅(その1):活性酸素ががん細胞を死滅する
【2価鉄イオン(Fe2+)はフリーラジカルを発生して細胞を傷害する】
鉄は様々な生体反応に必須の物質ですが、過剰になると活性酸素発生の触媒作用を発揮することによって細胞の酸化傷害を引き起こし、発がんのリスクを上げることが明らかになっています。
鉄の代謝異常で細胞内に鉄が多く蓄積する遺伝性疾患や、慢性炎症などでフリーの鉄イオンが増える状況では、細胞のがん化が促進することが明らかになっています。
さらに、人間では定期的に除鉄を行うとがん発生が抑制されることが明らかになっています。1年に2回の定期的瀉血が内臓がんの発生を35%減少させるという論文が2008年に報告されています。(J Natl Cancer Inst. 2008 Jul 16;100(14):996-1002.)
つまり、献血のようにして定期的に瀉血して、体内の過剰な鉄を減らすことはがん予防に有効であることが示されています。 さらに、鉄による酸化傷害を防ぐことは細胞の老化の進行の抑制にも有効です。
2価のフリーの鉄は過酸化水素(H2O2)と反応してフェントン反応により有毒なヒドロキシルラジカルを生じ、DNA障害、脂質酸化、細胞死などを引き起こします。
フェントン反応とは、過酸化水素(H₂O₂)と2価の鉄イオン(Fe2+)が反応して、非常に強力な酸化剤であるヒドロキシルラジカル(•OH)を生成する化学反応のことです。(下図)

図:フェントン反応による過酸化水素(H2O2)からのヒドロキシラジカル(HO・)の産生(A)と脂質(ROOH)からの脂質ラジカル(RO・)の産生経路(B)。鉄イオンが関与する酵素は赤で示している。
鉄は電子の授受を容易に行いうることから種々の酵素の活性中心として働いており、地球上のほぼすべての生物にとってその生存に必須な元素です。 しかし一方で,二価鉄(Fe2+)が過剰に存在すると、その高い反応性ゆえにフリーラジカルの産生を促進し細胞に対する傷害性をもたらすということです。
つまり、鉄は「両刃の剣」であり、鉄は不足しても過剰でも生体に悪影響を及ぼすため、生体においては鉄の量がつねに適切な量になるよう厳密に調節される必要があるのです。
慢性炎症組織やがん組織では、この鉄イオンの調節に破綻をきたし、フリーの2価鉄(Fe2+)が過剰に存在する状況になっています。この過剰鉄がフリーラジカルや活性酸素の産生を惹起して細胞毒として働き、細胞の老化やがん化を促進すると考えられています。
したがって、慢性炎症やがんの予防や治療における戦略としては、鉄イオンを減らす方法が考えられます。この方法として、瀉血や鉄のキレート剤の使用があります。 このような方法で鉄を減らせば、慢性炎症やがんの発生や進行を抑えられると考えられています。
しかし一方、がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を死滅させる治療が検討されています。それがフェロトーシス誘導療法です。
【フェロトーシスは鉄介在性の細胞死】
フェロトーシス(Ferroptosis)の「フェロ(Ferro)」は鉄という意味です。「ptosis」は「下垂する」という意味で、枯れ葉が枝から落ちる様から細胞の死を意味します。つまり、フェロトーシスは「鉄が介在する細胞死」を表しているのです。
フェロトーシスでは、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。細胞内の鉄に依存する機構であり、他の金属類には依存しません。
がん細胞は鉄の取り込みが増えており、鉄介在性に活性酸素の産生が増え、細胞膜の脂質の過酸化が蓄積して細胞死が起こります。この鉄介在性の細胞死をフェロトーシスといいます。(図)

図:がん細胞はトランスフェリン受容体(①)の発現が亢進し、鉄(②)の取り込みが増え、がん細胞は鉄を多く含む。2価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で活性酸素の産生が増え(③)、脂質の酸化が強く起こり(④)、細胞膜の脂質二重層が破綻し(⑤)、細胞死(フェロトーシス)が誘導される(⑥)。正常細胞は鉄の含有量が少ないので、フェロトーシスは起こりにくい(⑦)。
【ミトコンドリアの酸素呼吸で活性酸素が発生する】
細胞が生きていくために必要なエネルギーであるATP(アデノシン3リン酸)は、細胞内のミトコンドリアで酸素を還元して水になる反応(電子伝達系)を使って産生しています。この過程では1分子の酸素(O2)は4つの電子(e-)をもらって還元され、さらに水素イオン(H+)と結合して水(H2O)になります。(図)
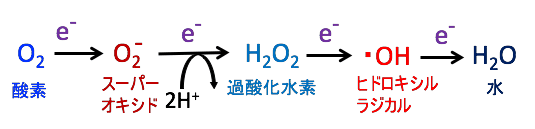
図:TCA回路(クエン酸回路)でNADHとFADHとして捕捉された電子(e-)は、ミトコンドリア内の電子伝達系で酸素を4原子還元して水(H2O)を生成する過程で、スーパーオキシドや過酸化水素やヒドロキシルラジカルといった活性酸素が発生している。
この反応過程で酸素分子に不完全に電子が渡され、部分的に還元された分子が発生して活性酸素になります。例えば、酸素分子は16個の電子を持っていますが、スーパーオキシド(O2-)は17個の電子を持ち、そのうち1個が不対電子になりフリーラジカルとなるのです。
スーパーオキシド(O2-)はスーパーオキシド・ディスムターゼという酵素よって過酸化水素(H2O2)に変わり、過酸化水素はカタラーゼによって水(H2O)と酸素(O2)に変換されて除去されます。このとき、スーパーオキシドや過酸化水素の一部は鉄イオンや銅イオンと反応して、ヒドロキシルラジカル(・OH)と呼ばれるフリーラジカルが発生します。
本来、鉄や銅はタンパク質と結合して存在しますが、がん組織や炎症が起こっている部位ではこれらの金属はイオンの形で存在するようになり、鉄や銅の金属イオンが触媒となって大量のヒドロキシラジカルが産生されるようになるのです。
さらに、誘導型一酸化窒素合成酵素によって炎症細胞から産生される一酸化窒素(NO)とスーパーオキシド(O2-)が反応すると、ペルオキシナイトライト(・ONOO2-)という酸化力の強いフリーラジカルが発生します。(図)

図:酸素(O2)がエネルギー産生過程などで1電子還元されてスーパーオキシド(O2-)が発生する(①)。スーパーオキシドはスーパーオキシド・ディスムターゼによって過酸化水素(H2O2)に変わり(②)、過酸化水素はカタラーゼやグルタチオン・ペルオキシダーゼによって水(H2O)と酸素(O2)に変換されて無毒化される(③)。スーパーオキシドや過酸化水素の一部は鉄イオンや銅イオンと反応してヒドロキシルラジカル(・OH)が発生する(④)。誘導型一酸化窒素合成酵素によって炎症細胞から産生される一酸化窒素(NO)とスーパーオキシドが反応すると、ペルオキシナイトライト(・ONOO2-)という酸化力の強いフリーラジカルが発生する(⑤)。ヒドロキシルラジカルとペルオキシナイトライトは細胞や組織を酸化してダメージを与える(⑥)。
【がん細胞のミトコンドリアは活性酸素が出やすい】
細胞のエネルギーであるATP(アデノシン3リン酸)は、細胞質の解糖系とミトコンドリアでの呼吸鎖(酸化的リン酸化)によって産生されます。解糖系では酸素を使わずに、グルコース1分子当たり2分子のATPを産生します。一方、ミトコンドリアでは酸素を使ってグルコース1分子当たり32分子のATPを産生できます。
細胞内における活性酸素は、主にミトコンドリアにおける酸素を使ったエネルギー産生過程で発生しますが、正常細胞においては、ミトコンドリアにおける物質代謝やエネルギー産生過程は整然とコントロールされており、活性酸素の発生は最小限に抑えられています。
一方、がん細胞ではミトコンドリアに様々な異常が起こっています。ATPを産生する呼吸鎖にも異常が起こっており、酸素を使ったエネルギー産生過程で大量の活性酸素が産生されやすくなっています。これは、排気ガス処理装置が壊れた自動車が排気ガスをまき散らすのと同じ状態です。つまり、がん細胞はミトコンドリアでの酸素消費を増やせば活性酸素の産生が増え、細胞が強いダメージを受け、自滅するリスクが高くなります。
がん細胞では酸素が十分に利用できる条件でも酸素を使わない解糖系でのATP産生を増やし、酸素を使ったミトコンドリアでのATP産生を抑制しています。これは活性酸素の産生を増やしたくないからです。ミトコンドリアでのエネルギー産生を抑制するため、エネルギー産生効率の悪い解糖系でエネルギー産生を行う必要があるために、グルコースの取り込みと解糖系の亢進が起こっているということになります。
またグルコース-6-リン酸からのペントースリン酸経路での代謝も亢進しており、この系で産生されるNADPHが細胞内の酸化ストレスを軽減するために利用されます。つまり、がん細胞はミトコンドリアでの酸素呼吸を抑制することによって活性酸素の発生を防ぐ必要があるため、必然的に酸素を使わない解糖系の活性が亢進しているのです。(図)

図:がん細胞はミトコンドリアの呼吸鎖の異常によって、酸素を使ってATPを産生すると活性酸素の産生量が増える(①)。がん細胞は解糖系(②)が亢進し、乳酸(③)の産生が増えている。また、ペントースリン酸経路(④)が亢進し、この経路でできるNADPH(⑤)はグルタチオンやチオレドキシンを還元して活性酸素を消去する(⑥)。
【放射線と抗がん剤は活性酸素でがん細胞を死滅する】
放射線治療にも活性酸素が大きく関与しています。がん細胞に対する放射線治療の効果は、細胞のDNA分子の傷が多く蓄積することによって現れます。DNA傷害に際しては、放射線がDNA鎖を直接傷害する直接作用と、水の放射線分解によって発生するヒドロキシルラジカルがDNA鎖を傷害する間接作用の二つが関係していると考えられています。
多くの抗がん剤においても、細胞に傷害を与え細胞死が実行される過程で活性酸素種が関与しています。(図)

図:放射線がDNAを構成する分子の電子をはじき飛ばす(電離)ことによって、分子間の結合を切断して直接的にDNAを傷害する(①)。さらに、放射線は組織の水分子(H2O)を電離してヒドロキシルラジカル(OH・)を発生し、このヒドロキシルラジカルがDNA分子に間接的にダメージを与える(②)。抗がん剤の多くも、細胞死を誘導する過程で活性酸素の発生が関与している(③)。
放射線治療や抗がん剤治療ががん細胞に酸化傷害を引き起こして死滅させるというメカニズムから、フェロトーシスを誘導する治療法は、放射線や抗がん剤によるがん治療に対する抵抗性(耐性)を逆転させる治療戦略として注目されています。
【「酸化ストレスを高める方法はがん治療法として有望」by James Watson】
放射線治療も抗がん剤治療も、がん細胞に酸化ストレスを高める方向で作用します。したがって、放射線治療や抗がん剤治療を行っているときには抗酸化剤の併用は治療効果を妨げます。むしろ、酸化ストレスを高めることを併用すれば、治療効果を高めることができます。
この考えを主張しているのがジェームズ・ワトソン(James Watson)です。
ワトソンは「がん細胞の無制限の増殖の結果として必然的に生じるエネルギー代謝や酸化ストレスに対するがん細胞の脆弱性をターゲットにしたがん治療」の重要性を主張しています。
Oxidants, antioxidant and the current incurability of metastatic cancers.(酸化剤と抗酸化剤と転移がんの現在の不治性)Open Biol. 2013 Jan 8;3(1):120144
ジェームズ・ワトソン(James Watson)は、1953年(25歳)にフランシス・クリックらとDNAの分子構造を解明し、1962年(34歳)にノーベル生理学・医学賞を受賞しています。
分子生物学研究のトップレベルの研究施設であるコールド・スプリング・ハーバー研究所に所長(1968年~1993年)や会長(1993年~2007年)として長く君臨し、NIH(国立衛生研究所)の国立ヒトゲノム研究センター初代所長を勤め、大統領自由勲章やアメリカ国家科学賞も受けています。
このような分子生物学やがん研究の領域で卓越した業績を残しているジェームズ・ワトソンが、この論文を「DNA二重螺旋の発見以来、私にとって最も重要な仕事」とインタビューで語っています。
この論文は24項目に分けて解説しています。その中から、上記の内容と関連した部分を日本語訳しておきます(重要な部分のみの抜粋です)。番号はこの論文でのサブタイトルの部分の番号(24項目の通し番号)です。
- Leakage from drug-impaired mitochondrial electron transport chains raises reactive oxygen species levels(薬剤で障害されたミトコンドリアの電子伝達鎖からの漏れが活性酸素種の量を高める)
ミトコンドリアにおける電子伝達系においてATPと熱が産生されるとき、必然的に活性酸素種(ヒドロキシラジカル、過酸化水素、スーパーオキシドなど)が発生する。
正常な状態では、これらの活性酸素種によって核酸やタンパク質が非可逆的なダメージを受けるのを防ぐために、細胞内にはグルタチオンやチオレドキシンといった強力な抗酸化性物質が存在する。
呼吸鎖へのNADHの供給を阻害するrotenoneのようなミトコンドリアに特異的に作用する薬や、アブラナ科植物に含まれるがん予防物質として古くから知られていて、ミトコンドリアのF1F0ATP合成複合体(the mitochondrial F1F0 ATP synthesis complex)を阻害する作用があるジインドリルメタン(3′-3′ diindolylmethane)によって酸化的リン酸化が阻害されると、ミトコンドリアからの活性酸素種の産生が増加する。このようにして産生された多量の活性酸素に対して、グルタチオンやチオレドキシンのような抗酸化物質が通常の量しかなければ十分に消去できない。
その結果、消去できなかった活性酸素種がミトコンドリア内の成分を酸化傷害でダメージを与え、アポトーシスによる細胞自滅を引き起こす。
活性酸素種そのものが細胞にアポトーシスを誘導することは、elesclomol (アポトーシス阻害薬の探索の過程でSynta Pharmaceuticals 社で発見された)が、活性酸素種の産生を高めることによってがん細胞を死滅させるという研究結果から確かめられた。
このような活性酸素種を産生させてがん細胞を死滅させるときに抗酸化剤のN-アセチルシステインを同時に投与すると、活性酸素によるがん細胞の死滅は起こらなくなる。
正常細胞に対してはelesclomolがアポトーシスを誘導できないのは、ミトコンドリアの電子伝達系が正常な場合は、活性酸素の産生が少ないためだと思われる。
- Reactive oxygen species may directly induce most apoptosis(活性酸素種は直接的にほとんどのアポトーシスを引き起こす)
多くの抗がん剤治療によって引き起こされるプログラム細胞死(アポトーシス)は、全てではないにしてもそのほとんどは活性酸素種によって引き起こされる可能性が示唆される。
パクリタキセルのようなタキサン系の微小管結合性の抗がん剤や、トポテカンやドキソルビシンのようなDNAトポイソメラーゼを阻害する抗がん剤や、アクリフラビンのようにフレームシフト型の遺伝子変異を引き起こす抗がん剤は、作用機序が全く異なるにもかかわらず、酸素に非常に感受性がある低酸素誘導因子-1α(HIF-1α)の活性を阻害することが知られており、このことは長い間の謎であった。
これらの一見無関係に思える全ての事実から導きだされる結論は、放射線照射が活性酸素種の産生によってアポトーシスを誘導するのと同じように、多くの抗がん剤やフレームシフト型遺伝子変異物質も活性酸素種を産生することによってアポトーシスを誘導していることが示唆される。
タキサン系抗がん剤のパクリタキセルがDNAに結合して活性酸素を生成しているということは、パクリタキセルに対するがん細胞の感受性がそのがん細胞の抗酸化能に逆相関するという実験結果から明らかになった。(抗酸化能の高いがん細胞ほどパクリタキセルが効きにくいということ)
多くの抗がん剤ががん細胞にアポトーシスを誘導する共通のメカニズムとして活性酸素を使っているということは、なぜ抗がん剤に抵抗性のがん細胞は放射線治療も同様に抵抗性になるかという理由を説明している。
- Blockage of reactive-oxygen-species-driven apoptosis by antioxidants (抗酸化剤による活性酸素種で誘導されるアポトーシスの阻害)
活性酸素種はアポトーシスを誘導する作用などで生命の維持において有用な働きを担っていることはよく知られているが、同時に、活性酸素種はタンパク質や核酸に非可逆的なダメージを与えるという負の作用もある。
そこで、活性酸素種は必要がないときは、グルタチオンやスーパーオキシド・ディスムターゼやカタラーゼやチオレドキシンなどの抗酸化性物質によって絶えず消去されなければならない。
このような多くの抗酸化性物質の合成を調節しているのが転写因子のNrf2であり、この転写因子は生命に重要な働きを担っているので、生命の発生の初期に出現したと考えられている。
最も重要なことは。ケンブリッジ大学のDavid Tuvesonの研究室からの研究によって、細胞の増殖や細胞分裂を促進するRAS, RAF, MYCというがん遺伝子によってNrf2の合成が増加することが示されている。
このことは生物学的に合目的なことである。というのも、DNAがより働くときに抗酸化物質が多く存在する方が都合が良いからである。
がん遺伝子のRASやMYCの異常によって増殖が亢進しているがん細胞が治療に抵抗性を示すのは、このようながん細胞では活性酸素種を消去する抗酸化物質の量が極めて多いからである。進行したがんはしばしばRASやMYCの遺伝子コピーを多数もっている(遺伝子増幅)という事実があり、このことが抗酸化物質の量の増加が治療抵抗性と関連しているかもしれない。
- Enhancing apoptotic killing using pre-existing drugs that lower antioxidant levels(抗酸化物質のレベルを低下させる既存の薬を使ったアポトーシスの促進)
造血性腫瘍を使った実験で、活性酸素種を生成する三酸化砒素(arsenic trioxide; As2O3) によるがん細胞の殺細胞能は、細胞内の主要な細胞内抗酸化物質であるグルタチオンの量に逆相関することが示されている。三酸化砒素はまた、細胞代謝のいくつかの重要なステップに必要なチオレドキシンの還元力を減弱させる作用がある。
三酸化砒素はチオレドキシンとグルタチオンの両方を阻害する能力を持つので、前骨髄球性白血病だけでなく、その他の多くのがんに対しても有効な治療効果を示す可能性がある。
三酸化砒素の抗がん作用を促進する効果があるのがビタミンC(アスコルビン酸)で、ビタミンCは細胞内の抗酸化作用の役割を担っているが、酸化されるとデハイドロアスコルビン酸(dehydroascorbic acid)になり、これは酸化剤となる。
残念なことに、臨床例において体内にあるがん細胞内のグルタチオンのレベルを低下させる有効な方法を我々はまだ持っていない。
グルタチオンの産生を阻害するbuthionine sulphazineを使ってグルタチオンの量を減らすと、転写因子のNrf2の量と活性が直ぐに上昇し、その結果、グルタチオンの合成が促進される。
【ジェームズ・ワトソンが言っているというインパクト】
上記の論文では、「多くの抗がん剤による細胞死は活性酸素が関与している」「抗酸化剤を使うと抗がん剤による細胞死が阻止される」「抗酸化システムを阻害すると抗がん剤の効き目を高めることができる」ということをジャームズ・ワトソンは主張しています。
もともと「がんと酸化ストレスと抗酸化剤」に関する議論は相反する2つの意見があります。
「抗がん剤治療中や放射線治療中に抗酸化剤を併用すると副作用が軽減し効果も高まる」という意見と「抗酸化剤は抗がん剤や放射線治療の効き目を阻害する」という、全く相反する意見で、それぞれ実験データなどでともに根拠があるので、議論は長い間平行線でした。
抗酸化剤ががん治療を妨げる可能性については、今までも多くの議論が行われているので、抗酸化性サプリメントががんを悪化させるという意見の記事や論文をみてもあまり驚くことはありません。
抗がん剤や放射線治療中に抗酸化剤を併用すると副作用の軽減と抗腫瘍効果を高めるというメリットを補完医療を専門に行っている医療関係者は主張しています。一方、標準治療の立場の多くの人は、抗酸化剤がこれらの治療効果を妨げる可能性を指摘しています。
ジェームズ・ワトソンは「抗酸化剤は抗がん剤や放射線治療の効き目を阻害する」「がん細胞の抗酸化力を阻害する抗-抗酸化剤ががん治療薬として有望」とはっきりと主張しています。
ジェームズ・ワトソンは1953年にフランシス・クリックとDNAの二重螺旋構造を解明したとき、自分では実験は何一つ行っていません。それまでに報告されている多くの実験結果やDNAに関するデータの蓄積の中から、全てを満足させるDNAの構造を理論的に構築しただけです。
つまり、全ての実験データに矛盾しない理論的考察だけでノーベル賞を受賞したと言えます。そのワトソンが、最近の膨大ながん研究を総括して得た結論が「進行がんには抗酸化物質の投与は良くない」「がん細胞は酸化ストレスを高めて死滅するのが良い」「がん細胞の抗酸化システムががん治療のターゲットとして有用」ということなので、これが正解かもしれないと思う気持ちが強くなります。
「がん組織の酸化ストレスを抗酸化剤で軽減することはがんの悪性進展抑制に有効」という従来の常識も見直しをする必要がでてきたわけです。
ワトソンの意見が正しいと決まったわけではないのですが、ワトソンほどの研究者が得た結論は、並の研究者の意見の10倍くらいのインパクトはあるかもしれません。
実際に、この数年のがん研究の傾向として、「がん細胞に酸化ストレスを高めるがん治療法」に関する研究論文が増えています。(下図)

図:放射線や多くの抗がん剤は活性酸素種を産生してがん細胞にダメージを与えて死滅させる(①)。したがって、このような治療を行っているときに抗酸化剤を併用すると細胞を死滅させる効果が減弱する(②)。がん細胞、特にがん幹細胞は、活性酸素種を消去するグルタチオンやチオレドキシンの細胞内レベルが高く、抗酸化酵素の発現を誘導する転写因子のNrf2の活性が高いので、活性酸素種によるダメージに抵抗性を示す(③)。したがって、がん細胞の抗酸化力を減弱させる抗-抗酸化剤(Anti-antioxidant)はがん治療薬として有望視されている(④)。ジェームズ・ワトソンは最近の講演や論文の中で、「がん治療における抗酸化剤の問題点」を指摘し、「末期のがんにおいては抗酸化剤はがんを促進する」「抗酸化性のサプリメントは、がんを予防するよりがんの発生を増やす可能性がある」という趣旨の発現を行っている。そして、「酸化ストレスを高める方法はがん治療法として有望」と言っている(⑤)。
がん細胞は恒常的な増殖活性を示すために、グルコースの取込みと解糖系の亢進という特徴を持ちます。さらに、抗酸化システムを増強して酸化ストレスに対する抵抗性を高めて細胞死を防いでいます。そのため、がん細胞はグルコースの取り込みや解糖系の阻害や、抗酸化システムの阻害で死滅するという特徴があります。たとえば、ミトコンドリアでの酸化的リン酸化を亢進すると活性酸素の産生が増えて酸化ストレスが増大し、細胞死を誘導できます。細胞内の酸化還元バランスを破綻させてがん細胞を死滅させる治療法をワトソン博士は主張しているのです。
フェロトーシスという言葉が提唱されたのは2012年です。このワトソンの論文は2013年で、フェロトーシスについては言及されていませんが、この論文の「アポトーシス」は「フェロトーシス」と変換しても、現在の見解では間違いではありません。
【中途半端では逆効果になる】
がん細胞内では活性酸素の産生量が増えており、抗酸化システムを亢進して酸化傷害を防いでいます。がん細胞は酸化ストレスを軽減するために余分のエネルギーを使うことになるので、酸化ストレスは増殖や転移を抑制する作用があります。
したがって、がん細胞のミトコンドリアでの酸化的代謝を亢進すると、増殖や転移を抑制できます。がん細胞に高度に酸化ストレスを高めることができれば、死滅させることができます。
しかし、中途半端な酸化ストレスだと逆に増殖や転移を促進することになります。それは、中等度の酸化ストレスは逆にがん細胞の活動性を高める作用があるからです。(図)

図:がん細胞でミトコンドリアでの酸化的リン酸化によるエネルギー産生を増やすと、活性酸素の産生が増え、酸化ストレスが高まる。中等度の酸化ストレス亢進はがん細胞の活動性を亢進し、増殖シグナルや血管新生を亢進する。高度の酸化ストレスの場合は酸化傷害によるダメージを受け、増殖が抑制され、細胞死が誘導される。がん細胞の酸化ストレスを高める治療では、徹底した酸化ストレスの亢進を目標にしなければならない。
がん細胞に選択的に活性酸素の産生を高めるがん治療法に多くのがん研究者は注目しています。がん細胞内で活性酸素の産生を増やし、抗酸化力を低下させれば、がん細胞を死滅できます。その具体的な方法がフェロトーシス誘導療法です。

図:ミトコンドリアで酸素呼吸によって活性酸素が発生する(①)。活性酸素は細胞に酸化傷害を引き起こすが、細胞内には活性酸素を消去する抗酸化物質や抗酸化酵素による抗酸化力(活性酸素消去能)が存在する(②)。細胞内には活性酸素の産生増加に応じて、抗酸化酵素の発現や活性を亢進することによって抗酸化力を高めるメカニズムが存在し、酸化還元のバランスを維持することによって酸化傷害の発生を防いでいる(③)。しかし、細胞内の活性酸素の産生量が増えたり、抗酸化力が低下すると、酸化還元バランスが破綻して(④)、酸化ストレスが亢進し(⑤)。細胞の増殖が抑制され、細胞死が誘導される(⑥)。
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
新刊
| « 901)がん細胞... | 903)がん消滅... » |