がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
904)がん消滅(その3): 5-アミノレブリン酸はアルテスネイトのフェロトーシス誘導を増強する

図:トランスフェリンは3価の鉄イオン(Fe3+)を運搬し(①)、細胞膜に存在するトランスフェリン受容体(TFR)に結合すると、この複合体は細胞内に取り込まれる(②)。エンドソーム内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。2価の鉄イオンは細胞質に移行して鉄プールに入り、細胞内の様々な目的で使用される(④)。アルテスネイト(⑤)は細胞質の2価鉄イオンと反応して(⑥)、活性酸素やフリーラジカルを発生させる⑦)。5-アミノレブリン酸(⑧)はミトコンドリアでのヘム合成を促進し(⑨)、ヘムはアルテスネイトと反応して活性酸素やフリーラジカルを発生する。ジクロロ酢酸ナトリウムとメトホルミンはミトコンドリアに作用して活性酸素とフリーラジカルの産生を増やす(⑩)。活性酸素やフリーラジカルは過酸化脂質の蓄積を引き起こし(⑪)、フェロトーシスによる細胞死を誘導する(⑫)。ドコサヘキサエン酸はがん細胞の脂質二重層に取り込まれ、過酸化脂質の蓄積を促進する(⑬)。アルテスネイトと5-アミノレブリン酸とジクロロ酢酸ナトリウムとメトホルミンとドコサヘキサエン酸を併用すると、がん細胞に選択的に細胞死を誘導でき、相乗効果で抗腫瘍効果を増強する。
904)がん消滅(その3): 5-アミノレブリン酸はアルテスネイトのフェロトーシス誘導を増強する
【アルテミシニン誘導体は抗マラリア薬として開発された】
アルテミシニン誘導体はマラリア治療薬です。青蒿(セイコウ:Artemisia annua)というキク科の薬草は中国伝統医学でマラリアなど様々な感染症や炎症性疾患の治療に古くから使用されていました。青蒿に含まれる抗マラリア作用の活性成分がアルテミシニン(Artemisinin)で、その効果を高めたアルテスネイト(Artesunate)とアルテメーター(Artemether)という2種類の誘導体が合成されています。これらは現在、マラリアの治療薬として世界中で使用されています。
青蒿からアルテミシニンを発見して抗マラリア薬を開発した中国の女性科学者の屠呦呦(Tu Youyou)博士は、2015年のノーベル生理学・医学賞を受賞しています。マラリアは熱帯・亜熱帯地域に広く分布し、最近のデータでも全世界で年間2億人以上が発症し、死者は50万人以上と言われる感染症です。その治療薬のアルテミシニン誘導体の開発は、「伝統薬から開発された医薬品としては20世紀後半における最大の業績」という表現がなされているほど、医学において重要な成果だと言われています。

図:中国の女性科学者の屠呦呦(Tu Youyou)博士は、2015年度のノーベル医学生理学賞を受賞した。屠博士は、古くからマラリアの治療に利用されてきた青蒿(Artemisia annua)という薬草から活性成分としてアルテミシニン(Artemisinin)を発見した。アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)は、現在マラリアの治療薬として世界中で使用されている。さらに、抗がん作用があることから、がんの代替医療にも使用されている。
青蒿(セイコウ)という生薬は強力な解熱作用があり、中国医学でマラリアなど様々な感染症や炎症性性疾患の治療に古くから使用されていました。
ベトナム戦争中に南ベトナムで組織された南ベトナム解放民族戦線(通称ベトコン)を援助するために中国軍がベトナム戦争に従軍しましたが、密林でマラリアに感染して病死する兵士が多く、そこで毛沢東の命令でマラリヤの治療薬の開発が国家プロジェクトとして1967年に開始されました。
その指揮を取ったのが、当時37歳の屠博士でした。屠博士は1970年代に、その薬効成分のアルテミシニンを分離し、アルテミシニンやその誘導体のアルテスネイトやアルテメーターの抗マラリア薬としての有効性を確認しました。
アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)は分子の中に鉄イオンと反応してフリーラジカルを産生するエンドペルオキシド・ブリッジ(endoperoxide bridge)を持っています。
アルテスネイトは、非常に低濃度で体内のマラリア原虫を死滅させます。マラリア原虫は赤血球内に感染します。マラリア原虫が感染した赤血球内では、マラリア原虫によって赤血球中のヘモグロビンが分解してフリーの鉄やヘムが蓄積し、その鉄やヘムとアルテスネイトが反応してフリーラジカルが赤血球中で発生してマラリア原虫を死滅させると考えられています。
つまり、赤血球内のマラリア原虫の周りにはフリーの鉄やヘムが多く存在するので、アルテスネイトの効果が出やすいのです。(図)

図:マラリア原虫は赤血球に感染する(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し(②)、これはフリーの鉄イオンやヘムと反応して活性酸素を発生する(③)。マラリア原虫が感染した赤血球ではヘモグロビンが分解したフリーの鉄イオンやヘムが多量に存在し、アルテスネイトと反応して赤血球内で発生した活性酸素がマラリア原虫を死滅する。
【フェロトーシスは鉄介在性の細胞死】
フェロトーシス(Ferroptosis)の「フェロ(Ferro)」は鉄という意味です。「ptosis」は「下垂する」という意味で、枯れ葉が枝から落ちる様から細胞の死を意味します。つまり、フェロトーシスは「鉄が介在する細胞死」を表しています。
フェロトーシスでは、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。細胞内の鉄に依存する機構であり、他の金属類には依存しません。
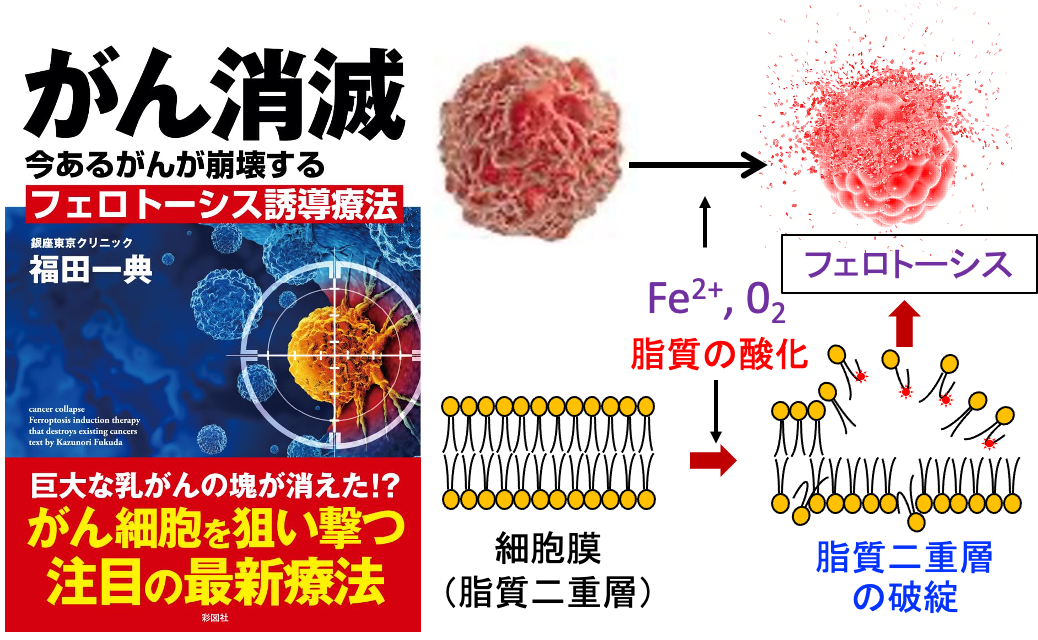
がん細胞は鉄の取り込みが増えており、鉄介在性に活性酸素の産生が増え、細胞膜の脂質の過酸化が蓄積して細胞死が起こります。この鉄介在性の細胞死をフェロトーシスといいます。(図)

図:がん細胞はトランスフェリン受容体(①)の発現が亢進し、鉄(②)の取り込みが増え、鉄を多く含む。2価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で活性酸素の産生が増え(③)、脂質の酸化が強く起こり(④)、細胞膜の脂質二重層が破綻し(⑤)、細胞死(フェロトーシス)が誘導される(⑥)。正常細胞は鉄の含有量が少ないのでフェロトーシスは起こりにくい(⑦)。
【アルテスネイトはがん細胞にフェロトーシスを誘導する】
アルテスネイトはマラリアの治療薬です。この薬ががん細胞を死滅するという基礎研究は1990年代から報告され、人間でも効果を認めた症例が報告されていました。がん細胞は鉄を多く含み、鉄とアルテスネイトが反応してフリーラジカルを産生してがん細胞を死滅します。正常細胞は鉄の含有量が少ないので傷害を受けず、がん細胞が選択的に死滅します。鉄介在性のフリーラジカル産生によって細胞死を誘導するのです。(下図)

図:がん細胞は細胞内に鉄を多く取り込んでいる(①)。抗マラリア薬のアルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し(②)、これは鉄イオンやヘムと反応して活性酸素を発生する。鉄イオンを介してがん細胞内で多量に発生した活性酸素は、細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、細胞死(フェロトーシス)を誘導する(③)。正常細胞は鉄の含有量が少ないのでアルテスネイトによる酸化傷害を受けない(④)。
2012年に米国のコロンビア大学の研究グループが鉄依存性の細胞死に対してフェロトーシス(Ferroptosis)という用語を提唱しました。フェロトーシスは、細胞内で鉄介在性に活性酸素やフリーラジカルが発生し、細胞膜の脂質の過酸化が生じて細胞膜が破綻して誘導される細胞死です。
アルテスネイトの抗腫瘍効果はフェロトーシスという特殊な細胞死の誘導であることが明らかになりました。アルテスネイト単独では抗がん作用に限界がありますが、細胞内の抗酸化システムを阻害する方法や、がん細胞内に活性酸素の産生を増やす方法を併用することによってアルテスネイトのフェロトーシス誘導作用を強化できることが明らかになりました。
【フリーの鉄よりヘムの方がアルテスネイトの抗がん作用を増強する】
一般的には、アルテスネイトはがん細胞に多く含まれるフリーの2価鉄(Fe2+)と反応して、活性酸素やフリーラジカルの産生を増やして、がん細胞を死滅すると考えられています。この考え自体は間違いでないと思います。アルテスネイトで誘導される細胞死は、抗酸化剤と鉄キレート剤で阻止できるからです。
抗酸化剤で細胞死が阻止されるのは、細胞死が活性酸素による細胞傷害(酸化傷害)の機序で起こっていることを意味します。
鉄キレート剤は細胞内の鉄と結合し、これを無害化します。がん細胞内の過剰な鉄はフリーラジカルの生成を促進し、酸化ストレスを引き起こします。鉄キレート剤はフリーラジカル生成に加担する鉄の供給を制限することによりフリーラジカル生成を抑制し、細胞に対する酸化的ダメージを軽減します。したがって、鉄キレート剤で細胞死が阻止されるのは鉄が介在するフェロトーシスによる細胞死が起こっていることを意味します。
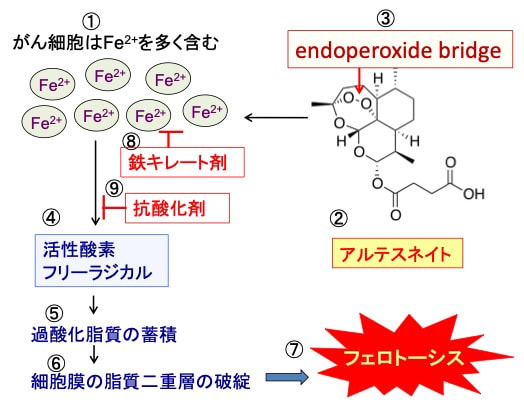
図:がん細胞はフリーの2価鉄(Fe2+)を多く含む。アルテスネイト(②)の分子内のendoperoxide bridge(③)は2価鉄(Fe2+)と反応して活性酸素やフリーラジカルを産生し(④)、過酸化脂質を蓄積し(⑤)、細胞膜の脂質二重層が破綻して(⑥)、フェロトーシスで死滅する(⑦)。アルテスネイト誘導性のフェロトーシスは鉄キレート剤(⑧)や抗酸化剤(⑨)で阻止できる。これはアルテスネイト誘導性の細胞死が鉄介在性に発生する活性酸素やフリーラジカルによる細胞傷害によることを示唆する。
フリーの鉄よりヘムの方がアルテスネイトの抗がん作用を増強することが報告されています。以下のような報告があります。
Heme activates artemisinin more efficiently than hemin, inorganic iron, or hemoglobin(ヘムは、ヘミン、無機鉄、またはヘモグロビンよりも効率的にアルテミシニンを活性化する)Bioorg Med Chem. 2008 Aug 15;16(16):7853-61.
アルテミシニン誘導体は、酸化還元反応を通じて抗マラリア活性を発揮すると考えられます。ヘム、無機鉄、ヘモグロビンはすべて、アルテミシニンを活性化する重要な分子として関与していると考えられています。
アルテミシニンと、さまざまな酸化還元形態のヘム、第一鉄、脱酸素化ヘモグロビンおよび酸素化ヘモグロビンとの反応を、同様の in vitro 条件下で分析しました。その結果、ヘムは他の鉄含有分子よりもはるかに効率的にアルテミシニンと反応し、アルテミシニンの主要な活性化因子であることを報告しています。
がん細胞内の鉄やヘムの濃度は、マラリア原虫が感染した赤血球ほど高くはありません。したがって、マラリアの治療に比べて、がん細胞に対するアルテスネイトの効果はあまり強くありません。
しかし、アルテスネイトの抗腫瘍効果を高める方法が幾つか報告されていますので、それらを組み合せれば、強い抗がん作用が期待できます。以下のような報告があります。
The Role of Heme and the Mitochondrion in the Chemical and Molecular Mechanisms of Mammalian Cell Death Induced by the Artemisinin Antimalarials(アルテミシニン抗マラリア薬による哺乳類細胞死の化学的および分子的メカニズムにおけるヘムおよびミトコンドリアの役割)J Biol Chem. 2011 Jan 14; 286(2): 987–996.
この研究ではヒトがん細胞株のHeLa細胞と、HeLa細胞のミトコンドリアDNAを欠損させた細胞(HeLa ρ0)の2種類のがん細胞株を用いてアルテスネイトの抗腫瘍活性を比較しています。
ミトコンドリアは固有のDNA(ミトコンドリアDNA)を持ち、このミトコンドリアDNAには呼吸酵素複合体IからVを構成する85種類のサブユニットのうち13種類のたんぱく質を作成する遺伝子が存在します。
従って、ミトコンドリアDNAを欠失させるとミトコンドリアでの酸化的リン酸化によるATP産生が起こらなくなります。
ミトコンドリアDNAが欠損しても、酸化的リン酸化以外のミトコンドリアの機能は維持できます。がん細胞はミトコンドリアでの酸素を使ったATP産生を行わなくても、解糖系でATPを賄うことができるので、酸化的リン酸化が障害されても生存はできます。
アルテスネイト存在下で48時間培養した場合の50%細胞致死量はHeLa細胞が6 ± 3 μMで、ミトコンドリアDNAを欠損したHeLa ρ0細胞では34 ± 5 μMでした。
50%細胞致死量が大きいのは、死ににくいことを意味するので、この結果はミトコンドリアDNAが欠損しているとアルテスネイトで死滅しにくくなることを意味します。
つまり、ミトコンドリアでの酸化的リン酸化が低下しているとアルテスネイトの殺細胞作用が減弱するという結果です。
また、アルテスネイトの殺細胞作用は、細胞のヘムの合成を亢進すると増強し、ヘムの合成を阻害すると減弱することを示しています。つまり、アルテスネイトの殺細胞作用の活性化にはヘムの存在が重要であることを示しています。
以上の実験結果は、ミトコンドリアの酸化的リン酸化の活性化とヘム合成の亢進はアルテスネイトの殺細胞作用を増強できることを意味しています。これは、ミトコンドリアの酸化的リン酸化を亢進する5-アミノレブリン酸とジクロロ酢酸ナトリウムがアルテスネイトの抗腫瘍効果を増強する理由になります。(下図)

図:ピルビン酸をアセチルCoAに変換するピルビン酸脱水素酵素(①)はピルビン酸脱水素酵素キナーゼ(②)で阻害され、ジクロロ酢酸ナトリウム(③)はピルビン酸脱水素酵素キナーゼを阻害する。その結果、ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素の活性を高め、酸化的リン酸化を促進してミトコンドリア内での活性酸素の産生を高める(④)。5-アミノレブリン酸(⑤)はミトコンドリアでのヘム合成を促進し、ヘムはアルテスネイトと反応し(⑥)、活性酸素の産生を増強する(⑦)。活性酸素の産生は細胞膜の過酸化脂質の蓄積を引き起こし(⑧)、フェロトーシスによる細胞死を誘導する(⑨)。
【アルテスネイトの抗腫瘍効果はポルフィリン(ヘム)生合成が必要】
以下のような報告があります。アルテスネイトの抗がん作用のメカニズムに関する研究として現時点で最も重要な論文です。
A whole-genome scan for Artemisinin cytotoxicity reveals a novel therapy for human brain tumors(アルテミシニンの細胞毒性の全ゲノムスキャンにより、ヒト脳腫瘍の新規治療法が明らかになった)EMBO Mol Med. 2023 Mar 8;15(3):e16959.
【要旨】
天然化合物アルテミシニンは、世界中で最も広く使用されている抗マラリア薬である。その細胞毒性に基づいて、がん治療にも使用されている。アルテミシニンとその誘導体は、真核細胞のタンパク質に損傷を与えるエンドペルオキシドである。しかし、それらの明確な作用機序と宿主細胞の標的は、ほとんど解明されていないままである。
酵母および半数体幹細胞のスクリーニングを使用して、アルテミシニンの細胞毒性には単一の細胞経路、すなわちポルフィリン(ヘム)生合成が必要であることを実証した。ポルフィリン産生の遺伝的または薬理学的調節は、真核細胞におけるその細胞毒性を変化させるのに十分であった。
脳神経膠芽腫オルガノイドや患者由来の腫瘍スフェロイドなど、ヒト脳腫瘍の複数のモデルシステムを使用して、臨床的に承認されているポルフィリン合成促進剤であり外科用蛍光マーカーとして使用されている 5-アミノレブリン酸(5-ALA) を使用して、がん細胞をジヒドロアルテミシニンに対して感作させることができる。
アルテミシニンと 5-ALA の併用治療は、生体内での移植腫瘍を含む、試験したすべてのモデル系において脳腫瘍細胞を顕著かつ特異的に死滅させた。
これらのデータは、アルテミシニンの細胞毒性の重要な分子経路と、薬剤耐性ヒト神経膠芽腫を含むさまざまな脳腫瘍を治療するための感作戦略を明らかにした。
この論文の著者は22人です。著者らの所属は、オーストリア科学アカデミー分子生物工学研究所、ウィーン医科大学(がん研究センター、小児科総合センター、脳神経外科)、ノバルティス バイオメディカル研究所(スイス、バーゼル)、米国マサチューセッツ州のダナファーバー・ボストン小児がん・血液疾患センター、米国のハーバード大学とMITのブロード研究所、ドイツのヨハネス・グーテンベルク大学薬学・生物医学研究所薬学生物学部、オーストリアのケプラー大学病院の脳神経外科、中国上海の同済大学生命科学技術学院、中国上海の同済大学幹細胞研究フロンティア科学センター、カナダのブリティッシュコロンビア大学生命科学研究所の医学遺伝学科です。一流の研究所の研究者の共同研究です。
この論文の責任著者(corresponding author)のヨーゼフ・ペニンガー(Josef Penninger)博士は、ブリティッシュコロンビア大学生命科学研究所所長です(2018年から2023年まで)。それ以前は、2002年から2018年まで、オーストリア・ウィーンにあるオーストリア科学アカデミーの研究機関の分子生物工学研究所(IMBA)の所長を務めました。
ヨーゼフ・ペニンガーは、数多くの賞や名誉賞を受賞しています。その中には、医学部門のエルンスト・ユング賞、デカルト賞(ヨーロッパ最高賞)、そして「オーストリアのノーベル賞」とも呼ばれるウィトゲンシュタイン賞などがあります。2015年、彼はドイツ語圏で最も影響力のある思想的リーダーのランキングで11位にランクインしました。さらに、彼は世界で最も論文引用されている科学者のトップ10に2度選ばれ、青島中国大学の名誉教授の称号を授与され、オーストリア功労十字章を授与されています。
掲載されている雑誌(EMBO Mol Med.)も一流です。つまり、アルテスネイトの抗腫瘍効果のメカニズムに関する研究論文としては、最もインパクトのある論文と言っても過言ではありません。
この論文で明らかにされた「アルテミシニンの細胞毒性にはポルフィリン(ヘム)生合成が必要である」「ポルフィリン産生を阻害するとアルテミシニンの抗腫瘍効果は阻止された」「ポルフィリン生合成を促進する5-アミノレブリン酸(5-ALA)は、アルテミシニンの抗腫瘍効果を増強する」「アルテミシニンと 5-ALA の併用治療は、生体内での移植腫瘍を含む、試験したすべてのモデル系において脳腫瘍細胞を顕著かつ特異的に死滅させた」という実験結果は重要です。
アルテミシニンは細胞毒性機能を果たすために細胞ヘムを必要とします。その細胞毒性は、がん細胞に蓄積するポルフィリン増強剤 5-ALA によって増強されます。5-ALA は腫瘍細胞を感受性にします。アルテミシニンの抗腫瘍効果は5-ALAによって増強されるという結果です。(下図)

図:トランスフェリンは3価の鉄イオン(Fe3+)を運搬し(①)、細胞膜に存在するトランスフェリン受容体(TFR)に結合すると、この複合体は細胞内に取り込まれる(②)。エンドソーム内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。2価の鉄イオンは細胞質に移行して鉄プールに入り、細胞内の様々な目的で使用される(④)。アルテスネイト(⑤)は細胞質の2価鉄イオンと反応して(⑥)、活性酸素やフリーラジカルを発生させる⑦)。5-アミノレブリン酸(⑧)はミトコンドリアでのヘム合成を促進し(⑨)、ヘムはアルテスネイトと反応して活性酸素やフリーラジカルを発生する。活性酸素やフリーラジカルは過酸化脂質の蓄積を引き起こし(⑩)、フェロトーシスによる細胞死を誘導する(⑪)。アルテスネイトと5-アミノレブリン酸を併用すると、がん細胞に選択的に細胞死(フェロトーシス)を誘導でき、相乗効果で抗腫瘍効果を増強する。
生化学的には、アルテミシニンはエンドペルオキシド(endoperoxide)です。エンドペルオキシドは化学構造においてペルオキシド結合を含む化合物です。
ペルオキシド結合とは、酸素原子が過酸化水素のように2つの酸素原子が単結合で結ばれている状態(-O-O-構造)を指します。エンドペルオキシドは、一般に環状構造を持ち、化合物の中に含まれる特定の官能基によって特徴付けられます。
ペルオキシドの酸素-酸素間の単結合は非常に壊れやすく、RO・形のフリーラジカルを作ります。
この化合物は、生物学的な研究や医薬品の開発において重要な役割を果たすことがあり、特に抗がん剤や抗炎症剤としての活性が注目されています。
そのエンドペルオキシド特性は、抗マラリア効果に必要です。エンドペルオキシド架橋が切断されると、アルテミシニンが活性化され、活性酸素種とフリーラジカルの生成を招き、細胞内の感受性タンパク質と高分子をアルキル化します。このアルキル化反応は、タンパク質の構造と機能を変化させ、DNA を損傷し、細胞ストレスを誘発し、最終的に細胞死をもたらします。
さらに、アルテミシニンはさまざまな細胞タンパク質と関連し、解糖、タンパク質生合成、ミトコンドリアプロセス、抗酸化応答など、複数の経路に影響を及ぼすことが報告されています。
アルテミシニンの明確な調節因子または活性化因子についてはまだ議論が続いていますが、ヘムやヘモグロビンなどの遊離鉄または複合体鉄が有力な候補と考えられています。しかし、アルテミシニンの多様な結合特性と報告されている機能の多さから、これまでのところ明確な細胞標的の特定はできていません。
そこで、ゲノムワイドスクリーニングを使用して解析した結果、真核細胞におけるジヒドロアルテミシニン毒性の必須経路として、ミトコンドリア機能、特にポルフィリン生合成を同定しました。
ジヒドロアルテミシニンはアルテミシニンやアルテスネイトの体内の代謝産物の一つです。
ポルフィリン産生の遺伝的および薬理学的操作は、in vitroでの複数のマウスおよびヒト腫瘍細胞のDHAに対する感受性を変えるのに十分でした。つまり、ポリフィリン生合成を促進するとアルテミシニンの抗腫瘍効果が増強され、ポルフィリン生合成を阻害するとアルテミシニンの抗腫瘍効果が阻止されました。
臨床的に承認された光力学ポルフィリン増強剤および外科用蛍光マーカーである 5-ALA を使用してポルフィリン生合成経路を増強すると、ヒト脳腫瘍オルガノイドおよび患者由来脳腫瘍スフェロイドだけでなく、生体内の同所性患者由来異種移植においてもアルテミシニンおよびその誘導体の抗癌活性が著しく増加しました。
この実験系にポルフィリン/ヘム生合成の薬理学的阻害剤を使用してヘム生合成を阻害するとアルテミシンの細胞毒性は消失しました。
つまり、ポルフィリン生合成がアルテミシニンやアルテスネイトの細胞毒性に必須であることが証明されたということです。
この論文では、5-ALAとアルテスネートの併用治療は神経膠芽腫の増殖を減少させることを複数の実験モデルで示しています、
アルテミシニンおよびアルテスネートなどのその誘導体はプロドラッグであり、抗マラリアおよび抗がん効果を得るためには、エンドペルオキシド部分を切断するために細胞活性化が必要です。これまでの研究では、 アルテスネイトのエンドペルオキシドのin vitro分解における鉄の役割が提案されています。他方、他の研究では、細胞環境の状況に応じてヘムが同様の機能を担っていることが指摘されています。最近、化学プロテオミクス手法を用いて、複数の研究グループが独立して「アルテスネイトが複数のタンパク質を無差別にアルキル化する前にヘムによって活性化される」ことを示しました。
この治療におけるがん細胞特異性は、正常細胞と比較してがん細胞におけるヘム合成能力の向上に起因する可能性があることが示されています。
アルテスネイトはがん細胞でも同様にヘムによって活性化される可能性がありますが、ヘモグロビンが大量に消化されるマラリア寄生虫の場合と比較すると、ヘムレベルははるかに低いと言えます。そこで5-ALAを投与して細胞内ヘムのレベルを上昇させ、それによってアルテスネイト の活性化とその細胞毒性を高めることができると考えられます。
ALA 合成酵素は正常細胞と比較して癌細胞で高度に発現していることがわかり、癌細胞がヘム合成に ALA を利用する能力が高いことを示唆しています。ALA 自体は、画像誘導手術または腫瘍治療のための光線力学療法で臨床的に使用されている薬剤です。
アルテスネイト、アルテスネイト+5-ALA、アルテスネイト+5-ALA+ヘム合成阻害剤スクシニルアセトンをそれぞれ投与した後の癌細胞の生存率を調べました。アルテスネイト単独の24時間処理ではIC50は 約2μMでしたが、5-ALAの添加によりIC 50は約10倍低下し、約200nMとなりました。
ヘム合成阻害剤スクシニルアセトンの添加は、5-ALAの存在にかかわらず、アルテスネイト処理の細胞毒性を完全に阻害しました。
アルテスネイトと5-アミノレブリン酸とジクロロ酢酸ナトリウムとメトホルミンとドコサヘキサエン酸を併用すると、がん細胞に選択的に細胞死を誘導でき、相乗効果で抗腫瘍効果を増強することができます。(トップの図)
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
新刊
| « 903)がん消滅... | 905)ドコサヘ... » |