がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
877)小胞体ストレスを高めてがん細胞を死滅する
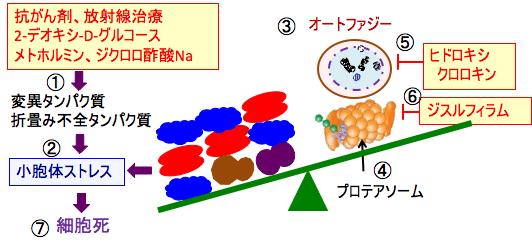
図:抗がん剤、放射線治療、2-デオキシ-D-グルコース、メトホルミン、ジクロロ酢酸ナトリウムは細胞内に変異タンパク質や折畳み不全のタンパク質を増やし(①)、小胞体ストレスを引き起こす(②)。オートファジー(③)とプロテアソーム(④)は異常タンパク質を分解することによって小胞体ストレスを軽減する。ヒドロキシクロロキンはオートファジーを阻害し(⑤)、ジスルフィラムはプロテアソームを阻害する(⑥)。これらを併用すると、小胞体ストレスが増強して、細胞は死滅する(⑦)。
877)小胞体ストレスを高めてがん細胞を死滅する
【強いストレスが長期に及ぶと、細胞はアポトーシスを誘導する】
細胞はストレス(負担となる刺激や状況)に対して一連の反応(恒常性維持機能や抵抗力など)で適応し、細胞傷害に対して抵抗します。しかし、強度のストレスが長期に及ぶと、恒常性維持機能や抵抗力も限界を迎えて、細胞は死滅します。
がん細胞は、正常な細胞に比べてストレスの多い状況で生きています。それは、低酸素や低グルコースや異常タンパク質の蓄積や活性酸素の産生増加などによって細胞内でストレスの高い状況が起こっているのです。
ストレスの代表が小胞体ストレスや酸化ストレスです。
小胞体ストレスと酸化ストレスをがん細胞に特異的に高めることによってがん細胞を選択的に死滅させようという治療法が注目されています。
抗がん剤治療や放射線治療は、がん細胞に小胞体ストレスや酸化ストレスを高めて死滅させます。これに対して、がん細胞は小胞体ストレス応答や抗酸化システムを亢進して、細胞傷害や細胞死に対抗します。
このがん細胞の抵抗(小胞体ストレス応答や抗酸化システム)を阻害すると、抗がん剤治療や放射線治療の効果を高めることができます。(下図)

図:がん組織内ではがん細胞は低酸素や低グルコースによるストレスを受け、さらに抗がん剤や放射線もがん細胞にダメージを与える(①)。その結果、がん細胞は異常タンパク質や活性酸素種の産生増加と蓄積によって、小胞体ストレスと酸化ストレスを受ける(②)。これに対して、がん細胞は小胞体ストレス応答、抗酸化システム、オートファジーやプロテアソームにおけるタンパク質分解などのメカニズムで細胞内ストレスに対して応答して、生存を維持しようとする(③)。このバランスが崩れて、小胞体ストレスおよび酸化ストレスが増強すると、細胞傷害の増大によって細胞死(アポトーシス)が起こる(④)。2-デオキシグルコース、メトホルミン、ジスルフィラム、アルテスネイト、ジクロロ酢酸ナトリウム、ヒドロキシクロロキンは小胞体ストレス応答や抗酸化システムやオートファジーやプロテアソームを阻害することによってストレス応答を阻害する(⑤)。さらに、異常タンパク質や活性酸素の蓄積を亢進して小胞体ストレスと酸化ストレスを亢進する(⑥)。がん細胞内のストレスを増強し、ストレス応答による恒常性維持機構を破綻させると、がん細胞を死滅できる。
【タンパク質はリボソームで合成される】
タンパク質は細胞内のリボソームで作られます。DNAからメッセンジャーRNA(mRNA)が作られ(転写)、このmRNAに転写された遺伝情報をトランスファーRNA(tRNA)を用いて、対応するアミノ酸を連結することで、タンパク質を合成します。
mRNAのコドン(3文字の塩基配列)によってアミノ酸の種類が決まります。合成されたタンパク質は様々な修飾や折りたたみを経て正しい機能をもつタンパク質に成熟します。

図:リボソーム内では、mRNAに転写された遺伝情報をトランスファーRNAを用いて解読し、対応するアミノ酸を連結することで、タンパク質を合成する。mRNAのコドン(3文字の塩基配列)によって連結されるアミノ酸の種類が決定する。アミノ酸の鎖から成るタンパク質が合成された後、折り畳みや翻訳後修飾が行われて、成熟したタンパク質となる。
【タンパク質は小胞体で折り畳まれる】
タンパク質なしでは生命は存在しません。このタンパク質が正しく機能するためには、3次元的に正しく折り畳まれる必要があります。
タンパク質はアミノ酸が複数結合した直鎖状の分子で、可能な立体構造は無数に存在しますが、細胞内では熱力学的に最も安定な立体構造を自発的にとります。このようにタンパク質が機能するために特定の立体構造に折り畳まれることを「タンパク質折り畳み(Protein Folding)」と言っています。
タンパク質折り畳みは小胞体で行われます。小胞体は真核生物の細胞内小器官の一つで、一重の生体膜に囲まれた板状あるいは網状の膜系の器官です。
細胞質を横断するようにして核膜までつながる袋状の膜構造によって構成されます。
小胞体は、その構造と機能によって、2つに分けられます。一つは粗面小胞体 (Rough endoplasmic reticulum) と呼ばれ、小胞体膜の細胞質側にリボソームが付着しています。粗面小胞体は、主にタンパク質合成に関与します。
もう一方は、滑面小胞体 (Smooth endoplasmic reticulum) と呼ばれ、リボソームが付着していない小胞体です。滑面小胞体は、酵素およびその代謝産物の貯蔵を行います。
リボソームで合成された膜タンパク質や分泌タンパク質は、小胞体内やゴルジ体で「タンパク質の折り畳み」や、「糖鎖の結合」などたんぱく質の翻訳後修飾を受けて正しい機能を発揮できるたんぱく質として完成します。
小胞体はタンパク質の折り畳み以外にも、脂肪やステロイドの合成、解毒、エネルギー代謝、細胞内カルシウムの制御、酸化還元反応を制御など多彩な機能を果たしています。
つまり、小胞体の機能が破綻すると、細胞は増殖も生存もできなくなります。これが、がん細胞に小胞体ストレスを誘導・亢進する方法ががん治療法となる理由です。

図:細胞核の中でDNA上の遺伝子からRNAポリメラーゼや転写因子の働きによってmRNA(メッセンジャーRNA)が生成される過程を転写という(①)。リボソームではmRNAの情報に基づき、アミノ酸が順番に結合してタンパク質が生成され、これを翻訳という(②)。翻訳後のポリペプチド鎖(③)は小胞体で3次元的に折り畳まれて、機能を発揮する(④)。小胞体には、リボソームが付着した粗面小胞体と付着していない滑面小胞体がある(⑤)。
20種類のアミノ酸は側鎖の違いによって個々の性質を持ちます。その性質の一つに、水になじみやすい親水性のアミノ酸と、水になじみにくい疎水性のアミノ酸があります。この親水性と疎水性という性質がタンパク質の3次構造の決定に重要な要素になります。
タンパク質には親水性のアミノ酸が密に存在している部分と、疎水性のアミノ酸が多数集まっている部分が混在しています。この場合、細胞内は水分で満たされているため、疎水性アミノ酸の多い部分はタンパク質の内部に折り込まれ、親水性のアミン酸の多い部分は外側に集まるような力が働いて、ある程度は自然に安定的な3次元構造に折り畳まれるのです。
多くのタンパクやペプチドはさらに様々な化学修飾を受けます。これは翻訳後修飾と呼ばれます。
例えば、リン酸化や糖鎖付加、ジスルフィド(S-S)結合の形成の他にメチル化、イソプレニル化などの化学修飾や、酵素による切断などが知られています。
ジスルフィド結合(S-S結合)はシステインが持っているイオウ原子(S)同士が共有結合します。
タンパク質の3次元構造は、このジスルフィド結合と、疎水性アミノ酸同士が集合する性質による疎水性相互作用、アミノ酸が持つ水素原子間の相互作用(水素結合)、アミノ酸側鎖のプラスとマイナスの電気的な引力や斥力からなる静電的相互作用などによって、構造が安定化されます。

図:ポリペプチドが折り畳まれるとシステインのSH基の間でジスルフィド結合(S-S結合)による共有結合で立体構造がより強固なものになる。多くのタンパク質はさらに、リン酸化、糖鎖付加、脂質付加、アセチル化、メチル化などの翻訳後修飾を受けることによって機能を持つようになる。これらは小胞体膜表面や小胞体内腔やゴルジ体で行われる。

図:リボソームで作られた蛋白質は、小胞体で修飾を受けて高次構造(折り畳み)を形成し、さらにゴルジ体で糖鎖の結合などによって成熟蛋白質となって細胞外へ搬出、あるいは細胞内で利用される。
【折り畳みの異常なタンパク質が増えると小胞体ストレスを起こす】
折り畳みに失敗した異常なタンパク質は小胞体にとどまります。
このような正常な高次構造に折り畳まれなかった異常タンパク質が小胞体内に蓄積して、細胞への悪影響(=ストレス)が生じることを小胞体ストレス(ERストレス:Endoplasmic reticulum stress)と言います。
小胞体ストレスの原因となる変性タンパク質は、遺伝子変異、ウイルス感染、炎症、有害化学物質(抗がん剤など)、栄養飢餓、低酸素(虚血)などにより生じます。
変性タンパク質が過剰に蓄積し、小胞体ストレスの強さが細胞の回避機能を越えると、細胞死(アポトーシス)が誘導されます。
小胞体ストレスはアルツハイマー病や筋萎縮性側索硬化症(ALS)などの神経変性疾患などさまざまな疾患の原因となると考えられています。
小胞体ストレスが生じると、細胞は小胞体ストレスを軽減する応答が発動します。これを小胞体ストレス応答(unfolded protein response: UPR) と言います。
小胞体に異常タンパク質が増えると、まず、タンパク質の翻訳(合成)を抑制します。さらに、折り畳み不全の異常タンパク質を正常化する分子シャペロンのGRP78と言うタンパク質の合成を亢進し、異常タンパク質の修復を行います。それでも異常タンパク質が減らなければ、異常タンパク質をプロテアソームやオートファジーで分解します。
しかし、小胞体ストレスが強度で長期に及んだり、小胞体ストレス応答が阻害されたりすると、細胞はアポトーシスのシグナルのスイッチが入り、自滅します。(下図)

図:栄養飢餓(グルコース枯渇)や虚血や低酸素が起こると(①)、折り畳みに異常をきたした不良タンパク質が小胞体に蓄積する(②)。これを『小胞体ストレス』という(③)。小胞体ストレスに対して細胞は小胞体ストレス応答で対抗する(④)。すなわち、タンパク質の合成を抑制したり(⑤)、分子シャペロンのGRP78の発現を亢進して、異常タンパク質の折り畳みを助けて、不良タンパク質の軽減を行う(⑥)。さらに、異常タンパク質のプロテアソームでの分解を促進して小胞体ストレスを軽減する(⑦)。しかし、小胞体ストレスが軽減できず、強い小胞体ストレスが長期に及ぶと、細胞はアポトーシスによる細胞死を起こす(⑧)。したがって、がん細胞に小胞体ストレスを高め、小胞体ストレス応答を阻害すると、がん細胞を自滅できる。
【小胞体ストレスを軽減する分子シャペロン】
小胞体ストレスは細胞の機能を妨げるため、細胞にはその障害を回避する仕組みが備わっています。この小胞体ストレスに対する細胞反応を小胞体ストレス応答 (unfolded protein response: UPR) といいます。
折り畳みの不完全な異常タンパク質(unfolded protein)に対する細胞内応答です。
変性タンパク質は小胞体ストレスセンサー(PERK, ATF6, Ire1)によって感知され、小胞体ストレス応答を誘導します。以下のような複雑なシグナル伝達系が関与しています。(詳細な解説は省きます)

図:小胞体ストレスのセンサー分子のPERK(PKR-like endoplasmic reticulum kinase)、ATF6(activating transcription factor 6)、Ire1(inositol-requiring 1)は小胞体膜を貫通して、小胞体内腔のGRP78と結合して不活性化されている。小胞体内に折り畳み不全の不良タンパク質が増えると、分子シャペロンのGRP78は不良タンパク質と結合してリクルートされる。その結果、PERKとATF6とIre1が遊離されて、下流のシグナル伝達系か発動される。その結果、小胞体ストレスの程度に応じて、タンパク質翻訳の停止、分子シャペロンの合成亢進、プロテオソームでの分解促進、アポトーシスによる自滅が引き起こされる。CHOPは小胞体ストレスによって顕著に誘導されるタンパク質で、CHOPの活性化はアポトーシスを誘導する。
この小胞体ストレス応答は人間社会の工場の品質管理と似ています。
工場の生産ラインでどんどん出来上がってくる製品の中に不良品が増えると(不良タンパク質の増加)、まず生産ラインを止めて、それ以上不良品が増えないようにします(タンパク質翻訳の停止)。次いで、直せるものは直して出荷しようとします(分子シャペロンによる折り畳みの修正)。それでも処理できないほど不良品が多ければ、それを廃棄処分にします(プロテアソームでの分解)。不良品ばかり作られる生産ラインであれは、工場を閉鎖します(アポトーシスによる自滅)。

小胞体ストレス応答は、タンパク質の産生量を低下させることで小胞体におけるタンパク質の折り畳みの負担を軽減したり、分子シャペロンの量を増やすことで折りたたみ機能を亢進させたり、変性タンパク質の除去(分解)効率をあげることで小胞体ストレスを軽減するよう働きます。
すなわち、翻訳開始因子の活性を阻害し、メッセンジャーRNAの分解を亢進して、タンパク質の合成を抑制します。
遺伝子発現に作用して、分子シャペロンのGRP78やGRP94の発現を亢進して正常な折り畳みを促進します。さらに、プロテアソームやオートファジーでの異常タンパク質の分解を促進して異常タンパク質の蓄積を抑制します。
このように、異常タンパク質の蓄積によって生じた小胞体ストレスが引き金になって、細胞内のシグナル伝達系が活性化されて引き起こされる細胞応答が、小胞体ストレス応答(unfolded protein response: UPR)です。
分子シャペロン (Molecular chaperone) とは、他のタンパク質分子が正しい折りたたみ(3次元構造)をして機能を獲得するのを助けるタンパク質の総称です。シャペロンとはフランス語で介添人のことで、社交界にデビューする若い婦人に付き添い、世話監督する人のことです。タンパク質が正常な3次構造と機能を獲得するのを助ける役割から、シャペロン(介添人)になぞらえた命名です。
分子シャペロンには多くの種類がありますが、小胞体ストレスが負荷されたときに特異的に発現が誘導される分子シャペロンの一つがGRP78です。GRP78とは78-kDa glucose-regulated proteinのことで、分子量が78000のグルコース制御性蛋白質という意味の蛋白質です。
GRP78は、「免疫グロブリン重鎖結合タンパク質 (immunoglobulin heavy chain-binding protein: BiP)」とも呼ばれます。GRP78(BiP)はHSP70 (Heat Shock Protein 70 : 熱ショックタンパク質70) ファミリーのメンバーで、すべての真核生物細胞の小胞体で恒常的に発現する小胞体タンパク質です。
その発現量は小胞体ストレス応答 (unfold protein response: UPR)の指標となります。
折り畳み不全の異常タンパク質は、疎水性アミノ酸クラスターが外部に露出すると、このような異常タンパク質は疎水性部分で相互に結合してタンパク質の凝集を作ります。分子シャペロンは疎水性アミノ酸クラスターにくっついてマスクして凝集を防ぎます。さらに、ATPのエネルギーを使って変性したタンパク質を元に戻して再生していきます。
固形がんは生体内において低酸素・低栄養という環境に適応するための様々なストレスに対する耐性を獲得しています。その中でも、小胞体内で分子シャペロンとして働くGRP78の発現亢進は、ストレス耐性において最も大きな役割を担っていることが明らかになっています。
すなわち、本来であれば、低酸素・低栄養の環境で、小胞体ストレスの増大によってがん細胞は死滅するのですが、がん細胞内ではGRP78の発現が亢進して小胞体ストレス応答が増強しているために死ななくなっていると考えられています。
つまり、GRP78はグルコース欠乏など細胞にストレスがかかった際に細胞死を避けるために誘導されるタンパク質と言えます。
したがって、GRP78の発現誘導などの小胞体ストレス応答を特異的に阻害する物質は、抗がん剤治療が困難な固形癌に対して抗がん作用を発揮することが期待されています。また、抗がん剤の効き目(感受性)を高めることも報告されています。
がん細胞に強い小胞体ストレスを与えることができれば、がん細胞は死滅できます。
【細胞が栄養飢餓になるとオートファジーが亢進する】
オートファジー (Autophagy) は、細胞内のタンパク質を分解するための仕組みの一つです。「auto-」はギリシャ語の「自分自身」を表す接頭語で「phagy」は「食べること」の意で、「自食(じしょく)」と日本語訳されています。「自分を食べる」という意味です。
オートファジーは細胞内タンパクや小器官を二重の脂質膜で包み込み,これをリソソームに輸送して分解する仕組みです。リソソーム(Lysosome)は酸性で働く種々の加水分解酵素を内包しており,細胞内外から取り込まれた生体分子を加水分解する細胞内小器官の一つです。
細胞は栄養飢餓に陥るとオートファジーにより細胞質や細胞内小器官の一部を分解および再利用し、細胞の生存に必要なエネルギーやアミノ酸を得ています。さらに、オートファジーを使い老廃物や損傷したミトコンドリア、病原体、異常タンパク質を除去しており、それにより神経変性疾患、がん、糖尿病、心不全、各種の炎症や感染症など、さまざまな疾患の発症を抑制していることが明らかになっています。
細胞が飢餓条件下におかれると、細胞質に隔離膜と呼ばれる扁平な小胞が現れます。その後、膜は細胞質内の異常タンパク質や細胞内小器官を取り込みながら伸長し、先端どうしが融合して、オートファゴソームが形成されます。オートファゴソームがリソソームと融合して内包物は分解されます。自己消化で得られたアミノ酸は栄養源として再利用されます。(図)
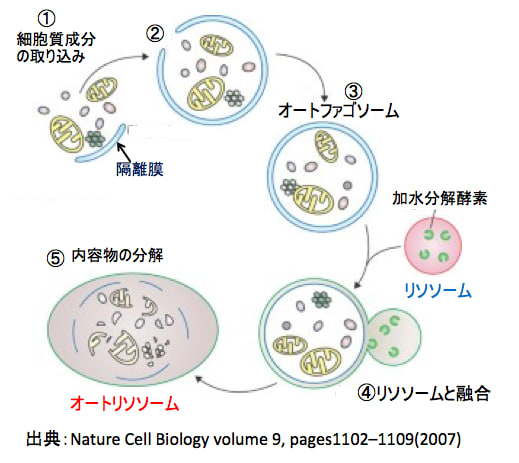
図:細胞質に隔離膜と呼ばれる扁平な小胞が現れ、異常なタンパク質や細胞内小器官を取り込む(①)。その後、膜は細胞質を取り込みながら伸長し(②)、先端どうしが融合して、オートファゴソームが形成される(③)。 オートファゴソーム内にはミトコンドリアなどの大きなオルガネラも含まれる。オートファゴソームがリソソームと融合すると(④)、内包物は分解される(⑤)。自己消化で得られたアミノ酸は栄養源として再利用される。
【オートファジーは抗がん剤や放射線によるダメージからがん細胞を保護する】
オートファジーは細胞内の異常タンパク質を分解してリサイクル(再利用)するシステムです。抗がん剤などでダメージを受けた細胞内小器官や異常タンパク質を分解して細胞のストレス負荷(小胞体ストレス)を軽減し、同時に栄養枯渇した状態において、細胞内のタンパク質やエネルギーを産生するための物質を得るために分解した栄養素をリサイクルすることによって生存を維持します。
オートファジーの細胞保護機能は栄養欠乏の条件下で細胞の生存に必要なエネルギーと代謝中間体を提供するものとして一般的に理解されています。抗がん剤治療に対する抵抗性のメカニズムの一つとしてオートファジーが注目されています。
抗がん剤治療で小胞体ストレスが亢進すると細胞に死滅しやすくなります。オートファジーは異常タンパク質を分解して小胞体ストレスを軽減すると同時に、タンパク質を分解してアミノ酸を再利用して増殖に使うことができます。
つまり、オートファジーはがん細胞を抗がん剤によるダメージから守る作用があります。
したがって、抗がん剤治療にオートファジー阻害剤を併用すると、小胞体ストレスの亢進と、栄養飢餓が亢進して細胞が死滅しやすくなって、抗がん剤の効き目を高めることができます。

図:リボソームで合成されたタンパク質は小胞体で折り畳みや翻訳語修飾を受けて正常な機能を持ったタンパク質になる(①)。抗がん剤治療は小胞体にダメージを与え(②)、小胞体ストレスを引き起こし(③)、小胞体内で折畳み不全の異常タンパク質が増える(④)。小胞体内に異常タンパク質が凝集して蓄積し(⑤)、細胞機能が阻害されて細胞死が誘導される(⑥)。異常タンパク質はオートファゴソームに取り込まれ(⑦)、リソソームと癒合してオートファジーのメカニズムで分解される(⑧)。オートファジーは小胞体ストレス負荷を軽減し、栄養素をリサイクルすることによって(⑨)、細胞死を阻止する(⑩)。
【ヒドロキシクロロキンはオートファジーを阻害する】
クロロキン(chloroquine)はマラリアの治療もしくは予防のために1940年代から用いられています。クロロキンの側鎖末端にヒドロキシル基(-OH)が付加したのがヒドロキシクロロキン(hydroxychloroquine)です。(下図)

図:クロロキンとヒドロキシクロロキンの構造
ヒドロキシクロロキンは日本では2015年に全身性エリテマトーデスの治療薬として承認されていますが、米国では1955年に承認され、現在では欧州諸国を含む70カ国以上で、全身性エリテマトーデスの標準的治療薬として広く使用されています。関節リュウマチや皮膚筋炎などの他の自己免疫疾患の治療にも使用されています。免疫調節作用によって自己免疫疾患に効果があるようです。
がん治療の領域でもヒドロキシクロロキンは注目されています。それはヒドロキシクロロキンにオートファジーを阻害する作用があるためです。
オートファジー阻害薬はがん治療薬として開発が行われていますが、ヒドロキシクロロキンは現時点でFDA(米国食品医薬品局)が承認している医薬品の中でオートファジ阻害作用が証明されている唯一の医薬品です。
様々ながん種で、クロロキンやヒドロキシクロロキンが抗がん剤の抗腫瘍効果を高めることが示されています。
たとえば、卵巣がんに対してシスプラチンを投与すると、卵巣がん細胞のおいて細胞保護的なオートファジーが誘導されて、シスプラチンの抗がん作用が弱くなります。そこで、クロロキンを併用すると、クロロキンはオートファジーを阻害することによって、シスプラチンの抗腫瘍効果を高めることが報告されています。(Low concentration of chloroquine enhanced efficacy of cisplatin in the treatment of human ovarian cancer dependent on autophagy.Am J Transl Res. 2017 Sep 15;9(9):4046-4058.)
がん治療におけるヒドロキシクロロキンの効果をメタ解析した報告があります。
The clinical value of using chloroquine or hydroxychloroquine as autophagy inhibitors in the treatment of cancers:A systematic review and meta-analysis(がんの治療におけるオートファジー阻害剤としてのクロロキンまたはヒドロキシクロロキンを使用することの臨床的価値:系統的レビューとメタ分析)Medicine (Baltimore). 2018 Nov; 97(46): e12912.
このメタ解析では7件の臨床試験が対象になりました(n = 293)。ヒドロキシクロロキン+ゲムシタビンの併用が2件、ヒドロキシクロロキン+ドキソルビシンの併用が1件、クロロキン+放射線の併用が1件、クロロキン+テモゾロミド+放射線の組み合わせが1件、およびヒドロキシクロロキンの単独療法が1件でした。
オートファジー阻害剤を併用しなかった場合に比べて、オートファジー阻害剤を併用したがん治療では、全奏功率(RR:1.33、95%信頼区間:0.95–1.86、P = .009)、6か月間の無増悪生存率(RR:1.72、95%信頼区間:1.05–2.82、P = .000 )、1年間の全生存率(RR:1.39、95%信頼区間:1.11–1.75、P = .000)はいずれも改善が認められました。
このメタ分析の結果は、化学療法や放射線療法においてオートファジー阻害剤の併用が治療効果を高めることを示しており、オートファジー阻害剤の併用はがん治療に新しい戦略を提供する可能性を示唆しています。
ヒドロキシクロロキンの薬物動態はクロロキンと同様ですが、消化管からの吸収がより速やかで腎臓からの排泄も速く、クロロキンより毒性が低いので、ヒドロキシクロロキンの方が主に使用されています。
経口投与で70%前後が消化管から吸収されます。
シトクロムP450酵素(CYP 2D6、2C8、3A4、3A5)で代謝されます。
WHO必須医薬品モデル・リストに収載されている薬です。
ヒドロキシクロロキン硫酸塩(Hydroxychloroquine sulfate)は、マラリア、皮膚エリテマトーデス、全身性エリテマトーデスなどの治療薬として世界中で広く使用されています。
現在ではクロロキンに耐性を持つマラリア原虫が出現しているため、マラリア治療にはクロロキンやヒドロキシクロロキを単独で用いることはあまりなく、他の薬剤と併用されています。
ヒドロキシクロロキンは米国で1955年に承認されて以降、70 カ国以上で承認されており、適正量かつ短期間の使用では重篤な副作用は少ないとされています。
全身性エリテマトーデスの治療に欠かせない薬とされており、日本でもヒドロキシクロロキンの全身性エリテマトーデスへの治験が 2012 年に始まり、2015 年に承認されました。
ヒドロキシクロロキン硫酸塩(商品名:プラケニル)は免疫調節薬に分類されており、免疫系を抑制することによって自己免疫疾患の活動性を抑制します。
全身性エリテマトーデスでステロイドと免疫抑制薬を使用している場合、ヒドロキシクロロキン硫酸塩(プラケニル)を加えることによってステロイドをより減量しやすくなります。
ただし、長期間服用すると網膜障害などの副作用もあるので、使用には注意が必要です。
【オートファジーを阻害するとアルテスネイトの抗腫瘍効果が増強する】
以下のような報告があります。オートファジーを阻害するヒドロキシクロロキンを併用するとアルテスネイトの抗腫瘍効果が増強するという報告です。
Artesunate induces apoptosis and autophagy in HCT116 colon cancer cells, and autophagy inhibition enhances the artesunate‑induced apoptosis(アルテスネートは HCT116 結腸がん細胞のアポトーシスとオートファジーを誘導し、オートファジー阻害はアルテスネート誘導性のアポトーシスを増強する)Int J Mol Med. 2018 Sep; 42(3): 1295-1304.
【要旨の抜粋】
本研究では、HCT116 結腸がん細胞に対するin vitroおよびin vivoでのアルテスネイトの抗腫瘍効果とその作用機序を検討した。アルテスネイトは、in vitroおよびin vivoの両方の実験系で HCT116 細胞のアポトーシスを誘導することにより増殖を阻害した。
フローサイトメトリー分析により、2μg/ml および 4μg/mlの濃度のアルテスネイトで 48時間処理すると、それぞれ 22.7% および 33.8% の細胞でアポトーシスが誘導された。BALB/c ヌードマウスの異種移植腫瘍では、対照群(生理食塩水群)と比較してアルテスネイト投与群でアポトーシス陽性細胞が増加した。
さらに、細胞および動物の両方に実験系で、アルテスネイトはミトコンドリア切断型カスパーゼ 3、ポリADPリボース・ポリメラーゼ (PARP)、カスパーゼ 9、および Bcl-2 関連 X(BAX)タンパク質のレベルを増加し、B 細胞リンパ腫-2 (Bcl-2) は減少した。
アルテスネイト処理細胞は、軽鎖 3 (LC3) およびベクリン 1 のタンパク質発現レベルの増加、およびオートファゴソームの存在によって証明されるように、オートファジーの誘導も認められた。
特に、ヒドロキシクロロキンを使用したオートファジー活性化の薬理学的阻害は、切断型カスパーゼ3およびPARPのタンパク質レベルを増加させてアルテスネイト誘導性アポトーシスを顕著に増強し、LC3およびベクリン-1のレベルを低下させた。
これらの発見は、アルテスネイト誘導性オートファジーがアポトーシスを抑制することによって細胞保護効果を有する可能性を示唆した。
結論として、アルテスネイトはヒト結腸ガンに対して臨床的に有用な抗がん剤となる可能性がある。
「ミトコンドリア切断型カスパーゼ 3、ポリADPリボース・ポリメラーゼ (PARP)、カスパーゼ 9、およびBcl-2 関連 X(BAX)タンパク質のレベルを増加」はアポトーシスの誘導を意味します。つまり、アルテスネイトは大腸がん細胞にアポトーシスを誘導します。
アルテスネイト投与は同時に、オートファジーも誘導しました。「軽鎖 3 (LC3) およびベクリン 1 のタンパク質発現レベルの増加、およびオートファゴソームの存在」はオートファジーの誘導を意味します。このオートファジーは細胞保護的オートファジーで、このオートファジー誘導はがん細胞の細胞死(アポトーシス)を阻止する作用があります。そこで、オートファジーを阻止するヒドロキシクロロキンを併用すると、アルテスネイト誘導性の細胞死(アポトーシスとフェロトーシス)を増強できるという話です。
アルテスネイトとヒドロキシクロロキンによる同時治療は、効果的な抗がん療法となる可能性があります。つまり、抗がん剤治療やアルテスネイト治療を行うとき、オートファジーを阻害するヒドロキシクロロキンの併用は抗がん作用を強化できます。(下図)

図:抗がん剤治療やアルテスネイト(①)はがん細胞にダメージを与えアポトーシスやフェロトーシスの機序でがん細胞を死滅する(②)。がん細胞はオートファジーのメカニズムを誘導し(③)、細胞死に抵抗する(④)。ヒドロキシクロロキンはオートファジーの過程を阻害する(⑤)。したがって、抗がん剤とアルテスネイトヒドロキシクロロキンを併用すると、抗腫瘍効果を増強できる。
【2-デオキシ-D-グルコースは酸化ストレスと小胞体ストレスを引き起こす】
ヒドロキシクロロキンは、通常の抗がん剤だけでなく、抗がん作用のある代替医療薬との併用でも、相乗効果が報告されています。たとえば、解糖系を阻害する2-デオキシ-D-グルコースと併用すると、それぞれを単独で使用した場合よりも、抗腫瘍効果が相乗的に増強することが報告されています。
以下のような報告があります。
The combination of hydroxychloroquine and 2-deoxyglucose enhances apoptosis in breast cancer cells by blocking protective autophagy and sustaining endoplasmic reticulum stress.(ヒドロキシクロロキンと 2-デオキシグルコースの組み合わせは、保護的オートファジーをブロックし、小胞体ストレスを維持することにより、乳がん細胞のアポトーシスを促進する)Cell Death Discov. 2022 Jun 11;8(1):286.
【要旨】
2-デオキシグルコース (2-DG) は解糖を阻害し、小胞体ストレスを亢進することで抗腫瘍作用を発揮するが、用量制限のある副作用と細胞保護的オートファジーの誘導によるがん細胞死の抑制により、臨床応用は制限されている。
FDA 承認のオートファジー阻害薬であるヒドロキシクロロキンと2-DG の組み合わせが有望な治療戦略であるかどうかを検討した。
今回我々は、ヒドロキシクロロキンと2-DG を組み合わせると、他の個々の薬剤と比較して、乳がん細胞の生存率と遊走を阻害し、アポトーシスを誘導できることを報告する。
2-DG とヒドロキシクロロキンの組み合わせは、in vivo で移植腫瘍サイズと肺および肝臓の腫瘍細胞転移を大幅に減少させた。
細胞レベルでは、ヒドロキシクロロキンはオートリソソーム形成を抑制し、2-DG 媒介性小胞体ストレスによって誘導されるオートファジープロセスを停止させ、その結果小胞体に折り畳み不全タンパク質が継続的に蓄積し、PERK-eIF2α-ATF-4- CHOP軸を介して持続的な小胞体ストレスを生成し、細胞死を誘導した。
私たちの研究は、トリプルネガティブ乳がんにおける代謝撹乱物質の研究への関心を強化し、抗がん治療としての 2-DG とヒドロキシクロロキンの組み合わせの可能性を明らかにした。
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系とペントース・リン酸経路(Pentose Phosphate Pathway: PPP)を阻害し、がん細胞の酸化ストレスを高めます。
2-DGは小胞体ストレスを高めてがん細胞を死滅させる作用も報告されています。
小胞体(Endoplasmic reticulum)は、細胞内における分泌・膜タンパク質の品質管理において大切な小器官です。
2-DGは解糖系を阻害する以外に、タンパク質に糖鎖が着くN-グリコシル化の過程を阻害するので、糖タンパク質の生成を阻害します。
グリコシル化というのはタンパク質に糖類が付加する反応で、小胞体で行われて、正常に糖が付加したタンパク質はゴルジ体に運ばれます。
糖鎖異常の糖タンパク質は、折り畳みが不完全な異常タンパク質になり、小胞体に蓄積して小胞体ストレスを引き起こし、細胞死の原因にもなります。
しかし、2-デオキシ-D-グルコース投与による小胞体ストレスに対して、がん細胞は細胞保護的オートファジーを誘導して、小胞体ストレスを軽減して、細胞死を免れようとします。そこで、オートファジーを阻害するヒドロキシクロロキンを併用すると2-デオキシ-D-グルコースによる抗腫瘍効果を増強できるというメカニズムです。
【ジスルフィラムがプロテアソームを阻害する】
ジスルフィラムがプロテアソームを阻害することは10年くらい前から注目されています。以下の報告は2011年の論文です。
Disulfiram, and disulfiram derivatives as novel potential anticancer drugs targeting the ubiquitin-proteasome system in both preclinical and clinical studies.(前臨床試験および臨床試験の両方でユビキチン・プロテアソーム系をターゲットにする新規の抗がん剤としての可能性を持つジスルフィラムとジスルフィラム誘導体)Curr Cancer Drug Targets. 2011 Mar;11(3):338-46.
【要旨】
ジスルフィラムは、アルコール依存症の治療のためのFDA(米国食品医薬品局)認可の薬物であり、50年以上にわたり臨床で使用されてきた。 ジスルフィラムとその類似体は、抗がん剤の抗腫瘍効果を高める効果や化学予防剤としての有効性を示す研究結果が1970年代から80年代にかけて報告されたが、根底にある分子メカニズムは最近まで不明のままであった。
プロテアソームを阻害し、新規な抗がん剤として使用できる薬剤の大規模スクリーニングの結果、ジスルフィラムがプロテアソーム阻害活性を有することが明らかになった。
さらに、ジスルフィラムは発がんに重要な役割を果たすジンク・フィンガーおよびRINGフィンガー・ユビキチンE3リガーゼに対して特異的活性を有することも見出された。 ここでは、抗がん剤としてジスルフィラムを探索する前臨床および臨床研究、ならびにユビキチン - プロテアソーム系の阻害剤としてのジスルフィラム誘導体の開発に焦点を当てた研究プログラムを検討する。
以下の様な報告もあります。2012年の論文です。
High-throughput chemical screens identify disulfiram as an inhibitor of human glioblastoma stem cells.(ハイスループット化学スクリーニングは、ジスルフィラムをヒト膠芽腫幹細胞の阻害剤として特定する)Oncotarget. 2012 Oct;3(10):1124-36.
【要旨】
多形性膠芽腫は、最適な標準治療を行っても、患者の予後が不良であり続けている。膠芽腫幹細胞は、腫瘍の再発と治療への抵抗性の原因となっている。これを念頭に置いて、2,000の化合物の多様な化学ライブラリーをスクリーニングし、膠芽腫幹細胞の増殖を阻害し、患者の生存を延長する可能性のある治療薬を特定した。
ハイスループットスクリーニング(High-throughput screens)により、細胞増殖を繰り返し阻害する78の化合物が特定され、そのうち47は他の適応症で臨床的に承認されており、31は実験に使用される薬であった。
いくつかの化合物(ジギトキシン、デグエリン、パツリン、カフェイン酸フェネチルなど)は高い細胞毒性を示し、50%最大阻害濃度(IC50)が低ナノモル範囲であった。
特に、アルコール依存症の治療のためのFDA承認薬であるジスルフィラムは、複数の患者サンプルにおいて有意に強力であった(IC50は31.1nM)。
ジスルフィラムの抗腫瘍活性は、銅の併用によって強化され、細胞死を顕著に増加した。ジスルフィラム-銅は、培養膠芽腫幹細胞のキモトリプシン様プロテアソーム活性を阻害した。これは、ユビキチン-プロテアソーム経路の不活性化とそれに続く腫瘍細胞死の誘導と一致している。
ジスルフィラムは血液脳関門を通過できる比較的毒性のない薬剤であるため、ジスルフィラムをヒト膠芽腫幹細胞の前臨床モデルで(単剤療法または補助療法として)検討する必要がある。実験結果はまた、膠芽腫の治療においてユビキチン-プロテアソーム経路の阻害の可能性を支持している。
High-Throughput Screening(高速大量スクリーニング)というのは、「高度にシステム化した方法で短期間に多数の化合物を生化学的に評価して、薬効物質を見つける探索法(スクリーニング法)」です。
この論文では、2000種類の化合物をスクリーニングして、膠芽腫幹細胞の増殖を阻害し死滅させる効果が高い化合物としてジスルフィラムが同定されたという報告です。そのメカニズムとしてユビキチン-プロテアソーム経路の阻害の可能性を指摘しています。
ユビキチン・プロテアソーム系はタンパク質に付加されたユビキチン鎖をプロテアソームが認識し,ATP依存的で迅速かつ不可逆に標的タンパク質を分解するシステムです。
ユビキチン(Ubiquitin)は,アミノ酸76残基からなり,酵母からヒトまであらゆる真核細胞に存在する進化的に保存されたタンパク質です。名前の由来は、ラテン語の“ubique=あらゆるところで”という形容詞を基にした英語 「ユビキタス(ubiquitous)」からきています。「至る所に存在する」という意味があります。
ユビキチンは不要なタンパク質、たとえば出来損なったタンパク質や古くなったタンパク質に複数個付加(ポリユビキチン化)されることで、「このタンパク質を壊してくれ」という分解シグナルとして働きます。
ユビキチン自体はあくまで目印なので、分解を行うのは他の物質です。ユビキチンが結合した不要たんぱく質をシュレッダーのように分解する酵素をプロテアソームといいます。
標的タンパク質へのユビキチン付加反応はユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチンリガーゼ(E3)によって行われます。
プロテアソームは真核生物のATP依存性プロテアーゼ複合体で、分解目印として働くユビキチンが結合したたんぱく質を選択的に壊す複雑な細胞内装置です。
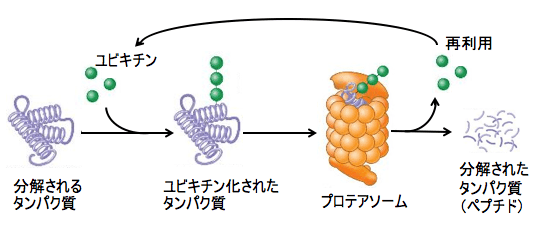
図:分解されるタンパク質はユビキチンが複数個結合し、ユビキチンが結合したタンパク質をプロテアソームが認識して、タンパク質を分解する。
ユビキチン-プロテアソーム・システムは細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。プロテアソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
すでに、プロテアソーム阻害剤は抗がん剤としても使用されています(ボルテゾミブなど)。
ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸(diethyldithiocarbamate)に速やかに変換されます。
ジエチルジチオカルバミン酸は銅イオンや亜鉛イオンと複合体を形成し、この金属複合体がプロテアソームを阻害する事が報告されています。

図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する。ジエチルジチオカルバミン酸と銅の複合体はプロテアソームにおけるタンパク質の分解機能を強力に阻害する。プロテオソームの働きが阻害されるとユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によって致死的に作用する。
ユビキチン・プロテアソーム系を阻害するジスルフィラムに、オートファジーを阻害するヒドロキシクロロキン、小胞体ストレスと酸化ストレスを高める2-デオキシグルコース、メトホルミンを併用する治療法は試してみる価値はあります。副作用はほとんどなく、がん細胞を比較的選択的に攻撃します。

図: 2-デオキシグルコースは糖鎖異常の糖タンパク質を増やして小胞体ストレスを誘導する(①)。これに対して、細胞は小胞体ストレス応答(②)で対抗し、さらにユビジチン・プロテアソーム系(③)とオートファジー・リソソーム系(④)で異常タンパク質を分解することによって小胞体ストレスを軽減する。メトホルミンは小胞体ストレス応答を阻害する(⑤)。ジスルフィラムとオーラノフィンはユビキチン・プロテアソオーム系を阻害し(⑥)、ヒドロキシクロロキンはオートファジー・リソソーム系を阻害する(⑦)。これらを組み合わせると、がん細胞の小胞体ストレスが亢進して細胞死(アポトーシス)を誘導できる(⑧)。
| « 876)オピオイ... | 878)カンナビ... » |



