がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
584)がん細胞の抗がん剤感受性を高める方法(その2):Nrf2を阻害するメトホルミンと漢方薬

図:放射線や抗がん剤は、活性酸素の産生を高めて酸化ストレスを亢進し、細胞の酸化傷害を引き起こして細胞死を誘導する(①)。酸化ストレスを軽減するために転写因子のNrf2の活性を亢進し、グルタチオンやチオレドキシン・システムを亢進して活性酸素による酸化傷害に抵抗する(②)。アルテスネイト、半枝蓮(はんしれん)、高濃度ビタミンC点滴は細胞内の活性酸素の産生を高める(③)。ジクロロ酢酸ナトリウムはミトコンドリアの酸素呼吸を亢進して活性酸素の産生を高める(④)。メトホルミンや2-デオキシ-D-グルコースや黄芩(おうごん)や半枝蓮はNrf2の活性化を阻害する(⑤)。ジスルフィラムやオーラノフィンはグルタチオンやチオレドキシンによる抗酸化システムを阻害することによって酸化ストレスを高める(⑥)。これらを組み合せると、がん細胞に効率的に酸化ストレスを増強して、がん細胞の増殖を抑制でき、抗がん剤や放射線治療の抗腫瘍効果を増強できる。
584)がん細胞の抗がん剤感受性を高める方法(その2):Nrf2を阻害するメトホルミンと漢方薬
【細胞内の抗酸化システムを利用してがん細胞は抗がん剤抵抗性になる】
細胞には、活性酸素や有毒物質による害から細胞自身を守る手段や仕組みが備わっています。
例えば、細胞内で活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンなどの抗酸化物質の合成を高めたりして、活性酸素の害(酸化ストレス)を軽減しようとします。
また、グルタチオンSトランスフェラーゼ(GST)などのフェースII(第2相) 解毒酵素と言われる代謝酵素は、様々な発がん物質や有害物質を無毒化する作用があります。
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、これらの活性酸素消去酵素や抗酸化物質(グルタチオンやチオレドキシン)やフェースII解毒酵素が細胞内に誘導され(遺伝子発現が増えたり産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2(Nuclear factor erythroid 2-related factor 2)という転写因子です。

図:放射線や抗がん剤は、活性酸素の産生を高め(①)、細胞の酸化傷害を引き起こして、細胞増殖を抑制し、細胞死を誘導する(②)。酸化ストレスを軽減するために転写因子のNrf2の活性を亢進し(②)、スーパーオキシド・ディスムターゼ(SOD)やカタラーゼやグルタチオン・ペルオキシダーゼなどの活性酸素消去酵素やグルタチオンやチオレドキシンなどの抗酸化物質の産生を高めて、活性酸素による害(酸化ストレス)を軽減している。この抗酸化システムの亢進によって、がん細胞は放射線や抗がん剤に抵抗性になる。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質です。
抗酸化酵素やグルタチオンの産生に関する酵素やフェース2解毒酵素の遺伝子の発現調節領域には、抗酸化反応エレメント(antioxidant response element:ARE)という領域があって、この部分にNrf2が結合するとこれらの遺伝子の転写が促進されるのです。
ホルミシス(hormisis)効果というものがあります。体に有害と思われている放射線や活性酸素やある種の発がん物質も、微量であれば体を刺激する方向で働いて、これらの害に対する抵抗力が高まるという効果です。
刺激やストレスがくり返されると、生体はそれらに対して適応するように体が反応するため、その刺激やストレスに対して抵抗性になると考えられるのですが、抗酸化力や解毒力の増強のメカニズムに関しては転写因子のNrf2の活性化が関与しています。
除草剤(農薬)のパラコートは活性酸素を発生させます。線虫を様々な濃度のパラコートの入った培地で育てて、その寿命を検討した実験があります。
パラコートの濃度が極めて低い(0.005mM以下)と寿命に影響は及ぼしませんが、濃度が0.01mMから0.5mMの場合は、寿命が最大で60%くらい延長します。1mM以上だと逆に寿命は短縮します。
軽度の酸化ストレスは寿命を延ばし、高度の酸化ストレスはダメージを与えるので寿命は短縮するという結果です。
化学発がん物質の研究でもホルミシス効果が認められています。体内で活性酸素を発生させて発がん作用を示すような物質を少量だけ投与すると、かえって発がんが抑えられることがあります。これは、軽度の酸化ストレスに対して、適応反応として体の中の抗酸化酵素が増加するためであると考えられています。この場合も、Nrf2の活性化が重要な役割を担っています.
このNrf2は様々なストレスや有害物質から細胞を守っているので、細胞にとっては重要な防御システムです。

図:生物に対して通常有害な作用を示す刺激が、微量であれば逆に有益な作用(ストレス抵抗性の亢進)になるという現象を「ホルミシス(Hormesis)」と言う(①)。活性酸素は大量に発生すると細胞膜やDNAの酸化傷害から増殖抑制や細胞死誘導などの細胞傷害作用を示す(②)。しかし、適度な活性酸素の産生は、転写因子のNrf2の活性化を介するホルミシス効果によって、抗酸化システムの亢進やストレス抵抗性の亢進を誘導する(③)。
最近の研究によると、がん細胞ではNrf2の活性が非常に高くなっており、しかもNrf2の活性が高いがん細胞ほど治療に抵抗性で予後が悪いという結果が得られています。
つまり、がん細胞は、抗がん剤や放射線治療から自分を守るためにNrf2を利用しているということです。
がん細胞におけるNrf2の働きを阻害することができれば、抗がん剤や放射線治療の効き目を高めることができます。培養細胞や動物実験の段階ですが、抗がん剤治療や放射線治療にNrf2阻害剤を併用すると抗腫瘍効果が高まることが報告されています。
【Nrf2は細胞の抗酸化力を高める】
転写因子のNrf2は、抗酸化機能や解毒機能を持つ様々な遺伝子の転写を誘導します。
活性酸素種や食物に含まれる親電子性物質によりもたらされる酸化ストレスは,DNAやタンパク質や脂質などの生体高分子を酸化することで傷害を与え、がんや糖尿病や腎臓疾患や神経変性疾患など様々な疾患を引き起こす原因になります。
このような酸化ストレスに対する防御機構において重要な機能を担っているのが、Keap1-Nrf2システムです.
正常細胞において酸化ストレスの無い状況では、Nrf2はKeap1(Kelch-like ECH-associated protein 1)というタンパク質に結合することによりユビキチン化を受け、分解しています。
しかし、酸化ストレスにさらされるとKeap1のシステイン残基が修飾を受けて構造が変化し、Keap1からNrf2が離れて核へ移行し、遺伝子上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合することによって、このARE配列をもつ様々な遺伝子(抗酸化酵素やグルタチオンの合成に関与する酵素やフェースII解毒酵素など)の発現を誘導し、抗酸化や解毒に関するタンパク質や因子の合成を高めます。
このような作用によって、正常細胞や前がん細胞においては、Nrf2の活性を亢進するNrf2活性剤は発がん過程を抑制するので、がん予防物質として認識されています。このようなNrf2の活性化を介したがん予防物質としてスルフォラファンやクルクミンやレスベラトロールなどが報告されています。
一方、がん細胞においてはNrf2が恒常的に活性化しており、Nrf2活性を阻害するとがん細胞は死にやすくなることが報告されています。
ヒトの肺がんなど多くの固形腫瘍でNrf2機能の異常亢進が見つかっています。そして、Nrf2の活性が高いと治療に抵抗性で予後が不良であることが報告されています。
Nrf2は解毒酵素、抗酸化タンパク質、薬剤排出トランスポーターなどの遺伝子を統括的に活性化することにより、がん細胞の抗がん剤耐性と放射線耐性をもたらします。
さらに、Nfr2はグルコースやグルタミンの代謝を変化させて細胞増殖に有利な同化反応を促進します。
Nrf2はがん細胞のペントースリン酸経路を活性化して、核酸とNADPHの産生を増やすことで細胞増殖を亢進します。NADPHはグルタチオンの合成にも必要です。
多くのがん細胞では、酸化ストレスの有無とは関係なくNrf2の発現量と活性が亢進しています。その理由は、RASやMYCなどのがん遺伝子がNrf2を活性化しているからです。
Nrf2の活性を抑制するKeap1の遺伝子変異によってNrf2が活性化する場合も見つかっています。
恒常的に安定化したNrf2は酸化ストレスや抗がん剤/放射線治療に対する抵抗性を増強し、さらに積極的に細胞増殖を促進することになります。
抗がん剤治療や放射線治療によって活性酸素が増えると、がん細胞はさらにNrf2の量を増やして抵抗性を獲得してきます。
このようにNrf2の活性化はがん細胞が治療に対する抵抗性を獲得するメカニズムとして重要です。したがって、がん細胞のおけるNrf2の機能阻害は、抗がん剤治療の有効な戦略となります。

図:Keap1-Nrf2システムは酸化ストレスや有害物質に対する防御機構において重要な役割を担っている。転写因子のNrf2は細胞質でKeap1によって分解が促進されることによって活性が抑制されている。正常細胞では酸化ストレスが加わると、Keap1の構造が変化してNrf2から離れ、フリーになったNrf2が核内に移行して(①)、抗酸化酵素や解毒酵素の遺伝子の上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合して、これらの遺伝子の発現を亢進する(②)。その結果、正常細胞では活性酸素や発がん物質を解毒することになるので、Nrf2の活性を促進するもの(=Nrf2活性剤)はがん予防効果がある(③)。一方、がん細胞においては、KRasやcMycなどのがん遺伝子の活性化やKeap1の遺伝子変異などによってNrf2は恒常的に活性化しており(④)、抗酸化酵素や解毒酵素の産生や活性が亢進している。そのため、がん細胞は酸化ストレスや細胞傷害性物質に対する抵抗性が亢進しており(⑤)、これが抗がん剤や放散線治療に対する抵抗性の原因になっている(⑥)。したがって、がん細胞においては、Nrf2の活性を阻害するもの(=Nrf2阻害剤)ががん治療に役立つ。このように、正常細胞(前がん細胞も含む)とがん細胞とではNrf2に対する対応は全く異なる。
糖尿病性腎症や慢性閉塞性肺疾患など多くの酸化ストレスと関連する疾患の予防や治療のためにNrf2の活性化剤が臨床応用に向けて開発されています。
一方、がんの治療になるとNrf2の阻害剤が有益になる可能性が高いと考えられています。
がん細胞のNrf2を阻害すると、
①がん細胞内での活性酸素種の蓄積によってアポトーシス(細胞死)が誘導できる。
②抗がん剤治療や放射線治療の効き目を高めることができる。
③がん細胞での物質合成(同化反応)を阻害することによって増殖を阻害できる。
などの効果が期待できます。
ただし、全身投与の場合は、がん組織以外の正常組織での酸化ストレス応答を減弱させる欠点もあります。つまり、がん細胞特異的にNrf2を阻害できる方法があれば、がん治療に役立ちます。
【2-デオキシ-D-グルコースとメトホルミンはがん細胞特異的にNrf2活性を阻害する】
前回(583話)、2-デオキシ-D-グルコース(2-DG)は解糖系を阻害してATP産生と物質合成を阻害する作用によってがん細胞の抗がん剤感受性を高め、メトホルミンは呼吸酵素複合体Iを阻害してミトコンドリアでのATP産生を減らし、同時に活性酸素の産生量を増やす作用によってがん細胞の抗がん剤感受性を高めることを説明しました。
さらに、この2つの薬は、がん細胞に特異的にNrf2活性を阻害する可能性が報告されています。
Nrf2の転写活性を介した抗酸化酵素や解毒酵素の発現にはグルコースの供給が必要であるという報告があります。
Glucose availability is a decisive factor for Nrf2-mediated gene expression.(グルコースの供給がNrf2を介した遺伝子発現のための決定的な要因である)Redox Biol. 2013 Jun 21;1(1):359-65.
この論文では、スルフォラファンでNrf2を活性化する方法や、Nrf2を阻害するKeap1遺伝子を機能欠損させる方法(遺伝子ノックアウト)でNrf2の活性を亢進する方法で実験しています。
Nrf2を活性化するとグルコースの取込みが増え、ペントースリン酸経路でのNADPHの産生が増えることが示されています。
そして、グルコースの供給や取込みを阻害するか、あるいはペントースリン酸経路を阻害してNADPHの産生を阻害すると、Nrf2を介した遺伝子発現が抑制され、抗酸化酵素や解毒酵素の発現が抑制されることが示されています。
つまり、糖質制限やケトン食や2−デオキシグルコースなどで、がん細胞におけるグルコースの取込みやペントースリン酸経路を抑制する方法は、グルコースの取込みが亢進しているがん細胞に選択的にNrf2の活性を阻害できる可能性があります。
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
前述のように、メトホルミンはミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体Iを阻害することが明らかになっています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。
さらに、AMPKの活性化は細胞増殖を促進するmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を抑制します。(下図参照)
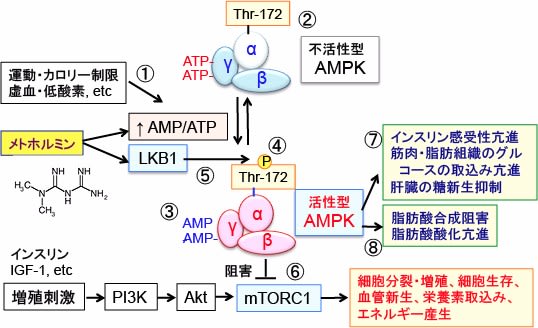
図:AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っている。AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化される(①)。AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する(②)。γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる(③)。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される(④)。 LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化する(⑤)。リン酸化されたAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制する(⑥)。活性化AMPKはインスリン感受性亢進、筋肉・脂肪組織のグルコースの取込み亢進、肝臓の糖新生抑制によって血糖を低下させる(⑦)。さらに、脂肪酸合成を阻害し、脂肪酸の酸化を亢進する(⑧)。
メトホルミンががん細胞のNrf2活性を抑制して抗腫瘍作用を示すことが報告されています。
以下のような報告があります。
Metformin inhibits heme oxygenase-1 expression in cancer cells through inactivation of Raf-ERK-Nrf2 signaling and AMPK-independent pathways.(メトホルミンはRaf-ERK-Nrf2 シグナル伝達系とAMPK非依存的経路の阻害によってがん細胞のヘムオキシゲナーゼ-1を阻害する)Toxicol Appl Pharmacol. 2013 Sep 1;271(2):229-38.
ヘムオキシゲナーゼ-1は、ヘム(heme)をビリベルジン(biriverdin)と一酸化炭素(CO)と遊離鉄(Fe)に分解する酵素です。ビリベルジン(緑色の色素)は、ビリベルジン・リダクターゼ(biriverdin reductase)により、ビリルビン(bilirubin:黄疸の時の黄色の色素)に分解されます。このヘム分解により産生れるビリベルジンとビリルビンには強力な抗酸化作用があり、酸化ストレスによる細胞傷害を抑制します。 この論文では、メトホルミンはRaf-ERKシグナル伝達系を抑制しNrf2の発現量を減らす効果があることを報告しています。
Metformin Sensitizes Non-small Cell Lung Cancer Cells to an Epigallocatechin-3-Gallate (EGCG) Treatment by Suppressing the Nrf2/HO-1 Signaling Pathway.(メトホルミンは、Nrf2 / HO-1シグナル伝達経路を抑制することにより、非小細胞肺がん細胞をエピガロカテキン-3-ガレート治療に感受性にする。)Int J Biol Sci. 2017 Nov 27;13(12):1560-1569.
【要旨の抜粋】
緑茶中の主要ポリフェノールであるエピガロカテキン-3-ガレート(EGCG)は、潜在的な抗がん作用を有するがん化学予防剤として広く研究されている。
NF-E2関連因子2(Nrf2)/ヘムオキシゲナーゼ-1(HO-1)シグナル伝達経路の活性化は、EGCGに対する細胞抵抗性を引き起こす。古典的抗糖尿病薬であるメトホルミンは、がんの進行を抑制することが示されている。メトホルミンがEGCGの抗がん効果を増強するかどうかは報告がない。
この研究では、メトホルミンはHO-1発現を阻害し、EGCGの抗腫瘍効果を増強することを明らかにした。メトホルミンはまた、EGCG(100μM)によって誘導される活性酸素種の産生を増やし、アポトーシスを誘導した。
さらに移植腫瘍を用いた動物実験で、メトホルミンとEGCGの併用投与は腫瘍の縮小効果を相乗的に増強した。
メカニズム的には、EGCGで活性化されたNrf2 / HO-1経路を、メトホルミンはNrf2のSIRT1依存性脱アセチル化によって阻害した。さらに、メトホルミンは、部分的にNF-kB経路を介してSIRT1発現を亢進した。
これと比較して、EGCGとメトホルミンとの組み合わせは正常な肺上皮細胞BEAS-2Bに対してほとんど影響を与えなかった。
以上の結果から、メトホルミンは、Nrf2 / HO-1シグナル伝達経路を抑制することにより、非小細胞性肺がん細胞のEGCGの抗がん作用に対する感受性を高める。
エピガロカテキン-3-ガレート(EGCG)は緑茶中の主要なポリフェノールです。EGCGはがん細胞に作用して酸化ストレスを引き起こして、抗がん作用を発揮します。
ポリフェノールはがん細胞に対して酸化剤として作用して増殖抑制や細胞死誘導の作用を発揮するという考えが最近は主流になりつつあり、これに関しては512話で解説しています。
EGCGの抗腫瘍作用に対して、がん細胞はNrf2/ヘムオキシゲナーゼ-1(HO-1)シグナル伝達経路の亢進によって抵抗しようとします。
それに対抗して、メトホルミンはNrf2/HO-1シグナル伝達経路を抑制してHO-1発現を阻害し、EGCGの抗腫瘍効果を増強することを示しています。
以下のような論文もあります。
Metformin induces microRNA-34a to downregulate the Sirt1/Pgc-1α/Nrf2 pathway, leading to increased susceptibility of wild-type p53 cancer cells to oxidative stress and therapeutic agents.(メトホルミンは、マイクロRNA-34aを誘導してSirt1 / Pgc-1α/ Nrf2経路を抑制し、野生型p53がん細胞の酸化ストレスおよび抗がん剤に対する感受性を亢進する)Free Radic Biol Med. 2014 Sep;74:21-34.
【要旨】
サーチュイン1は、細胞の酸化還元バランスと酸化ストレスに対する抵抗性に重要な役割を果たす。サーチュイン1は野生型p53がん細胞において発がん促進因子として作用するが、p53変異型がん細胞では腫瘍抑制因子として作用する。ここでは、いくつかのがん細胞株におけるサーチュイン1発現に対するメトホルミンの効果を調べた。
p53の発現に違いを示すヒトがん細胞株を用いた検討において、野生型p53を有するがん細胞ではメトホルミンがサーチュイン1タンパク質レベルを低下させたが、変異型p53を有するがん細胞株ではサーチュイン1タンパク質レベルに影響しなかった。
野生型p53がん細胞におけるメトホルミンにより誘導されるp53タンパク質レベルは、マイクロRNA-34aの発現亢進をもたらした。
miR-34a阻害剤を使用することによって、メトホルミン誘導性のmiR-34aの発現亢進がサーチュイン1の発現抑制に必要であることを確認した。
メトホルミンは、MCF-7細胞におけるペルオキシソーム増殖因子活性化受容体γ(PPARγ)共活性化因子-1α(Pgc-1α)発現およびその下流標的のNrf2を抑制した。
メトホルミンによるSirt1およびPgc-1αの発現抑制は、PPARγ転写活性の抑制を介して、Nrf2の発現抑制を引き起こすことを証明した。
メトホルミンはMCF-7細胞において、ヘムオキシゲナーゼ-1およびスーパーオキシドジスムターゼ2を減少させたが、カタラーゼの発現を亢進した。
メトホルミンを投与したMCF-7細胞は、活性酸素種の産生量の増加を示さなかったが、酸化ストレスに対して感受性を亢進した。
さらに、メトホルミンにより誘導されるサーチュイン1の発現抑制によるデスレセプター5(death receptor 5)の発現亢進は、野生型p53がん細胞のTRAIL誘発アポトーシスに対する感受性を増強した。
以上の結果は、メトホルミンがmiR-34aを誘導してサーチュイン1 / Pgc-1α/ Nrf2経路を抑制し、野生型p53がん細胞において酸化ストレスおよびTRAIL誘発アポトーシスに対する感受性を増加させることを示した。
メトホルミンの作用は正常細胞とがん細胞で異なるという点が重要です。
一般的に、メトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害してATPの産生を減らし、AMPKを活性し、サーチュイン1も活性化します。その結果、サーチュイン1 / Pgc-1α/ Nrf2経路を活性化して老化や発がんを抑制し、寿命を延ばす効果を発揮します。
一方、正常なp53を持つがん細胞では、メトホルミンはmiR-34aを誘導してサーチュイン1 / Pgc-1α/ Nrf2経路を抑制し、酸化ストレスおよびTRAIL誘発アポトーシスに対する感受性を増加させるという結果を報告しています。ただ、この作用は変異型のp53を持つがん細胞では働かないという結果です。
この論文の内容は、前述の「メトホルミンは非小細胞肺がん細胞をエピガロカテキン-3-ガレート治療に感受性にする」という論文の作用機序の考察とは矛盾します。がん細胞の種類など条件によってメトホルミンの作用機序は異なる可能性があります。
しかし、メトホルミンはがん細胞に対してNrf2/HO-1経路を抑制することによって、抗酸化システムを弱体化する作用が期待できるようです。
正常細胞とがん細胞のメトホルミンの作用の違いは、ミトコンドリアにおける活性酸素の量による可能性もあります。がん細胞は細胞に比べて活性酸素が発生しやすい状況にあり、活性酸素の適度な発生はホルミシス効果によって有益な作用を示し、がん細胞では大量の活性酸素が出やすいので、細胞傷害が優位になる可能性があります。

図:メトホルミンはミトコンドリアの呼吸鎖を阻害して活性酸素の産生を高め、ATP産生を低下させる(①)。この作用は正常細胞に対しては、適度な活性酸素の産生がミトホルミシスの作用によってストレス抵抗性を高め(②)、AMP/ATP比の上昇はAMPK(AMP活性化プロテインキナーゼ)やサーチュインを活性化して、抗加齢(加齢関連疾患の抑制)や寿命延長効果を発揮する(③)。一方、がん細胞においてはミトコンドリアで活性酸素が産生されやすい状況にある。その結果、呼吸鎖の阻害は活性酸素の産生が過剰になって酸化傷害を引き起こし(④)、エネルギー低下によって増殖を抑制する(⑤)。酸化ストレスの亢進に対してがん細胞はNrf2/HO-1系を活性化して酸化傷害を軽減しようと抵抗する(⑥)。メトホルミンはNrf2/HO-1系を阻害することによってがん細胞の抗酸化システムを弱体化する(⑦)。酸化傷害によって効果を発揮する抗がん剤や放射線治療に対して、メトホルミンはがん細胞に対しては抗腫瘍効果を高め(⑧)、正常細胞に対しては保護的に作用して副作用を軽減する(⑨)。
メトホルミンが抗がん剤や放射線治療の抗腫瘍効果を高めことは、最近では常識になりつつあるくらいに多数の報告があります。さらに、様々なメカニズムで抗がん剤や放射線治療の副作用の軽減にも有効であることが報告されています。
さらに、2-デオシキ-D-グルコースやジクロロ酢酸と併用すると、抗腫瘍効果が高まることを示す報告が増えています。
がんの標準治療の効き目を高める目的でメトホルミン+2−デオキシ-D-グルコース+ジクロロ酢酸ナトリウム(+ビタミンB1、R体αリポ酸)の組合せは、もっと利用されても良いと思います。(583話参照)
【漢方薬はNrf2阻害薬の宝庫】
黄芩(おうごん)という生薬に含まれるクリシン(chrysin)というフラボノイドがNrf2活性を抑制するという報告があります。
Chrysin enhances sensitivity of BEL-7402/ADM cells to doxorubicin by suppressing PI3K/Akt/Nrf2 and ERK/Nrf2 pathway.(クリシンはPI3K/Akt/Nrf2 と ERK/Nrf2 経路を抑制することによってBEL-7402/ADM細胞のドキソルビシンに対する感受性を高める)Chem Biol Interact. 2013 Oct 25;206(1):100-8
この論文では、クリシンが増殖シグナル伝達系のPI3K-Aktと ERK経路を抑制することによってNrf2のmRNAとタンパク質の発現量を顕著に減少させ、抗がん剤に対する感受性(効き目)を高めることが報告されています。クリシンにはグルタチオン濃度を低下させて抗がん剤の効き目を高める効果も報告されています。
Chrysin enhances doxorubicin-induced cytotoxicity in human lung epithelial cancer cell lines: the role of glutathione.(Chrysinはヒト肺がん細胞株におけるドキソルビシンによる細胞毒性を増強する:グルタチオンの役割)Toxicol Appl Pharmacol. 258(1):1-9.2012年
Chrysinがグルタチオンの細胞内からの排出を誘導してグルタチオン濃度を低下させて抗がん剤感受性を高める機序が報告されています。この論文では、4種類のヒト肺がん細胞株を用いた実験で、chrysinがドキソルビシンの殺細胞効果を増強することが報告されています。
黄芩(おうごん)は抗炎症作用や様々な抗がん作用が報告され、がんの漢方治療においても使用頻度が高く、その抗腫瘍作用は経験的に知られています。その抗がん成分としてバイカリン、バイカレイン、オーゴニンなどが知られていますが、クリシンの効果もあるのかもしれません。
(クリシンは米国などではサプリメントとしても販売されていますが、ヒトに対する効果に関しては証明されているわけではありません)
ルテオリンは、フラボノイドの一種で、野菜やハーブや生薬に多く含まれています。
食品としては、シュンギク、ピーマン、セロリ,パセリ、ブロッコリー、ニンジン、キャベツなどに多く含まれます。オリーブオイルにも含まれています。
ハーブや生薬としてはシソ科のペパーミント(peppermint)、タイム(thyme)、ローズマリー(rosemary)、オレガノ(oregano)に多く含まれています。キク科のタンポポ(蒲公英)の葉にも含まれています。
漢方薬でも、シソ科の生薬(蘇葉、黄芩、半枝蓮など)は抗がん作用が知られており、多くの抗がん成分が含まれていますが、ルテオリンも重要な薬効成分と言えます。
抗がん生薬として有名な半枝蓮(はんしれん)の活性成分としてscutellarein, scutellarin, carthamidin, isocarthamidin, wogoninが報告されています(J Agric Food Chem. 53(21):8197-204. 2006)。さらにルテオリンも半枝蓮に多く含まれ、半枝蓮の抗腫瘍作用の活性成分の一つと考えられています。(Ann N Y Acad Sci. 1095:598-611. 2007)
ルテオリンの豊富な食品はがんの予防や治療に役立ちます。ルテオリンは熱に安定で、調理によってロスが少ないと言われています。
また、ルテオリンの豊富なハーブや生薬を使った漢方治療はがんの治療や再発予防の目的で効果が期待できます。ルテオリンは血液脳関門(blood-brain barrier)を通過できるので、脳腫瘍にも効果が期待できます。
このルテオリンにNrf2阻害作用が報告されています。以下のような報告があります。
Luteolin inhibits the Nrf2 signaling pathway and tumor growth in vivo. (ルテオリンは生体内の実験でNrf2シグナル伝達系と腫瘍増殖を阻害する)Biochem Biophys Res Commun. 2014 May 16;447(4):602-8.
【要旨】
Nrf2(Nuclear factor erythroid 2-related factor 2)は多くのタイプの腫瘍において過剰発現しており、がん細胞の増殖を促進し、抗がん剤治療に対する抵抗性を高める。したがって、Nrf2はがん治療における新規治療標的とみなされている。
我々は、in vitro(培養細胞を使った実験)の実験系で、ルテオリンがNrf2の強力な阻害剤であることを報告した。
この報告では、ルテオリンがマウス肝臓におけるNAD(P)Hキノンオキシドレダクターゼ1の発現を時間および用量依存的に減少させることを示した。さらに、ルテオリンは、抗酸化酵素およびグルタチオントランスフェラーゼの発現を阻害し、マウスの肝臓における還元型グルタチオンの量を減少させた。対照的に、そのような応答は、Nrf2欠損マウスでは検出されなかった。
さらに、ルテオリンの単独経口投与、あるいは細胞毒性薬物シスプラチンの腹腔内注射と組み合わせたルテオリンの経口投与は、ヌードマウスに移植した非小細胞性肺がんA549細胞の増殖を、顕著に阻害した。
移植腫瘍における細胞増殖活性、Nrf2の発現、および抗酸化酵素の活性の全ては、ルテオリン投与によって減少した。
さらに、ルテオリンは、シスプラチンの抗がん効果を増強した。
以上の結果から、ルテオリンが生体内(in vivo)でNrf2経路を阻害し、非小細胞性肺がんの化学療法において補助療法として役立ち得ることを示した。
漢方薬はフラボノイドなどのポリフェノールが豊富です。このようなポリフェノールの抗がん作用は、従来は抗酸化作用で理解されてきました。
しかし、抗酸化剤ががんを予防したり、がん治療にプラスになることは否定されています。最近の研究では、ポリフェノールは酸化剤として作用し、正常細胞に対してはホルミシスの機序で、がん細胞に対しては酸化ストレスを高める作用によって、がん予防効果と抗がん作用を説明する方が理にかなっているように思われます。

図:お茶の健康作用は、エピガロカテキンなどのポリフェノールによると考えられている(1)。ポリフェノールは抗酸化作用(活性酸素の消去)によってがん予防や抗老化の作用を発揮すると一般に考えられている(2)。しかし、ポリフェノールが酸化剤として作用して細胞に酸化ストレスを与え(3)、適度な酸化ストレスは細胞の抗酸化システムを亢進するというホルミシス効果によって抗酸化力を高め、健康作用を発揮している可能性が報告されている(4)。さらに、がん細胞やがん組織では銅イオンが多いため、銅イオンとポリフェノールが反応して活性酸素の産生を増やし、がん細胞に選択的に酸化傷害を引き起こす機序が報告されている(5)。すなわち、ポリフェノールはがん細胞に対して酸化剤として作用して増殖抑制や細胞死誘導の作用を発揮する(6)。(詳しくは512話参照)
以上のような報告は、抗がん剤治療や放射線治療の副作用軽減と抗腫瘍効果増強の目的でメトホルミンと漢方治療を併用する根拠を与えています。
【野菜が抗酸化作用によって健康作用を発揮するという考えは間違いかもしれない】
「活性酸素は生体成分を酸化してダメージを与え、がんや動脈硬化性疾患や神経変性疾患の発症原因となっている」というのは、現時点では正しいと思います。「現時点」と断っているのは、将来的にその考えが覆る可能性が残されているからです。
そこで、「体の抗酸化システムを活性化すると老化や病気を予防し、寿命を延ばすことができる」というのも現時点では理論的に正しいと言えます。
転写因子のFOXOを活性化すると、スーパーオキシドジスムターゼやカタラーゼの発現を誘導し、酸化ストレスに対する耐性が増強し、寿命延長作用や抗がん作用を発揮することが明らかになっています(322話)。
少なくとも、細胞に備わった抗酸化システムの働きを高めることは健康や抗老化や寿命延長や発がん予防にプラスになります。
問題は、抗酸化剤をサプリメントとして外来性に補充する場合です。
多くの人は、「抗酸化作用のある食品やサプリメントを多く摂取すると、老化や病気の予防につながる」ということは理論的に正しいと考えます。
抗酸化作用を唱った健康食品やサプリメントが多数販売されていますが、その宣伝文句は、「抗酸化剤は体の活性酸素を消去して、活性酸素の害を減らす」という点を強調しています。
しかし、外来性の抗酸化剤の補充が健康に悪い影響を及ぼすことは最近の多くの研究で証明されています。抗酸化性のサプリメントが寿命を短くし、がんの発生を促進することが報告されています。
運動した後に抗酸化剤を摂取すると、運動の健康作用がキャンセルされることも報告されています。
これは、抗酸化剤の摂取によって、体内に備わった抗酸化システムの働きを弱めるためです。
適度な酸化ストレスはミトホルミシス効果の作用によって体の抗酸化力や解毒力を高め、老化を遅くし、がんの発生を予防し、寿命を延ばす効果が期待できます。
適度な酸化ストレスがある方が体の抵抗力は強くなります。過保護にすると、体の抵抗力は弱くなるということです。
これに関しては、504話と505話で詳しく解説しています。
【活性酸素の産生を増やすがん治療】
がん細胞の酸化ストレスを高めてがん細胞を死滅させる治療法は「oxidation therapy(酸化治療)」と呼ばれています。
がん細胞ではミトコンドリアの機能異常などによって酸素呼吸を行うと活性酸素の産生が高まります。
がん細胞は酸化ストレスを高めたくないので、ミトコンドリアでの代謝を抑制し、酸素を使わない解糖系での代謝を亢進させています。
したがって、解糖系を抑制しミトコンドリアでの酸化的リン酸化(酸素を使ったエネルギー産生)を亢進すれば、がん細胞内の酸化ストレスを能動的に高め、がん細胞を死滅させることができます。
放射線治療と一部の抗がん剤(ビンブラスチン、シスプラチン、マイトマイシンC、ドキソルビシン、カンプトテシンなど)は、がん細胞に酸化傷害を引き起こして細胞にダメージを与えて死滅させます。その他の抗がん剤も、細胞死を引き起こすときに活性酸素が使われます。
したがって、放射線治療や抗がん剤治療の最中は、抗酸化作用のあるサプリメントの摂取は細胞死を阻害します。一方、酸化ストレスを増強すれば、放射線治療や抗がん剤治療の効き目を高めることができます。
がん研究分野におけるここ数年の動きとして、がん細胞の酸化ストレスを高める治療が注目されています。
基本は、解糖系を阻害(2-DG)し、ミトコンドリアの活性化などによって活性酸素の産生を高め(ジクロロ酢酸、メトホルミン)、がん細胞の抗酸化システムを阻害する方法(メトホルミン、漢方薬、ジスルフィラム、オーラノフィン)の併用が有効です。
さらにがん細胞に酸化ストレスを高めるケトン食、アルテスネイト、高濃度ビタミンC点滴、半枝蓮の煎じ薬を併用すると、がん細胞に酸化傷害を与えて、増殖を抑制し、細胞死を誘導できます。
メトホルミンや高濃度ビタミンC点滴やアルテスネイトや漢方薬やジクロロ酢酸などが抗がん剤治療や放射線治療と併用して、抗腫瘍効果を高める根拠は活性酸素の産生を高めるからと考えるのが理屈に合っていると思います(トップの図)。
| « 583)がん細胞... | 585)がん細胞... » |



