がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
583)がん細胞の抗がん剤感受性を高める方法(その1): 2-デオキシグルコース+ジクロロ酢酸+メトホルミン
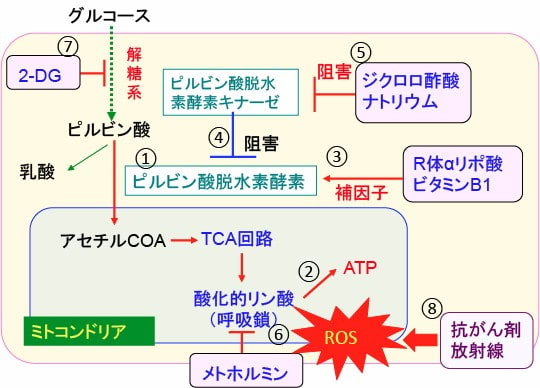
図:グルコースが解糖系で代謝されてピルビン酸に変換された後、ピルビン酸脱水素酵素によってミトコンドリア内でアセチルCoAに変換される(①)。アセチルCoAはミトコンドリア内でTCA回路と呼吸酵素複合体における酸化的リン酸化によってATPが産生される(②)。R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の活性に必要な補因子であり(③)、ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素をリン酸化して活性を阻害している(④)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する作用があり、その結果ピルビン酸脱水素酵素を活性化する(⑤)。メトホルミンは呼吸酵素複合体Iを阻害してミトコンドリアでのATP産生を減らし、同時に活性酸素の産生量を増やす(⑥)。2-デオキシ-D-グルコース(2-DG)は解糖系を阻害してATP産生と物質合成を阻害する(⑦)。抗がん剤や放射線治療が最終的にがん細胞を死滅するときに活性酸素によって細胞死が誘導される(⑧)。したがって、抗がん剤治療や放射線治療を行うときに、2-DG(2-デオキシ-D-グルコース)、ジクロロ酢酸ナトリウム、R体αリポ酸、ビタミンB1、メトホルミンを併用すると抗腫瘍効果を増強できる。
583)がん細胞の抗がん剤感受性を高める方法(その1): 2-デオキシグルコース+ジクロロ酢酸+メトホルミン
【「抗がん剤治療を受けてはいけない」という意見は正しいのか?】
がんが進行すると標準治療では抗がん剤治療が主体になります。しかし、固形がんや肉腫の多くに対しては現行の抗がん剤治療は効果が限定的なことと、正常細胞への毒性による副作用という欠点があるため、必ずしもメリットがあるわけではありません。
したがって、抗がん剤治療の是非についてはいろんな意見があります。「抗がん剤治療は受けてはいけない」という趣旨の書籍がベストセラーになっている背景には、このような抗がん剤治療の限界と欠点が存在するからです。
しかし、抗がん剤治療に勝る治療法がなければ、抗がん剤治療に頼らざるを得ないというのが、がん治療の現状です。
免疫療法や漢方治療やサプリメントなどを使った代替医療と言われている治療法も、現行の抗がん剤治療よりも有効性が高いというエビデンス(証拠)がでれば、標準治療に置き換わることができるかもしれませんが、まだそこまでのエビデンスがあるとは言えません。
そこで、進行した固形がんや肉腫のに対する治療は、副作用というデメリットはあっても、抗がん剤に頼るしかありません。
効く抗がん剤が無い場合や、抗がん剤治療を受ける体力や抵抗力が無い場合には、「抗がん剤治療を受けてはいけない」という意見は正しいのですが、副作用を耐えられる体力がありがんの縮小効果が期待できるときは「抗がん剤治療を受けてはいけない」という意見は必ずしも正しくありません。
抗がん剤治療の問題は、がん細胞の攻撃だけが目標になっていることです。
漫然とがん細胞を抗がん剤で攻撃するだけでは限界が見えています。
抗がん剤の効き目を高める(がん細胞の抗がん剤感受性を高める)方法を併用すれば、がんを消滅する確率を高めることができます。そのような方法を積極的に利用すれば、進行がんでも根治できる可能性があります。
抗がん剤が効きにくいという理由の一つが、がん幹細胞の存在です。がん幹細胞は様々なメカニズムで抗がん剤や放射線治療に対して抵抗性を持っているので、これらの治療に生き残り、再発や転移の原因になっています。
したがって、抗がん剤や放射線に対するがん幹細胞の感受性を高める方法の開発が重視されています。がん幹細胞を死滅させることができれば、進行がんでも根治できます。
【ステージ4の固形がんでも治ることはある】
がんが早期であれば手術だけで根治できます。がんが進行して他の臓器に転移したステージ4の場合は、通常は手術の適応はなく、抗がん剤治療が中心になります。
急性白血病や悪性リンパ腫は抗がん剤治療が良く効きますが、胃がんや肺がんや大腸がんなどがん細胞の塊を作る固形がんは、基本的には抗がん剤では全滅できません。
抗がん剤治療で縮小しても、ほぼ確実に一部のがん細胞(特にがん幹細胞)は生き残り、再増殖します。その理由は、抗がん剤は正常細胞に対しても毒性があるため、生体を死なせない量しか投与できないためです。生体が死なない投与量だと、がん細胞を全滅することはできないためです。
そこで、ステージ4の固形がんの抗がん剤治療は根治治療ではなく、延命治療しかできません。しかし、転移巣が少ない場合は、残った転移巣を手術で切除すると根治する場合もあります。
通常、目に見える転移が1個か数個あれば、目に見えない転移は多数あるいは無数にあると考えるのが常識です。したがって、遠隔転移があるときは、手術は意味が無いと一般には考えられています。
しかし、目に見える転移を切除したあと免疫力を高めたり、適切な食事療法などで再発を防ぐこともできます。最近は、ピンポイントで腫瘍を照射する放射線治療で転移を消滅させることもできます。
大腸がんの場合、肝臓や肺の転移が少数の場合は、原発と一緒に転移を切除して術後補助化学療法を行うと再発せずに治癒する症例はそれほど珍しくありません。
転移が大きかったり多数ある場合でも、術前に抗がん剤治療でできるだけ縮小させて原発と転移を手術で切除することが行われています。
昔は、遠隔転移があると手術は意味が無いと考えられていたのですが、最近は縮小効果の高い抗がん剤治療やピンポイントの放射線治療が行われるようになって、がん組織をできるだけ縮小して、生き残った抗がん剤耐性のがん細胞は手術で切除して、体内のがん細胞の数を大きく減らせば、その後の抗がん剤治療や免疫療法や食事療法などで積極的にがん再発予防の治療を行えば、根治することも経験するようになりました。
この場合、手術前の抗がん剤治療の効き目を高める方法を併用すると、手術ができる可能性を高めることができます。
【手術不能の進行がんが根治することもある】
抗がん剤治療はがんの標準治療として認められています。しかし、その強い副作用や、わずかな延命効果に対しては多くの批判があります。
最近の論文でも、「抗がん剤の新薬の半数以上は延命効果が証明されていない(564話)」「統計的に有意差があっても、臨床的に意味のある有益性の無い抗がん剤が多い(572話)」という事実が明らかになっています。
抗がん剤治療だけでは、副作用が強いわりに奏功率や延命効果(全生存期間の延長)がわずかであるため、ステージ4のがんに対する抗がん剤治療に対して批判や拒否が多くなっています。
しかし、がん細胞の抗がん剤感受性を高める方法や、副作用を軽減する補完療法を積極的に行うと、ステージ4のがんでも根治が期待できるレベルに持っていくことは可能です。抗がん剤感受性を高める方法を併用することによって、ステージ4の進行がんでも根治できる症例を多く経験するようになりました。
抗がん剤治療に限界があるのは、がん細胞が抗がん剤に抵抗性を持つからです。したがって、がん細胞の抗がん剤感受性を高める方法を併用すると、遠隔転移のあるステージ4の進行がんでも治る可能性を高めることができます。以下の症例は、大きな肝臓転移のある進行大腸がんが、抗がん剤治療によって著明に縮小したのちに切除ができた患者さんです。
Tさん(49歳女性)は倦怠感と食欲低下と3ヶ月間で約6kgの体重減少が起こったので、近くのクリニックを受診しました。CT検査の結果、肝臓の右葉に8cmくらいの大きさの腫瘍が見つかり、腫瘍マーカーのCEAとCA19-9が上昇していたので、消化器系のがんの転移が疑われました。PET検査や下部消化管内視鏡検査の結果、上行結腸に全周性の大きながんが見つかりました。
肝臓転移が大きく肝静脈に近いので、手術で切除することは困難な状況でした。そこで、肝臓の腫瘍をできるだけ小さくして、手術ができる状態にすることを目標に抗がん剤治療が開始されました。
抗がん剤はFOLFOX(フォリン酸+フルオロウラシル+オキサリプラチン))+ベバシズマブ(商品名:アバスチン)のレジメで行われました。
抗がん剤治療の副作用を軽減する目的で、漢方治療とミルクシスルの服用を開始しました。さらに、抗がん剤の効き目を高める目的で、2-デオキシ-D-グルコース(2.0g/日)、メトホルミン(1000mg/日)、ジクロロ酢酸ナトリウム(0.7g/日)、ビタミンB1製剤のベンフォチアミン(150mg/日)、R体αリポ酸(66mg/日)、ビタミンD3(4000 IU/日)、炭酸水素ナトリウム(重曹:10g/日)、オメプラゾール(20mg/日)を併用しました。
FOLFOX+ベバシズマブが8クール終了した時点で、腫瘍マーカーのCEAは抗がん剤開始前の5620 ng/mlから142 ng/mlに、CA19-9は抗がん剤開始前の18500 U/mlから526 U/mlに、いずれも30分の1以下に減少しました。
その結果、腸管の半分くらいを塞いでいた大腸がんの原発巣は1cm以下に縮小し、肝臓の転移巣も直径が3cmくらいに著明に縮小していました。
そこで、原発巣と肝臓の転移を切除する手術が行われました。
切除した原発部位と肝臓転移以外には目に見える転移はありませんでしたが、目に見えないレベルで転移が残存している可能性があります。そこで、内服の抗がん剤(UFT+ロイコボリン)が6ヶ月間投与されました。
術後化学療法の間も、がん細胞の抗がん剤感受性を高める目的で手術前に服用した薬とサプリメントは継続しました。6ヶ月間の術後化学療法が終了したあとは、再発予防の目的で漢方治療とビタミンD3と発酵小麦胚芽エキスのAveULTRAを継続しています。術後の抗がん剤治療が終了後、3年が経過していますが再発は認めていません。
まだ3年ですので、根治したかどうかは不明です。手術前の抗がん剤治療(FOLFOX+ベバシズマブ)が8クール終了した時点で、腫瘍マーカーは30分の1以下になりましたが、それ以上は下がる様子はなく、上がりそうな状況でした。つまり、抗がん剤耐性のがん細胞が生き残って増殖を開始することが予想されましたので、手術が行われました。
手術しなければ、抗がん剤耐性のがん細胞が増殖するので、余命は1年くらいと推測されます。しかし、手術ができたおかげで、根治する可能性が出ています。
切除不能と判断される肝臓転移例でも、抗がん剤治療後に根治切除が可能になる症例が一定の割合で存在することが明らかになっています。また,抗がん剤治療の奏効率と切除率には密接な関連があることが報告されてます。つまり、抗がん剤治療によって腫瘍縮小率を高めれば、切除できる可能性を高めることができます。
この患者さんで行ったような方法は、有効性と安全性のエビデンスはあります。
乳がんの手術前の抗がん剤治療に併用して、病理学的完全奏功(病理検査でがん細胞が見つからない状態)の結果を得た患者さんもいます。
進行がんの抗がん剤治療では、がん細胞の抗がん剤感受性を高めることが重要です。
がん治療における問題の多くは、「固形がんに対する抗がん剤治療の有効性が低い」ことと「抗がん剤治療の副作用がきつい」ことの2点に起因していて、これを解決することが、がんの補完・代替医療の最大の目的になっています。
「抗がん剤は効かない」「副作用で苦しむ」と否定や拒否をするより、「抗がん剤が効く方法や副作用を軽減する方法を見つけて、実践する」ことがより建設的など思います。
【がん細胞の酸化ストレスを高めると死滅しやすくなる】
がん細胞では酸素が十分に存在する場合でも、解糖系でのグルコース代謝が亢進して、相対的にミトコンドリアでの酸化的リン酸化は抑制されています。その結果、乳酸の産生が増えています。これを好気性解糖あるいはワールブルグ効果と言います。
ミトコンドリアでの酸化的リン酸化を抑えているのは、活性酸素の害を減らしたいからです。
しかし、それでもミトコンドリアでの酸化的リン酸化によるエネルギー産生は起こっています。一般的に、増殖の早いがん細胞では、ATP産生の50%以上が解糖系で産生されると言われています。
がん細胞はミトコンドリア機能にいろんな異常があるので、正常細胞に比べて活性酸素が発生しやすくなっています。そこで、がん細胞は酸化ストレスを軽減するために、ミトコンドリアでの酸化的リン酸化を抑え、細胞に備わった抗酸化システムを亢進しています。
多くの抗がん剤治療によって引き起こされる細胞死(アポトーシス)は、全てではないにしてもそのほとんどは活性酸素種によって引き起こされる可能性が示されています。放射線照射が活性酸素種の産生によってアポトーシスを誘導するのと同じように、多くの抗がん剤も最終的には活性酸素種を産生することによってアポトーシスを誘導しているのです。
多くの抗がん剤ががん細胞にアポトーシスを誘導する共通のメカニズムとして活性酸素を使っているということは、なぜ抗がん剤に抵抗性のがん細胞は放射線治療も同様に抵抗性になるかという理由を説明しています。
このような活性酸素種を産生させてがん細胞を死滅させるときに抗酸化剤のN-アセチルシステインやグルタチオンを同時に投与すると、活性酸素によるがん細胞の死滅は起こらなくなります。
したがって、抗がん剤や放射線治療の効き目を高める方法として、ミトコンドリアでの活性酸素の量を増やす方法(呼吸酵素複合体-Iの阻害+酸化的リン酸化の活性化)と抗酸化システム(グルタチオン、チオレドキシンなど)を阻害する方法を組み合せることが有用であることが理解できます。
【電子伝達系(呼吸鎖)からの漏れが活性酸素種の量を高めている】
ミトコンドリアにおける電子伝達系(呼吸鎖)においてATPが産生されるとき、必然的に活性酸素種(スーパーオキシド、過酸化水素、ヒドロキシラジカルなど)が発生します。
ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,ミトコンドリアにおいて,一連の酵素系(呼吸鎖複合体 I~IV)とATP合成酵素(呼吸鎖複合体Vとも言う)の連鎖を経て,最終受容体である酸素(O2)に渡されて水(H2O)になります。複合体 I~IVの段階は,ミトコンドリア内膜のタンパク質や補酵素間で電子のやり取りが起こる過程であるため電子伝達系(呼吸鎖)と呼ばれます。
電子伝達系によってミトコンドリアマトリックスから膜間空間にプロトン(水素イオン)がくみ出され、輸送されたプロトンによってミトコンドリア内膜の内外にΔΨと呼ばれる電気化学的ポテンシャル(プロトンによって生じる電荷の差)が作り出されます。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成します。これを酸化的リン酸化と言います。
ミトコンドリアの呼吸鎖や酸化的リン酸化の過程が阻害されると、プロトン(水素イオン)がうっ滞して、ミトコンドリアからの活性酸素種の産生が増加します。メトホルミンは呼吸酵素複合体Iを阻害して、ミトコンドリアからの活性酸素の発生を増やす作用が報告されています。

図:呼吸酵素複合体のIとIIIでスーパーオキシド(O2-)が産生される。スーパーオキシドはスーパーオキシド・ディスムターゼによって過酸化水素(H2O2)に変換される。過酸化水素の一部はFenton/ Haber-Weiss反応によってヒドロキシルラジカル(Hydroxyl radical)に変換される。
【メトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害する】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体Iを阻害することが明らかになっています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。
活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。AMPKはインスリン感受性を高めるので、少ないインスリンで血糖をコントロールできるようになります。インスリンは老化と発がんを促進し、がん細胞の増殖を促進するので、糖尿病でない人でも抗老化とがん予防の目的で服用しています。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。運動でATPが減少してAMPKが活性化されるのと同じメカニズムです。ATP産生が減少するのでAMPKが活性化します。
このメトホルミンの呼吸酵素阻害作用は、がん細胞において活性酸素の産生を増やす目的でがん治療への応用が検討されています。

図:メトホルミンはミトコンドリアの呼吸酵素複合体1を阻害する(①)。その結果、ATP産生が減少してエネルギー低下によって増殖や抑制される(②)。呼吸鎖の阻害によってミトコンドリアでの活性酸素の産生が増え、酸化ストレスで細胞は障害される(③)。
【2-デオキシ-D-グルコースは解糖系を阻害する】
2-デオキシ-D-グルコース(2-Deoxy-D-glucose)は、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換された物質(グルコース誘導体)です。
2-デオキシグルコース(2-DG)はグルコースと同じようにグルコース輸送体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれます。
グルコースと2-DGは細胞内に入るとヘキソキナーゼによってリン酸化され、グルコース-6-リン酸あるいは2-デオキシ-D-グルコース-6-リン酸(2-DG-6-リン酸)に変換されます。リン酸化されるとグルコース・トランスポーターを通過できないため細胞外へ出れなくなります。
このヘキソキナーゼによる6位のリン酸化は解糖系によるブドウ糖(グルコース)の代謝の最初のステップで、細胞内に取込んだブドウ糖を細胞内にとどめておく目的があります。
リン酸化反応後は、グルコース-6-リン酸はさらに解糖系で代謝されてエネルギー産生に使われ、ペントース・リン酸経路で核酸などの物質合成の材料としても利用されます。
しかし、2-DG-6-リン酸は、解糖系酵素で代謝できないため、細胞内に蓄積します。グルコース-6-リン酸や2-DG-6-リン酸を脱リン酸化するフォスファターゼが糖新生を行う肝臓や腎臓の細胞にはありますが、多くのがん細胞はフォスファターゼの活性が低いので、一旦入った2-DGは2-DG-6-リン酸に変換されたあとは細胞外に出ることができず、さらにそれ以上代謝されることもできないので、2-DG-6-リン酸の状態でどんどん蓄積します。
2-DGによってエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーターの発現がさらに増え、2-DGの取り込みをさらに増やすことにもなります。したがって、がん細胞は正常細胞に比べてより2-DGの取込みが増えます。
細胞内で蓄積した2-DG-6-リン酸はヘキソキナーゼとヘキソース・フォスフェート・イソメラーゼを阻害します(拮抗阻害)。したがって、2-DGを経口摂取すると、がん細胞に多く取り込まれ、がん細胞の解糖系を阻害するので、ブドウ糖の代謝によるエネルギー産生と物質合成を阻害することになります。
2-DGががん細胞内に多くトラップされることを利用した検査法がPETです。PETは「ポジトロン・エミッション・トモグラフィー(Positron Emission Tomography)」の略で、日本語では陽電子放射線断層撮影といいます。
2-DGの2位の水素原子(つまり、グルコースの2位のOH基)を陽電子放出同位体フッ素18(18F)で置換された18F-フルオロデオキシグルコース(FDG)という薬剤を注射した後、それをPET装置で撮影し、FDGの集まり方を画像化して診断するものです。多くのがんは、グルコース取り込みおよびヘキソキナーゼレベルが上昇しているため、がん細胞にFDGが集まるのです。
2-DGは優先的にがん細胞に取り込まれ、解糖系やペントース・リン酸経路を阻害して、がん細胞を内部から崩壊させることができるのです。
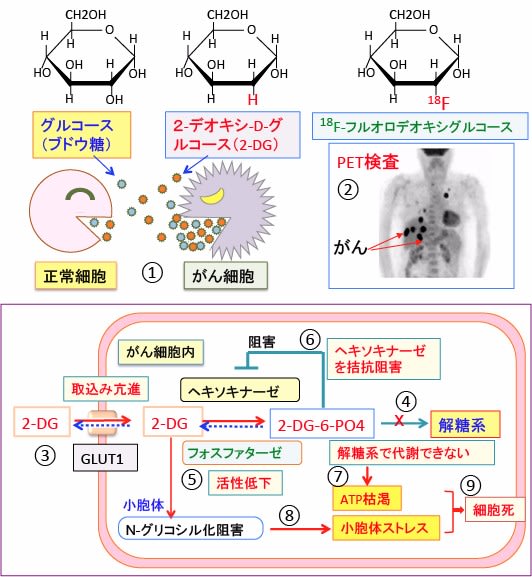
図: 2-デオキシ-D-グルコース(2-Deoxy-D-glucose)は、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換された物質(グルコース誘導体)で、がん細胞はグルコースの取込みが多く、2-DGの取込みも多い(①)。2-DGががん細胞内に多く取り込まれることを利用した検査法がPET(Positron Emission Tomography)(②)。2-デオキシ-D-グルコース(2-DG)はグルコース・トランスポーター(GLUT1)によって細胞内に取り込まれる(③)。がん細胞はGLUT1の発現量が増え、グルコースと同時に2-DGも多く取り込む。2-DGはヘキソキナーゼで2-DG-6-リン酸(2-DG-6-PO4)に変換されるが、それ以上代謝されない(④)。がん細胞はフォスファターゼの活性が低いので、2-DG-6-リン酸ががん細胞内に蓄積する(⑤)。2-DG-6-リン酸はヘキソキナーゼをフィードバック阻害(アロステリック阻害)するので、 2-DG-6-リン酸を取り込んだがん細胞はグルコースの解糖系での代謝が阻害される(⑥)。その結果、がん細胞のエネルギー産生と物質合成は阻害されることになり、ATPが枯渇する(⑦)。2-DGは小胞体でのタンパク質のN-グリコシル化(糖鎖の結合による修飾)を阻害し、折り畳みの不完全な異常タンパク質(unfolded protein)を増やして小胞体ストレスを引き起こす(⑧)。その結果、がん細胞は死滅しやすくなり、抗がん剤感受性が亢進する(⑨)。
2-DGががん細胞の増殖を抑制する効果が指摘されたのは1950年代です。「細胞のエネルギー源であるグルコースの誘導体を取り込ませれば、がん細胞の増殖を抑制できる」というアイデアは、もう60年も前に研究されており、グルコースの誘導体の抗腫瘍活性が検討され、2-DGに強い抗腫瘍効果があることが証明されています。
しかし、2-DGを使ったがん治療は、その後あまり注目されなかったようです。その理由の一つは、がんの治療においては、「強い毒性をもった化合物を使ってがん細胞を一掃するような治療法」が1950年代以降は主流になっていたからだと思われます。そのため、「エネルギー産生経路を阻害してがん細胞の増殖を低下させる」というようなアイデアは注目されなかったのかもしれません。
しかし、ワールブルグ効果が再評価されるようになり、がん細胞のエネルギー産生と物質合成を阻害する方法として、2-DGにも注目が集まるようになり、多くの動物実験で抗腫瘍効果が証明され、人間での臨床試験も実施されるようになったということです。
2-DGは単独では抗がん作用は弱いのですが、抗がん剤治療や放射線治療やメトホルミンやジクロロ酢酸との相乗効果が報告されています。
【2-デオキシ-D-グルコースは抗がん剤治療や放射線治療の効き目を高める】
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害するので、がん細胞の増殖速度を低下させる効果がありますが、2-DG単独ではがん細胞を死滅させる作用は弱いと言わざるをえません。今まで、動物実験や人間での研究が報告されていますが、2-DGの投与だけでは十分な抗腫瘍効果は得られていません。がん細胞のブドウ糖を完全に枯渇させることが現実的に困難だからです。
しかし、がん細胞のエネルギー産生や物質合成の経路を阻害すると、抗がん剤や放射線に対するがん細胞の感受性が高まります。抗がん剤治療や放射線治療の時に2-DGを服用すると、それらの抗腫瘍効果を高めることが多くの臨床試験で確認されています。
抗がん剤との併用において1日体重1kg当たり40~60mg程度の投与量で臨床試験が行われています。長期投与の安全性は十分に検討されていないため、がんの再発予防の目的ではまだ推奨できませんが、進行がんの治療の目的で抗がん剤などとの併用など短期間の使用に関しては問題無いようです。
2DGとグルコース(ブドウ糖)が競合してがん細胞のエネルギー代謝を阻害するため、糖質制限でグルコースの摂取量を減らせば、2DGは少ない量で阻害作用を発揮できます。
就寝時は筋肉や心臓や脳の働きが低下して血流やブドウ糖の取込みが減ります。そのため、2-DGを就寝前に服用すると、最も抗腫瘍効果が高まります。
2-DGの毒性に関しては、マウスの実験では50%致死量は2g/kg以上という報告があります。(Cent Eur J Biol. 5:739–748. 2010年) 人での検討では200mg/kgくらいまでは投与できるという報告があります。
解糖系を阻害すると寿命延長効果があるので、昔は抗加齢(アンチエイジング)の領域で研究されたこともありますが、長期投与では副作用が出るので、抗加齢の目的での研究は断念されています(後述)。
最も多い副作用は高血糖です。2-DGは細胞内のグルコースの濃度を低下させます。脳の視床下部の神経細胞が細胞内グルコースの低下を感知すると、低血糖状態と勘違いして、脳下垂体のホルモン分泌を制御して血糖を高めるホルモンや伝達物質を出すようになるため高血糖になるようです。食事からの糖質摂取を減らすケトン食や肝臓の糖新生を阻害するメトホルミンを併用すると高血糖を避けることができます。
一方、服用量が多いと低血糖のような症状(倦怠感や脱力)を感じます。がん細胞の多く取込まれるため、低血糖症状が起こらないレベルで服用量を調節することが重要です。
【カロリー制限と類似の作用を示す2-デオキシ-D-グルコース】
カロリー制限による寿命延長の研究を行っている米国国立老化研究所(National Institute on Aging)のジョージ・ロス(George Roth)博士の研究グループは、カロリー制限と同じ効果を真似る薬の開発において、2-デオキシ-D-グルコース(2-DG)の可能性を研究していました。
カロリー制限と同じ効果(抗老化や寿命延長効果)を示す薬をCalorie restriction mimetics (CRM:カロリー制限模倣化合物)と言います。
CRMには抗糖尿病薬のメトホルミン、赤ワインに含まれるレスベラトロール、ポリアミンの一種のスペルミジンなども知られていますが、2-DGはCRMとして最初に研究された物質です。現在でも抗老化の観点からの研究は行われています。
グルコース代謝が阻害されてATP量が減少するとAMP活性化プロテイン・キナーゼ(AMPK)が活性化され、活性化されたAMPK はmTORC1(哺乳類ラパマイシン標的タンパク質)を抑制します。mTORC1は老化と発がん過程の両方を促進する働きがあるので、mTORC1の抑制は抗老化と抗がんの両方の効果になります。
線虫の実験では、2-DGが寿命を顕著に延長する結果が得られています。
しかし、ラットの実験では2-DGを大量に長期間投与すると心筋細胞の空砲化と死亡率の上昇などの毒性が確認されています。(Toxicol Appl Pharmacol 243(3): 332-9, 2010年)
つまり、動物にとっては老化予防や寿命延長の目的では2−DGは現実的とは言えないようです。
ただし、てんかんやがんの治療目的においては、臨床効果の方が毒性より上回っていると考えられ、人間での臨床試験が行われています。
2-デオキシ-D-グルコースがケトン体の産生を高めて神経細胞におけるミトコンドリアでのエネルギー産生を高めることによってアルツハイマー病を改善する作用が動物実験で確認されています。
【2-DGは正常細胞を抗がん剤や放射線のダメージから保護する】
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害するので、がん細胞の増殖速度を低下させる効果があります。
がん細胞のエネルギー産生や物質合成の経路を阻害すると、抗がん剤や放射線に対するがん細胞の感受性が高まります。
2-デオキシ-D-グルコース(2-DG)は抗がん剤や放射線に対するがん細胞の感受性を高めるだけでなく、抗がん剤や放射線による正常細胞のダメージを軽減する効果があるという報告があります。以下のような報告があります。
Protection of normal cells and tissues during radio- and chemosensitization of tumors by 2-deoxy-D-glucose. (2-デオキシ-D-グルコースはがん組織の放射線感受性と抗がん剤感受性を高め、正常細胞と組織のダメージを軽減する)J Cancer Res Ther. 2009 Sep;5 Suppl 1:S32-5.
【要旨】
正常組織への毒性はがん治療における重要な制限因子の一つである。正常組織や重要臓器に対するダメージが大きくなるため、抗がん剤や放射線照射の用量を増やすことができない。そのため治療効果も弱くなる。グルコース類縁体の2-デオキシ-D-グルコース(2-DG)は、解糖系を阻害してATP産生を阻害する作用があり、がん細胞に対する抗がん剤や放射線治療の感受性を高めることが、多くのがん細胞種において認められている。さらに、正常細胞に対しては、放射線や抗がん剤からのダメージを軽減することが報告されている。この総説では、正常細胞や正常組織を抗がん剤や放射線から保護する2-DGの作用機序を考察し、このグルコース類縁体ががん治療において有用な補助療法である根拠を示す。
がん細胞は正常細胞に比べてグルコース(ブドウ糖)の取込みが多く、ATP産生や細胞分裂するための物質合成に大量のグルコースを必要としています。したがって、グルコースの取込みや利用を妨げれば、ATP産生や物質合成が低下し、抗がん剤や放射線治療の効き目が高くなります。
がん細胞はグルコーストランスポーターを多く発現しているので、2-DGの取込みも多く、2-DGによるグルコース代謝の阻害作用が著明に現れます。
培養細胞を使った実験や動物にがん細胞を移植した動物実験で、2-DGを投与すると抗がん剤や放射線治療の治療効果が高まることが多くの実験系で確認されています。
さらに動物実験で、2-DGが脳や心臓に対する抗がん剤や放射線のダメージを軽減する作用が認められています。その作用機序についてはまだ十分に解明されていませんが、AMP活性化プロテインキナーゼ(AMPK)の活性化やオートファジーの阻害など複数のメカニズムが示唆されています。以下のような論文があります。
Caloric restriction mimetic 2-deoxyglucose antagonizes doxorubicin-induced cardiomyocyte death by multiple mechanisms.(カロリー制限と同様の作用がある2-デオキシグルコースはドキソルビシンによる心筋細胞死を複数のメカニズムで阻止する)J Biol Chem. 2011 Jun 24;286(25):21993-2006.
【要旨】
食事からのカロリー摂取を減らすカロリー制限が心血管系の健康状態を良くすることが知られている。グルコース類縁物質の2-デオキシ-D-グルコースはカロリー制限と同様の作用を示すことが複数の動物実験で報告されている。しかしながら、2-DGが心機能に有益な作用を示すかどうかはまだ不明である。
この研究では、抗がん剤で副作用として心筋障害を引き起こすドキソルビシンの投与で引き起こされる心筋細胞死に対して2-DGが抑制作用を示すかどうかを検討した。
新生児ラットの心筋細胞を0.5mMの2-DGで処理すると、ドキソルビシンで誘導される心筋細胞のダメージや細胞死を顕著に抑制した。
2-DGは細胞内ATP量を17.9%低下させたが、ドキソルビシンによって引き起こされる著明なATP枯渇は阻止し、これが2-DGによる心筋細胞死の抑制に寄与していると考えられた。
さらに、2-DGはAMP活性化プロテインキナーゼ(AMPK)の活性を高めた。
AMPKシグナルの阻害剤(compound Cまたは干渉RNA)を投与すると、2-DGの心筋細胞保護作用は阻止された。
逆に、薬や遺伝子的方法でAMPK活性を増強すると、ドキソルビシンの心筋細胞障害は抑制された。2-DGとAMPK活性化剤を併用すると相加効果は認めなかった(注:両方とも同じ機序でドキソルビシンによる心筋障害を抑制するので、併用しても相加や相乗効果は得られないということ)
さらに2-DGはオートファジー(自食作用)を誘導するが、このオートファジーは細胞内タンパク質の分解であり、その活性化は細胞の状況によって良い場合(細胞障害から保護する)と悪い場合(細胞障害を悪化する)がある。
2-DGはオートファジーを活性化するが、ドキソルビシンによって引き起こされる細胞障害性のオートファジーは阻止した。
以上のことから、カロリー制限と同様な作用を示す2-DGはドキソルビシンで誘導される心筋細胞のダメージや細胞死を阻止することが明らかになり、その作用機序としては、ATP量の維持、AMPKの活性化、ドキソルビシンによって誘導されるオートファジーの阻害など複数のメカニズムが関与していることが示唆された。
このように、2-DGはがん細胞の抗がん剤感受性や放射線感受性を高め、正常細胞に対しては抗がん剤や放射線のダメージから守る作用があります。
【がん細胞ではピルビン酸脱水素酵素キナーゼの活性が亢進している】
がん細胞の代謝の特徴である「解糖系の亢進とミトコンドリアでの酸化的リン酸化の抑制」という、いわゆるワールブルグ効果を根本で制御しているのが低酸素誘導因子-1(Hypoxia-inducible Factor-1:HIF-1)という転写因子です。
転写因子というのは特定の遺伝子の発現(DNAの情報をメッセンジャーRNAに変換すること)を調節している蛋白質です。HIF-1のターゲット遺伝子は100種類以上知られており、エネルギー代謝、血管新生、細胞増殖、アポトーシスなど細胞の機能と深く関連している遺伝子の発現を制御しています。
HIF-1は細胞が低酸素状態におかれると活性化してきます。したがって、酸素が十分に利用できる状況で細胞分裂している正常細胞では必要がない転写因子です。
一方、多くのがん細胞では、低酸素状態であってもなくてもHIF-1の活性が亢進しています。急速に増大するがん組織の中で、がん細胞は常に低酸素や低栄養による細胞死の危険にさらされています。そこで、低酸素や低栄養による細胞死を起こさないようにするメカニズムとしてがん細胞はHIF-1活性を高めています。これは、HIF-1活性が亢進しているほど、がん細胞は低酸素や低栄養で生存できる(死ににくい)ということを意味しています。
がん細胞では、遺伝子変異などによって増殖のシグナル伝達系が恒常的に亢進しており、その結果としてHIF-1の活性が恒常的に亢進しています。
つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。
ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへの変換する酵素)をリン酸化して活性を低下させます。HIF-1はピルビン酸脱水素酵素キナーゼの発現を促進し、さらにピルビン酸から乳酸への嫌気性解糖系に働く乳酸脱水素酵素(LDH)の発現を促進する作用があります。
つまり、HIF-1はピルビン酸からアセチルCoAへの変換を阻害してTCA回路と酸化的リン酸化での代謝を抑制し、嫌気性解糖(ピルビン酸から乳酸の変換)を亢進します。解糖系の途中のブドウ糖の代謝産物から核酸や脂肪酸やアミノ酸の合成を促進する作用もあります。
正常細胞ではHIF-1は低酸素になったときしか活性化されませんが、がん細胞では増殖シグナルの異常などによってHIF-1は恒常的に活性化し、酸素がある状況でも酸素が無い状態と同じ代謝を行うため、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化が抑制されています。
がん細胞で活性化されているHIF-1は、がん細胞における乳酸脱水素酵素の産生を高めます。また、HIF-1はピルビン酸脱水素酵素の活性を阻害するピルビン酸脱水素酵素キナーゼの遺伝子発現を促進します。したがって、がん細胞では、HIF-1の発現亢進によって、TCA回路へいく経路が遮断され、嫌気性解糖系の亢進によって乳酸が大量に産生される代謝が亢進しています。
複雑なメカニズムですが、HIF-1の活性亢進はがん細胞の代謝異常の中心になっているので、代謝をターゲットにしたがん治療法の理解に役立ちます。(図)

図:低酸素や増殖シグナル伝達系(PI3K/Akt/mTOR)の活性亢進によって低酸素誘導因子-1(HIF-1)の発現と活性が亢進する(①)。HIF-1は細胞核のDNAに作用して、がん細胞の増殖や転移を促進する様々な遺伝子の発現を亢進する(②)。HIF-1は解糖系酵素(ヘキソキナーゼなど)や乳酸脱水素酵素の発現を亢進して解糖系の代謝を亢進する(③)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を誘導する(④)。このキナーゼはピルビン酸脱水素酵素を阻害する(⑤)。したがって、HIF-1の活性亢進によってミトコンドリアでの酸化的リン酸化が抑制される(⑥)。つまり、がん細胞における解糖系亢進とミトコンドリアでの酸化的リン酸化の抑制はHIF-1の活性亢進によってもたらされている。
【ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する】
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)の2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから使用されています。
前述のようにがん細胞ではHIF-1の活性亢進によってピルビン酸脱水素酵素キナーゼの活性が亢進し、ピルビン酸脱水素酵素の活性が低下し、ピルビン酸からアセチルCoAへの変換が阻止されているため、ミトコンドリアでのエネルギー産生が低下しています。
そこで、ジクロロ酢酸ナトリウムでがん細胞のピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、乳酸の産生が抑えられます。さらに、酸化的リン酸化の過程で活性酸素の産生が増え、酸化ストレスの増大によってがん細胞を死滅できるという作用機序が報告されています。(図)。

図:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して(①)、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので(②)、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素の活性を高め(③)、R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働き(④)、ピルビン酸脱水素酵素の活性を高めてピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する(⑤)。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増え、乳酸産生が減少し、アポトーシスが起こりやすくなって、抗がん剤感受性が亢進する(⑥)。
がん細胞では活性酸素の発生を減らして死ににくくするために、ミトコンドリアでの酸化的リン酸化を抑制しています。ジクロロ酢酸ナトリウムでがん細胞のミトコンドリアでの代謝を促進して活性酸素の産生を増やすと抗がん剤で死にやすくなります。ジクロロ酢酸ナトリウム単独でもがん細胞が死滅することが培養細胞や動物実験で明らかになっています。
ミトコンドリアでの活性酸素の産生量を増やしたくらいでがん細胞が本当に死滅するのかという疑問が出るかもしれませんが、ミトコンドリアは細胞の重量の10%以上を占めるくらい大量に存在するので、ミトコンドリアで一斉に酸化的リン酸化が亢進すれば細胞を死滅させることができると考えられています。
培養がん細胞や動物移植腫瘍を用いた実験でジクロロ酢酸ナトリウムの抗腫瘍作用は証明されています。臨床試験でも有効性が報告されており、がんの代替医療では利用する患者さんが増えています。
ジクロロ酢酸が抗がん剤耐性を減弱することが多く報告されています。例えば、以下のような報告があります。
Suppression of pyruvate dehydrogenase kinase-2 re-sensitizes paclitaxel-resistant human lung cancer cells to paclitaxel.(ピルビン酸脱水素酵素キナーゼ-2の抑制は、パクリタキセル耐性ヒト肺がん細胞をパクリタキセル感受性にする)Oncotarget. 2017 Apr 10;8(32):52642-52650.
【要旨】
治療開始後の初期の臨床的効果は顕著であっても、パクリタキセルで治療された大部分の肺がん患者は、最終的にはパクリタキセルに耐性になる。ピルビン酸脱水素酵素キナーゼ-2(PDK2)は、解糖および酸化的リン酸化の重要な調節因子であり、その発現は様々な腫瘍において増加する。本研究では、生化学および同位体追跡法を用いて、肺がん細胞におけるパクリタキセル耐性の機序におけるPDK2の役割を調べた。
パクリタキセルに感受性の肺がん細胞に比べて、パクリタキセル耐性肺がん細胞ではPDK2の発現亢進が認められた。
siRNAを用いたPDK2遺伝子の発現抑制は、パクリタキセル耐性肺がん細胞のパクリタキセルに対する感受性を増加させた。PDK2発現抑制によるパクリタキセル耐性肺がん細胞への作用は、酸化的リン酸化の亢進よりも解糖の減少として認められた。
PDK2の特異的阻害剤のジクロロ酢酸とパクリタキセルを併用すると、パクリタキセル耐性肺がん細胞の生存率に相乗的な阻害効果を示した。
これらの結果は、パクリタキセルによるPDK2の発現誘導が、肺がん細胞のパクリタキセル耐性の獲得の重要な機序として働くことを示している。これらの結果は、パクリタキセルに耐性を獲得した肺がん患者の治療において、PDK2の阻害が有効である可能性を示している。
人間の場合、1日体重1kg当たり10〜15mgを水に溶解して服用します。ピルビン酸脱水素酵素が活性化すると、この酵素の補因子であるビタミンB1とR体αリポ酸を消耗するのでビタミンB1とR体αリポ酸の補充が副作用予防と効果増強に必要です。

図:αリポ酸にはR体とS体という2種類の光学異性体(鏡像異性体)が存在する。体内で生成されるαリポ酸はR体のみで、S体は天然には存在しない。しかし、αリポ酸を人工的に合成するとR体50%、S体50%のラセミ体ができる。ピルビン酸脱水素酵素を活性化する作用はR体のみで、逆にS体のαリポ酸はピルビン酸脱水素酵素の活性を阻害する。したがって、ジクロロ酢酸でミトコンドリアを活性化するときにはR体αリポ酸でなければならない。
【メトホルミンと2-デオキシ-D-グルコースの相乗効果】
2-デオキシ-D-グルコース(2-DG)は解糖系を阻害することによってATP産生を阻害します。経口糖尿病薬のメトホルミンはミトコンドリアの呼吸酵素を阻害してATPの産生を阻害する作用があります。最近の研究では、メトホルミンが2-DGと同様に解糖系酵素のヘキソキナーゼの活性を阻害する作用も明らかになっています。
したがって、2-DGとメトホルミンを併用すると、がん細胞のエネルギー産生を阻害する効果を高めることができます。実際に、マウスの移植腫瘍の実験モデルで、2-DGとメトホルミンを併用すると相乗的な抗腫瘍効果が得られることが、テキサス大学MDアンダーソンがんセンターから報告されています。(Mol Cancer Ther. 10(12): 2350-2362, 2011年)
培養がん細胞を用いた実験では、2-DGで解糖系を阻害しても、がん細胞を死滅させるだけの効果は得られませんが、メトホルミンを同時に投与すると、がん細胞は死滅しました。様々な種類のがん細胞をマウスに移植した動物実験において、2-DGとメトホルミンはそれぞれ単独では抗腫瘍効果は弱いのですが、この2つを併用すると強い腫瘍縮小効果が認められています。
がん細胞が増殖するためには、増殖のシグナルと、エネルギー産生と物質合成のための材料が必要です。増殖シグナル伝達系は、インスリン/インスリン様成長因子-1(IGF-1)とそれらの受容体の結合によって刺激されるPI3K/Akt/mTORC1伝達系が重要です。
メトホルミンはミトコンドリアの呼吸鎖(電子伝達系)と解糖系のヘキソキナーゼを阻害してATP産生を阻害する作用がありますが、さらにAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を抑制します。
一方、2-DGはグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。
メトホルミンには乳酸アシドーシスを引き起こす副作用があります。乳酸が増えて、血液が酸性になる状態です。
大きながん組織があると乳酸の産生が増えています。乳酸アシドーシスを防ぐために、肝臓では乳酸をブドウ糖に変換する糖新生が亢進します。メトホルミンは糖新生を阻害する効果があるので、乳酸産生の増加した状態でメトホルミンを服用すると乳酸アシドーシスを起こしやすくなります。したがって、がん細胞の解糖系を抑制し、ミトコンドリアでの酸素呼吸を増やす2-デオキシグルコースやジクロロ酢酸ナトリウムやケトン食を併用するとメトホルミンによる乳酸アシドーシスの発生を防ぐことができます。特にジクロロ酢酸ナトリウムは乳酸アシドーシスの治療に古くから使用されています。(図)

図: がん細胞は解糖系が亢進して乳酸の産生が増えている(①)。乳酸は肝臓や腎臓やがん間質細胞で糖新生によってグルコースに変換されている(②)。2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害し(③)、ジクロロ酢酸ナトリウム(DCA)はピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進する(④)。メトホルミンは糖新生を阻害する(⑤)。メトホルミンは呼吸鎖を阻害して(⑥)、ATP産生を低下させ(⑦)、さらにミトコンドリアでの活性酸素の産生を増やして酸化ストレスを亢進する(⑧)。これらの組み合せは、酸化ストレスを高め、ATP産生を低下させて、がん細胞の増殖を抑制し、細胞死を誘導する(⑨)。2-DGとDCAはメトホルミンによる乳酸アシドーシスを防ぐので、副作用も少なくなり、抗腫瘍活性を高めることができる。
【ジクロロ酢酸ナトリウムとメトホルミンの相乗効果】
メトホルミンはミトコンドリアの呼吸酵素複合体1(電子伝達複合体1)を阻害してATPの産生を減らし、そのためにAMP:ATP比が上昇するためにAMPKが活性化されます。つまり、メトホルミンはミトコンドリア毒であり、この毒を適量使うと血糖を低下させることができるというメカニズムです。
さて、その作用機序から、ミトコンドリアの呼吸酵素複合体をメトホルミンで阻害した状態でジクロロ酢酸でがん細胞のミトコンドリアの代謝を亢進すれば、がん細胞に比較的特異的に酸化ストレスを高めることができます。
実際に、ジクロロ酢酸とメトホルミンの相乗効果が報告されています。次のような論文があります。
Dichloroacetate and metformin synergistically suppress the growth of ovarian cancer cells.(ジクロロ酢酸とメトホルミンは卵巣がん細胞の増殖を相乗的に抑制する)Oncotarget. 2016 Sep 13;7(37):59458-59470.
【要旨】
ジクロロ酢酸とメトホルミンはいずれも、がん細胞の代謝を制御することによって有望な抗腫瘍効果を示している。しかしながら、ジクロロ酢酸は細胞保護的なオートファジーを誘導し、メトホルミンは乳酸蓄積を引き起こす作用によって、その抗がん作用の可能性を制限している。
したがって、それぞれの欠点を克服することによって、それぞれの治療効果を高めることができる。
本研究では、ジクロロ酢酸とメトホルミンが、卵巣がん細胞の増殖抑制とアポトーシス誘導において相乗的に効果を増強することを明らかにした。
興味深いことに、ジクロロ酢酸によって誘導されるMcl-1タンパクと細胞保護的オートファジーをメトホルミンは劇的に減弱し、メトホルミンによって引き起こされる過剰な乳酸蓄積とグルコース消費をジクロロ酢酸が著しく減弱した。
ヌードマウスを使った移植腫瘍の実験では、ジクロロ酢酸とメトホルミンは異種移植卵巣腫瘍の増殖を相乗的に抑制した。これらの結果は、ジクロロ酢酸とメトホルミンの併用は、卵巣がんの治療のための新しい戦略を開発する道を開くかもしれない。
体内で産生された乳酸は肝臓で糖新生に使われます。これをコリ回路と言います。メトホルミンは肝臓における糖新生を阻害するので、体内で乳酸蓄積を引き起こして乳酸アシドーシスの副作用が起こすリスクがあります。
がん組織では乳酸産生が亢進していますので、メトホルミンだけでは乳酸アシドーシスを引き起こすリスクを高めます。
ジクロロ酢酸は乳酸アシドーシスの治療に使われています。ミトコンドリアでの代謝を活性化して乳酸産生を抑えるためです。
したがって、がん治療の目的でメトホルミンを使用するとき、ジクロロ酢酸の併用は、抗腫瘍効果増強と副作用軽減の目的で、合理的な組合せと言えます。
以上の最近の研究結果から、抗がん剤治療や放射線治療を行うときに、2-DG(2-デオキシ-D-グルコース)、ジクロロ酢酸ナトリウム、R体αリポ酸、ビタミンB1、メトホルミンを併用すると抗がん剤感受性を高め、抗腫瘍効果を増強できると言えます(トップの図)。
| « 582)健康寿命... | 584)がん細胞... » |



