がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
685)メトホルミンはがん患者の生存期間を延ばす
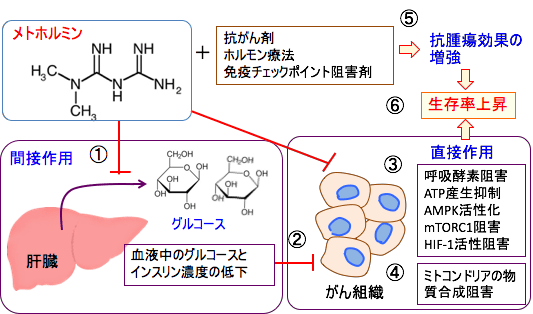
図:メトホルミンは直接的および間接的な多彩なメカニズムで抗腫瘍作用を示す。メトホルミンは肝臓における糖新生を阻害し(①)、血液中のグルコースとインスリンの量を低下し、がん細胞の増殖を抑制する(②)。さらにメトホルミンは、ミトコンドリアの呼吸酵素複合体Iの阻害によるATP産生抑制、AMP活性化プロテインキナーゼ(AMPK)活性化、mTORシグナル伝達系の抑制、低酸素誘導因子-1(HIF-1)活性の抑制など複数のメカニズムで直接的な抗腫瘍効果を示す(③)。さらに、がん細胞のミトコンドリアでのグルコースとグルタミンの利用を阻害し、物質合成を阻害する効果も報告されている(④)。抗がん剤やホルモン療法や免疫チェックポイント阻害剤などと併用してこれらの治療による抗腫瘍効果を増強することが報告されている(⑤)。これらの総合作用によってがん患者のメトホルミン服用は生存率を高める効果が期待できる(⑥)。
685)メトホルミンはがん患者の生存期間を延ばす
【糖尿病はがんの発生を増やし、がん患者の予後を悪くする】
糖尿病ががんの発生を増やすことは多くの研究で明らかになっています。
日本では、糖尿病は1960年代までは稀でしたが、最近では5人に一人が糖尿病あるいは糖尿病予備軍と言われるくらい増えています。
厚生労働省の平成28年(2016年)「国民健康・栄養調査」によると、20歳以上の人口(約1億500万人)のうち、「糖尿病が強く疑われる者」の割合は、12.1%(男性16.3%、女性9.3%) で、「糖尿病の可能性を否定できない者」の割合は12.1%(男性12.2%、女性12.1%)となっています。
つまり、「糖尿病が強く疑われる者」と「糖尿病の可能性を否定できない者(糖尿病予備軍)」はそれぞれ1,000 万人以上で、「糖尿病あるいは糖尿病の可能性のある人」は2000万人を超えています。
糖尿病の増加はがんの発生を増やす重要な原因の一つと認識されています。
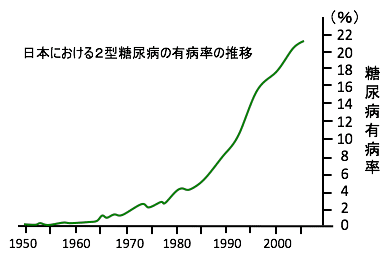
図:(左)日本における2型糖尿病の有病率(糖尿病+糖尿病予備軍)の年次推移を示す。1960年代まで糖尿病は極めて稀な疾患であったが、現在では人口の20%を超えている。
糖尿病ががんの発生を増やすことは多くの研究で確認されています。日本で行なわれた大規模調査では、糖尿病と診断されたことのある人はない人に比べ、20~30パーセントほどがんの発生率が高くなることが報告されています。
多数の研究をメタアナリシスした報告によると,糖尿病は非ホジキンリンパ腫,膀胱がん,乳がん,大腸がん,子宮内膜がん,肝がん,膵がんなどの発症リスクを高めることが示されています。
糖尿病の存在ががん患者さんの予後(生存率)を悪くすることは多くのがん種で明らかになっています。例えば以下のような報告があります。
Fasting plasma glucose is an independent predictor of survival in patients with locally advanced non-small cell lung cancer treated with concurrent chemoradiotherapy.(空腹時血糖は、同時化学放射線療法で治療された局所進行非小細胞肺がん患者の生存の独立した予測因子である)BMC Cancer. 2019 Feb 21;19(1):165.
【要旨の抜粋】
背景:糖尿病は複数のがん種においてがん死亡率の増加と関連していることが示されている。同時化学放射線療法で治療された局所進行非小細胞肺がん患者における空腹時血糖および糖尿病と肺がんの予後との関連を検討した。
方法:III期非小細胞肺がんの患者170人は、2010年から2014年の期間に同時化学放射線療法を受けた。56人の患者(33%)は、試験開始時に2型糖尿病の基準を満たしていた。 空腹時血糖およびその他の臨床的変数と予後との関連が評価された。
結果:追跡期間の中央値は36カ月で、空腹時血糖が7 mmol/L(126mg/dl)以上の患者では、無増悪生存期間の中央値は8.0ヶ月で、全生存期間の中央値は15.0ヶ月であった。
これに比較して、空腹時血糖が7 mmol/L(126mg/dl)未満の患者では、無増悪生存期間の中央値は20ヶ月 (HR 1.13; 95% CI 1.07-1.19, p < 0.001)で、全生存期間の中央値は31ヶ月 (HR 1.09; 95% CI 1.04-1.15; p < 0.001)であった。(HRはハザード比、95%CIは95%信頼区間)
プラチナ化合物の使用と併存疾患の存在によって調整されたコホート全体の多変量解析では、高空腹時血糖(HR 1.14; 95%CI 1.07-1.21; p <0.001)、併存疾患の存在(HR 1.72; 95%CI 1.12-2.63; p = 0.012)、およびカルボプラチンでの治療(HR 1.95; 95%CI 1.26-2.99; p = 0.002)は、全生存期間を短くする独立した予測因子であった。
非糖尿病患者を対照群として考慮した追加の多変量モデルでは、HbA1cが8.5%以上のコントロール不十分な糖尿病患者(HR 4.53; 95%CI 2.21-9.30; p <0.001)およびインスリン投与者(HR 3.22; 95 %CI 1.90-5.46 p <0.001)は、有意に独立した全生存期間の悪化を示した。
結論:空腹時血糖レベルは、同時化学放射線療法で治療された局所進行非小細胞肺がん患者のコホートにおける独立した生存予測因子である。
肺がんの治療において、高血糖や糖尿病の存在、インスリン使用は予後を悪くするという結果です。カルボプラチンの化学療法も予後を悪くしているという結果です。
糖尿病の存在は、がんの進行が早く転移しやすいことが指摘されています。高血糖や高インスリン血症ががん細胞の増殖を促進するからです。さらに、高血糖や高インスリン血症はがん細胞の抗がん剤感受性を低下させ、治療に対する抵抗性を高めます。
このように、糖尿病は様々なメカニズムでがんの発生や進展を促進し、抗がん剤が効きにくくするので、糖尿病の存在自体ががん患者の予後を悪くしていると言えます。
【メトホルミンは糖尿病患者のがん発生率を低下させる】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
ビグアナイド剤は、中東原産のマメ科のガレガ(Galega officinalis)から1920年代に見つかったグアニジン誘導体から開発された薬です。ガレガは古くから糖尿病と思われる病気(口渇や多尿)の治療に経験的に使われ有効性が認められており、その関係でこのガレガから血糖降下作用のあるビグアナイドが発見されました。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体Iを阻害することが明らかになっています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。
この呼吸酵素複合体Iの阻害とAMPKの活性化は抗がん作用を発揮します。AMPKの活性化は細胞増殖を促進するmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を抑制します。(下図)

図:AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っている。AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化される(①)。AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する(②)。γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる(③)。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される(④)。 LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化する(⑤)。リン酸化されたAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制する(⑥)。活性化AMPKはインスリン感受性亢進、筋肉・脂肪組織のグルコースの取込み亢進、肝臓の糖新生抑制によって血糖を低下させる(⑦)。さらに、脂肪酸合成を阻害し、脂肪酸の酸化を亢進する(⑧)。メトホルミンは、ミトコンドリアの呼吸酵素複合体Iを阻害し、ミトコンドリアでのATP産生を減少し、AMP:ATPの比を高める効果とLKB1の活性化によってAMPKを活性化する(⑨)。
メトホルミンの血糖降下作用は1960年代から知られていますが、臨床レベルでメトホルミンのがん予防効果や抗がん作用が注目されてきたのは2005年ころからです。
人間でのがん予防効果が最初に指摘されたのは2005年の論文で、2型糖尿病患者でメトホルミンを服用しているグループは全てのがんの発生率が低下することが後向きケース・コントロール研究で報告されています(Metformin and reduced risk of cancer in diabetic patients. BMJ. 2005 Jun 4;330(7503):1304-5.)。
2009年に、メトホルミンが糖尿病患者の膵がんリスクを低下させることを示す結果が、米テキサス大学M. D.アンダーソンがんセンターの研究グループから報告されています。(Antidiabetic therapies affect risk of pancreatic cancer. Gastroenterology. 2009 Aug;137(2):482-8.)
この研究では、糖尿病の患者でメトホルミンを服用していた場合、メトホルミンを服用しなかった人々と比べて、膵がんのリスクが 62 %低減することが示されています。一方、インスリンまたはインスリン分泌促進薬を使用した糖尿病患者では、それらを使用しなかった患者と比較して、それぞれ、膵がんのリスクが 4.99 倍と 2.52 倍に増加しました。
その後、膵臓がん以外にも、肺がんや大腸がんや乳がんなど多くのがんの予防や治療にメトホルミンが有効であることが多くの研究で明らかになっています。
台湾で実施された80万人を対象にした前向きコホート研究では、2型糖尿病があって血糖降下剤を服用していないグループでは、大腸がん・肝臓がん・胃がん・膵臓がんの発生率が約2倍に高く、メトホルミンの服用によって非糖尿病グループのレベルに低下することが報告されています。
この論文では、1日500mgのメトホルミンががん(特に、胃がん、結腸直腸がん、肝臓がん、膵臓がん)の発生率を有意に低下させるという結論が記述されています。(Type 2 diabetes increases and metformin reduces total, colorectal, liver and pancreatic cancer incidences in Taiwanese: a representative population prospective cohort study of 800,000 individuals. BMC Cancer. 2011 Jan 18;11:20.)
2型糖尿病患者における肺がんリスクをメトホルミンが低下させることが報告されています。
Metformin and lung cancer risk in patients with type 2 diabetes mellitus.(2型糖尿病患者におけるメトホルミンと肺がんリスク)Oncotarget. 2017 Jun 20;8(25):41132-41142.
この研究は台湾の国民健康保険の償還データベース(いわゆる台湾医療ビッグデータ)を解析して、2型糖尿病患者におけるメトホルミン使用と肺がん発症率の関連を検討しています。1999年から2005年の間に新規に診断された2型糖尿病患者で、メトホルミン非使用の15414人とメトホルミン使用の280159人の中から、条件を一致させた1:1ペア(各群15414人づつ)を選び出して、2011年12月31日まで追跡して比較しています。
解析の結果、1年間に10万人当たり(100000 person-years)の肺がん発症率は、全ての2型糖尿病患者を対照にした場合が、メトホルミン使用群が173.36、メトホルミン非使用群が292.65でした。
1:1でマッチさせた比較では、1年間に10万人当たりの肺がん発症率は、メトホルミン使用群が211.71で、メトホルミン非使用群が292.65でした。
メトホルミン使用による肺がん発症のハザード比は、元のサンプルでは0.586 (95%信頼区間:0.509-0.674)、一致したペアのサンプルでは0.717(95%信頼区間:0.584-0.881)でした。
つまり、2型糖尿病でメトホルミンによる治療を受けていると肺がんの発症リスクが全体で60〜70%程度に低下するという結果です。
さらに、メトホルミンの服用期間で比較しています。
メトホルミン使用の累積期間が22.60ヶ月以下、22.60〜46.67ヶ月、46.67ヶ月以上で比較した場合のハザード比は、元のサンプルでは1.163、 0.612 0.176でした。
1:1マッチのサンプルでは、それぞれのハザード比は、1.465、0.758 、0.228 でした。
つまり、メトホルミンの服用期間が長いほど、肺がん発症にリスクが低下し、4年以上服用していると肺がんの発症リスクが2割くらいに低下するという結果です。2型糖尿病患者はメトホルミンの服用が肺がん予防に有効という結果です。
メタ解析の研究では、全ての種類のがんを対象にして、メトホルミンの使用はがんの発生率を31%減少させ、がんによる死亡を34%減少させるという結果が報告されています。(Metformin and cancer risk and mortality: a systemic review and meta-analysis taking into account biases and confounders. Cancer Prev Res. 7: 867-885, 2014)
【糖尿病のがん患者はメトホルミン服用で生存率が向上する】
メトホルミンが糖尿病患者のがんの発生を抑制するだけでなく、糖尿病のがん患者の生存率を高める効果も多くのがんで確認されています。例えば、以下のような報告があります。
Metformin therapy associated with survival benefit in lung cancer patients with diabetes.(糖尿病を有する肺がん患者における生存利益に関連するメトホルミン治療)Oncotarget. 2016 Jun 7;7(23):35437-45.
この論文では、糖尿病の肺がん患者の生存とメトホルミンの使用と関連を検討した研究(全部で17件の臨床試験を報告した10編の論文)のメタ解析を行い、メトホルミン使用は糖尿病を有する肺がん患者のより良い生存率と有意な関連を報告しています。
メトホルミン使用による無病生存期間のハザード比は0.65(95%信頼区間:0.52-0.83)、全生存期間のハザード比は0.78 (95%信頼区間:0.64-0.93)でした。つまり、メトホルミンの使用が、糖尿病を有する肺がん患者の生存率を高めることを示しています。
以下のような報告もあります。
Effect of hypoglycemic agents on survival outcomes of lung cancer patients with diabetes mellitus: A meta-analysis.(糖尿病の肺がん患者の生存転帰に対する血糖降下剤の影響:メタ解析)Medicine (Baltimore). 2018 Mar;97(9):e0035.
この論文では、糖尿病を持つ肺がん患者の予後と血糖降下剤使用の関連を検討する目的で2017年5月までの文献を検索し、基準を満たす18件の臨床試験の結果を統計的に解析しています。
メタ解析の結果、メトホルミン使用者における全生存期間に対するハザード比は0.77(95%信頼区間:0.68-0.86)、無病生存期間に対するハザード比は0.50(95%信頼区間:0.39-0.64)でした。
この論文の結論は「このメタ解析の結果は、メトホルミン使用が糖尿病の肺がん患者の転帰を改善する可能性があることを実証した。」となっています。
他のがん種でもメトホルミン服用が糖尿病のがん患者の生存期間を延長することが多く報告されています。大腸がんに関しては以下のような報告があります。
Prognostic role of metformin intake in diabetic patients with colorectal cancer: An updated qualitative evidence of cohort studies.(結腸直腸がんの糖尿病患者におけるメトホルミン摂取の予後的役割:コホート研究の最新の定性的証拠)Oncotarget. 2017 Apr 18;8(16):26448-26459.
この論文では、メトホルミンと大腸がん死亡率との関連性を分析するために、2016年7月までの関連データベースを検索し、メタ解析の結果を報告しています。
269,417人の患者を登録している17件の研究が対象になりました。
糖尿病の結腸直腸がん患者における非メトホルミン使用者と比較すると、メトホルミン使用者における全生存期間のハザード比は0.69(95%信頼区間:0.61-0.77)でした。
ステージIIおよびIIIの疾患を有する患者において、有意な全生存期間の利益が認められました。
メトホルミン摂取は患者のがん特異的生存と有意に関連していました(ハザード比=0.75、95%信頼区間:0.59-0.94)が、無病生存期間とは関連していませんでした(ハザード比=0.38、95%信頼区間:0.13-1.17)。
この結果は、メトホルミン使用が、糖尿病を有する結腸直腸がん患者における全生存期間およびがん特異的生存を良くすることを示しており、特にステージIIおよびステージIIIの患者の全生存期間を良くすることを示しています。
以下のような報告もあります。
Metformin Improves Overall Survival of Colorectal Cancer Patients with Diabetes: A Meta-Analysis.(メトホルミンは糖尿病をもつ結腸直腸がん患者の生存を良くする)J Diabetes Res. 2017;2017:5063239.
【要旨の抜粋】
糖尿病患者は、非糖尿病患者よりも結腸直腸がんの発生率および死亡率が高い。大腸がん予後におけるメトホルミンの効果に関してはまだ議論が続いている。メトホルミンが糖尿病を有する結腸直腸がん患者の生存率を改善するかどうかを調査する目的で、2016年7月1日までに報告された7件のコホート研究のメタ解析を行なった。
糖尿病を伴う結腸直腸がん患者の中で、メトホルミン使用者は非使用者よりも全生存期間の改善が認められた(ハザード比=0.75; 95% 信頼区間: 0.65 〜 0.87)。しかしながら、メトホルミンは、がん特異的生存のための利益は示さなかった(ハザード比=0.79、95%信頼区間: 0.58〜1.08)。
結論:メトホルミンは糖尿病の結腸直腸がん患者の全生存期間を延長させるが、結腸直腸がん特異的生存率には影響しない。メトホルミンは、臨床現場で糖尿病の結腸直腸がん患者を治療するのに良い選択かもしれない。
予後不良の膵臓がんでもメトホルミンを服用するメリットはありそうです。
Metformin is associated with survival benefit in pancreatic cancer patients with diabetes: a systematic review and meta-analysis.(メトホルミンは糖尿病を有する膵臓がん患者における延命効果と関連する:系統的レビューとメタアナリシス)Oncotarget. 2017 Apr 11;8(15):25242-25250.
【要旨の抜粋】
メトホルミンは膵臓がんの発症リスクを低下させることが観察されているが、2型糖尿病の膵臓がん患者の生存にも影響を与えることができるかどうかは明らかではない。2型糖尿病を有する膵臓がん患者の生存に対するメトホルミンの効果を評価するために、2016年07月8日までのデータを検索し、系統的レビューおよびメタ解析を実施した。
全生存期間において、メトホルミンを使用しない治療法と比較してメトホルミンを使用する治療は相対的生存利益があることを見出した(ハザード比=0.84; 95%信頼区間:0.73 - 0.96)。
我々の結果は、メトホルミンが膵臓がんの2型糖尿病患者において最適な抗糖尿病薬であるかもしれないという考えを支持している。
メトホルミン使用とがん患者の生存率との関係については多くの臨床試験が行なわれ、メタ解析の報告も多くあります。まだ、相反する結果が報告されているのが現状で、大規模な前向き臨床試験の結果がでるまでは結論は出せませんが、メタ解析の結果では、糖尿病患者ががんになった場合は、メトホルミンの使用は生存期間を延長する可能性は高いと言えます。
【メトホルミンは糖尿病でないがん患者の治療成績を良くする】
糖尿病でないがん患者に1日1500~2000mgを投与して、標準治療の効果を高める作用が報告されています。
メトホルミンががん細胞やがん幹細胞の抗がん剤感受性を高める作用、転移を抑制する作用などが数多く報告されています。
抗がん剤や放射線治療中にメトホルミンを同時に服用すると腫瘍縮小効果が高まることが肺がんや乳がんや食道がんや大腸がんなど多くのがんで確認されています。
抗がん剤治療や免疫療法との併用でメトホルミンの有効性を検証する臨床試験が数多く行なわれています。以下の論文は非小細胞性肺がんの抗がん剤治療とメトホルミンの併用の臨床試験です。
A Randomized Phase II Study of Metformin plus Paclitaxel/Carboplatin/Bevacizumab in Patients with Chemotherapy-Naïve Advanced or Metastatic Nonsquamous Non-Small Cell Lung Cancer.(化学療法を受けたことが無い進行性または転移性の非扁平上皮性の非小細胞肺がん患者におけるメトホルミン+パクリタキセル/カルボプラチン/ベバシズマブの無作為化第II相試験。)Oncologist. 2018 Jul;23(7):859-865.
【要旨の抜粋】
この非盲検単一施設の第2相試験(NCT01578551)では、化学療法を受けたことの無い進行性または転移のある扁平上皮がん以外の非小細胞性肺がん患者を登録し、カルボプラチン+パクリタキセル+ベバシズマブによる抗がん剤治療を4〜6サイクル行なったあと、ベバシズマブ単独での維持療法を行なった。この治療において、A群はメトホルミンを併用し、B群はメトホルミンを併用しなかった。
2012年8月から2015年4月までに合計25人の患者が登録され、そのうちの24人が少なくとも1サイクルの治療投与を受けた。この研究は、進行した非小細胞性肺がんの標準的な第一選択療法の変化のために、早期に中止された。
A群(n = 18)の1年間の無増悪生存は47%(95%信頼区間:25%〜88%)であり、これは過去に報告されている15%を超過した。 A群で治療された患者の全生存期間の中央値は15.9ヶ月でメトホルミン非併用のB群では13.9ヵ月であった。
結論:この研究は、進行した非小細胞性肺がんの治療において、メトホルミンの併用は無増悪生存において有意な利益をもたらすことを示す最初の研究であり、進行した非小細胞性肺がんにおけるメトホルミンの有効性を示唆している。
これは、単一施設で実施された第2相臨床試験です。24例の非小細胞性肺がんを対象にしてコントロール群が6例、メトホルミン併用群が18例という小規模な臨床試験です。
ただ、この臨床試験を実施したのががん研究では超一流のジョンズ・ホプキンス大学のSidney Kimmel Comprehensive Cancer Center のDepartment of Medical Oncologyなので、その結果には信頼性とインパクトはあると思います。
ステージIIIBまたはIVの扁平上皮がん以外の非小細胞性肺がんを対象に、当初の計画では、60人の患者を登録し、対照群(抗がん剤治療のみ)15人とメトホルミン併用群45人の1:3にランダムに群分けするランダム化比較試験を実施する予定でした。
それが24人(メトホルミン併用群が18人、コントロール群が6人)になったのは、この病院では転移のある非小細胞性肺がんの一次治療にpemetrexed(商品名:アリムタ)が使用されるようになったためです。
この臨床試験が開始された時はカルボプラチン+パクリタキセル+ベバシズマブが標準治療であったのが、pemetrexedの優位性が報告されてpemetrexedが標準治療に置き換わったので、当初の抗がん剤治療で臨床試験を行なうことが困難になったため、早期に中止になっています。
試験期間の途中の解析で、対照群と試験群で有効性や毒性で明らかな差が出れば、成績の悪い治療群に割り当てられた患者は不利益を受けるので、倫理的に試験の継続はできなくなります。
このような理由でこの臨床試験は早期に中止になっていますが、試験が終了するまでの結果を解析すると、統計的有意にメトホルミンが抗がん剤治療の効き目を高めるという結果が得られたという報告です。
今までに抗がん剤治療を受けたことのない、進行あるいは転移のあるステージIIIBまたはIVの非小細胞性肺がん患者(扁平上皮がんは除外)を対象にしています。主要エンドポイントは1年間の無増悪生存の比率です。
メトホルミンは1回1000mgを1日2回服用(1日2000mg)しています。
同様のがん患者を対象にした同じ治療法の過去の臨床試験のECOG 4599 studyでは、1年間の無増悪生存は15%という結果が出ています。(Paclitaxel‐carboplatin alone or with bevacizumab for non‐small‐cell lung cancer. N Engl J Med 2006;355:2542–2550.)
この臨床試験では、メトホルミンの併用群の1年間の無増悪生存が47%で95%信頼区間が25%–88%で、95%信頼区間の下限が25%ですので、過去のECOG 4599 studyの15%を超えているので、メトホルミン併用の有効性が示されたという結論になっています。
無増悪生存期間の中央値は、コントロール群が6.7ヶ月(95% CI: 4.4〜not applicable)、メトホルミン併用群が9.6ヶ月(95% CI: 7.3–not applicable)でlog-rank testのp値が0.024で統計的有意差ありという結果です。
サンプルサイズが計画当初の40%しか無かったのですが、それでも無増悪生存期間では統計的有意差がでたということです。
治療期間の中央値は対照群が16.6週(1.6〜36週)、メトホルミン併用群が29.8週(0.7〜76週)でした。
奏功率は対象群が33%(95% CI: 6%–76%)、メトホルミン併用群が56%(95% CI: 31%–78%)、過去の臨床試験(ECOG 4599 study)では35%でした。
1年間の全生存率は、過去の試験の結果が51%に対して、今回のメトホルミン併用群では68% (95% CI: 48%–92%)でした。
全生存期間の中央値はコントロール群が13.9ヶ月(95% CI: 12.7–NA)でメトホルミン併用群が15.9ヶ月 (95% CI: 8.4–NA)で、統計的有意差は認められませんでした。(p = .186)
ただし、統計的有意差が出なかったのはサンプル数が少ないためと考察しています。

図:パクリタキセル/カルボプラチン/ベバシズマブの抗がん剤治療のみの群と、この抗がん剤治療にメトホルミン(2000mg/日)を併用した群の無増悪生存期間(左)と全生存期間(右)のカプラン・マイヤー曲線。 全生存期間では統計的有意差は出なかった(p = 0.186)が、無増悪生存期間では統計的に有意であった(p = 0.024)。
前述のように、糖尿病の肺がん患者でメトホルミンを服用している群は生存期間が有意に延長することが報告されています。
この報告は、糖尿病でない肺がん患者の場合も、メトホルミンが通常の抗がん剤治療の効果を高めることを示した最初の前向き臨床試験の報告です。
この臨床試験では、メトホルミンは1日に2000mgを使用しています。別の報告では1日500mgで臨床試験を行い、メトホルミンの有効性は認められていません。つまり、500mgでは少ないという考察です。
日本人の体格から、1日1000〜1500mg(可能であれば1日2000mg)を試してみる価値はありそうです。
私自身は糖尿病はありませんが、がん予防と寿命延長の目的で1日に500mg〜1000mg程度を服用しています。
大腸がんの抗がん剤治療の効き目を高める効果が報告されています。
以下のような報告があります。
Metformin: A Potential Therapeutic Agent for Recurrent Colon Cancer(メトホルミン:再発性大腸がんに対する潜在的な治療薬)PLoS One. 2014; 9(1): e84369.
【要旨の抜粋】
ビグアナイド系の糖尿病治療薬のメトホルミンが抗がん作用を有することを示すエビデンスが集まっている。しかし、メトホルミンの抗がん作用に関する研究の多くは原発がんを対象にしたものである。
メトホルミンが再発がんに対しても有効な抗腫瘍効果を示すかどうかを検討した報告はまだ無い。特に、50%以上の患者が標準的な抗がん剤治療を受けている結腸直腸がんの再発に対する効果を知ることは有用である。
この研究では、抗がん剤抵抗性のがん幹細胞に対する5−フルオロウラシル(5-FU)とオキサリプラチンの併用治療にさらにメトホルミンを追加した場合の有効性について検討した。
実験結果は、メトホルミンが 5-FUとオキサリプラチンの抗腫瘍効果に相乗的に作用して、抗がん剤抵抗性の大腸がん細胞株(HT-29とHCT-116)に細胞死を誘導し、がん幹細胞の増殖による細胞塊の形成を阻害した。
培養細胞を使用した実験では、5-FUとオキサリプラチンとメトホルミンの併用は抗がん剤抵抗性の大腸がん細胞の移動を阻害した。
この変化はマイクロRNA 145(miRNA 145)の増加とマイクロRNA 21(miRNA21)の増加と関連していた。また、大腸がんの増殖を促進するWnt/βカテニン・シグナル伝達系は抑制されていた。
抗がん剤抵抗性の大腸がん細胞(HCT-116とHT-29)を免疫不全マウスに移植した移植腫瘍の動物実験モデルでの検討では、5-FUとオキサリプラチンにメトホルミンを併用することによって移植腫瘍の増殖速度を顕著に抑制できた。
我々の実験結果は、再発した抗がん剤抵抗性の大腸がんに対して、標準的な抗がん剤治療にメトホルミンを併用することが有効であることを示唆している。
乳がんのホルモン療法でもメトホルミンの有効性が報告されています。
Metformin enhances tamoxifen-mediated tumor growth inhibition in ER-positive breast carcinoma(エストロゲン受容体陽性の乳がん細胞に対するタモキシフェンの増殖抑制作用をメトホルミンは増強する)BMC Cancer. 2014; 14: 172.
【要旨】
背景:乳がんのホルモン療法で使用されるタモキシフェンはエストロゲンとエストロゲン受容体(ER)の結合を阻害して増殖抑制効果を発揮する。しかしながら、ER陽性乳がんの多くの患者はタモキシフェンによる抗腫瘍効果が弱かったり、あまり効果が出ない場合もある。メトホルミンは糖尿病治療薬として広く使用され、抗がん作用があることが報告されている。この研究では、ER陽性の乳がんのタモキシフェン治療にメトホルミンを併用することによって抗腫瘍効果の増強作用があるかどうかを検討した。
方法:ER陽性乳がん細胞に対するメトホルミン単独およびメトホルミンとタモキシフェンの併用の場合の作用を、細胞生存、DNA合成活性、コロニー形成能、フローサイトメトリー、免疫染色、ヌードマウスへの移植腫瘍を使った実験モデルで検討した。
結果:タモキシフェンとメトホルミンを併用すると、乳がん細胞の増殖抑制に必要なタモキシフェン濃度は著明に減少した。さらに、タモキシフェンによる乳がん細胞の増殖、DNA合成活性、コロニー形成能、軟寒天コロニー形成能の阻害作用をメトホルミンは増強し、タモキシフェンによるアポトーシス誘導作用を亢進した。この作用は、bax/bcl-2アポトーシス・シグナル伝達系とAMPK/mTOR/p70S6細胞増殖シグナル伝達系が関与していた。さらに、移植腫瘍を用いた動物実験で、タモキシフェンとメトホルミンの併用は腫瘍の成長を顕著に抑制した。
結論:メトホルミンとタモキシフェンの併用はER陽性乳がん細胞の増殖を相加的に阻害し、アポトーシス誘導を増強した。ER陽性乳がんの治療にメトホルミンとタモキシフェンの併用は抗腫瘍効果の増強が期待できるので、さらに臨床例での検討が必要である。
メトホルミンが膵臓がんのゲムシタビン治療の効果を高める作用が報告されています。
Inhibitory effect of metformin combined with gemcitabine on pancreatic cancer cells in vitro and in vivo.(in vitroとin vivoにおける膵臓がん細胞に対するメトホルミンとゲムシタビンの阻害作用)Mol Med Rep. 2016 Oct;14(4):2921-8.
この論文では、ヒト膵臓がん細胞株(CFPAC1)を用い、培養細胞(in vitro)と移植腫瘍(in vivo)の実験系で、メトホルミン単独とメトホルミン+ゲムシタビン併用の抗腫瘍効果を検討しています。
メトホルミンは単独投与で膵臓がん細胞の増殖を抑制しました。その機序として、メトホルミンは、アポトーシスを誘導するタンパク質(Bax,caspase-3)の発現を亢進し、アポトーシスに抵抗性にするタンパク質(Bcl-xL, surviving, cyclin D1)の発現を抑制しました。このメトホルミンの抗腫瘍効果はゲムシタビンと併用することによってさらに増強しました。
以下のような報告もあります。
Antidiabetic Drug Metformin Prevents Progression of Pancreatic Cancer by Targeting in Part Cancer Stem Cells and mTOR Signaling. (抗糖尿病薬のメトホルミンはがん幹細胞とmTORシグナルを介して膵臓がん細胞の進展を阻害する)Transl Oncol. Dec 2013; 6(6): 649–659.
【要旨】
多くの疫学データは糖尿病が膵臓がんの発生リスクを高めることを明らかにしている。そして近年のメタ解析によって、糖尿病治療薬のメトホルミンが膵臓がんの発生リスクを減らすことが明らかになっている。
膵臓がんを発生するように遺伝子改変したトランスジェニックマウスを用い、膵臓がん発生過程に対するメトホルミンの効果を検討した。
コントロール食を投与されたマウスの膵臓がん発生率はオスが80%でメスが62%であった。メトホルミンを1000ppmで投与すると膵臓がんの発生率はオスで20%、メスで7%であり、2000ppmのメトホルミン投与量の場合の膵臓がん発生率はオスで26%でメスで0%であった。
1000~2000ppmのメトホルミンの投与で発生した膵臓がんの重量はコントロール群の34~49%を示した。
メトホルミン投与は早期膵臓がん病変(上皮内がん)の発生を28〜39%抑制し、膵臓がん細胞の広がりを顕著に抑制した。
メトホルミンを投与されたマウスの膵臓組織および血清のmTOR(哺乳類ラパマイシン標的タンパク質)、ERK(extracellular signal-regulated kinases)、リン酸化されたErk(extracellular signal-regulated kinases)、インスリン様成長因子-1、などの低下を認めた。膵臓組織におけるがん幹細胞のマーカーの発現は顕著に低下していた。
以上の結果より、メトホルミンはがん幹細胞を減らし、mTORシグナル伝達系を抑制する作用があることが示唆された。この前臨床試験の結果は、膵臓がんの化学予防の臨床試験にメトホルミンを検証する価値があることを意味している
メトホルミンが卵巣がん患者の生存率を高めることも報告されています。
Metformin intake associates with better survival in ovarian cancer: A case control study(メトホルミン摂取は卵巣がんの生存率を高める:ケースコンロトール研究)Cancer. Feb 1, 2013; 119(3): 555–562.
この後ろ向きケースコントロール試験(症例対照試験)では、メトホルミンを服用している卵巣がん患者と、ステージや年齢などの条件を合わせたコントロール(メトホルミンを服用していない卵巣がん患者)を比較しています。
メトホルミンを服用していた卵巣がん患者72例と対照143例の予備試験の解析では、5年生存率はメトホルミン服用群が73%に対して対照群は44%で、統計的に有意な差を認めました(p=0.0002)。
メトホルミン服用群61例、(全ての条件を症例群に合わせた選択した)対照群178例の解析では、5年生存率はメトホルミン服用群で67%、対照群で47%であり、統計的に有意な差を認めました(p=0.007)。
この論文の結論は「メトホルミンの服用は卵巣がん患者の生存率を高める。したがって、卵巣がん患者における臨床試験を実施する価値がある。」となっています。
以上のように、まだ基礎研究の段階の報告が多いのですが、非糖尿病患者を対象にした臨床試験も行われており、がん幹細胞の抗がん剤感受性を高める作用などが報告されています。
非糖尿病患者でも、大腸がんや乳がんや膵臓がんや卵巣がんなど多くのがんの治療にメトホルミンを1日500~1500mg程度併用することは有用と考えられます。
【メトホルミンは上皮成長因子受容体チロシンキナーゼ阻害剤の効き目を高める】
上皮成長因子受容体(Epidermal Growth Factor Receptor; EGFR)は、細胞膜を貫通して存在する分子量170キロダルトンの糖蛋白質で、チロシンキナーゼ型受容体の一種です。細胞外(血液や体液中)にある成長因子(EGFやTGF-αなど)のシグナルを細胞内に伝える働きをします。
EGFRは621個のアミノ酸から構成される細胞外領域(リガンド結合ドメイン)、23アミノ酸の膜貫通領域、542アミノ酸の細胞内領域(チロシンキナーゼ・ドメイン)を持ちます。
細胞外領域に上皮成長因子(EGF)やTGF-αなどのリガンドが結合すると、受容体は細胞膜上を移動して、EGFR同士、あるいは他のErbBファミリー受容体と二量体を形成します。
二量体を形成すると、細胞内領域にあるチロシンキナーゼ部位はATP(アデノシン三リン酸)を利用して受容体の細胞内領域にあるチロシン残基を自己リン酸化します。チロシンのリン酸化が起こると、さらに細胞内のシグナル伝達系の蛋白質が次々に活性化され、増殖シグナルが核まで伝わり、増殖に関連する遺伝子の発現が起こります。その結果、細胞増殖、アポトーシス抑制、血管新生、浸潤・転移などが起こります。
細胞内で機能している多数のシグナル伝達経路の中で、がん細胞の増殖と生存で最も重要なのが、PI3K-Akt経路(生存シグナル経路)とERK-MAPK経路(増殖シグナル経路)です。
細胞膜の増殖因子受容体にリガンド(増殖因子)が結合し2量体化すると、PI3Kのリン酸化活性からAktのリン酸化を通して、アポトーシス(細胞死)の誘導を阻害します。(PI3K-Akt経路)
増殖因子による刺激は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路(MAPKカスケード)によりシグナルが伝達されます。活性化したERKは最終的に核へ移行し、転写因子が活性化され、細胞増殖関連の遺伝子が発現します。(ERK-MAPK 経路)
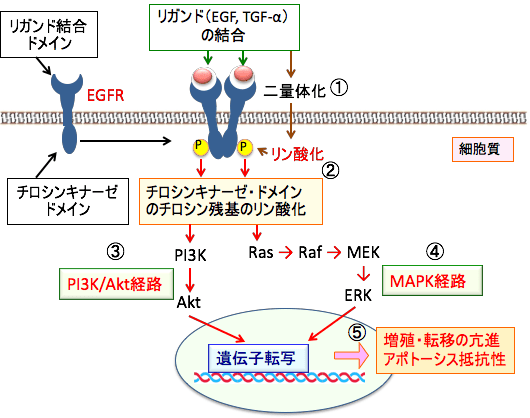
図:チロシンリン酸化型受容体の上皮成長因子受容体(EGFR)にリガンド(EGFやTGF-α)が結合し2量体化すると(①)、受容体が自己リン酸化されて活性化する(②)。受容体が活性化されるとPI3Kのリン酸化活性からAktがリン酸化されて活性化する(PI3K/Akt経路 ③)。一方、受容体の活性化は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路によりシグナルが伝達される(④)。PI3K/Akt経路とMAPK経路の活性化は、最終的に核の転写因子の活性化を介して、がん細胞の増殖や転移を亢進し、アポトーシスに抵抗性(死ににくくなる)の性質を持つようになる(⑤)。
EGFRは正常組織において細胞の分化や増殖の調節に重要な役割を演じていますが、このEGFRに遺伝子異常(増幅や変異や構造変化)や過剰発現が起きると、細胞のがん化や、増殖、浸潤、転移などに関与するようになります。実際に多くのがんでEGFRの遺伝子異常や過剰発現が認められています。
したがって、EGFRのチロシンキナーゼ活性を阻害する薬はがんの治療薬となります。そのような目的で開発され、現在使用されているEGFRチロシンキナーゼ阻害薬として、ゲフィチニブ(Gefitini:商品名イレッサ)とエルロチニブ(erlotinib:商品名タルセバ)とアファチニブ(Afatinib:商品名ジオトリフ)とオシメルチニブ(Osimertinib:商品名タグリッソ)があります。
EGFR(上皮成長因子受容体)遺伝子変異は進行非小細胞肺がんの3~4割に見つかりEGFR阻害薬が非常に高い効果を示しますが、1年程度で耐性を生じて再増悪してしまいます。この耐性のおよそ半数を占めるのがEGFR-T790M変異ですが、その耐性変異にも有効なEGFR阻害薬がオシメルチニブです。
EGFR-チロシンキナーゼ阻害剤治療にメトホルミンを併用すると、進行肺腺がん患者の無増悪生存期間(PFS)を有意に改善することが報告されています。以下のような論文が最近報告されています。
Effect of Metformin Plus Tyrosine Kinase Inhibitors Compared With Tyrosine Kinase Inhibitors Alone in Patients With Epidermal Growth Factor Receptor-Mutated Lung Adenocarcinoma: A Phase 2 Randomized Clinical Trial.(上皮成長因子受容体変異肺腺癌患者におけるチロシンキナーゼ阻害剤単独と比較したメトホルミンとチロシンキナーゼ阻害剤の効果:第2相無作為化臨床試験。)JAMA Oncol. 2019 Sep 5:e192553. doi: 10.1001/jamaoncol.2019.2553. [Epub ahead of print]
この報告はメキシコの国立がん研究所(Instituto Nacional de Cancerologia)で実施された非盲検無作為化第II相臨床試験です。進行肺腺がん患者をEGFR-チロシンキナーゼ阻害剤単独療法とメトホルミン+EGFR-チロシンキナーゼ阻害剤の併用療法を比較しています。
対象は、18歳以上のEGFR変異陽性Stage IIIB/IV肺腺がん患者で、メトホルミン(500mg 1日2回)+EGFRチロシンキナーゼ阻害剤(標準用量のエルロチニブ、アファチニブまたはゲフィチニブ)群またはEGFRチロシンキナーゼ阻害剤単独群に無作為に割り付け、忍容できない毒性発現または同意撤回まで投与しました。
2016年3月31日~2017年12月31日に、計139例(平均年齢59.4歳、女性65.5%)が、EGFRチロシンキナーゼ阻害剤群(n=70)またはメトホルミン+EGFRチロシンキナーゼ阻害剤群(n=69)に無作為に割り付けられた。
無増悪生存期間の中央値は、EGFRチロシンキナーゼ阻害剤単独群が9.9ヵ月(95% 信頼区間:7.5-12.2 ヶ月)に対し、メトホルミン+EGFRチロシンキナーゼ阻害剤併用群が13.1ヵ月(95%信頼区間:9.8〜16.3 ヶ月)とメトホルミン+EGFRチロシンキナーゼ阻害剤群で有意に延長しました(HR:0.60、95%CI:0.40~0.94、p=0.03)。
全生存期間中央値も、併用群で有意に延長しました(31.7ヵ月vs.17.5ヵ月、p=0.02)。
【メトホルミンは免疫チェックポイント阻害剤の効き目を高める】
メトホルミンがオプジーボなどの免疫チェックポイント阻害剤の効き目を高める効果が報告されています。以下のような報告があります。
Efficacy of metformin in combination with immune checkpoint inhibitors (anti-PD-1/anti-CTLA-4) in metastatic malignant melanoma.(転移のある悪性黒色腫における免疫チェックポイント阻害剤(抗PD-1抗体/抗CTLA-4抗体)との併用におけるメトホルミンの効果)J Immunother Cancer. 2018 Jul 2;6(1):64. doi: 10.1186/s40425-018-0375-1.
【要旨】
背景:メトホルミンは、II型糖尿病の患者に一般的に使用されるビグアナイドの1つである。 その血糖降下作用とは別に、メトホルミンはまた、LKB1 / AMPK経路に作用して、タンパク質合成および細胞増殖を抑制する。 さらに、腫瘍低酸素の減少によりPD-1阻害を増強する。 メトホルミンは、固形腫瘍における治療関連転帰に有意な好影響を示したが、これらの結果は、悪性黒色腫について行われた限られた臨床研究では再現されていない。 さらに、これらの研究のいずれも、メトホルミンと免疫チェックポイント阻害剤との併用の有効性に関する研究報告は無い。
方法:これは、2011年1月1日から2017年12月15日までに転移性悪性黒色腫と診断され、イピリムマブ(ipilimumab)、ニボルマブ(nivolumab)および/またはペンブロリズマブ(pembrolizumab)で治療された患者を含む後ろ向きコホート研究である。A群はこれらの免疫チョックポイント阻害剤のみで治療を受け、B群は免疫チェックポイント阻害剤にメトホルミンを併用した。主要エンドポイントは客観的反応率で、副次的エンドポイントは 疾患コントロール率、全生存期間および無増悪生存期間とした。
結果:A群は33人(60%)、B群は22人(40%)であった。 全患者の特徴は両コホート間で類似していた。 客観的反応率は、B群においてより高かった(68.2%対54.5%、P = 0.31)。 疾患コントロール率もB群の方が高かった(77.3%対60.6%、P = 0.19)。 B群では全生存期間中央値(46.7ヶ月対28ヶ月間)および無増悪生存期間中央値(19.8ヶ月対5ヶ月間)とも長かった。しかし、単変量および多変量解析では、これらの差異のいずれも統計的に有意ではなかった。 治療中に出現した新しい転移部位の平均数は、A群において有意に高かった(A:1.51対B:0.59、P = 0.009)。
結論:免疫チェックポイント阻害剤とメトホルミンの併用による治療は、免疫チェックポイント阻害剤単独の治療より良好な治療関連アウトカム(客観的反応率、疾患コントロール率、無増悪生存期間および全生存期間)が観察された。統計的有意差に達しなかったが、これはサンプルサイズが小さかったためと思われる。 したがって、免疫チャックポイント阻害剤とメトホルミンの併用が標準的な併用療法として推奨される前に、大きな前向き臨床試験が必要である。
以下のような報告もあります。
Metformin Promotes Antitumor Immunity via Endoplasmic-Reticulum-Associated Degradation of PD-L1.(メトホルミンはPD-L1の小胞体関連の分解を介して抗腫瘍免疫を増強する)Mol Cell. 2018 Aug 16;71(4):606-620.
【要旨】
メトホルミンは抗腫瘍活性を有し、さらに細胞傷害性Tリンパ球による免疫監視機構を増強することが報告されている。ただし、癌免疫におけるメトホルミンの役割の機能と詳細なメカニズムは完全には理解されていない。ここでは、メトホルミンがプログラム細胞死リガンド-1(programmed death ligand-1:PD-L1)の安定性と膜局在を減らすことによって細胞傷害性Tリンパ球活性を高めることを示す。
さらに、メトホルミンによって活性化されたAMP活性化プロテインキナーゼ(AMPK)が直接PD-L1のセリン195をリン酸化することを発見した。 セリン195のリン酸化は異常なPD-L1のグリコシル化を誘導し、その結果、小胞体での蓄積および小胞体関連タンパク質分解を誘導した。
この結果と一致するように、メトホルミン治療を受けた乳がん患者の腫瘍組織は、AMPK活性化を伴うPD-L1レベルの低下を示した。
メトホルミンによるPD-L1の阻害シグナルの遮断はがん細胞に対する細胞傷害性Tリンパ球活性を増強する。この実験結果は小胞体関連タンパク質分解を介するPD-L1発現の新しい調節メカニズムを明らかにし、メトホルミンと免疫チェックポイント阻害剤の組み合わせが免疫療法の有効性を高める可能性があることを示唆している。
メトホルミンはオプジーボやキイトルーダなどの免疫チェックポイント阻害剤の抗腫瘍効果を高める効果が期待できると言うことです。
以上、多くの研究で、糖尿病でないがん患者さんも、病状や治療の状況や体重や体調に応じて、メトホルミンを1日500から2000mgを服用することは生存率を高める上で有効だと言えます。
日本では、糖尿病の患者さんががんになった場合でも、インスリン注射やインスリン分泌を増やす薬での治療が継続されています。インスリンががん細胞の増殖を促進することは多くのエビデンスがあります。高血糖と高インスリン血症が重なるとがん細胞の増殖と転移が促進することはがん研究者の常識です。
つまり、糖尿病患者ががんになった場合は、糖質制限+メトホルミンによる治療でコントロールすべきだと思います。少なくとも、インスリンは糖尿病がん患者の予後を悪くします。
高脂質血症治療薬のスタチン(特に脂溶性のシンバスタチンやアトルバスタチン)ががん患者の生存率を高めることは前回(684話)解説しました。高脂質血症や糖尿病が無くても、がん患者さんが生存率を高める目的でスタチンとメトホルミンを併用して服用することは根拠があると思います。
新 刊 紹 介

| « 684)高脂血症... | 686)メトホル... » |



