がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
819)脂質ラフトをターゲットにしたがん治療(その2):ドコサヘキサエン酸(DHA)
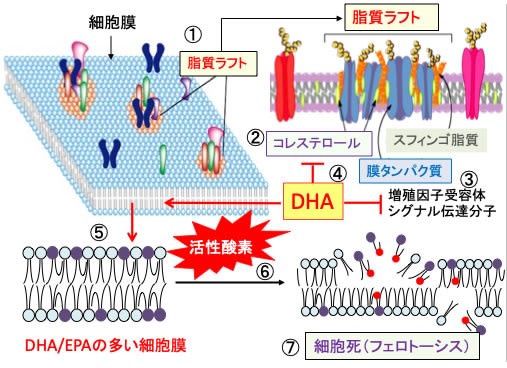
図:細胞膜の脂質分布は均質ではなく、一部の脂質は限局したドメイン(領域)を形成しており、脂質ラフトと呼ぶ(①)。脂質ラフトはコレステロールやスフィンゴ脂質が多く、流動性が低下し、シグナル伝達タンパク質のプラットフォームおよびハブとして機能する(②)。脂質ラフトにはシグナル伝達系のタンパク質が集合し、シグナル分子間の相互作用の場として働いている(③)。ドコサヘキサエン酸は脂質ラフトのコレステロールを減らし、脂質ラフトを減少してがん細胞の増殖シグナル伝達系の活性を低下させる(④)。ドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)は細胞膜に取り込まれる(⑤)。多価不飽和脂肪酸は酸化を受けやすいので、がん細胞内で鉄介在性に活性酸素の産生が高まると(⑥)、脂質の過酸化によって細胞は酸化傷害を受け、フェロトーシスの機序で死滅する(⑦)。(赤丸は活性酸素による脂質酸化を示す。多価不飽和脂肪酸は酸化を受けやすいことを示している。)
819)脂質ラフトをターゲットにしたがん治療(その2):ドコサヘキサエン酸(DHA)
【DHA/EPAは細胞膜の流動性を高める】
体を構成する個々の細胞は細胞膜で囲まれています。細胞膜は脂質二重層を土台にしてできており、この細胞膜によって細胞外と細胞内が分けられています。脂質二重層はリン脂質分子が膜状に並んで作られます。リン脂質分子は親水性のリン酸部分と、疎水性の2個の脂肪酸が尻尾のように繋がった構造をしています。
細胞の内外は主に水で満たされているので、リン脂質分子は親水性のリン酸部分(頭部)を外側に、水に反発する疎水性の脂肪酸部分(尾部)を内側にして2重の層を作って並びます(図)。

図:リン脂質は親水性のリン酸部分(頭部)と、疎水性の脂肪酸部分(尾部)から構成される。疎水性の尾部は水によってはじかれ、互いに引き付けられて内側に並び、親水性の頭部の領域が水に接する外側に露出して膜状の二重層を形成する。この脂質二重層が細胞膜の基本構造になる。
細胞膜は脂質二重層を土台にして、その中にタンパク質粒子が浮遊するように移動しています。脂質二重層に浮かぶタンパク質粒子は、受容体や物質を通すチャネルなどとして働きます。(図)

図:細胞膜は脂質の二重膜の海に、膜タンパク質が氷山のように頭を少し出して浮かんだような構造をしている。この構造モデルを流動モザイクモデル(fluid mosaic model)と呼んでいる。
脂肪は、それを構成している脂肪酸の構造の違いによって融点などの化学的性状が異なってきます。二重結合をもつ不飽和脂肪酸の多い脂肪は常温で液状になりますが、飽和脂肪酸になると固まりやすくなります。固まりやすい脂肪を多く摂取すると血液がドロドロになって動脈硬化が起こりやすくなります。
前述のように細胞膜は流動性を持ち、脂質や膜タンパク質は動いています。この流動性は膜の構成物質で決まります。特にリン脂質を構成する脂肪酸の不飽和度(二重結合の数)に影響されます。不飽和度が高まるほど脂肪酸の融点は低くなるためです。つまり、不飽和脂肪酸を多く含む細胞膜は流動性が高まります。
脂肪酸は、構造の違いにより「飽和脂肪酸」と「不飽和脂肪酸」の2種類に分類できます。パルミチン酸(炭素数16)やステアリン酸(炭素数18)のように炭素と炭素の間に二重結合が全くない脂肪酸を飽和脂肪酸といい、二重結合がある脂肪酸を不飽和脂肪酸といいます。
不飽和脂肪酸のうち炭素の二重結合が一つのものを「一価不飽和脂肪酸」、2つ以上あるものを「多価不飽和脂肪酸」といいます。一般に、脂肪酸は炭素の数が多くなるほど融点(固体から液体に変化する温度)が高くなります。また、同じ炭素数の脂肪酸を比較した場合、二重結合の数が多くなるほど融点が低くなります。(下表)

表:脂肪酸は炭素の数が多くなるほど融点(固体から液体に変化する温度)が高くなる。同じ炭素数の脂肪酸を比較した場合、二重結合の数が多くなるほど融点が低くなる。
原子は、他の原子と結合できる手を持ち、その数は原子毎に異なっています。炭素原子は、他の原子と結合できる手を4本持っています。炭素-炭素二重結合とは、2つの炭素原子どうしが互いに2本の手でつながっている状態のことをいい、「C=C」で表記します。
分子が接近すると分子間に引力のような力が働きます。この分子間引力をファンデルワールス力(van der Waals force)といいます。ファンデルワールス力は、分子間の距離が近づくほど強くなります。
飽和脂肪酸は炭素原子が直鎖状に並びます。まっすぐな棒状の構造なので、たくさんの分子が集まると、鉛筆を束ねた構造になります。したがって、ぎゅぎゅう詰めになるので、分子が動きにくくなり固体となります。ファンデルワールス力が強く働いて分子間の結合が強固になるためです。液体にするには熱を加え加えなければなりません。したがって、融点が高くなります。
不飽和脂肪酸は二重結合の部分でくの字に曲がった構造になります。分子が曲がっているため、分子を束ねると隙間の多い構造になり、分子間のファンデルワールス力は弱くなります。その結果、分子は動き回ることができ、融点が低下して液体になります。(図)
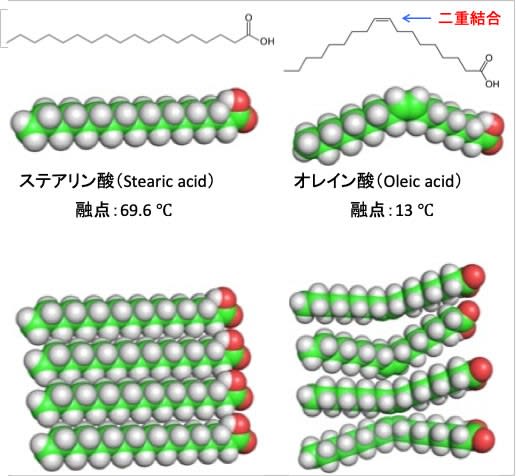
図:脂肪酸のステアリン酸とオレイン酸は、どちらも18個の炭素原子で構成される。ステアリン酸は炭素結合が全て飽和しているが、オレイン酸は不飽和脂肪酸であり、1つのシス二重結合を含んでいる。ファンデルワールス力による分子間の引力による結合はステアリン酸の方がオレイン酸よりはるかに強くなる。その結果、ステアリン酸の融点は69.9 ℃であり、オレイン酸の13℃の融点よりも高くなっている。不飽和脂肪酸が豊富な細胞膜は、飽和脂肪酸が豊富な膜よりも流動性が高くなる。
植物油や魚油が液体なのは不飽和脂肪酸が多いためです。細胞膜に不飽和脂肪酸が多く含まれるほど、流動性が高くなります。
体内の隅々の組織に酸素を運ぶ赤血球は、赤血球自身の直径よりも細い毛細血管を通過できます。赤血球の細胞膜が柔軟で、変形する能力をもっているためで、これを赤血球変形能といいます。赤血球の細胞膜の飽和脂肪酸の割合が大きくなると細胞膜の流動性が低下し、赤血球変形能が低下し、体の隅々まで酸素が行き渡らなくなります。食事からの不飽和脂肪酸の摂取が多いと、組織の血液循環が良くなります。
【脂質ラフトはシグナル分子間の相互作用のプラットフォームとして働いている】
細胞膜はリン脂質を基本成分とする油の膜(脂質二重層)から成り、そこに膜タンパク質が挿入されて出来ています。細胞膜は流動的で、膜タンパク質は生体膜上をダイナミックに移動しています。
細胞膜は均一な構造体ではなく、ところどころに分子の集合体を作っています。このように分子が集まった微小領域を膜マイクロドメイン、あるいは脂質ラフト(lipid raft)と言います。
ラフト(Raft)とは筏(いかだ)のことで、細胞膜中に特定の脂質(スフィンゴミエリンやコレステロールなど)とタンパク質(受容体など)が集合した領域(構造)が存在し、それが脂質ラフトです。(下図)
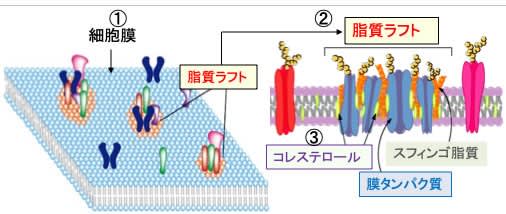
図:細胞膜(①)の脂質分布は均質ではなく、一部の脂質は限局したドメイン(領域)を形成している。これを流動膜に浮かぶ筏(いかだ)になぞらえて脂質ラフトと呼ぶ(②)。脂質ラフトの脂質およびタンパク質組成は周囲の細胞膜とは異なり、コレステロールやスフィンゴ脂質が多い(③)。脂質ラフトにはシグナル伝達系のタンパク質が集合し、シグナル分子間の相互作用のプラットフォームおよびハブとして機能している。
脂質ラフトはステロールとスフィンゴ脂質に富んだ10-200 nmサイズの小さく不均一で非常に動的なドメイン(領域)であり、細胞機能のコンパートメント化(区画化)を担っています。
脂質ラフトにおけるタンパク質の物理的分離は、シグナル伝達系における調節分子やエフェクター分子へのタンパク質の接近性を調節し、シグナル伝達タンパク質の選別プラットフォームおよびハブとして機能します。
【オメガ3多価不飽和脂肪酸のDHAとEPAは脂質ラフトの性状を変えて、抗腫瘍効果を発揮する】
食事は、細胞膜の変更に大きな影響を与える可能性があります。細胞膜自体はリン脂質で構成されているため、食物中の脂質が膜構造に影響を与える可能性があります。
哺乳類細胞は、ほとんどの脂肪酸を内因的に生成できますが、オメガ6(n-6) または オメガ3(n-3)脂肪酸を新たに生成するのに必要な酵素を欠いています。したがって、これらの脂質は食事から摂取する必要があり、不可欠であると考えられています。
がん細胞は細胞分裂をして数を増やし、増殖します。細胞数を増やすために、細胞膜に使う脂肪酸の合成が亢進しています。さらに、がん細胞は自分で作った脂肪酸以外に、食事から摂取して血液中に存在する脂肪酸を積極的に取り込んで、細胞膜の合成に使います。食事からのDHAやEPAの摂取を増やすと、がん細胞の細胞膜にDHAやEPAが多く取り込まれます。
がん細胞の細胞膜に取り込まれたDHAやEPAががん細胞の脂質ラフトの性状を変えることによって、がん細胞の増殖を抑制し、細胞死を誘導する可能性が指摘されています。
以下のような論文があります。
Chemical-physical changes in cell membrane microdomains of breast cancer cells after omega-3 PUFA incorporation.(オメガ3多価不飽和脂肪酸取り込み後の乳がん細胞の細胞膜マイクロドメインの化学的物理的変化)Cell Biochem Biophys. 2012 Sep;64(1):45-59.
【要旨の抜粋】
疫学的および実験的研究は、食事性脂肪酸が乳がんの発症と進行に影響を与えることを示唆している。しかし、オメガ3多価不飽和脂肪酸が乳がんの増殖を抑制するメカニズムは十分に解明されていない。オメガ3多価不飽和脂肪酸は、細胞膜、特に脂質ラフトの構造を変化させる可能性が示唆されている。
この研究では、乳がん細胞(MCF-7およびMDA-MB-231細胞)をアラキドン酸、エイコサペンタエン酸(EPA)、およびドコサヘキサエン酸(DHA)で処理して、これらの脂肪酸が脂質ラフトのリン脂質に組み込まれ、脂質ラフトの構造の化学的および物理的特性を変更できるかどうかを検討した。
私たちのデータは、多価不飽和脂肪酸とその代謝物が細胞膜マイクロドメイン(脂質ラフト)に異なる収率で挿入され、脂質ラフトの構造を特徴付ける飽和脂肪酸の合計パーセンテージを低下させることなく脂肪酸組成を変更できることを示している。
特に、コレステロールと飽和脂肪酸の含有量が最も高いMDA-MB-231細胞では、おそらく立体的な理由から、DHAの取り込みが最も少ないことが観察された。それにもかかわらず、DHAはコレステロールとスフィンゴミエリンの含有量を減らすことができた。
両方の細胞株について、DHA処理は脂質ラフトの約20-30%の減少をもたらした。
結論として、オメガ3多価不飽和脂肪酸は脂質ラフトの生化学的および生物物理学的特徴を変更することができ、おそらくアシル鎖の長さと不飽和結合に関連するさまざまなメカニズムを通じて乳がん細胞の増殖を抑制する。
EPAは主に脂質ラフトリン脂質のアラキドン酸濃度の低下を通じて細胞アポトーシスに寄与する可能性がある。一方DHAは、脂質ラフトの生物物理学的特性を変化させ、コレステロールの含有量とおそらく重要なタンパク質の分布を低下させる可能性がある。
n-3多価不飽和脂肪酸が細胞膜脂質マイクロドメイン組成を変更し、それによって表面受容体から下流のシグナル伝達ネットワークへの細胞外シグナルの中継を有利に調節することがますます明らかになりつつあります。以下のような報告もあります。
(n-3) PUFA alter raft lipid composition and decrease epidermal growth factor receptor levels in lipid rafts of human breast cancer cells.(n-3多価不飽和脂肪酸 はラフト脂質組成を変更し、ヒト乳がん細胞の脂質ラフトにおける上皮成長因子受容体レベルを低下させる) J Nutr. 2007 Mar;137(3):548-53.
【要旨】
n-3系多価不飽和脂肪酸のエイコサペンタエン酸 (EPA) およびドコサヘキサエン酸 (DHA) はMDA-MB-231 ヒト乳がん細胞の増殖を減少させ、アポトーシスを誘導する。そのメカニズムを明らかにするために、脂質ラフトの脂質組成、ならびに上皮成長因子受容体(EGFR)の脂質ラフトの局在化およびリン酸化に対するDHAとEPAの効果を検討した。
n-3系多価不飽和脂肪酸(EPA と DHA の組み合わせ) は、リノール酸の存在下と非存在下で、MDA-MB-231 細胞の増殖をそれぞれ 48 〜62% 阻害した (P < 0.05)。
リノール酸で処理した細胞と比較して、n-3系多価不飽和脂肪酸で処理した後にMDA-MB-231細胞から単離した脂質ラフトに、より多くのEPAおよびDHAが取り込まれた(P < 0.05)。 EPA および DHA 投与は、脂質ラフトのスフィンゴミエリン、コレステロール、およびジアシルグリセロールの含有量を減少させ (P < 0.05)、リノール酸の非存在下では、EPA および DHA は脂質ラフトのセラミド量を増加させた (P < 0.05)。
さらに、EPA+DHA処理細胞では、脂質ラフトの上皮成長因子受容体(EGFR)レベルが著しく低下し、EGFRとp38マイトジェン活性化プロテインキナーゼ(MAPK)の両方のリン酸化が増加した(P <0.05)。 EGFR および p38 MAPK の持続的な活性化は、ヒト乳癌細胞のアポトーシスと関連しているため、我々の結果は、n-3系多価不飽和脂肪酸が細胞膜の脂質ラフトの脂質組成を変更し、EGFR シグナル伝達を変更することによって乳がん細胞の増殖を抑制することを示している。
DHAやEPAを多く摂取すると、脂質ラフトのコレステロールの量を減らし、がん細胞の脂質ラフトとそこに分布する増殖関連タンパク質を減らして、がん細胞の増殖を抑制する可能性を示唆しています。
脂質ラフトはスフィンゴ脂質とコレステロールが豊富で、存在するリン脂質の側鎖は通常、膜の周囲の非ラフト領域と比較して飽和脂肪酸が非常に豊富です。飽和脂肪酸によるリン脂質の濃縮により、ラフト内の脂質の密集が可能になります。
コレステロールと飽和脂肪酸が存在する結果、脂質ラフトは周囲の膜よりも流動性が低くなります。Srcファミリーキナーゼ、Gタンパク質、成長因子受容体、マイトジェン活性化タンパク質キナーゼ(MAPK)など、シグナル伝達に関与する多くのタンパク質、3タンパク質キナーゼ C は主に脂質ラフトに見られ、さまざまなシグナル伝達成分をまとめて (つまり、共局在化)、それらの相互作用を促進することで、シグナル伝達のプラットフォームとして機能しています。
【ドコサヘキサエン酸(DHA)はがん細胞のフェロトーシスを促進する】
フェロトーシスでは、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。細胞内の鉄に依存する細胞死であり,ほかの金属類には依存しません。「フェロ(Ferro)」は「鉄」という意味です。
前述のように、がん細胞は自分で作った脂肪酸以外に、食事から摂取して血液中に存在する脂肪酸を積極的に取り込んで、細胞膜の合成に使います。食事からのDHAやEPAの摂取を増やすと、がん細胞の細胞膜にDHAやEPAが多く取り込まれます。
EPAは二重結合が5個、DHAは二重結合が6個存在する多価不飽和脂肪酸です。不飽和脂肪酸は酸化されて過酸化脂質になります。EPAやDHAは酸化されやすいので、鉄を多く含み、活性酸素の産生が増加しているがん細胞では、EPAとDHAは過酸化脂質を増やし、細胞膜の酸化傷害を増強します。つまり、EPAやDHAを多く取り込んだがん細胞はフェロトーシスが起こりやすくなるのです。
放射線治療や多くの抗がん剤は、がん細胞に活性酸素を産生してフェロトーシスで最終的に死滅することが明らかになっています。したがって、食事からのDHAとEPAの摂取を増やすと、放射線や抗がん剤による細胞死を起こしやすくなります。
放射線治療や抗がん剤治療以外で、がん細胞に活性酸素の発生量を増やす方法として、高濃度ビタミンC点滴、アルテスネイト、ジクロロ酢酸ナトリウムなどがあります。
さらに、瘍性大腸炎の治療に使われていスルファサラジン(別名:サラゾスルファピリジン:商品名はサラゾピリンなど)はシスチン・トランスポーターを特異的に阻害し、がん細胞内のグルタチオンの濃度を低下し、抗がん剤や放射線治療が効きやすくします。
がん細胞にDHAを多く取り込ませた後に、このような活性酸素を多く発生する治療を行うと、がん細胞を選択的に死滅できます。(下図)

図:食事(①)からのドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)は細胞膜に取り込まれる(②)。多価不飽和脂肪酸は酸化を受けやすいので、がん細胞内で鉄介在性に活性酸素の産生が高まると(③)、脂質の過酸化によって細胞は酸化傷害を受け(④)、フェロトーシスの機序で死滅する(⑤)。抗がん剤、放射線照射、アルテスネイト、鉄剤、高濃度ビタミンC点滴、スルファサラジン、ジクロロ酢酸ナトリウムはがん細胞に比較的選択的にフェロトーシスを誘導する(⑥)。食事からのDHA/EPAの摂取量を増やすと、がん細胞のフェロトーシスを増強できる。(赤丸は活性酸素による脂質酸化を示す。多価不飽和脂肪酸は酸化を受けやすいことを示している。)
【がん治療におけるドコサヘキサエン酸(DHA)の有効性が多く報告されるようになった】
ドコサヘキサエン酸(DHA)の抗がん作用が最近注目されています。
がん細胞は細胞分裂によって細胞の数を増やします。この時、細胞膜を作るのに必要な脂肪酸は、がん細胞が自分で合成するだけでなく、血液中に存在する脂肪酸を取り込みます。DHAを細胞膜に取り込むと、抗がん剤や放射線照射に対する感受性が高まる(死滅しやすくなる)ことが報告されています。
DHAの代謝産物ががん細胞の細胞死(アポトーシス)を誘導することが報告されています。
DHAは抗炎症作用があり、正常細胞を抗がん剤や放射線から保護する作用があります。抗炎症作用はがん性悪液質の軽減にも有効です。
DHAの方がEPAより抗がん作用が強いことが報告されています。EPAはナチュラルキラー(NK)細胞活性を抑制するが、DHAはNK活性を抑制しないという報告もあります。
以下のような報告があります。
Dietary supplementation with eicosapentaenoic acid, but not with other long-chain n−3 or n−6 polyunsaturated fatty acids, decreases natural killer cell activity in healthy subjects aged >55 y (55歳以上の健康な被験者において、エイコサペンタエン酸の栄養補助食品はナチュラルキラー細胞活性を低下させるが、他の長鎖n-3またはn-6多価不飽和脂肪酸は低下させない) Am J Clin Nutr. 2001 Mar;73(3):539-48.
【要旨】
背景:動物実験では、亜麻仁油[n-3多価不飽和脂肪酸α-リノレン酸が豊富]、イブニングプリムローズ(月見草)油[n-6多価不飽和脂肪酸γ-リノレン酸が豊富]、魚油[長鎖n-3多価不飽和脂肪酸エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)が豊富]の投与は、ナチュラルキラー(NK)細胞の活性を低下させる可能性が示されている。しかし、これらの油を人間の食事に加えることによるNK細胞活性への影響に関する研究はない。
目的:α-リノレン酸、γ-リノレン酸、アラキドン酸、ドコサヘキサエン酸(DHA)、またはEPAとDHA(魚油)が豊富なオイルブレンドの栄養補助食品が、ヒト末梢血中のNK細胞活性に及ぼす影響を調べた。
設計:無作為化、プラセボ対照、二重盲検、並行試験が実施された。 55〜75歳の健康な被験者は、12週間にわたって1日あたり9カプセルを消費した。カプセルには、プラセボオイル(ヤシとヒマワリの種子油の80:20ミックス)、またはプラセボオイルとα-リノレン酸、γ-リノレン酸、アラキドン酸、ドコサヘキサエン酸(DHA)、または魚油(EPAとDHA)のブレンドが含まれていた。これらのグループの被験者は、それぞれ2 gのα-リノレン酸、770 mg のγ-リノレン酸、680 mg のアラキドン酸、720 mg のDHA、または1 gの EPA + DHA(720 mg EPA + 280 mg DHA)を毎日摂取した。カプセルからの総脂肪摂取量は4g/日であった。
結果:血漿リン脂質の脂肪酸組成は、γ-リノレン酸、アラキドン酸、ドコサヘキサエン酸(DHA)、および魚油グループで大幅に変化した。 NK細胞活性は、プラセボ、α-リノレン酸、γ-リノレン酸、アラキドン酸、またはDHA治療によって有意な変化は認めなかった。魚油はNK細胞活性の有意な低下(平均低下:48%)を引き起こしたが、補給が停止した後4週間で完全に正常に戻った。
結論:中程度の量のEPAは、健康な被験者のNK細胞活性を低下させる可能性がある。他のn-6またはn-3多価不飽和脂肪酸でNK細胞活性を低下させる効果は認めない。
抗炎症と免疫抑制は紙一重です。炎症を抑制する薬やサプリメントは免疫細胞の働きを抑える可能性があります。
ナチュラル・キラー(natural killer; NK)細胞は、文字どおり生まれつきの殺し屋で全身をパトロールしながら、がん細胞やウイルス感染細胞などを見つけ次第攻撃するリンパ球です。生まれながらに備わっているからだの防衛機構である自然免疫に重要な役割を担っています。他の免疫細胞からの指令なしに、異常細胞を攻撃することができます。
この論文は、EPA単独、およびEPAを含む魚油はナチュラルキラー細胞活性を抑制するが、DHA単独の補給はNK細胞活性を低下させないということを報告しています。
α-リノレン酸やEPAは体内でDHAにはほとんど変換されません。従って、α-リノレン酸の多い亜麻仁油や紫蘇油を多く摂取しても、DHAは増えません。
従って、がん治療にはDHAの摂取を増やすことが重要です。
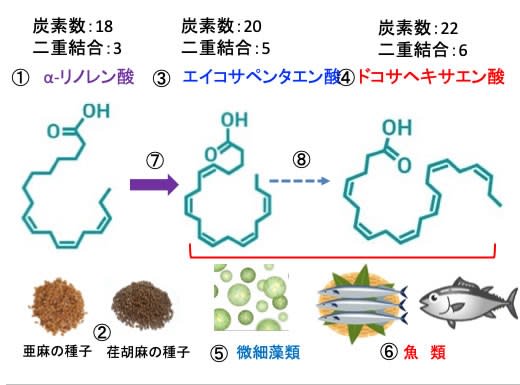
図:α-リノレン酸(①)は亜麻の種子や荏胡麻(エゴマ)の種子など植物油に含まれる(②)。エイコサペンタエン酸(③)とドコサヘキサエン酸(④)は微細藻類(⑤)や魚類(⑥)に多く含まれるが植物油には含まれない。α-リノレン酸を摂取すると一部はエイコサペンタエン酸に変換される(⑦)。しかしドコサヘキサエン酸への変換は極めて少ない(⑧)。
DHAは1分子に不飽和結合が6個存在し、活性酸素を産生しやすく、DHAを多く取り込んだがん細胞はアントラサイクリンなどの酸化ストレスを高める抗がん剤の効果を高めることが報告されています。以下のような報告があります。
Improving outcome of chemotherapy of metastatic breast cancer by docosahexaenoic acid: a phase II trial(ドコサヘキサエン酸による転移性乳がんの化学療法の結果の改善:第II相試験)Br J Cancer. 2009 Dec 15; 101(12): 1978–1985.
【要旨の抜粋】
背景:遠隔転移が発生すると、乳がんは致命的になる。この段階でのがん治療は、追加の毒性をもたらすことなく、症状を緩和し、死を遅らせることが目標になる。正常細胞とがん細胞には抗酸化システムに違いがあり、ドコサヘキサエン酸(DHA)は酸化ストレスを高めるので、細胞膜の脂質にDHAが多く取り込まれると、がん細胞は正常細胞より抗がん剤に対して酸化障害によるダメージを受けやすい。
方法:この臨床試験はオープンラベルのシングルアーム第II相試験で、急速に進行する遠隔転移を伴う乳がん患者(n=25)のアントラサイクリンベースの化学療法に毎日1.8 gのDHAを追加することの安全性と有効性(奏功率)を主要エンドポイントとして評価した。二次エンドポイントは、無増悪生存期間と全生存期間であった。
結果:客観的奏功率は44%であった。平均追跡期間は31か月(範囲2〜96か月)で、無増悪生存期間の中央値は6か月で、全生存期間の中央値は22か月であった。血漿DHAの取り込みが最も高かった患者の亜集団(n = 12)では全生存期間の中央値は34か月に達した。最も一般的なグレード3または4の毒性は好中球減少症(80%)であった。
結論:化学療法中のDHAには有害な副作用がなく、がん細胞に高度に組み込まれると化学療法の結果を改善することができる。 DHAは、がん細胞を特異的に抗がん剤感受性にする可能性がある。
この研究ではコントロール群のないシングルアーム第II相試験で、遠隔転移を伴う乳がん患者のアントラサイクリンベースの化学療法の従来の成績と比較して、その安全性と有効性を検討しています。その結果、「DHAの併用には有害な副作用がなく、がん細胞に高度に組み込まれると化学療法の結果を改善することができる」という結論になっています。
ドコサヘキサエン酸(DHA)が抗がん剤の効き目を高める効果があることが、多くの研究で示されています。
食事やサプリメントから摂取されたDHAは、特に腫瘍細胞や腫瘍組織などの急速に成長または増殖する細胞の細胞膜リン脂質に組み込まれます。
培養乳がん細胞株を使用して、これらの細胞をDHA存在下で培養すると、さまざまな抗がんクラスの薬剤に対する感受性が高まることが報告されています。
さらに臨床試験で、化学療法の前に開始され、化学療法中に継続されたDHA(魚油または藻類由来のDHA)の長期(数週間)補給は、抗がん剤に対する乳がん細胞の感受性を増加させることが示されています。
特に、アントラサイクリンなどの酸化ストレス誘発性抗がん剤の抗腫瘍効果を高めます。
アントラサイクリン関連の心筋毒性は、化学療法によって生成された活性酸素種による直接的な心筋傷害の結果として考えられているため、DHAの追加はこの毒性を潜在的に増幅する可能性があります。しかし、心臓毒性の増強は報告されていません。
その理由の一つは、心筋細胞は細胞分裂していないので、食事から摂取したDHAは細胞分裂しているがん細胞に多く取り込まれ、心筋細胞にはあまり取り込まれないためと考えられます。
つまり、乳がんのアントラサイクリンベースの抗がん剤治療にDHAを併用しても、副作用は増強せず、抗腫瘍効果を高めることができます。
この際、抗酸化物質のサプリメントは摂取しない方がよいと言えます。むしろ、抗酸化作用を阻害する治療法の併用が有効になります。
同様の結果が放射線療法でも観察されています。 これは、DHAが乳がん細胞を抗がん剤や放射線に対してより敏感にする可能性があることを示しています。
抗がん剤や放射線に対するがん細胞のDHA誘発性の増感は、抗酸化物質であるα-トコフェロールを添加することにっよって用量依存的に阻止されました。 6つの二重結合を持つDHAは、最も過酸化性の高い脂肪酸の1つであり、化学療法に対する腫瘍細胞の感受性の増加は、抗がん剤によって誘発される酸化ストレスの結果として、膜に富むDHAの過酸化に一部起因する可能性があります。
がん細胞の抗酸化力を阻害すれば、DHAによる抗がん剤や放射線に対する感受性をさらに高めることができます。この方法としてスルファサラジン、オーラノフィン、メトホルミン、2-デオキシグルコースなどが有効です。(下図)
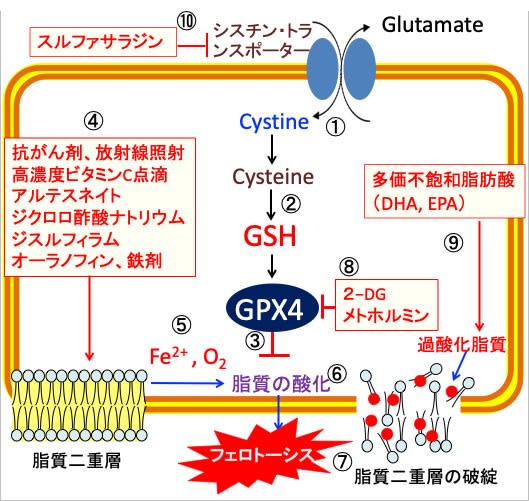
図:シスチン・トランスポーターはシスチン/グルタミン酸交換輸送体とも呼ばれ、細胞内のグルタミン酸との交換により細胞外のシスチン(Cystine)を細胞内に輸送する(①)。シスチンはグルタチオンの構成成分であるシステイン(Cysteine)が2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに変換されて還元型グルタチオン(GSH)の合成が増える(②)。グルタチオンペルオキシダーゼ4(GPX4)は細胞膜の脂質の酸化を防ぐ(③)。抗がん剤、放射線照射、高濃度ビタミンC点滴、アルテスネイト、ジクロロ酢酸ナトリウム、ジスルフィラム、オーラノフィン、鉄剤は活性酸素の産生を増やし(④)、二価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で(⑤)、脂質酸化を促進し(⑥)、脂質二重層の破綻によってフェロトーシスによって死滅する(⑦)。2-デオキシ-D-グルコース(2-DG)とメトホルミンはATPとNADPHの産生を減らしてグルタチオンペルオキシダーゼ4(GPX4)の活性を低下する(⑧)。ドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)は多価不飽和脂肪酸で酸化されやすいので、細胞膜の脂質過酸化を促進する(⑨)。スルファサラジンはシスチン・トランスポーターの働きを阻害してグルタチオンの合成を阻害する(⑩)。これらを組み合わせると、がん細胞に選択的にフェロトーシスによる細胞死を誘導できる。
【DHAは副作用の少ない抗がん剤になる】
DHAの代謝産物が直接的な抗がん作用を発揮することが報告されています。
以下のような報告があります。米国のペンシルバニア州立大学医学部やコロラド州立大学の研究グループからの報告です。
Lipoxygenase catalyzed metabolites derived from docosahexaenoic acid are promising antitumor agents against breast cancer(ドコサヘキサエン酸に由来するリポキシゲナーゼ触媒代謝物は、乳がんに対する有望な抗腫瘍剤である)Sci Rep. 2021 Jan 11;11(1):410.
【要旨】
ドコサヘキサエン酸(DHA)は、ラットの乳がんを抑制することが知られている。ここでは、DHA自体またはその代謝物の抗腫瘍作用を検討した。リポキシゲナーゼ経路に由来する代謝物に焦点を当てたのは、それらがDHAと比較して優れた抗がん作用を発揮することを以前に示したからである。 4-OXO-DHAが最も抗がん作用が強いことが示されていた。
DHAを与えられたラットの血漿と乳腺でいくつかのDHAのリポキシゲナーゼ代謝物が検出された。また、ラット血漿中の4-OXO-DHAを初めて同定した。レポーターアッセイでは、4-OXO-DHAと4-HDHAはDHAよりもPPARɣのより効果的な活性化因子であった。
乳がん細胞株では、4-OXO-DHAはPPARɣと15-ヒドロキシプロスタグランジンデヒドロゲナーゼ(15-PGDH)を誘導し、NF-κBの活性を阻害し、PI3KとmTORのシグナル伝達を抑制した。
4-OXO-DHAは他のヒドロキシル化DHAには無い特殊な構造特性を有し、NF-κBのシステイン残基を共有結合的に修飾できることを示した。
また、DHAの化学予防効果は、発がん物質(MNU)によって誘発されたラット乳腺腫瘍と、非腫瘍性乳腺組織の両方で、PGE2レベルの有意な低下と関連していることが示された。
まとめると、我々の結果は、4-OXO-DHAが将来の化学的予防研究で選択される代謝物であることを示している。
つまり、DHAがリポキシゲナーゼによって代謝されて産生される4-OXO-DHAがPPARɣを誘導し、NF-κBの活性を阻害し、PI3KとmTORのシグナル伝達系を抑制して、強力な抗がん作用を発揮するということです。がん組織はリポキシゲナーゼ活性が高いので、DHAを多く摂取すると、抗がん作用のあるDHA代謝産物も増えます。
以下のような報告があります。
Role of docosahexaenoic acid in enhancement of docetaxel action in patient-derived breast cancer xenografts(患者由来の乳癌異種移植片におけるドセタキセル作用の増強におけるドコサヘキサエン酸の役割)Breast Cancer Res Treat. 2019 Sep;177(2):357-367.
この報告では、2つの異なる薬剤耐性トリプルネガティブ乳がん患者由来異種移植片(MAXF574とMAXF401)を用いた実験系で、ドセタキセルの抗がん作用をDHAが増強するかどうかを検討しています。
雌のNSGマウスに2種類のトリプルネガティブ乳がん患者由来乳がん細胞を移植し、食事は対照群(0%DHA)またはDHA群(総脂肪の3.9%w / wのDHA) の2群に無作為に分けて投与し、ドセタキセルを週2回投与を6週間行いました。
DHA食餌を与えられドセタキセルで治療されたMAXF574異種移植片を有するマウスの腫瘍重量は、対照食餌を与えられたマウスと比較して57%減少し(P <0.004)、対照食餌+ ドセタキセル群と比較して64%減少し(P <0.01)、ドセタキセルなしのDHA食餌群と比較して34%減少しました(P <0.04)。
MAXF401異種移植片のマウスでは、DHA + ドセタキセル併用群は、対照食餌および対照食餌+ ドセタキセルと比較して、腫瘍重量がそれぞれ43%および34%減少しました(P <0.05)。
両方の異種移植片において、DHA + ドセタキセル併用群は、対照食餌+ドセタキセル群と比較して、アポトーシス促進タンパク質Ripk1およびBidの発現が高く、増殖マーカーKi67および抗アポトーシスタンパク質Bcl-2およびParpの発現が低く、細胞周期停止のより大きな増加をもたらした。
つまり、化学療法治療中のDHA補給が、トリプルネガティブ乳がんにおけるドセタキセルの抗がん作用を増強することを示しています。作用機序として、アポトーシス、細胞増殖、および細胞周期経路の変化を介して起こったことを示唆しています。
【シンバスタチンとドコサヘキサエン酸(DHA)の相乗効果】
コレステロールはアセチルCoA(グルコースや脂肪酸などの分解によって生成される)からメバロン酸を経由して合成されます。この生合成経路をメバロン酸経路と言います。メバロン酸経路の律速酵素は3-ヒドロキシ-3-メチルグルタリルCoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase ;HMG-CoA還元酵素)です。
HMG-Co還元酵素阻害剤のシンバスタチンが脂質ラフトのコレステロールを減らし、脂質ラフトを減らすことによってがん細胞の増殖を抑制し、細胞死を起こしやすくする作用については前回(818話)解説しています。
したがって、スタチンとドコサヘキサエン酸の併用は抗がん作用における相乗効果が期待できます。

図:細胞膜でコレステロールが増えると、細胞膜の流動性が低下する(①)。細胞膜の脂質二重層にはコレステロールとスフィンゴ脂質が豊富なミクロドメイン(脂質ラフト)が存在する(②)。ラフトは筏(いかだ)の意味で、脂質ラフトには細胞増殖を促進する増殖因子受容体やシグナル伝達分子が集まっており(③)、がん細胞の増殖や細胞死抵抗性を促進する(④)。ドコサヘキサンエン酸(DHA)は脂質二重層のコレステロールの量を減らし(⑤)、シンバスタチンはコレステロールの合成を阻害する(⑥)。その結果、DHAとシンバスタチンはがん細胞の脂質ラフトを減少して増殖を抑制し、細胞死を起こりやすくする。
がん治療には1日3から5グラムのDHAの摂取が有効であることが多くの研究で示されています。通常の魚油の場合、DHA含有量は10%から20%程度です。1日5グラムのDHAを摂取するには25gから50gの魚油の摂取が必要になります。
そこで、微細藻類の中でもDHA含有量が極めて多いシゾキトリウム(Schizochytrium sp.)をタンク培養して製造したDHA(フランス製)を原料にした「微細藻類由来オイル(DHA含有量51%)」を製造してがん治療に使用しています。閉鎖環境での培養のため、汚染の心配がありません。しかも、植物由来なので、菜食主義者(ベジタリアン、ヴィーガン)も摂取できます。
詳細は以下のサイトで紹介しています。
| « 818)脂質ラフ... | 820)末期がん... » |




