がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
818)脂質ラフトをターゲットにしたがん治療(その1):シンバスタチン
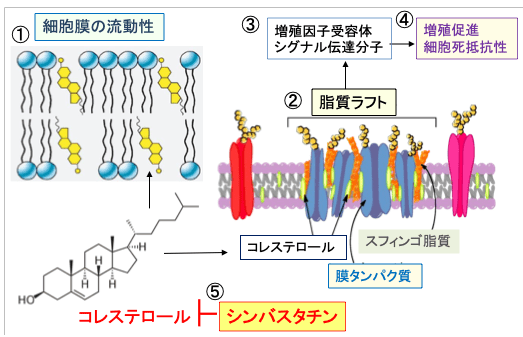
図:細胞膜でコレステロールが増えると、細胞膜の流動性が低下する(①)。細胞膜の脂質二重層にはコレステロールとスフィンゴ脂質が豊富なミクロドメイン(脂質ラフト)が存在する(②)。ラフトは筏(いかだ)の意味で、脂質ラフトには細胞増殖を促進する増殖因子受容体やシグナル伝達分子が集まっており(③)、がん細胞の増殖や細胞死抵抗性を促進する(④)。シンバスタチンはコレステロールの合成を阻害する(⑤)。その結果、シンバスタチンはがん細胞の脂質ラフトを減少して増殖を抑制し、細胞死を起こりやすくする。
818)脂質ラフトをターゲットにしたがん治療(その1):シンバスタチン
【細胞は脂質二重層で包まれている】
体を構成する個々の細胞は細胞膜で囲まれています。細胞膜は脂質二重層を土台にしてできており、この細胞膜によって細胞外と細胞内が分けられています。
脂質二重層はリン脂質分子が膜状に並んで作られます。リン脂質分子は親水性のリン酸部分と、疎水性の2個の脂肪酸が尻尾のように繋がった構造をしています。
細胞の内外は主に水で満たされているので、リン脂質分子は親水性のリン酸部分(頭部)を外側に、水に反発する疎水性の脂肪酸部分(尾部)を内側にして、3〜6ナノメートル(nm)程度の厚さの2重の層を作って並びます(図)。

図:リン脂質は親水性のリン酸部分(頭部)と、疎水性の脂肪酸部分(尾部)から構成される。疎水性の尾部は水によってはじかれ、互いに引き付けられて内側に並び、親水性の頭部の領域が水に接する外側に露出して膜状の二重層を形成する。この脂質二重層が細胞膜の基本構造になる。
細胞の内外を分ける細胞膜は脂質二重層を土台にして、その中にタンパク質粒子が浮遊するように移動しています。脂質二重層に浮かぶタンパク質粒子は、受容体や物質を通すチャネルなどとして働きます。細胞膜に埋め込まれたタンパク質や脂質に糖鎖が結合し、細胞の識別や情報交換のマーカーとして細胞機能に影響を与えています。(図)

図:細胞膜は脂質の二重膜の海に、膜タンパク質が氷山のように頭を少し出して浮かんだような構造をしている。この構造モデルを流動モザイクモデル(fluid mosaic model)と呼んでいる。
【脂質ラフトはシグナル分子間の相互作用のプラットフォームとして働いている。】
細胞膜はリン脂質を基本成分とする油の膜(脂質二重層)から成り、そこに膜タンパク質が挿入されて出来ています。細胞膜は流動的で、膜タンパク質は生体膜上をダイナミックに移動しています。
細胞膜は均一な構造体ではなく、ところどころに分子の集合体を作っています。このように分子が集まった微小領域を膜マイクロドメイン、あるいは脂質ラフト(lipid raft)と言います。
ラフト(Raft)とは筏(いかだ)のことで、細胞膜中に特定の脂質(スフィンゴミエリンやコレステロールなど)とタンパク質(受容体など)が集合した領域(構造)が存在し、それが脂質ラフトです。
脂質ラフトの部分はコレステロールや飽和脂肪酸が多く、膜の流動性が低下し、海に浮かぶ筏のような構造物を提供し、プラットホームや中継基地のような機能を担っています。
脂質ラフト(膜マイクロドメイン)は膜の内外のシグナル伝達や物質輸送などで重要な役割を果たしています。(下図)
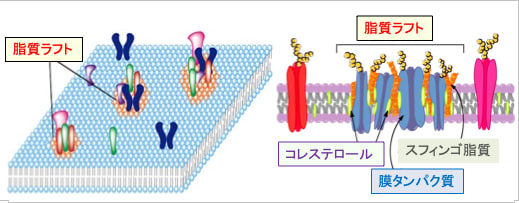
図:細胞膜の脂質分布は均質ではなく、一部の脂質は限局したドメイン(区画)を形成している。これを流動膜に浮かぶ筏(いかだ)になぞらえて脂質ラフトと呼ぶ。脂質ラフトの脂質およびタンパク質組成は周囲の細胞膜とは異なり、コレステロールやスフィンゴ脂質が多く、流動性が低下し、シグナル伝達タンパク質のプラットフォームおよびハブとして機能する。脂質ラフトにはシグナル伝達系のタンパク質が集合し、シグナル分子間の相互作用の場として働いている。
細胞外から細胞内へのシグナル伝達は細胞表面でランダムに発生しているのではありません。シグナルを受け取り、細胞内に効率良くシグナルを伝達するためのネットワークのプラットフォームや中継基地のような構造が存在します。
細胞膜の脂質二重層では、コレステロールとスフィンゴ脂質が集合体を形成して膜マイクロドメイン(脂質ラフト)を作っています。脂質ラフトはステロールとスフィンゴ脂質に富んだ10-200 nmサイズの小さく不均一で非常に動的なドメインであり、細胞機能のコンパートメント化(区画化)を担っています。
脂質ラフトにおけるタンパク質の物理的分離は、シグナル伝達系における調節分子やエフェクター分子へのタンパク質の接近性を調節し、シグナル伝達タンパク質の選別プラットフォームおよびハブとして機能します。
つまり、細胞膜の脂質ラフト上に受容体などの機能性物質が集合することにより、シグナル伝達や物質輸送の窓口として機能しています。シグナル伝達において複数の分子が連続して作用する場合、それらの分子を一箇所に集めることにより、それらの分子が相互作用する確率を高め、一連の反応を速やかに行うことができます。
たとえば、がん細胞ではインスリン様成長因子 I (IGF-I)/ホスファチジルイノシトール 3-キナーゼ (PI3K)/Akt シグナル伝達系の活性が亢進しています。IGF-1がPI3K(PI3キナーゼ)を活性化してAkt (プロテインキナーゼBまたはPKBとしても知られている)をリン酸化して活性化します。
Akt はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。
がん細胞においてはAktの活性化はがん細胞の増殖・転移を亢進し、アポトーシスに抵抗性にします。
このIGF-1/PI3K/Aktに関与する受容体やタンパク質は脂質ラフトに集まって、効率良くシグナル伝達を行なっています。(下図)
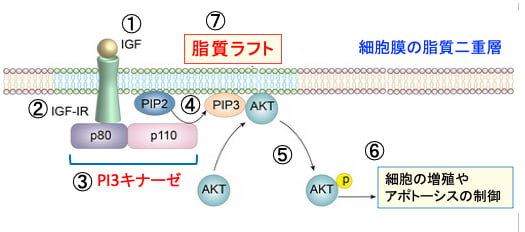
図:インスリン様成長因子-1(IGF-1)はIGF-1受容体(IGF-1R)に結合すると(①と②)、PI3キナーゼ(PI3K)というリン酸化酵素が活性化される(③)。PI3Kは細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素でp80とp110の2つのサブユニットから構成されている。PI3Kはホスファチジルイノシトール4,5-二リン酸(PIP2)の3位のOHをリン酸化してホスファチジルイノシトール3,4,5-三リン酸(PIP3)を生成する(④)。生成したPI3,4,5-三リン酸(PIP3)がAktをリン酸化して活性化する(⑤)。活性化したAktは、細胞内のシグナル伝達に関与する様々なタンパク質の活性を調節することによって細胞の増殖や生存(あるいは死)の調節を行う。がん細胞においてはAktの活性化はがん細胞の増殖・転移を亢進し、アポトーシスに抵抗性にする(⑥)。IGF-1、IGF-1R、PI3K、PIP2、PIP3、Aktのタンパク質は脂質ラフトに集合して、シグナル伝達を効率化している(⑦)。
【コレステロールは乳がん細胞の増殖を促進する】
がん細胞は、正常細胞よりも高レベルの細胞内コレステロールと脂質ラフトを含んでいます。がん細胞内のコレステロールが高いほど悪性度が高いという報告があります。
多くの実験系で、高脂肪や高コレステロールの食餌が乳がんの発生や増殖を促進することがマウスの実験で示されています。
このような実験で、脂肪の量を増やさずにコレステロールだけを増やした食餌を与えると乳がんの発生と増殖が促進されることから、コレステロール自体に乳がんを促進する作用があると考えられています。
これは、高脂肪・高コレステロール食による発がん促進作用が、コレステロールの合成を阻害する薬剤(スタチン)によって阻止されることからも支持されています。
このように、コレステロールが乳がんの発生や増殖を促進することが多くの研究で示されていますが、そのメカニズムは単純ではなく、まだ不明な点が多く残されています。
例えば、細胞膜でコレステロールが増えると、細胞膜の流動性に影響し、さらに脂質ラフト(Lipid Raft)の構造にも影響して、その結果、シグナル伝達系にも影響する可能性が指摘されています。
脂質ラフトはシグナル伝達や物質輸送などで重要な役割を果たしています。細胞内のコレステロールの量が脂質ラフトの働きに影響します。
さらに、コレステロールの代謝産物の27-hydroxycholesterolがエストロゲン受容体のリガンドとして作用するので、エストロゲン受容体陽性の乳がん細胞の増殖を亢進するメカニズムも指摘されています。これはScienceに報告されています。
27-Hydroxycholesterol links hypercholesterolemia and breast cancer pathophysiology.(27-ヒドロキシコレステロールは高コレステロール血症と乳がんの病理生理学を結びつける)Science. 2013 Nov 29;342(6162):1094-8.
【要旨】
高コレステロール血症は、エストロゲン受容体(ER)陽性乳がんの危険因子であり、内分泌療法に対する反応の低下と関連している。
ここでは、コレステロールの代謝産物の一つで、エストロゲン受容体とliver X receptor (LXR) のリガンドである27-ヒドロキシコレステロール(27-hydroxycholesterol)が、乳がんのマウスモデルにおいてエストロゲン受容体依存性増殖およびLXR依存性転移を増加させることを示す。
がん細胞に対するコレステロールの作用は、チトクロームP450オキシダーゼのCYP27A1による27-ヒドロキシコレステロールへの変換を必要とし、そしてCYP27A1阻害剤により減弱された。
ヒト乳がん組織では、CYP27A1の発現レベルは腫瘍の悪性度と相関していた。 高悪性度腫瘍では、がん細胞と腫瘍関連マクロファージの両方においてCYP27A1の高発現を認めた。
したがって、血中のコレステロールレベルを低下させること、またはコレステロールから27-ヒドロキシコレステロールへのその変換を阻害することは、乳がんの予防や治療における有効な治療法となりうる。
つまり、がん組織では薬物代謝酵素のCYP27A1の発現や活性が亢進しており、CYP27A1によってコレステロールが27-ヒドロキシコレステロールに変換され、この27-ヒドロキシコレステロールがエストロゲン受容体やliver X receptorのリガンドとして作用してこれらの受容体を刺激して、乳がん細胞の増殖や転移を促進するという事です。(下図)
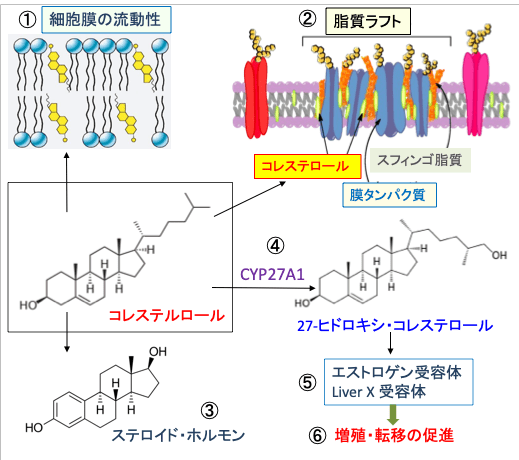
図:細胞膜でコレステロールが増えると、細胞膜の流動性(①)や脂質ラフト(②)の機能に影響して、シグナル伝達系など細胞機能に影響する。コレステロールはステロイドホルモンに変換される(③)。がん組織で発現が亢進している薬物代謝酵素のCYP27A1によってコレステロールが27-ヒドロキシコレステロールに変換され(④)、この27-ヒドロキシコレステロールがエストロゲン受容体やliver X receptorを刺激して(⑤)、乳がん細胞の増殖や転移を促進する(⑥)。
すなわち、乳がん患者では高コレステロールはがんを進行させるので、コレステロールを低下させる治療は意味があります。この目的ではシンバスタチンが有効です。コレステロールは、動物細胞にとっては生体膜の構成物質の一つであり、細胞膜の流動性や機能の調節に重要な働きを行っています。さらにシグナル伝達など様々な生命現象に関わる重要な化合物で、生体内に広く分布します。
コレステロールは食物にも含まれていますが、体内のコレステロールのうち、食事由来は3割程度で、7割くらいは糖質や脂肪酸を材料にして体内(肝臓や皮膚、腸粘膜、副腎、卵巣、精巣など)で合成されています。
コレステロールはアセチルCoA(グルコースや脂肪酸などの分解によって生成される)からメバロン酸を経由して合成されます。この生合成経路をメバロン酸経路と言います。メバロン酸経路の律速酵素は3-ヒドロキシ-3-メチルグルタリルCoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase ;HMG-CoA還元酵素)です。
HMG-CoA還元酵素を阻害すると肝臓でのコレステロール生合成を抑制することができるため、多くのHMG-CoA還元酵素阻害剤が開発され高脂血症治療薬として臨床で使われています。このようなHMG-CoA還元酵素の働きを阻害することによって血液中のコレステロ-ル値を低下させる薬(HMG-CoA還元酵素阻害剤)の総称をスタチン(Statin)といいます(図)。

図:スタチンは肝臓においてヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害することによってコレステロール合成を抑制する。
細胞内でメバロン酸経路は、コレステロールだけでなく細胞の増殖や機能に重要な働きを持つ多くの物質を産生しています。
例えば、細胞内シグナル伝達系のスイッチとして働くGTP結合タンパク質の機能にメバロン酸経路の中間代謝産物のファルネシル・ピロリン酸とゲラニルゲラニル・ピロリン酸が必要です。
GTP結合タンパク質(Gタンパク質)は内在性のGTP加水分解(GTPase)活性をもつタンパク質の総称で、この内、低分子量Gタンパク質群(Ras, Rho,など)は分子量が2万~3万のタンパク質で、これまで100種類以上報告されています。RasやRhoはがん遺伝子として知られています。
RasやRhoといったGTP結合タンパク質(Gタンパク質)が機能を発揮するためにはGタンパク質がプレニル化をいう修飾を受ける必要があります。
プレニル化反応(Prenylation)とは、疎水性のプレニル基を付加する反応のことです。プレニル基とは、炭素数5のイソプレン単位で構成される構造単位の総称ですが、このプレニル基はメバロン酸経路で合成されます。
また、がん細胞の増殖を促進するインスリン様成長因子-1(IGF-1)の受容体の働きにも、メバロン酸経路の代謝産物が必要で、メバロン酸経路の阻害がIGF-1受容体の働きを阻害して、がん細胞の増殖を抑制することが知られています。
このように、がん細胞のメバロン酸経路を阻害することは、がん細胞の増殖を抑制することになります。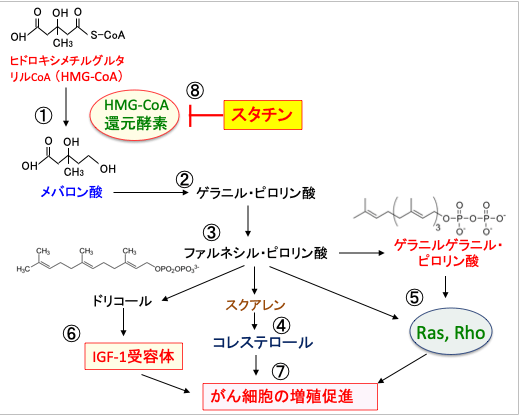
図:3-ヒドロキシ-3-メチルグルタリル補酵素A(HMG-CoA)がHMG-CoA還元酵素によってメバロン酸に変換され(①)、メバロン酸からゲラニル・ピロリン酸(②)、ファルネシル・ピロリン酸(③)が合成され、さらにコレステロールが合成される(④)。ファルネシル・ピロリン酸からゲラニルゲラニル・ピロリン酸が合成され、このゲラニルゲラニル・ピロリン酸とファルネシル・ピロリン酸は低分子量Gタンパク質のRasやRhoの活性化に必要(⑤)。さらにメバロン酸経路の中間代謝産物はインスリン様成長因子-1(IGF-1)受容体の活性化にも関与する(⑥)。これらはがん細胞の増殖を促進する(⑦)。高脂血症治療薬のスタチンはHMG-CoA還元酵素とHMG-CoAとの結合を競合阻害することによって活性を阻害する(⑧)。
【脂溶性スタチンは乳がん治療後の再発率を低下させる】
スタチンによる抗腫瘍効果は薬剤の種類によって異なります。スタチンには水溶性のものと脂溶性のものがあり、がん細胞に対する効果を期待するには脂溶性のものを使う必要があります。
水溶性スタチンは肝臓細胞膜に存在する有機アニオン輸送担体によって細胞内に取り込まれるので、肝細胞に選択的に取り込まれます。一方、脂溶性スタチンは細胞膜透過性が良いので、あらゆる臓器・組織の細胞内へ移行し得えます。
つまり、肝臓におけるコレステロール産生を抑制する目的では、他の細胞に影響が少ない点で水溶性スタチンの方が良いのですが、がん細胞に取り込まれて、メバロン酸経路を阻害して増殖抑制効果を期待するには脂溶性のスタチンの方が良いのです。
スタチンの中で最も脂溶性の高いのがシンバスタチン(simvastatin)で、乳がんの患者さんがシンバスタチンを服用すると再発率が顕著に低下することが複数の臨床試験で報告されています。
例えば、1996年から2003年の間にデンマークの乳がん登録に報告されたステージIからIIIの浸潤性乳がんの患者18,769人を対象にしたデンマークの全国規模の前向きコホート研究の結果が報告されています。
(Statin Prescriptions and Breast Cancer Recurrence Risk: Danish Nationwide Prospective Cohort Study. J Natl Cancer Inst 2011;103:1461-1468)
この研究では、平均6.8年間追跡して3,419人の再発を認めています。6.8年間で18%の再発率です。
シンバスタチンを服用していた乳がんサバイバーはスタチンを服用していない群に比べて再発リスクが70%に減っていました。この値は、スタチンを服用しない場合に比べて、シンバスタチンを服用すると10年間の追跡で100人あたり10人の再発患者を減らすのに相当するという結果です。
この研究において、水溶性スタチンには再発予防効果は認められませんでした。
脂溶性スタチンが乳がんの予後の改善に有効であることはメタ解析でも指摘されています。
スタチンの使用と乳がんの転帰(再発や死亡)との関連を記述した14件の臨床研究をメタ解析した報告では、脂溶性スタチンを服用していた乳がん患者は、再発や死亡率が30%前後の低下が認められています。この研究でも、水溶性スタチンには再発や死亡を減少させる効果は認められませんでした。
(Impact of statin use on cancer recurrence and mortality in breast cancer: A systematic review and meta-analysis. Int J Cancer. 2016 Sep 15;139(6):1281-8.)
HMG-CoA還元酵素は乳がんに発現し,予後関連因子であることが同定されています。したがって、HMG-CoA還元酵素阻害剤のスタチン(特に脂溶性のシンバスタチン)は、乳がん細胞の増殖を抑制する効果が期待できます。
【スタチンは膵臓がん患者の生存率を高める】
スタチンが膵臓がんを含めて多くのがんの死亡率を減らすことは多くの研究で示されています。膵臓がん患者の延命にも有効であることが示されています。
例えば、米国のがん登録データを使って7813人の高齢の膵臓がん患者を解析した結果が報告されています。
(The association of statin use after cancer diagnosis with survival in pancreatic cancer patients: a SEER-medicare analysis.PLoS One. 2015 Apr 1;10(4):e0121783.)
その結果、全ての膵臓がん患者を対象にした場合は、がん診断後のスタチン使用と生存率との間には関連は認めませんでした(ハザード比 = 0.94, 95%信頼区間: 0.89 - 1.01)。しかし、ステージIとIIの膵臓がん患者を対象にした場合は、がん診断後のスタチン使用は死亡率の21%の低下が認められました(ハザード比 = 0.79, 95% 信頼区間: 0.67 - 0.93)。腫瘍摘出手術を受けた膵臓がん患者でも、がん診断後のスタチン使用は同様の生存率の改善が認められました。
この論文の結論は「比較的早期あるいは切除可能が膵臓がん患者において、がん診断後のスタチン使用は生存率を高める」となっています。
この研究では、がん診断前にスタチンを使用していなくても、がん診断後にスタチンを服用すると膵臓がん患者の生存率を高めることを示しています。ただし、統計的に有意な生存率の改善がみられたのはステージIかIIあるいは切除可能の比較的早期の膵臓がん患者さんでした。
ステージIII以上や切除できない局所進行がんでは、平均余命が半年から1年くらいという状況ですので、スタチンによる統計的有意な生存率改善を得るほどにはスタチンの抗腫瘍効果は強くないということかもしれません。
しかし、進行した膵臓がんでも生存期間を延ばす目的でスタチンを服用するメリットはあることが報告されています。膵臓がん患者における死亡率に対するスタチンとコレステロールの影響を検討した研究があります。(Influence of Statins and Cholesterol on Mortality Among Patients With Pancreatic Cancer. J Natl Cancer Inst. 2016 Dec 31;109(5))
この研究は2142名の膵管腺がん患者を対象に、薬局の記録を使って、スタチンの種類や投与期間や投与量を解析した後ろ向きコホート研究です。死亡率に対するシンバスタチン、ロバスタチン、アトルバスタチン、プラバスタチンおよびロスバスタチンの影響を評価しています。
その結果、いかなるスタチンの使用はいずれも死亡リスクの低下と関連していました。個々のスタチンを評価すると、シンバスタチン(ハザード比 = 0.87,95%信頼区間 = 0.77〜0.98)およびアトルバスタチン(ハザード比 = 0.58,95%信頼区間 = 0.46〜0.72)の死亡率の低下が認められました。
シンバスタチンもアトルバスタチンもともに脂溶性です。
コレステロールは死亡率と関連がなく、スタチンと生存との間の関係を媒介しませんでした。つまり、コレステロールレベルよりスタチンの使用が、膵臓がん患者の死亡リスクの低下と関連していました。スタチン類は、脂質に依存しない機構を介して生存を改善する可能性が示唆されます。
スタチンが転移を伴う膵臓がん患者の生存期間を延ばす効果が2つの第III相試験のプール分析で示されています。
Statin treatment and outcomes of metastatic pancreatic cancer: a pooled analysis of two phase III studies.(スタチン治療と転移性膵臓がんの転帰:2つの第III相試験のプール分析)Clin Transl Oncol. 2019 Jun;21(6):810-816.
【要旨の抜粋】
背景:転移性膵臓がん患者の生存に対するスタチンの併用療法の影響を評価することを目的とした。
方法:2つの臨床試験(NCT01124786とNCT00844649)の匿名化された患者データのプール分析を実施した。患者サブセット(スタチンを投与した患者またはスタチンを投与しなかった患者)に応じた全生存期間および無増悪生存期間を、カプラン・マイヤー分析およびログランク検定により評価した。全生存期間および無増悪生存期間に潜在的に影響を及ぼすさまざまな要因を、単変量および多変量のCox回帰分析にて検討した。
結果:この研究では、合計797人の膵臓がん患者が評価された。 156人の患者がスタチンを服用しており、641人がスタチンを服用していなかった。カプラン・マイヤー生存推定値を使用すると、スタチンを投与された患者は、投与されなかった患者と比較して、全生存期間および無増悪生存期間が統計的有意な延長を認めた(それぞれP = 0.008; P <0.001)。
全生存期間に影響を与える要因の多変量解析では、全生存期間の悪化に関連していたのは、パフォーマンス状態の悪化(P <0.001)、スタチン使用なし(P = 0.044)、複数の転移(P = 0.023)であった。
同様に、無増悪生存期間に影響を与える要因の多変量解析では、無増悪生存期間の悪化に関連していたのは、パフォーマンス状態の悪化(P <0.001)、ゲムシタビン化学療法(P = 0.015)、スタチン使用なし(P = 0.048)であった 。
スタチンの使用は全生存期間および無増悪生存期間の改善と関連していた(それぞれP = 0.005; P = 0.040)。
結論:スタチンの使用は、一次化学療法で治療された転移性膵臓がん患者の全生存率の向上と関連することが示された。このスタチンの潜在的な効果を確認するために前向き研究が必要である。
がん患者の死亡率を減少させるスタチンの効果は、乳がんや膵臓がん以外にも、大腸がん、肺がん、前立腺がん、卵巣がん、肝細胞がんなど多くのがんでも報告されています。
例えば、スタチン服用と肺がんの生存率に関して以下のような報告があります。
Effects of statin exposure and lung cancer survival: A meta-analysis of observational studies.(スタチン服用の効果と肺がんの生存:観察研究のメタ解析)Pharmacol Res. 2019 Mar;141:357-365.
【要旨】
スタチン服用は、いくつかのがんの生存率を改善することが報告されている。しかし、肺がん患者のスタチン服用と予後との関連を評価する研究の結果は一致していない。スタチン服用と肺がんの予後との関連性を調査した研究を検討した。主要評価項目は全生存期間であり、二次評価項目はがん特異的生存期間と無再発生存期間であった。これらの結果のハザード比と95%信頼区間を解析した。
99,297人のデータからなる13の研究が特定された。研究は、バイアスのリスクが低から中程度であるとランク付けされた。
メタ分析により、スタチン服用は全生存期間(ハザード比= 0.79、95%信頼区間: 0.72〜0.86)、がん特異的生存期間(ハザード比= 0.83、95%信頼区間: 0.77〜0.89)および無再発生存期間(ハザード比= 0.85、95%信頼区間: 0.81〜0.89)の改善と有意に関連していることが示された。
サブグループ分析では、全生存期間は、肺がんの診断後のスタチン使用者(ハザード比=0.68, 95% 信頼区間:0.51〜0.92)は、診断前の服用者(ハザード比= 0.86、95%信頼区間: 0.81〜0.90)および現在の使用者(ハザード比= 0.79、95%信頼区間: 0.62〜1.02)よりも改善が高かった。
さらに、スタチン使用者は、他のステージの患者よりもステージIV肺がん患者(ハザード比= 0.77、95%信頼区間: 0.74-0.79)でより多くの生存利益を得る可能性が認められた。
スタチン服用は、肺がん患者の生存率の大幅な改善と関連している。今後さらに、肺がん患者におけるスタチンの治療的役割をさらに実証するための研究が必要である。
以下のような報告もあります。
The effect of statins on survival in patients with stage IV lung cancer.(ステージ4の肺がん患者の生存におけるスタチンの効果)Lung Cancer. 2016 Sep;99:137-42.
この研究では、肺がんの診断前にスタチンを服用していた場合と服用していなかった場合のステージIV非小細胞肺がん患者の生存率を比較しています。
メディケアのがん登録のデータを使用して、2007年から2009年にかけてステージIV非小細胞肺がんと診断された65歳以上の5118人の患者を特定し、交絡因子を調整しながら、全生存率および肺がん関連生存率とスタチン使用の関連を解析しました。
全体として、患者の27%が肺がんの診断時にスタチンを服用していました。スタチン服用群での生存期間の中央値は7ヶ月でしたが、スタチンを服用していない患者では4ヶ月でした(p <0.001)。
ベースラインの患者特性、癌の特性、病期分類、化学療法の使用などの因子を調整したあとのハザード比を解析すると、スタチンの服用は全生存率(ハザード比=0.76、95%信頼区間:0.73-0.79)および肺がん特異的生存率(ハザード比=0.77、95%信頼区間:0.73 -0.81)の有意な改善を認めました。
つまり、スタチンの使用は、ステージ4期の非小細胞肺がん患者の生存率を改善し、スタチンの潜在的な抗がん効果を示唆しています。
シンバスタチンが卵巣がんのがん幹細胞の性質を阻害して転移を抑制する効果が報告がされています。
Simvastatin interferes with cancer 'stem-cell' plasticity reducing metastasis in ovarian cancer.(シンバスタチンは、がんの「幹細胞」可塑性を妨げ、卵巣がんの転移を抑制する)Endocr Relat Cancer. 2018 Oct;25(10):821-836.
がん起始細胞(cancer-initiating cells)が持つ幹細胞様の細胞可塑性は、がん細胞の転移と進行の原因となっています。この報告では、親油性スタチンであるシンバスタチンが、婦人科悪性腫瘍の中で最も致命的な高悪性度漿液性卵巣がんのがん起始細胞の転移能を阻害するかどうかを検討しました。
シンバスタチンはがん幹細胞性および上皮間葉細胞可塑性に関するマーカーの発現パターン(mRNAとタンパク質レベルの両方)を変更し、がん起始細胞の腫瘍塊形成を著しく阻害することを実証しました。その結果、がん起始細胞は転移性が低下し、移植腫瘍の増大を抑制しました。
シンバスタチン非使用者と比較して、シンバスタチン使用者は生存率と生活の質において良好な結果が認められました。
【シンバスタチンは脂質ラフトを減らして増殖を抑制する】
脂質ラフトはコレステロールが豊富です。コレステロールは細胞膜の流動性を低下させるので、海に浮かぶ筏のように、流動性の高い細胞膜においてタンパク質や伝達因子が集合するプラットホームのようなドメイン(区画)を作る場合、コレステロールの存在は重要です。
シンバスタチンはコレステロールの産生を阻害し、がん細胞の脂質ラフトを減らし、増殖シグナル伝達を抑制することが報告されています。以下のような報告があります。
Simvastatin stimulates apoptosis in cholangiocarcinoma by inhibition of Rac1 activity(シンバスタチンは、Rac1活性の阻害により胆管がん細胞のアポトーシスを刺激する)Dig Liver Dis. 2011 May;43(5):395-403.
【要旨】
背景: シンバスタチンは、コレステロールを低下する薬で、動脈硬化性心血管疾患の予防と治療に広く使用されている。シンバスタチンは、抗がん作用を含む多彩な臨床効果を示す。しかし、胆管がんに対するシンバスタチンの効果は検討されていない。
目的: 胆管がん細胞の増殖に対するシンバスタチンの効果を検討した。
方法: シンバスタチンの効果は、5 つのヒト胆管がん細胞株 (Mz-ChA-1、HuH-28、TFK-1、SG231、HuCCT1) および正常な胆管細胞株 (HiBEpiC) で評価された。
結果: シンバスタチンは胆管がん細胞株に対しては、細胞生存率の低下とアポトーシスを促進した。正常なヒト胆管細胞 HiBEpiC では、シンバスタチンは増殖を抑制したが、アポトーシスは起こさなかった。シンバスタチンによる細胞生存率の低下は、メバロン酸経路の代謝産物による前処理によって部分的に阻止された。
Mz-ChA-1 細胞では、コレステロール単独で前処理すると生存細胞数が増加し、シンバスタチン処理による細胞生存率の低下を完全に回復した。シンバスタチンの投与は、Mz-ChA-1 細胞における脂質ラフトに局在する Rac1 の損失と Rac1 活性の低下を引き起こした。この効果は、コレステロールによる前処理によって阻止された。
結論:、我々 の結果は、シンバスタチンが Rac1/脂質ラフトの共局在化を阻害し、Rac1 活性を抑制することにより、胆管がん細胞の細胞死を誘導することを示している。
シンバスタチンが胆管がんのアポトーシスを刺激し、この活性が (i)細胞コレステロールの減少、(ii) 脂質ラフトにおける Rac1 共局在の破壊、(iii) Rac1 活性のダウンレギュレーションと密接に関連していることを示しています。
細胞の運動性を制御する細胞骨格の動的変化の背後にあるシグナル伝達経路にはRas関連の低分子量GTAアーゼ(Ras-related small GTPases)と、p21活性化キナーゼ(p21-activated kinases :PAKs)を含むエフェクタータンパク質が関与しています。
PAKキナーゼは酵母やショウジョウバエにも存在するセリン/スレオニンプロテインキナーゼのファミリーであり、哺乳類では6つのアイソフォーム(PAK1〜6)が発見されています。それらはすべて低分子量GTPaseの RacおよびCdc42の直接の標的です。
細胞骨格の動的変化の制御における役割に加えて、PAKは細胞の生存、分裂、遺伝子転写などの様々な細胞活動を調節することが明らかになっています。
いくつかの成長因子受容体チロシンキナーゼ(インスリン、EGF、PDGF、VEGF受容体など)およびGタンパク質共役受容体からのシグナルは、PAKの活性化につながります。
これらの経路は、PI-3キナーゼ(PI3K)とグアニンヌクレオチド交換因子(GEF)の連続的な活性化を通じて低分子量GTPase のRacおよびCdc42を活性化し、PAKを活性化します。
がん細胞では、PAKの活性化は変異Rasを介して頻繁に起こっています。
Rasは最も一般的に変異しているがん遺伝子の1つであり、MAPキナーゼ経路とPI3キナーゼを活性化し、PAKキナーゼを活性化します。
ヒトがんの70%以上において、PAK-1の活性亢進ががん細胞の増殖に関与していると言われています。
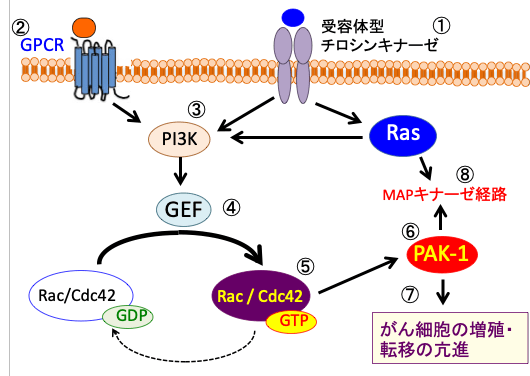
図:受容体チロシンキナーゼ(インスリン受容体、EGF受容体、PDGF受容体、VEGF受容体)およびGタンパク質共役型受容体(G protein coupled receptor : GPCR)からのシグナル(①と②)は、RASおよびPI3Kを活性化し(③)、GDP/GTP交換反応を促進するGEF(guanine-nucleotide exchange factors)の作用によって(④)、Rac/Cdc42はGTP結合型になって活性化し(⑤)、Rac/Cdc42のエフェクターであるp21活性化キナーゼ(PAK-1)を活性化する(⑥)。活性化したPAK-1は細胞の生存と増殖を促進し、がん細胞の増殖と転移を亢進する(⑦)。さらに、PAK-1はRASによるMAPキナーゼ(分裂促進因子活性化タンパク質キナーゼ)経路の活性化を増強する(⑧)。PAK-1の活性化は、RacおよびCdc42を介する以外に、GTPaseに依存しないメカニズムでも起こる。
細胞膜受容体からPI3Kへの増殖シグナルの下流の伝達系は脂質ラフトに集合しています。コレステロールを減らして脂質ラフトを減少させれば、このシグナル伝達系は抑制できます。
さらにPAK-1はイベルメクチンで阻害されます。つまり、シンバスタチンとイベルメクチンの相乗効果が期待できます。(下図)
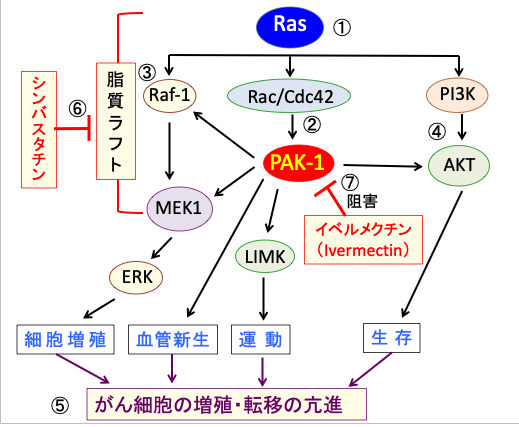
図:低分子量Gタンパク質のRASは細胞外のさまざまな刺激(チロシンキナーゼ受容体やサイトカイン受容体やカルシウムチャネルなど)を受けて細胞増殖や生存を促進するRAFキナーゼ(Raf-1)やPI-3キナーゼ(PI3K)など多数のシグナル伝達系を活性化する(①)。p21活性化キナーゼ(PAK-1)はRacおよびCdc42のような低分子量GTPaseによって活性化される(②)。PAK-1はRasシグナル伝達系の主要な経路であるRaf-1/MEK1/ERK経路(③)とPI3K/AKT経路(④)を活性化する。このように、PAK-1は複数のシグナル伝達系の制御に関与し、がん細胞の増殖と転移を促進する(⑤)。これらのシグナル伝達系のタンパク質は細胞膜の脂質ラフトに集合しているため、脂質ラフトを減少するシンバスタチンはRaf-1/MEK1/ERK経路とPI3K/AKT経路を阻害する(⑥)。寄生虫治療薬のイベルメクチン(Ivermectin)はPAK-1阻害する作用によって、抗腫瘍作用を発揮する(⑦)。したがって、シンバスタチンとイベルメクチンは相乗効果が期待できる。
以下のような報告もあります。
Cholesterol targeting alters lipid raft composition and cell survival in prostate cancer cells and xenografts.(コレステロール標的化は、前立腺がん細胞および異種移植片における脂質ラフト組成および細胞生存を変化させる)J Clin Invest. 2005 Apr 1; 115(4): 959–968.
【要旨の抜粋】
脂質ラフトは、細胞膜内のコレステロールおよびスフィンゴ脂質に富むマイクロドメインで、細胞膜に結合したタンパク質に由来するリン酸化カスケードを制御する。この研究では、前立腺がん細胞膜の脂質ラフトのコレステロール含有量の変化が、in vitro および in vivo での細胞生存メカニズムに影響を与えるかどうかを検討した。
コレステロール合成阻害剤であるシンバスタチンは、脂質ラフトのコレステロール含有量を低下させ、セリン-スレオニン・キナーゼ のAkt経路を阻害し、前立腺がん細胞のアポトーシスを誘導した。細胞膜にコレステロールを補充すると、シンバスタチンによるAkt阻害とアポトーシス誘導が阻止された。
コレステロールは、正常な前立腺上皮細胞の Akt 活性化も増強した。
SCIDマウスにおける循環コレステロールの上昇は、異種移植腫瘍から単離された脂質ラフトにおけるコレステロール含有量およびタンパク質チロシンリン酸化の程度を増加させた。
コレステロールの上昇は腫瘍の増殖を促進し、Akt のリン酸化を増加させ、異種移植片のアポトーシスを減少させた。
これらの結果は、正常細胞と悪性細胞の両方で膜コレステロールがAktシグナル伝達に関係していることを示しており、前立腺がん細胞の細胞生存が、コレステロールによって制御されたAkt経路に依存する可能性を示唆している。
シンバスタチン治療は、がん 細胞の脂質ラフトのコレステロール含有量を減少させ、ラフトでの Akt リン酸化を阻害します。Aktシグナル伝達がコレステロール依存性メカニズムの制御下にあり、腫瘍細胞におけるこの経路の必須の細胞生存機能が、膜コレステロールレベルの低下および/または脂質ラフト構造の変化によって損なわれることを示しています。
シンバスタチンや他のスタチン系薬剤は、ファルネシル ピロリン酸やゲラニル ピロリン酸など、メバロン酸経路の他の生成物の合成に影響を与えます。これらは、Ras や Rho GTPase などの多数のシグナル伝達タンパク質の翻訳後修飾にも使用されます。
すなわち、シンバスタチンはイソプレノイド合成の阻害によってRas や Rho GTPaseを阻害し、コレステロールの合成阻害によって脂質ラフトを減少させて、増殖シグナル伝達系の活性化を抑制し、細胞死(アポトーシス)を誘導する効果を発揮します。
| « 817)亜麻仁油... | 819)脂質ラフ... » |



