がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
476)ヒストンアセチル化をターゲットにしたがん治療(その2):食事+サプリ+医薬品
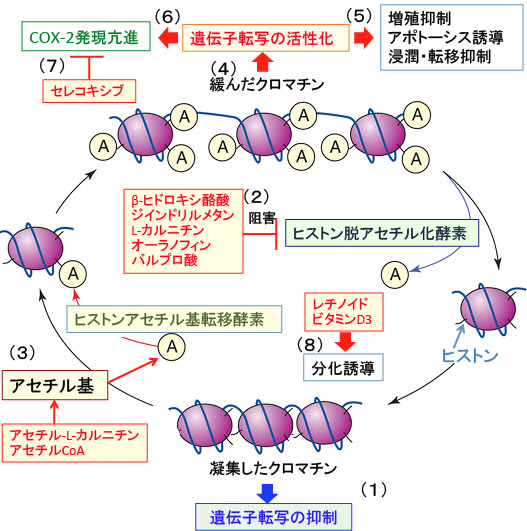
図:(1)ヒストン脱アセチル化酵素によってヒストンのアセチル化が低下するとクロマチンが凝集して遺伝子転写活性は抑制される。(2)ケトン食で産生されるβ-ヒドロキシ酪酸、サプリメントのジインドリルメタン、L-カルニチン、医薬品のオーラノフィン、バルプロ酸はヒストン脱アセチル化酵素を阻害してヒストン・アセチル化を亢進する。(3)グルコースや脂肪酸の分解で産生されるアセチルCoAやアセチル-L-カルニチンはアセチル基を供給してヒストン・アセチル化を亢進する。(4)ヒストン・アセチル化によってクロマチンが緩むと遺伝子転写活性が亢進する。(5)その結果、がん抑制遺伝子の発現亢進などによってがん細胞の増殖抑制、アポトーシス誘導、浸潤・転移の抑制が起こる。(6)一方、シクロオキシゲナーゼ-2(COX-2)の発現も亢進され、COX-2はがん細胞の増殖促進に作用する。(7)COX-2阻害剤のセレコキシブ(セレコックス)を併用することによってCOX-2活性を阻害できる。(8)ヒストン・アセチル化が亢進した状況で分化誘導剤のレチノイド(イソトレチノインなど)とビタミンD3を併用すると、がん細胞の分化を誘導できる。
476)ヒストンアセチル化をターゲットにしたがん治療(その2):食事+サプリ+医薬品
【がんの代替医療では副作用の少ないものから使用する】
標準治療における抗がん剤治療では、副作用が強くても、がん細胞を死滅させる効果の強い薬を優先的に使います。がんを縮小させることが最優先の目標であり、体力や抵抗力や治癒力が犠牲になっても気にしません。
一方、がんの代替医療では、副作用が少ないもの、体の治癒力を低下しないでがん細胞の増殖を抑えるものから使用します。
がんにもいろいろあり、食事療法だけで増殖を抑えられるものから、強い抗がん剤でも全く効果が出ないものまであります。したがって、効果が弱くても副作用が少ないものから、効果をみながら段階的に治療を追加していきます。
つまり、食事療法→サプリメント→医薬品の順で追加していきます。効果が出ていれば、その組合せで維持します。効果が弱ければ、さらに追加していきます。
ヒストンアセチル化をターゲットにしたがん代替医療でも、食事療法としてケトン食(ケトン体のβ-ヒドロキシ酪酸は内因性のヒストン脱アセチル化酵素阻害作用がある)や腸内での酪酸の産生を増やす水溶性食物繊維の摂取を行い、サプリメントとしてはヒストン脱アセチル化酵素阻害作用があるジインドリルメタン、L-カルニチン、アセチル-L-カルニチンがあります。これらのサプリメントはその他のメカニズムでも抗腫瘍効果や抗がん剤治療の副作用軽減効果があります。
これらでヒストンアセチル化を誘導して、さらにその抗腫瘍効果を高めるレチノイド(イソトレチノイン)とビタミンD3で細胞分化を誘導します。レチノイドとビタミンD3の分化誘導作用はヒストン脱アセチル化酵素阻害剤との併用で強化されることが報告されています。
さらに、シクロオキシゲナーゼ-2(COX-2)阻害剤のcelecoxib(セレコックス)を併用するとヒストン脱アセチル化酵素阻害剤の抗腫瘍効果が増強されます。(475話参照)
さらにヒストン脱アセチル化酵素阻害作用がある医薬品のオーラノフィン(リュウマチの治療薬)や抗てんかん薬のバルプロ酸ナトリウム(デパケン、セレニカなど)を追加すると抗腫瘍効果を高めることができます。
オーラノフィンはヒストン脱アセチル化酵素阻害作用以外にも様々なメカニズムで抗腫瘍効果を発揮します。(424話、427話、429話、431話)
さらにアルコールを飲まない人はアルデヒド脱水素酵素阻害剤のジスルフィラムが、以上の薬と併用して効果を発揮します。
【β-ヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害する】
β-ヒドロキシ酪酸はケトン体の一種です。ケトン体は絶食などで糖質が枯渇した状態で脂肪酸の燃焼(β酸化)が亢進したときに肝臓で産生され、グルコース(ブドウ糖)が枯渇した時の代替エネルギーになります。絶食時などで日常的に産生されています。
ケトン体としてアセト酢酸、βヒドロキシ酪酸、アセトンの3種が作られますが、アセトンは呼気となって排泄され、アセト酢酸とβヒドロキシ酪酸はエネルギー源になります。
グルコースのもとになる糖質の摂取をできるだけ減らし、がん細胞の増殖抑制効果があるω3系不飽和脂肪酸(αリノレン酸、エイコサペンタエン酸、ドコサヘキサエン酸)やオリーブオイルやケトン体を出しやすくする中鎖脂肪酸トリグリセリドのような脂肪を多く摂取するケトン食という食事療法が進行がんの治療に有効であることが報告されています。
ケトン食は、がん細胞にエネルギー源のグルコースの供給を減らし、がん細胞の増殖を刺激するインスリンの分泌を抑制する効果など、複数の作用機序でがん細胞の増殖を抑制します。
ケトン体のβヒドロキシ酪酸がクラスIのヒストン脱アセチル化酵素を阻害することが報告されています。2~3日の絶食や中鎖脂肪酸を多く摂取するケトン食で日常的に達成できる1~2mM程度の濃度でクラスIのヒストン脱アセチル化酵素の阻害作用が期待できます。(詳細は322話参照)
中鎖脂肪酸中性脂肪を多く摂取すると、糖質を1日40グラム以下の低糖質食でカロリー制限せずに血液中のβ-ヒドロキシ酪酸を1~2mM程度に上げることは簡単に達成できます。糖質摂取をもっと減らせば2mM以上に上げることができます。
ヒストン脱アセチル化酵素の阻害剤として単鎖脂肪酸の酪酸が有名です。酪酸は、食物繊維を腸内細菌が嫌気性発酵させてできます。脂肪酸の分解過程で生合成されるほか、バターやチーズや皮脂にも含まれています。銀杏や足の悪臭の原因にもなっています。
培養したがん細胞に酪酸を添加すると、増殖抑制や分化誘導が起こり、その作用機序は酪酸によるヒストン脱アセチル化酵素の阻害作用によるものです。
βヒドロキシ酪酸は酪酸のHがOHに変わっただけで化学構造が似ています。
酪酸とβヒドロキシ酪酸はともにヒストン脱アセチル化酵素阻害作用があります。
酪酸は水溶性食物繊維の摂取を増やすと腸内細菌の発酵で増やせます。(392話参照)

図:超低糖質と高脂肪の食事でケトン体の産生を高めるケトン食と、大腸内での短鎖脂肪酸の産生を増やす食物繊維の多い食事(高食物繊維食)は、抗がん作用において相乗効果が期待できる。ケトン体と短鎖脂肪酸はミトコンドリアで分解されてATP産生に使われるが、糖質摂取を避けることによってインスリン分泌を刺激しないエネルギー産生源となる。ケトン体のβ-ヒドロキシ酪酸と短鎖脂肪酸の酪酸はともにヒストン脱アセチル化酵素を阻害してヒストンのアセチル化を亢進する。ヒストンアセチル化はがん細胞の増殖を抑制する。短鎖脂肪酸は脂肪酸受容体のGPR43への結合を介してがん細胞の増殖を抑えるという報告もある。
短鎖脂肪酸は脂肪酸受容体のGPR43などを介して代謝やがん細胞の増殖に影響することが報告されています。例えば、大腸内で生成した短鎖脂肪酸のプロピオン酸が、門脈を介して肝臓に到達し、G タンパク質共役型受容体 (GPCR) の一つであるFFAR2 (別名:GPR43)を介して、肝臓に転移したがん細胞の増殖を抑制することが報告されています。
葉菜類や海草類やキノコ類のような糖質が少なく食物繊維の豊富な食品や、イヌリンやグルカンなど水溶性食物繊維のサプリメントを積極的に摂取するとケトン食の抗がん作用を増強できると思います。
また、亜麻仁油や紫蘇油や魚油に多く含まれるオメガ3系多価不飽和脂肪酸と中鎖脂肪酸を多く摂取すると、さらに抗腫瘍効果が得られます。(349話参照)

図。ココナッツオイルやMCTオイル(100%中鎖脂肪酸)の中鎖脂肪酸は糖質制限の条件下でケトン体(βヒドロキシ酪酸やアセト酢酸)を多く産生する。ω3系不飽和脂肪酸のドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)はレゾルビンやプロテクチンなどの抗炎症性の脂質メディエーターを産生する。ケトン体やDHA/EPA由来の抗炎症性メディエーターは抗炎症作用や抗がん作用を有する。さらに、ω3系多価不飽和脂肪酸自体に抗酸化作用があり、アラキドン酸と競合することによって抗炎症作用や抗がん作用を発揮する。がんのケトン食療法において、ω3系多価不飽和脂肪酸(αリノレン酸、DHA、EPA)と中鎖脂肪酸を多く摂取するメリットは大きい。
つまり、中鎖脂肪酸とω3系多価不飽和脂肪酸と水溶性食物繊維の多い食品を組み合せたケトン食はヒストン脱アセチル化酵素阻害作用だけでなく、抗炎症や抗酸化作用や直接的な抗がん作用も加わって抗腫瘍効果を発揮します。
【ジインドリルメタンは様々なメカニズムで抗腫瘍効果を発揮する】
ジインドリルメタンはアブラナ科の植物に含まれるインドール化合物で、欧米ではサプリメントとして販売されています。
ジインドリルメタンは「がんを促進する炎症性シグナル」の中心になっているIL-6/JAK/STAT3経路を阻害する作用が報告されています。(428話参照)
IL-6(インターロイキン-6)とJAK(ヤーヌス・キナーゼ)とSTAT3(シグナル伝達兼転写活性化因子-3)については427話で解説しています。この経路はリュウマチ治療薬のオーラノフィンでも阻害されます。オーラノフィンはヒストン脱アセチル化酵素を阻害する作用もあります。
ジインドリルメタンがヒスト脱アセチル化酵素を阻害する作用が報告されています。以下のような論文があります。
Chemopreventive agent 3,3'-diindolylmethane selectively induces proteasomal degradation of class I histone deacetylases.(がん化学予防物質ジインドリルメタンはクラスIヒストン脱アセチル化酵素のプロテアソームでの分解を選択的に誘導する。)Cancer Res. 2010 Jan 15;70(2):646-54.
【要旨】
ジインドリルメタン(3,3'-Diindolylmethane :DIM)は抗がん作用をもつ物質で、細胞周期の停止やアポトーシス誘導を引き起こすが、そのメカニズムは解明されていない。この論文では、DIMは、クラスIIのヒストン脱アセチル化酵素(HDAC)は阻害せず、クラスIのヒストン脱アセチル化酵素(HDAC1, HDAC2, HDAC3,HDAC8)を選択的に、プロテアソームを介するタンパク分解を誘導することを報告する。
ヒト大腸がん細胞を用いたin vitroの実験と、移植腫瘍を用いたin vivoの実験系において、DIMはクラスIHDACの発現量を減少させた。
ヒストン脱アセチル化酵素(HDAC)によって阻害されたサイクリン依存性キナーゼ阻害因子のp21WAF1とp27KIP2の転写は、HDACを枯渇させることによって発現量が増え、その結果、細胞周期のG2期で停止した。さらに、HDACの枯渇はDNAのダメージを誘導し、アポトーシスを引き起こす。これらの結果は、DIMがクラスIのHDACの分解を選択的にターゲットにしていることを示している。
次のような報告もあります。
3,3'-Diindolylmethane, but not indole-3-carbinol, inhibits histone deacetylase activity in prostate cancer cells.(3,3’-ジインドリルメタンは前立腺がん細胞におけるヒストン脱アセチル化酵素を阻害するがインドール-3-カルビノールは阻害しない)Toxicol Appl Pharmacol. 2012 Sep 15;263(3):345-51.
ブロッコリーやケールなどのアブラナ科の植物や野菜には抗がん作用のある成分が多く含まれていますが、その代表的な成分がGlucobrassicin(グルコブラシシン)です。
グルコブラシシンは加水分解してインドール-3-カルビノール(Indole-3-carbinol)になり、さらに胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタン(3,3'-diindolylmethane, DIM)になります(下図)。
ジインドリルメタンはヒストン脱アセチル化酵素を阻害し、細胞周期を停止させるp21の発現を亢進して、前立腺がんの増殖を抑制することが報告されています。

図:アブラナ科の植物や野菜に含まれるGlucobrassicin(グルコブラシシン)は加水分解してインドール-3-カルビノール(Indole-3-carbinol, I3C)になり、さらに胃の中の酸性の条件下でI3Cが2個重合したジインドリルメタン(3,3‘-diindolylmethane, DIM)になる。I3CとDIMは、がん細胞の増殖抑制、アポトーシス誘導などの抗がん作用を有する。ジインドリルメタンはAkt/NF-κBシグナル伝達系やIL-6/JAK/STAT3経路やHIF-1(低酸素誘導因子-1)の活性を抑制する作用やヒストン脱アセチル化酵素阻害など様々なメカニズムで抗腫瘍活性を示す。
【L-カルニチンとアセチル-L-カルニチンはヒストンのアセチル化を促進する】
L-カルニチンは生体の脂質代謝に関与するビタミン様物質です。L-カルニチンは脂肪酸と結合し、脂肪酸をミトコンドリアの内部に運搬する役割を担っています。
脂肪酸を燃焼してエネルギーを産生する際には、脂肪酸を燃焼の場であるミトコンドリアに運ばなければなりません。中鎖脂肪酸(炭素数が8~12個)の場合は直接ミトコンドリアに入ることができますが、長鎖脂肪酸(炭素数が13以上)の場合は、L-カルニチンが結合しないとミトコンドリアの中に入ることができません。したがって、ケトン食の場合もL-カルニチンは脂肪の代謝を促進するので、有用なサプリメントです。

図:長鎖脂肪酸はL-カルニチンと結合しないとミトコンドリアに入れない。
L-カルニチンはヒトの体内で合成されます。カルニチンの合成には2つの必須アミノ酸(リジン、メチオニン)、3つのビタミン(ビタミンC、ナイアシン、ビタミンB6)、還元型鉄イオンが必要で、これらの栄養素の一つでも不足すればカルニチンは不足することになります(下図)。

通常、体内に存在するカルニチンの75%は食事由来で、体内で合成されるのは25%程度です。L-カルニチンの合成は肝臓、腎臓、脳でのみ起こります。心筋細胞や骨格筋は脂肪酸の酸化によって主なエネルギーを得ていますが、カルニチンを合成できないため、血液中のカルニチンを取り込んで利用しています。筋肉中には体内の約95%のカルニチンが蓄積されており、筋肉中のカルニチンの濃度は血中の70倍以上と言われています。
食事性カルニチンの主な供給源は肉類と乳製品であり、穀類、果物、野菜にはほとんど含まれていません。体内で合成されますが、がんの治療で体力が消耗したり、栄要素が不足するとL-カルニチンの欠乏がおこり、細胞内でのエネルギー産生が低下します。
がんの代替医療では菜食主義を徹底する治療法もありますが、肉や乳製品を完全に排除する食事はカルニチンの不足を引き起こしやすくします。しかし、肉や乳製品の過剰摂取はがんの進行を促進する可能性もあるため、サプリメントでの摂取は有用です。
L-カルニチンは体脂肪の燃焼を促進することで、ダイエットのサプリメントとして人気がありますが、細胞のエネルギー産生を高める効果があるので、様々な病気の治療にも応用されています。がん治療においても、抗がん剤治療による倦怠感や抑うつ気分を軽減する効果が報告されています。
抗がん剤治療中をはじめ、がん患者が訴える倦怠感や体力低下に、体内でのL-カルニチンの不足の関与が指摘されています。カルニチンの不足は脳でのエネルギーの枯渇を引き起こし、抑うつ気分や思考力の低下の原因にもなります。
L-カルニチンが抗がん剤治療中の倦怠感や抑うつ気分を改善する効果が臨床試験で確認されています。
抗がん剤のアドリアマイシンの心臓へのダメージをL-カルニチンが軽減したという報告もあります。シスプラチンによる腎臓障害を防いだり、タキソールによる神経障害を軽減する効果も報告されています。
筋肉量を増やす作用や抗炎症作用(炎症性サイトカインの発現抑制)や抗酸化作用があるので、進行がんでのがん性悪液質における筋肉量減少や体力低下や倦怠感の改善に有効であることが多くの研究で報告されています。
前述のようにL-カルニチンは長鎖脂肪酸をミトコンドリアへ運ぶのが主な作用ですが、L-カルニチンが内因性のヒストン脱アセチル化酵素の阻害剤として作用し、がん細胞の増殖を選択的に阻害することが最近の研究で明らかになっています。
L-カルニチンはヒストン脱アセチル化酵素の活性部位に結合することによって、この酵素の活性を阻害し、ヒストンのリジンのアセチル化を高める作用があると報告されています。培養細胞や移植腫瘍を使った実験系で、L-カルニチンの投与によってがん抑制遺伝子のp21cip1遺伝子の部分のクロマチンのアセチル化したヒストンの量が増え、p21cip1遺伝子の発現量が増えることが示されています。その結果、L-カルニチンはがん細胞の増殖を抑制しました。
P21cip1は細胞周期の進行を担うサイクリン依存性キナーゼ(CDK)の活性を抑制し、細胞増殖を停止し、分化を誘導します。すなわち、L-カルニチンはヒストン脱アセチル化酵素を阻害することによって、p21cip1のような細胞周期の進展を阻害する遺伝子の発現を高めることによってがん細胞の増殖を抑える作用が期待できます。
アセチル-L-カルニチン(Acetyl-L-Carnitine)はL-カルニチン(L-Carnitine)にアセチル基(CH3CO-)が結合した体内成分です。
体内のL-カルニチンのうち約1割はアセチル-L-カルニチンの状態で存在しています。アセチル-L-カルニチンは、血液脳関門を通過して脳内に到達しアセチルコリン量を増やします。つまり、アセチル受容体であるコエンザイムA(CoA)にアセチル基を転移させてアセチルCoAを生成させ、さらにそれがコリンに受け渡され、最終的にアセチルコリンが生成します。
アセチル-L-カルニチンは細胞内でL-カルニチンに変換するので、L-カルニチンと同じ効果(脂質の燃焼促進)があります。
さらに、アセチル-L-カルニチンは神経細胞のダメージの軽減や、ダメージを受けた神経細胞の修復・再生を促進する効果が報告されています。したがって、抗がん剤による神経障害の軽減にも有効です。抗がん剤の効き目を高める効果も報告されています。
アセチル-L-カルニチンのアセチル基が、細胞核のヒストンのアセチル化に使われることが報告されています。(Epigenetics 4(6):399-403, 2009
)

図:L-カルニチンはヒストン脱アセチル化酵素を阻害する作用があり、アセチル-L-カルニチンはアセチル基を供給することによってヒストンアセチル化を促進する。
哺乳類の細胞核におけるヒストンのアセチル化に必要なアセチルCoAの供給源については十分に明らかになっていません。この論文では、グルコースや脂肪酸の分解によってミトコンドリアで生成されたアセチルCoAのアセチル基がL-カルニチンに渡されてアセチル-L-カルニチンになり、アセチル-L-カルニチンは細胞核に運ばれ、核でアセチルCoAに変換され、ヒストンのアセチル化のアセチル基の供給源となることが報告されています。
細胞核におけるヒストンのアセチル化では、アセチル-CoAのアセチル基が使われます。アセチル-CoAはミトコンドリアでグルコース(ブドウ糖)や脂肪酸の分解で生成されます。しかしアセチル-CoAは細胞膜を通れないので、ヒストンアセチル化に必要なアセチル基の供給源としてアセチルCoAを細胞核に運搬するのに、細胞膜を通過できるL-カルニチンとアセチル-L-カルニチンが利用されているというメカニズムです。この経路をまとめると図のようになります。
図:グルコースや脂肪酸の分解によってミトコンドリアで生成されたアセチルCoAのアセチル基がL-カルニチンに渡されてアセチル-L-カルニチンになる。アセチル-L-カルニチンは細胞核に運ばれ、核でアセチルCoAに変換され、ヒストンのアセチル化のアセチル基の供給源となる。アセチルCoAは細胞膜を通過できないので、L-カルニチンとアセチル-L-カルニチンが利用されている。
前述のように、L-カルニチンにはヒストン脱アセチル化酵素阻害作用によってヒストンのアセチル化のレベルを高める作用があります。さらに、L-カルニチンはアセチル-L-カルニチンとしてミトコンドリアで生成されたアセチルCoAを核に運ぶ役割も担っています。核ではアセチルCoAのアセチル基がヒストンアセチル基転移酵素の働きでヒストンをアセチル化します。つまり、L-カルニチンのヒストン脱アセチル化酵素阻害作用とアセチル-L-カルニチンによるアセチル基の供給作用によって、ヒストンのアセチル化を促進する作用があると言えます(下図)。
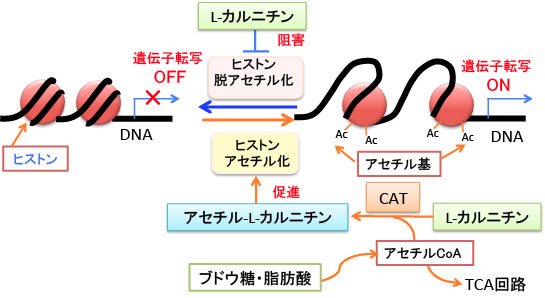
図:L-カルニチンはヒストン脱アセチル化酵素を阻害してヒストンのアセチル化を促進する。グルコースや脂肪酸の分解によってミトコンドリアで生成されたアセチルCoAのアセチル基はL-カルニチンに渡されアセチル-L-カルニチンとなって核に運ばれてアセチル基の供給源となる。
L-カルニチンには、抗がん剤治療中やがん性悪液質における倦怠感を緩和する効果が臨床試験で示されています。
抗がん剤治療の副作用を軽減し、抗腫瘍効果を高める効果も臨床試験で示されています。さらに、ヒストン脱アセチル化酵素の阻害によるヒストンのアセチル化というエピジェネティックな機序によってがん細胞の増殖を抑える効果が示唆されています。
ほとんど副作用は無いので、がんの治療にL-カルニチンを1日2~4グラム程度やや多めに摂取することは有用だと考えられます。特に、がんのケトン食療法では、長鎖脂肪酸の燃焼を促進するために、L-カルニチンのサプリメントでの摂取は有用です。(詳細は313話参照)
【関節リュウマチ治療薬のオーラノフィンはヒストンアセチル化を亢進する】
オーラノフィン(Auranofin)は、関節リュウマチにおける炎症反応や免疫異常を抑制して、寛解へと導く経口金製剤として1985年以降臨床で使用されています。通常、非ステロイド抗炎症剤を使用しても効果がないときに使われます。
作用機序は十分に解明されていませんが、炎症細胞の機能抑制や、免疫細胞に作用して自己抗体の産生を抑制して、関節における炎症を抑制します。
通常、成人にはオーラノフィンとして1 日6mg(本剤2 錠)を朝食後及び夕食後の2 回に分割経口します。
主な副作用は下痢や腹痛や口内炎などの消化器症状が1~5%程度、発疹や掻痒などの皮膚症状が2~3%程度、その他1%以下の頻度で蛋白尿、貧血、浮腫、肝障害などが報告されていますが、比較的副作用の少ない安全性の高い薬です。
そして最近、抗腫瘍効果が注目されています。実際、米国ではがん治療へのオーラノフィンの効果を検討する第2相臨床試験の実施がFDA(食品医薬品局)から承認されています。
今まで報告されたオーラノフィンの抗がん作用のメカニズムは多様です。
DNAやRNAやタンパク質の合成阻害や、ミトコンドリアのチオレドキシン還元酵素やグルタチオン-S-トランスフェラーゼやプロテアソームの機能阻害、IL-6/STAT3シグナル伝達系の阻害、NF-κB経路の阻害など多くの機序が報告されています。(424話、427話、431話参照)
さらに、オーラノフィンがヒストンアセチル化を促進してレチノイドやビタミンD3の分化誘導作用を促進することが報告されています。(429話参照)
Auranofin promotes retinoic acid- or dihydroxyvitamin D3-mediated cell differentiation of promyelocytic leukaemia cells by increasing histone acetylation.(オーラノフィンは、ヒストン・アセチル化を増やすことによって、レチノイン酸あるいはジヒドロキシ・ビタミンD3による前骨髄球性白血病の分化誘導作用を促進する) British Journal of Pharmacology. 2008;154(6):1196-1205. doi:10.1038/bjp.2008.197.
前骨髄球性白血病(promyelocytic leukaemia)は、骨髄球になる前の段階の前骨髄球ががん化しています。レチノイドとビタミンD3は、この前骨髄球性白血病を骨髄球まで最終分化させて腫瘍性を無くすことができます。
患者から採取した腫瘍細胞や培養株になっている腫瘍細胞を使って実験しています。
この実験系で、通常では分化誘導作用を示さない濃度のレチノイドやビタミンD3で細胞を処理するときにオーラノフィンを併用すると、分化誘導作用が増強されました。
細胞核内のレチノイン酸受容体β2(RARβ2)遺伝子のプロモーター領域のヒストンアセチル化が亢進していました。
ビタミンD3とオーラノフィンの併用投与はp21遺伝子のプロモーター領域のヒストン・アセチル化と細胞周期のG0/G1期での停止を促進しました。
細胞増殖を抑制するP21, p27, PTENの発現が亢進し、細胞分裂を促進するサイクリンA、Cdk2、Cdk4の発現は減少していました。
低リン酸化したpRbは、両方を併用することによって増加しました。Rbタンパク質はリン酸化されると細胞増殖が促進されます。低リン酸化の状態は細胞周期を停止させる効果があります。
ATRAか1,25(OH)2 vit D3にオーラノフィンを併用すると、ヒストン・アセチル化の促進と分化誘導関連の遺伝子の発現に作用して、前骨髄急性白血病の分化誘導を促進したという報告です。
固形がんの分化誘導や増殖抑制の目的で、ニキビ治療薬のイソトレチノイン(20~40mg/日)とサプリメントのビタミンD3(4000 IU/日)と関節リュウマチ治療薬のオーラノフィン(3~6mg/日)の併用や、さらに中鎖脂肪ケトン食、アセチル-L-カルニチンなどの組合せは、がん細胞の増殖を抑制する方法として相乗効果が期待できると思います。実際に、複数のがん患者さんに試してみて、副作用はほとんどなく、有効性を経験しています。

図:ビタミンD3とレチノイドはそれぞれの核内受容体に結合してヘテロ2量体を形成して遺伝子転写を促進し、がん細胞の増殖抑制や分化誘導や細胞死(アポトーシス)誘導作用を示す。絶食やケトン食によって産生されるβヒドロキシ酪酸やアセチル-L-カルニチンやオーラノフィンはヒストンのアセチル化を亢進する作用によってレチノイドとビタミンD3の抗腫瘍効果を増強する。オーラノフィンには抗炎症作用やチオレドキシン還元酵素阻害作用があり、これらの作用は抗腫瘍作用を増強する。
【COX-2阻害剤のセレコキシブとてんかん治療薬のバルプロ酸ナトリウム】
ヒストン脱アセチル化酵素阻害剤でヒストンアセチル化を亢進するとCOX-2の発現亢進が起こることが報告されています(475話)。したがって、COX-2阻害剤のcelecoxibe(セレコックス)を併用すると抗腫瘍効果が増強します。
てんかん治療薬のバルプロ酸ナトリウム(商品名はデパケン、セレニカなど)はヒストン脱アセチル化酵素の阻害作用が知られています。
以上のように、クラスIとIIのヒストン脱アセチル化酵素を阻害するためにケトン食(β-ヒドロキシ酪酸)、オーラノフィン(リュウマチの治療薬)、L-カルニチン、アセチル-L-カルニチン、ジインドリルメタン、酪酸(水溶性食物繊維の腸内発酵によって産生)、抗てんかん薬のバルプロ酸ナトリウム(デパケン、セレニカなど)などを併用し、これにシクロオキシゲナーゼ-2阻害剤のcelecoxib(セレコックス)や分化誘導作用があるビタミンD3やレチノイドを加えるという治療法はがんの代替医療として試してみる価値があります。(トップの図参照)
| « 475)ヒストン... | 477)医療大麻... » |



