がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
775)高用量メラトニン治療(その2):がん治療としての高用量メラトニン摂取
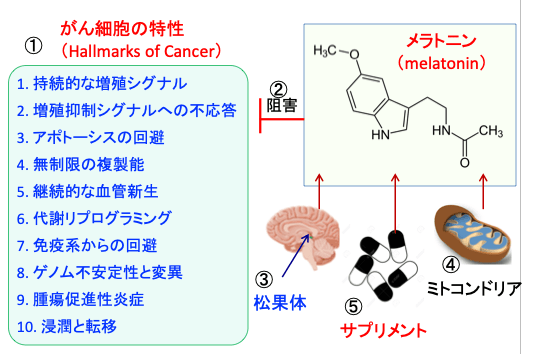
図:Douglas Hanahanと Robert Weinbergはがん細胞の特性(Hallmarks of Cancer)として10項目(持続的な増殖シグナル、増殖抑制シグナルへの不応答、アポトーシスの回避、無制限の複製能、継続的な血管新生、代謝リプログラミング、免疫系からの回避、ゲノム不安定性と変異、腫瘍促進性炎症、浸潤と転移)を挙げている(①)。この10項目のがん細胞の特性の全てにおいてメラトニンは抗腫瘍的に作用する(②)。体内では、メラトニンは脳の松果体(③)や、細胞のミトコンドリア(④)で産生されている。がん治療においてはサプリメント(⑤)から大量のメラトニンを外来性に摂取するという手段もある。
775)高用量メラトニン治療(その2):がん治療としての高用量メラトニン摂取
【メラトニンは多彩な機序で抗がん作用を発揮する】
メラトニンの抗腫瘍作用のメカニズムは多彩です。
メラトニンが低酸素誘導因子-1(HIF-1)の発現を抑制するメカニズムで、がん細胞の解糖系を抑制し、ミトコンドリアでの酸化的リン酸化を促進して、ワールブルグ効果を是正する効果については774話で解説しました。
がん細胞の代謝の特徴は、酸素が十分に利用できる状況でも、酸素を使わない解糖系が亢進し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されていることです。つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。
このような代謝の特徴の根本的なメカニズムは、がん細胞では酸素濃度とは関係なく、恒常的にHIF-1が活性化しているためです。つまり、がん細胞では恒常的に低酸素シグナルがオンになっているということです。その理由は、がん細胞で活性化されているmTORC1やSTAT3がHIF-1の産生を促進するからです。
HIF-1はがん幹細胞の幹細胞として能力を維持させる作用、上皮-間葉移行や細胞接着因子の遺伝子発現を誘導する作用、血管内皮増殖因子(VEGF)を介する血管新生によりがん細胞の遠隔転移を促進する作用なども知られています。
つまり、HIF-1活性が亢進するとグルコースの取込みと解糖系とペントースリン酸経路が亢進し、ミトコンドリアでの酸化的リン酸化の活性が抑制され、さらに、血管新生が促進され、乳酸の産生が増えると免疫細胞が抑制され、結合組織の分解も促進されて転移や浸潤が起こりやすくなるので、HIF-1活性が高いがんほど予後が悪いと言えます。
メラトニンはHIF-1αの核内への移行を阻害する作用があります。
Douglas Hanahanと Robert Weinbergはがん細胞の特性(Hallmarks of Cancer)として以下の10項目を挙げています。
- 持続的な増殖シグナル
- 増殖抑制シグナルへの不応答
- アポトーシスの回避
- 無制限の複製能
- 継続的な血管新生
- 代謝リプログラミング
- 免疫系からの回避
- ゲノム不安定性と変異
- 腫瘍促進性炎症
- 浸潤と転移
メラトニンはこれら10項目に対して、抗腫瘍的に作用します。
つまり、メラトニンはがん細胞の増殖や転移を抑制し、細胞死(アポトーシス)を誘導し、血管新生を阻害し、抗腫瘍免疫を増強し、代謝を正常化する作用があります。
HIF-1の活性を抑制しワールブルグ効果を是正する作用は、無制限の複製や増殖や浸潤や転移の抑制や、血管新生の抑制を説明できます。さらにメラトニンは強い抗酸化作用や免疫増強作用があります。

図:メラトニンは多彩なメカニズムで抗腫瘍効果を発揮する。HanahanとWeinbergががんの特徴として挙げている10項目(持続的な増殖シグナル、増殖抑制シグナルへの不応答、アポトーシスの回避、無制限の複製能、継続的な血管新生、代謝リプログラミング、免疫系からの回避、ゲノム不安定性と変異、腫瘍促進性炎症、浸潤と転移)の全てにおいてメラトニンは抗腫瘍的に作用する。(参考:Melatonin and Cancer Hallmarks. Molecules. 2018 Mar; 23(3): 518.)
【メラトニンは日本ではサプリメントとして認可されていない】
世の中には何千、何万という種類のサプリメントが販売されています。「がんに効く」という宣伝のサプリメント(いわゆる抗がんサプリメント)も何百種類と販売されています。
抗がんサプリメントの中で、効能の点において、メラトニンはかなり上位にくるサプリメントです。個人的意見としては、トップに位置づけても良いと思うほどエビデンスがあり、その研究論文は最近も増えています(下図)。

図: PubMed(アメリカ国立医学図書館の国立生物工学情報センターが運営する医学・生物学分野の学術文献検索サービス)で「Melatonin」で検索すると28000件以上の論文がヒットする(2021年9月末時点)。メラトニンが発見された1958年の論文から、1996年には年間500報を超え、最近では1年間に1800以上のメラトニンに関する論文が発表されている(上図)。 メラトニンとがん(Melatonin and cancer)で検索しても、論文数は毎年増えている(下図)。
米国ではサプリメント(dietary supplement)として販売されており、ドラッグストアーなどで誰でも容易に購入できます。
日本ではメラトニン製剤は医薬品に区分されているためサプリメントとしては製造や販売はできません。
メラトニンを利用する方法として、個人輸入で入手するか、米国渡航時に入手するなどがあります。個人使用の場合は、原則として1度に2ヶ月分くらいまでは輸入できることになっています。インターネット上では、メラトニンの個人輸入を代行するサイトも数多くあります。
医師の場合は、薬監証明(医薬品輸入報告書)を取得して輸入し、処方薬として病気の予防や治療に使えます。
日本で認可されていない医薬品でも、医師であれば、厚生労働省から薬監証明を取得することによって合法的に輸入し、日本国内で処方薬として治療に使えます(ただし、健康保険は使えないため自費診療になります。)。
メラトニンは米国ではサプリメントの扱いですが、日本では食品とは認めていませんので、医薬品として処方しなければなりません。私のクリニックで漢方薬についで最も処方数が多いのがメラトニンです。
【メラトニンは細菌や植物にも存在する】
メラトニンは細菌やプランクトンや植物を含めて、自然界に広く存在し、生物の進化において、最も古くから存在する生体活性物質の一つと考えられています。
メラトニンは多くの生物において、睡眠の制御や体の日内リズムの調整に働いていますが、その他にも多彩な生理活性を持っています。
メラトニンは光を感知して体内に昼夜のシグナルを送るセンサーとして働きます。
哺乳動物では、メラトニンは光刺激を受けた視交叉上核からのシグナルによって脳の松果体から分泌され、視床下部に作用して睡眠が始まります。
抗酸化物質としては、自然界で最も強力なフリーラジカル消去活性を有すると言われています。植物では、油の多い種子に多く含まれ、紫外線が多く当たる植物に多いという報告があります。
メラトニン受容体は7回膜貫通型のGプロテイン共役型受容体(G protein coupled receptor : 略してGPCR)の一種です。
GPCRは多くの種類の細胞に分布しており、光・匂い・味などの外来刺激や、神経伝達物質・ホルモン・イオンなどの内因性の刺激を感知して細胞内に伝達する役割を担っています。
例えば、光を感じて視覚に関わるロドプシン、におい物質に作用する嗅覚受容体、さまざまな生理現象を司る神経伝達物質(アドレナリン、ヒスタミン、セロトニンなど)の受容体などは全てGPCRの仲間です。
GPCRは酵母や原虫など単細胞の真核細胞でも外界の情報伝達に重要な働きを担っています。多細胞生物では進化の過程でさらに多くの種類のGPCRを持つようになっています。
人間ではGPCR遺伝子は1000種類以上が見つかっており、個々のGPCRは特定のシグナルに特異的に反応して生理機能を引き起こします。
メラトニンが作用するGプロテイン共役型受容体が存在することは、生物の進化の歴史の早い段階から、メラトニンは細胞のシグナル伝達系において重要な役割を担っていることを意味しています。
生物進化の過程において、かなり早い段階からメラトニンが重要な生理作用を担ってきたことは確かです。人体においても多彩な健康作用が確認されています。(下図)

図:メラトニンには多彩な健康作用が報告されている。(参考:Ital J Pediatr. 2013; 39: 61.[PMCID: PMC3850896])
【メラトニンは多彩なメカニズムで抗がん作用を発揮する】
メラトニンの抗がん作用に関しては多くの臨床試験で有効性が報告されています。例えば、以下のような報告があります。
Melatonin increases overall survival of prostate cancer patients with poor prognosis after combined hormone radiation treatment(メラトニンは、ホルモン療法と放射線治療の併用後の予後不良の前立腺癌患者の全生存期間を延長する)Oncotarget. 2020 Oct 13;11(41):3723-3729.
【要旨の抜粋】
背景: メラトニンの抗腫瘍作用および免疫調節活性は広く知られている。これらの作用は、複数の作用機序に基づいている。本論文では、前立腺がん患者の治療におけるメラトニンの臨床使用の長期的な結果を評価した。
材料と方法: 2000年から2019年にホルモン療法と放射線治療の併用を受けた様々な病期の955人の前立腺がん患者を対象にして、メラトニンで治療された前立腺がん患者の生存率を統計的に評価した。
結果: 予後が良好あるいは中等度の患者グループでは、メラトニン治療による全生存率はメラトニン非使用群と統計的有意差は認めなかった。
予後不良群では、メラトニンを服用している患者の全生存期間の中央値は153.5か月であったが、メラトニンを服用していない患者では64.0か月であった(p <0.0001)。5年全生存率はメラトニン投与群が66.8±1.9ヶ月で対照群が53.7±2.6であった(p <0.0001)。
多変量解析では、メラトニン投与が独立した予後因子であることが証明され、前立腺がん患者の死亡リスクが2倍以上減少した(p <0.0001)。
結論:予後不良の前立腺がん患者の治療に、メラトニン併用の有効性が証明された。
前立腺がんは悪性腫瘍の中でも最も予後の良いがんです。5年生存率は限局性前立腺がんでは 99%、遠隔転移のあるステージ4の前立腺がんでも50%%以上と報告されています。
したがって、予後が良好あるいは中等度の患者グループでは標準治療だけで5年生存率が99%なので、メラトニンを併用しても予後を改善する余地がありません。
しかし、がん細胞の悪性度が高く、遠隔転移があるゆな予後不良群では、5年生存率を改善する余地があります。このような予後不良群ではメラトニンの併用で死亡リスクが統計的有意に改善するという結果です。
メラトニンの抗腫瘍効果のメカニズムは多彩です。様々なメカニズムが報告されています。例えば、以下のような報告があります。
Potential Therapeutic Effects of Melatonin Mediate via miRNAs in Cancer(癌におけるmiRNAを介したメラトニン媒介の潜在的な治療効果)Biochem Genet. 2021 Jun 28. doi: 10.1007/s10528-021-10104-4.
miRNA(マイクロRNA)は、19〜25ヌクレオチドの長さの進化的に保存された非コードリボ核酸です。マイクロRNAは、タンパク質をコードするmRNAに作用し、その転写後調節・翻訳調節を担っています。
miRNAは遺伝子発現を調節する能力があるため、細胞周期、分化、増殖、アポトーシスなどのさまざまな生物学的プロセスの制御に重要な機能を持っています。
様々な種類の病気やがん細胞におけるmiRNAの発現プロファイルが研究されています。
メラトニンは、広範囲のがんにおいて、アポトーシス誘導、がん細胞の転移や浸潤の抑制、血管新生阻害など効果的な抗腫瘍作用を発揮します。
最近の多くの研究で、がんを含む幅広い疾患におけるmiRNAの発現に対するメラトニンの影響が明らかになっています。
miRNAの発現調節の長期的な影響により、メラトニンはmiRNAの調節を介したがんの治療における有望な治療因子となる可能性が指摘されています。この総説論文では、さまざまな種類の癌におけるmiRNAの発現に対するメラトニンの影響について考察されています。
以下のような報告があります。
Modulation of apoptosis by melatonin for improving cancer treatment efficiency: An updated review(癌治療効率を改善するためのメラトニンによるアポトーシスの調節:最新のレビュー)Life Sci. 2019 Jul 1;228:228-241.
【要旨の抜粋】
放射線療法と化学療法は、最も一般的ながん治療法である。これらの治療は正常組織に急性および晩期の副作用を引き起こす。さらに、腫瘍細胞は、放射線および化学療法剤に対して耐性を獲得し、治療抵抗性および再増殖が起こる。
放射線療法および化学療法に対する耐性は、免疫細胞や腫瘍微小環境を構成する細胞による多数の細胞間および細胞内メディエーターの放出によって引き起こされる。
メラトニンは、強力な抗酸化作用と抗炎症作用を有し、放射線や化学療法の有毒な副作用から正常細胞を保護する。さらに、一部のがん細胞では、メラトニンは、治療に対する感受性を高め、抗腫瘍効果を増強する。
アポトーシスは放射線および化学療法の細胞死の主なメカニズムの1つである。腫瘍細胞におけるアポトーシス誘導は、再発を遅延し、患者の生存率を高める。
メラトニンは、ミトコンドリア、Bax、Bcl-2、内因性ROS、アポトーシス受容体などのいくつかのアポトーシスメディエーターの調節を通じてアポトーシスを促進する。
以下のような報告もあります。
Exogenous melatonin inhibits neutrophil migration through suppression of ERK activation(外因性メラトニンは、ERK活性化の抑制を通じて好中球の移動を阻害する)J Endocrinol. 2015 Oct; 227(1): 49-60.
【要旨の抜粋】
炎症部位への好中球の移動は、病原体の侵入に対する自然免疫の基本的なプロセスである。睡眠調整ホルモンのメラトニンは炎症反応の様々なプロセスに関与していることが明らかになっている。
この研究は、生きているゼブラフィッシュの損傷部位への好中球の移動に対する外因性メラトニンの影響を評価し、ERKシグナル伝達がこのプロセスに関与しているかどうかを検討した。
ゼブラフィッシュの尾びれ切断モデルを使用して組織損傷を引き起こし、蛍光標識された好中球を使って、好中球の移動をin vivoで視覚化した。
外因性メラトニン投与は、用量依存的および時間依存的に、傷害によって誘発される好中球の遊走を劇的に阻害した。
好中球の遊走に対するメラトニンの阻害効果は、メラトニン受容体1、2、3の拮抗薬によって弱められた。損傷により亢進するERKリン酸化レベルはメラトニン投与によって有意に減少した。阻害剤PD0325901によるERK活性化の遮断は、傷害に応答して移動した好中球の数を抑制した。しかし、上皮成長因子によるERKの活性化は、好中球の遊走に対するメラトニンの阻害効果を抑制した。
in vivoにおいて、メラトニンは血管内皮細胞上を移動する好中球を有意に抑制した。
これらすべてのデータをまとめると、外因性メラトニンがERKリン酸化シグナルを遮断することにより好中球の遊走を阻止し、その後の接着分子発現につながることを示した。その結果、メラトニンは好中球の血管外への移動を阻止した。
【メラトニンの大量投与】
メラトニンは極めて安全性が高く、様々なメカニズムで確実な抗がん作用を発揮するので、メラトニンの大量投与というアイデアが出てきます。
時差ボケや不眠には1回に就寝前に1から5mg程度を服用します。
がん治療に通常、1日に10mgから40mg程度が使用されています。
米国には1カプセル20mgの製剤が販売されているので、1回20mgは通常の服用量と言えます。
メラトニンには抗老化作用、寿命延長作用、がん予防効果などが報告されており、進行がんの治療では1日40mg程度を使用していますが、副作用はほとんど経験しません。
私自身、メラトニンの効果と副作用を検討する目的で、1日に40mgから60mg程度をこの数年間、毎日服用しています。
この数週間は、メラトニン大量投与の可能性を検討する目的で1日(就寝前)80mgから100mgを服用していますが、副作用は経験しません。
それではどの程度まで増やせるのかということを考察する必要があります。そのためにはメラトニン服用時の薬物動態や、臨床試験や動物実験での投与量が参考になります。
人間での薬物動態に関しては以下のような報告があります。
Clinical pharmacokinetics of melatonin: a systematic review(メラトニンの臨床薬物動態:系統的レビュー)Eur J Clin Pharmacol. 2015 Aug;71(8):901-9.
論文で報告されている多数の実験データをまとめたものです。
メラトニンの投与量は0.3〜100 mgの間で、経口または静脈内に投与されました。
経口メラトニンの生物学的利用能(バイオアベイラビリティ)は平均で15%(9から33%の範囲)でした。低い生物学的利用能は、肝臓でのかなりの初回通過代謝によって引き起こされます。
経口メラトニンは小腸から急速に吸収され、約30〜45分後に血中濃度がピークになります。血中から減少していく半減期(排出半減期:Elimination half-life)は50分程度です。
1日1gを服用しても問題ないようです。
The effects of oral melatonin on skin color and on the release of pituitary hormones.(皮膚色と松果体ホルモンの分泌に対する経口メラトニンの効果)J Clin Endocrinol Metab. 1977 Oct;45(4):768-74.
この研究では、メラトニンを1日1gの長期摂取が、肌の色が濃くなった5人の被験者の肌の色と下垂体ホルモンの血清レベルに及ぼす影響を調べています。
メラトニンは、未治療の副腎生殖器症候群の1人の患者の色素沈着過剰の皮膚を明るくしましたが、特発性色素沈着過剰の3人の患者と治療されたアジソン病の1人の患者の皮膚には影響しませんでした。メラトニンは血清中の黄体形成ホルモン(LH)のレベルを低下させるようであり、ストレスまたはL-ドーパによる刺激後の下垂体からの成長ホルモンの放出を阻害した可能性があります。被験者は全員、眠気の増加に気づきましたが、目、肝臓、腎臓、および骨髄に関する研究を通じて、他の毒性の証拠は明らかになりませんでした。
30日間にわたって経口投与されたメラトニン1g /日さまざまな臨床パラメーター(血圧、心拍数、ECG、血清化学、尿分析)に統計的に有意な影響を与えることなく、潜在的な副作用として「眠気」が認められました。
つまり、1日1gを30日間服用しても、眠気がでる以外には副作用は出ないようです。
メラトニンの致死量50(LD 50)は無限大であると報告されています。すなわち、動物を殺すのに十分な量のメラトニンを投与することは不可能です。要約すると、メラトニンは臨床的に重大な副作用がなく、非常に安全と言えます。
動物実験では、マウスの場合は、体重換算で7分の1が目安です。
標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。
したがって、マウスの実験で100mg/kgであれば、その7分の1の用量(14mg/kg)が一つの目安となリます。(293話参照)
メラトニンノマウスやラットを使った実験では、50mg/kgから100mg/kgを投与しています。
この量は人間換算では7mg/kgから14mg/kgになります。体重60kgで400mgから800mgを投与している計算になります。
以下のような実験があります。
The histopathological evaluation of the effectiveness of melatonin as a protectant against acute lung injury induced by radiation therapy in a rat model(ラットモデルにおける放射線療法によって誘発された急性肺損傷に対する保護剤としてのメラトニンの有効性の組織病理学的評価)Int J Radiat Biol. 2007 Mar;83(3):187-93.
この研究は、放射線療法によって誘発される急性肺損傷に対する保護剤としてのメラトニンの有効性の組織病理学的評価を提示します。ラットを用いて、メラトニンは腹腔内注射にて100mg / kgの用量で投与されました。
Histopathological evaluation of melatonin as a protective agent in heart injury induced by radiation in a rat model.(ラットにおいて放射線によって誘発された心臓損傷における保護剤としてのメラトニンの組織病理学的評価)Pathol Res Pract. 2014 Dec;210(12):863-71.
照射前のメラトニン投与が実験ラットモデルの心臓の組織病理学的変化に保護効果を及ぼすかどうかを評価するために実施されました。この実験ではメラトニンの50mg / kgが放射線被曝の15分前に腹腔内注射されました。
ラットを使った実験ではメラトニンは体重1kg当たり10mgから100mg程度で、腹腔内投与や静脈内投与が行われています。経口でのバイオアベイラビリティは15%程度です。
メラトニンの内服の場合、人間で体重1kg当たり10mgでも問題は少ないと言えます。体重60kgで600mgです。
これは自己責任ですが、進行がんで他に方法が無い状況で、1日100mgから1000mgのメラトニンを試してみる価値はあります。メラトニンは安価なので、原料で仕入れれば、1日1gでも1ヶ月1万円程度でできます。
試してみたい方がいればご連絡いただければ、対応できます。
| « 774)高用量メ... | 776)がん細胞... » |



