がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
660)がん遺伝子c-Mycをターゲットにしたがん治療;メベンダゾール+ニトロキソリン
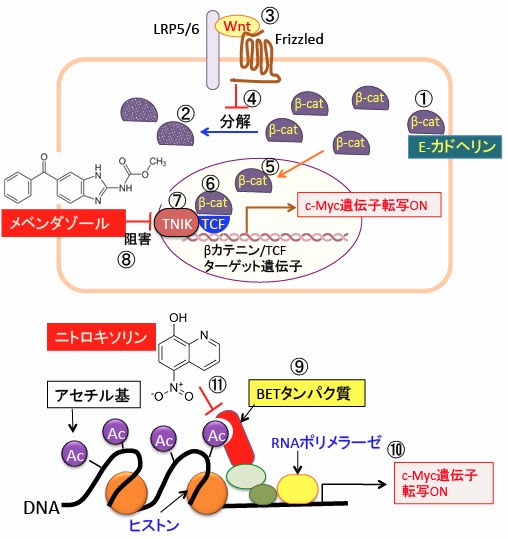
図:(上)β-カテニン(β-cat)は細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリンに結合し、カドヘリンとアクチン細胞骨格との連結を助けている(①)。E-カドヘリンと会合していないβ-カテニンはリン酸化され、ユビキチン化をうけて最終的にプロテアソームで分解される(②)。Wntは細胞膜上のFrizzled(7回膜貫通型受容体)と共役受容体である1回膜貫通型LRP5/6(Low-density lipoprotein receptor-related protein5/6)に結合する(③)。Wntが受容体に結合するとβ-カテニンのリン酸化が抑制され、β-カテニンの分解が阻止される(④)。βカテニンは細胞質に蓄積し核内に移行し(⑤)、転写因子のTCF(T cell factor)と複合体を形成する(⑥)。β-カテニンとTCFの相互作用において、TNIK(TRAF-2 and NCK-interacting kinase)によるTCFのセリン154のリン酸化が必要(⑦)。メベンダゾールはTNIKの活性を阻害する(⑧)。その結果、βカテニン/TCFターゲット遺伝子のc-Mycの発現を阻害する。
(下)ヒストンのアセチル化されたリシンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質(⑨)は、ヒストンのアセチル化リシンに結合し、RNAポリメラーゼなどの転写に必要なタンパク質をリクルートして、c-Mycの転写を活性化する(⑩)。ニトロキソリンはアセチル化リシンとブロモドメインの結合を阻害する(⑪)。その結果、c-Mycの発現を阻害する。メベンダゾールとニトロキソリンはc-Myc遺伝子の転写を異なるメカニズムで阻害するので、相乗効果が期待できる。
660)がん遺伝子c-Mycをターゲットにしたがん治療;メベンダゾール+ニトロキソリン
【c-Mycはバーキットリンパ腫の原因遺伝子として見つかった】
バーキットリンパ腫(Burkitt lymphoma)は、主に小児に生じる悪性リンパ腫の種類の1つで、リンパ球の中のB細胞から発生するリンパ腫です。週単位で病気が進行する「高悪性度」に分類されます。人間のがんで最も増殖の速いがんと言われています。
中央アフリカで風土病となっており、米国では小児リンパ腫の約30%を占めます。
病名は、外科医のデニス・バーキット(Denis Parsons Burkitt)が1958年にアフリカで小児に発症する腫瘍を報告したことに由来します。
c-Myc遺伝子が染色体転座によりイムノグロブリン重鎖遺伝子のエンハンサーにより制御されるようになったことでc-MycがB細胞において過剰発現し、リンパ腫を引き起こします(下図)。

図:正常ではc-Myc遺伝子は8番染色体に存在し、イムノグロブリン(抗体)の重鎖(heavy chains)遺伝子は14番染色体に存在する。バーキットリンパ腫細胞では、c-Myc遺伝子がイムノグロブリン重鎖遺伝子のエンハンサー(CH)の下流に転座している。その結果、c-Myc遺伝子が過剰発現して、B細胞が腫瘍化する。
c-Mycのcはcellular(細胞の)のcであり、トリ白血病ウイルスがもつv-Myc遺伝子の細胞性のカウンターパートして同定された遺伝子です。バーキットリンパ腫細胞の原因遺伝子として発見されたあと、多くの種類のがんにおいて, c-Mycタンパク質の安定性が向上する変異や遺伝子増幅による発現上昇などが認められてます。
このようにc-Mycは、腫瘍化に深くかかわる遺伝子として古くから知られており、さらに幹細胞維持にもかかわっていることや、iPS細胞誘導のための初期化因子の一つであることが示されています。
【c-Mycタンパク質は転写因子】
c-Mycは細胞増殖や嫌気的代謝を促進する因子としてがん細胞の特質に大いにかかわっている遺伝子であり、その遺伝子産物であるc-Mycタンパク質はパートナー因子であるMax(MYC-associated protein X)と相互作用することで転写因子として機能します。
さらに、c-Mycタンパク質は遺伝子のプロモーターやエンハンサー領域に集まって、転写シグナルを増幅する働きもあります(下図)。
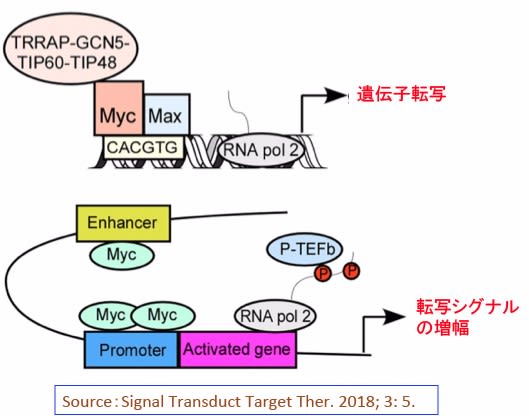
図:Mycタンパク質による標的遺伝子の転写活性化。
(上)MycはMaxと二量体を形成し、E-box(Enhancer box)と呼ばれるCACGTG配列に結合し、クロマチン構造を制御するタンパク質(GCN5, TIP60, TIP48, TRRAPなど)をリクルートし遺伝子転写を活性化する。GCN5 とTIP60はヒストンアセチル基転移酵素、TIP48はATP結合タンパク質、TRRAPは形質転換/転写ドメイン関連タンパク質。
(下)Mycタンパク質はE-boxのみでなく、遺伝子のプロモーターやエンハンサー領域に集まって、転写シグナルを増幅する働きがある。(出典:Signal Transduct Target Ther. 2018; 3: 5.)
c-Mycは細胞内の様々な機能を制御しています。タンパク質をコードしている遺伝子だけでなく、タンパク質をコードしていない遺伝子の制御にも関わっており、細胞周期、タンパク質合成、細胞接着、代謝、シグナル伝達、遺伝子転写、タンパク質翻訳、など多くの細胞機能を制御しています。(下図)

図:Mycは様々な遺伝子の転写を制御し、多彩な細胞機能の制御に関与している。
【遺伝子過剰発現とがん遺伝子中毒】
がんは遺伝子の変異や発現異常によって起こる病気です。
「がん遺伝子の活性化」や「がん抑制遺伝子の不活性化」などによって、細胞の増殖や生存の制御に異常が生じて、がん細胞が発生します。
発がんは一つの遺伝子の異常によって起こる単純なプロセスではなく、複数の遺伝子の変異が積み重なって起こります。
発がんが極めて複雑な要因によりもたらされるにもかかわらず、ある一つの遺伝子を正常化することによりがん細胞の増殖が劇的に抑制されることが示されています。
つまり、これらのがん細胞は悪性形質を維持するために、ある特定の遺伝子の持続的な活性化に強く依存していることを示唆しています。
これを2002年にWeinsteinは「oncogene addiction」という言葉で定義しています。
Addictionは「Drug addiction(薬物中毒、薬物依存)」や「alcohol addiction(アルコール中毒、アルコール依存)」と同じで「中毒」や「依存」という意味です。
つまり、「oncogene addiction」は「がん細胞が,増殖・進展するうえで特定のシグナル伝達経路に強く依存していること」を意味し、「がん遺伝子中毒」や「がん遺伝子依存」と訳されています。
例えば、乳がんにおけるHER2や神経芽細胞腫のN-Mycの過剰発現やなどがあげられます。
がん細胞が中毒(依存)に陥っている遺伝子異常はがん細胞のアキレス腱となる可能性を秘めています。つまり、このような遺伝子異常は治療標的として創薬につながる可能性の高い遺伝子と言えます。
正常な細胞では、様々な遺伝子が「必要なときに必要な量」発現することによって正常な働きを実行できます。遺伝子が通常の量よりも過剰に発現してしまうことを「過剰発現」といいます。遺伝子が過剰発現すると、細胞機能は様々な変調を来します。
がん細胞ではがん遺伝子の過剰発現が多く観察されます。過剰発現している遺伝子にがん細胞は依存性が高い状態にあると言えます。したがって、過剰発現しているがん遺伝子は治療のターゲットになります。
例えばc-Myc遺伝子が過剰発現しているがん細胞でc-Myc遺伝子の発現を押さえるとがん細胞が死んでしまいます。これはがん細胞の生存がc-Myc遺伝子に強く依存しているということを表しています。
多くのがん細胞でc-Myc遺伝子の過剰発現が起こっており、c-Mycはがん治療の重要なターゲットになっています。現時点で、c-Mycの働き自体を直接阻害する薬はありませんが、c-Mycの発現レベルを阻害する方法は幾つかあります。
c-Myc遺伝子の発現を抑制する治療法はがん治療に有効です。
実際に、MYCの不活性化はヒトがんの治療に有効であることが明らかになっています。
c-Mycの不活性化はリンパ腫、白血病、骨肉腫、肝臓がん、扁平上皮癌、すい臓がんなど多くのがん種に対して、増殖抑制、最終分化誘導、アポトーシス誘導、血管新生抑制など多彩な機序で抗腫瘍効果を示すことが報告されています。
【Wnt/β-カテニン経路の活性化はc-Mycの発現を亢進する】
Wntシグナルは種を超えて広く保存されたシグナル伝達経路で、遺伝子発現、細胞増殖、細胞運動、細胞極性などを調節することで、発生や幹細胞の維持、発がんなどに深く関与することが知られています。
特にβカテニンを介するWnt/β-カテニン・シグナル伝達系は多くのがん細胞で異常を起こしており、がん治療の重要なターゲットになっています。
βカテニンは781個のアミノ酸からなる92kDaのタンパク質で、細胞間接着と遺伝子発現調節の2つの働きを持っています。
βカテニンの大部分は細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリン(E-Cadherin)と会合体を作っています。このような細胞膜の接着部位のβカテニンはE-カドヘリンとアクチン細胞骨格との連結を助けています。
E-カドヘリンと会合していないβカテニンはすべて細胞質で複数のタンパク質からなる大型の分解複合体により分解されています。
しかし、Wnt(ウィント)という分子量約4万の分泌性糖タンパク質が受容体に結合すると、細胞質におけるβ-カテニンの分解が阻止されて細胞質に蓄積し、核内に移行した後, 転写因子のTcf/Lef(T cell factor/ Lymphoid enhancer factor)と複合体を形成し、Tcf/Lefの転写活性を亢進します。
つまり、β-カテニンはTcf/Lefの転写活性化補助因子として機能し、Tcf/Lefの標的遺伝子の転写を誘導します。このシグナル伝達系をWnt/β-カテニン経路と言い、この経路のターゲット遺伝子にc-Mycが含まれます。(下図)
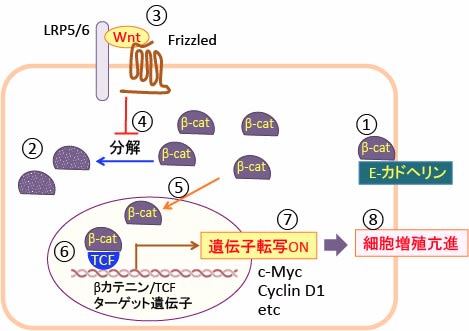
図:β-カテニンは細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリンに結合し、カドヘリンとアクチン細胞骨格との連結を助けている(①)。E-カドヘリンと会合していないβ-カテニンはリン酸化され、ユビキチン化をうけて最終的にプロテアソームで分解される(②)。Wntは細胞膜上のFrizzled(7回膜貫通型受容体)と共役受容体である1回膜貫通型LRP5/6(Low-density lipoprotein receptor-related protein5/6)に結合する(③)。Wntが受容体に結合するとβ-カテニンのリン酸化が抑制され、β-カテニンの分解が阻止される(④)。β-カテニンは細胞質に蓄積し核内に移行し(⑤)、転写因子のTCF(T cell factor)と複合体を形成する(⑥)。βカテニンにより活性化される遺伝子群にはc-Mycや cyclinD1など細胞の増殖を促進する因子が含まれ(⑦)、その結果、細胞の増殖が亢進する(⑧)。
β-カテニンは細胞膜近傍か細胞質・核のどちらかに局在し, 特に核にあるときは一連の遺伝子発現に影響を与えると考えられています。
Wnt/β-カテニン・シグナル伝達系により活性化される遺伝子群にはc-Myc、 c-Jun、 cyclinD1など細胞の増殖や転移を促進する因子が含まれます。つまり、Wnt/β-カテニン・シグナル伝達系が活性化されると、がん細胞の増殖や転移が促進されることになります。
【がん細胞ではWnt/β-カテニン経路の異常が高頻度で認められる】
Wnt/β-カテニン経路は極めて複雑で、まだ不明な点も多くあります。簡単にまとめると、次のようになります。
①Wntは分子量約4万の細胞外分泌糖タンパク質で、種を超えて保存されており、初期発生における体軸の決定や器官形成を制御しています。これまでに哺乳類において19種類のWnt が同定されています。
②Wnt はFrizzledやlow-density lipoprotein receptorrelated protein(LRP)5/6の受容体を介して細胞内にシグルを伝達し、多様な細胞機能を制御しています。Frizzledは7回膜貫通型受容体でLRP5/6はFrizzledの共役受容体として機能します。
③Wnt の非存在下では細胞質内のβ-カテニンのタンパク質量は低く保たれています。これはGSK-3がβ-カテニンをリン酸化し、リン酸化された-カテニンはユビキチン化を受け、最終的にはプロテアソームで分解されるためです。
④Wnt が分泌されて細胞膜上のFrizzled と共役受容体であるLRP5/6に結合すると,そのシグナルは細胞内へと伝達され、GSK-3依存性のβ-カテニンのリン酸化を抑制し、低リン酸化状態となったβ-カテニンはプロテアソームによる分解から免れ、細胞質内に蓄積します。
⑤細胞内に蓄積したβ-カテニンは核内に移行し、転写因子Tcf/Lef と複合体を形成して標的遺伝子の発現を促進することによって、種々の細胞機能を制御しています。Tcf/LefはT-cell factor/lymphoid enhancer factorの略です。
⑥Tcf/Lefの標的遺伝子は100種類以上に及び、細胞の増殖、分化、運動、幹細胞多能性維持などの制御に関わっています。c-mycやcyclin D1などの発現を亢進して細胞増殖を促進します。(下図参照)

図:(左)Wntのシグナルが無い状況では、β-カテニンは細胞質内で分解複合体によってリン酸化され(①)、ユビキチン(U)が結合し(②)プロテアソームで分解されている(③)。その結果、Tcf/Lef(T-cell factor/lymphoid enhancer factor)による遺伝子発現が阻止されている(④)。
(右)Wntが受容体のFrizzledとLRP5/6に結合してWntシグナルが活性化されると、分化複合体が不活性化され、β-カテニンのリン酸化が阻止されて(⑤)β-カテニンは分解されなくなり(⑥)、細胞質内で増加し核内に移行して転写因子のTCFに結合し(⑦)、β-カテニン/TCFのターゲット遺伝子の転写を活性化して(⑧)、細胞の増殖を亢進する(⑨)。
βカテニン分解複合体は、AXIN、aAPC(denomatous polyposis coli) 、セリン・スレオニンキナーゼのGSK3β(glycogen synthase kinase-3)、CK1α (casein kinase 1α)から構成され、GSK3βとCK1αがβカテニンをリン酸化する。βカテニンがリン酸化されるとβ‑TrCP E3 linker によってユビキチンが結合して、プロテアソームで分解される。
(参考:参考:npj Precision Oncologyvolume 2, Article number: 5 (2018) )
【駆虫薬のメベンダゾールはWnt/βカテニンによる遺伝子発現を阻害する】
がん細胞では様々なメカニズムでWnt/β-カテニン・シグナル伝達系が活性化され、核内でのβ-カテニンの量が増加し、その結果、TCf/Lefの転写因子活性が亢進して、がん細胞の増殖を促進しています。したがって、Wnt/β-カテニン・シグナル伝達系の阻害はがん治療のターゲットとして重要視されています。
駆虫薬のメベンダゾールがWnt/β-カテニン・シグナル伝達系の最下流の遺伝子発現レベルで阻害作用を示すことが報告されています。以下のような報告があります。
Comprehensive Modeling and Discovery of Mebendazole as a Novel TRAF2- and NCK-interacting Kinase Inhibitor.(包括的モデリングと新規TRAF2およびNCK相互作用キナーゼ阻害剤としてのメベンダゾールの発見)Sci Rep. 2016 Sep 21;6:33534. doi: 10.1038/srep33534.
【要旨】
TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)は、Wntシグナル系が活性化した結腸直腸がんの重要なターゲットの1つである。この研究では、2つのデータセットを選び、望ましい生物医薬品特性を有する新規なTNIK阻害剤を探索するための包括的なモデリング研究を行った。
データセットIを用いて、比較分子類似性指数分析(Comparative Molecular Similarity Indices Analysis :CoMSIA)および可変選択k-最近傍モデル(variable-selection k-nearest neighbor models)を導出し、そこからTNIK阻害剤活性にとって決定的な3D分子場(3D-molecular fields)および2D記述子(2D-descriptors)が明らかにされた。
データセットIIに基づいて、予測的なCoMSIA-SIMCA(Soft Independent Modelling by Class Analogy)モデルを取得し、1,448種類の FDA(米国食品医薬品局)承認の小分子薬物のスクリーニングに使用した。
実験的評価の結果、FDA承認の駆虫薬であるメベンダゾールは、解離定数Kd =〜1μMでTNIKキナーゼ活性を選択的に阻害することができることを発見した。その後のCoMSIAおよびkNN分析は、メベンダゾールがTNIKを結合および阻害するのに必要な好ましい分子特性を有することを示した。
理解困難な用語や解析法が並んでいますが、簡単に言うと、コンピュータを使った構造解析や結合活性の解析でメベンダゾールが「TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)」の阻害剤として有用である可能性を報告しています。
がん治療薬の開発では、培養がん細胞(in vitro)や移植腫瘍などを使った動物実験(in vivo)で抗がん活性や安全性や薬物動態が検討されます。
さらに最近は、薬剤の候補物質がデータベース化され、細胞の受容体やシグナル伝達物質の構造のデータベースや、抗がん剤による遺伝子発現パターンのデータベースなど様々な情報をコンピューターを使って探索する方法(in silico)もあります。
「in silico」という用語は,「コンピュータ(シリコンチップ)の中で」の意味で、in vitro(試験管内で)やin vivo(生体内で)に対応して作られた用語で、コンピューターを駆使した研究です。
米国では、FDA(米国食品医薬品局)が承認した既存薬や、開発に失敗して製薬企業内で保存されている物質のデーターベースが公開されており、様々な手法で新たな薬効を見つける研究が進んでいます。
TNIK(TRAF-2 and NCK-interacting kinase)はセリン・スレオニンキナーゼで、このキナーゼ活性(タンパク質をリン酸化する活性)は結腸直腸がんの増殖活性の維持に必須であることが報告されています。
Wnt/βカテニン経路の最終段階であるβカテニンとTCFの相互作用において、TNIKはTCFのセリン154をリン酸化します。このリン酸化がβカテニン/TCFの遺伝子転写活性に必要だと言うことです。
したがって、TNIKの阻害剤は大腸がんのようにWnt/βカテニンシグナル伝達系が亢進したがんの治療に有効と考えられており、多くの製薬会社が開発しています。まだ臨床的に使用できるものはありませんが、何十年も前から多くの国で使用されている駆虫薬のメベンダゾールが、TNIKの阻害剤としてかなり有望だという報告です。
以下のような報告もあります。メベンダゾールの抗腫瘍効果にc-Mycが関与しているという報告です。
Mebendazole induces apoptosis via C-MYC inactivation in malignant ascites cell line (AGP01).(メベンダゾールは悪性腹水細胞株AGP01においてC ‐ MYC不活性化を介してアポトーシスを誘導する)Toxicol In Vitro. 2019 Jun 14;60:305-312.
【要旨】
本研究の目的は、悪性腹水細胞に対するメベンダゾールの役割およびC-MYCの関与を調べることである。悪性腹水細胞株のAGP01細胞および正常ヒトリンパ球におけるメベンダゾールのDNA傷害作用を検討した。 AGP01細胞におけるメベンダゾールによるアポトーシス誘導と細胞周期に対する作用を検討した。C-MYC増幅、C-MYC mRNAおよびC-MYCタンパク質の発現を検討した。
また、AGP01細胞およびAGP01 shRNA MYC細胞においてメベンダゾールの細胞傷害性を評価した。
メベンダゾールは、悪性腹水細胞のAGP01細胞のDNA損傷を有意に増加させたが、正常ヒトリンパ球に対してはDNA損傷を引き起こさなかった。
メベンダゾールは、0.5μMおよび1.0 μMの濃度で、それぞれG0/G1 および G2/M期において顕著な細胞周期停止を引き起こし、そしてより高濃度で有意にアポトーシスを誘導した。さらに、メベンダゾール(0.5μM と 1.0 μM)はカスパーゼ3および7の活性を増加させた。
メベンダゾールは、AGP01細胞におけるC-MYC mRNA とC-MYCタンパク質発現を減少させた。 メベンダゾールは、同じ濃度において、AGP01 shRNA MYCと比較して、AGP01細胞においてより細胞生存率を低下した。したがって、我々の結果は、メベンダゾールが胃がん細胞において細胞死を誘導する経路の1つとしてC-MYC遺伝子の関与を示唆している。
shRNA(short hairpin RNA)は、RNA干渉による遺伝子サイレンシングのために用いられるヘアピン型のRNA配列です。AGP01 shRNA MYCはAGP01細胞にc-Myc遺伝子の発現を不活性化するshRNAを導入した細胞です。
c-Mycに依存性の高いがん細胞に対してメベンダゾールがc-Myc発現を阻害してアポトーシスを誘導する機序を示唆しています。
以下の報告もメベンダゾールの抗腫瘍効果にc-Mycの関与を報告しています。
Anthelmintic mebendazole enhances cisplatin's effect on suppressing cell proliferation and promotes differentiation of head and neck squamous cell carcinoma (HNSCC).(駆虫薬メベンダゾールはシスプラチンの細胞増殖抑制効果を高め、頭頸部扁平上皮癌(HNSCC)の分化を促進する。)Oncotarget. 2017 Feb 21;8(8):12968-12982.
【要旨】
頭頸部扁平上皮がんは、世界中で最も一般的で攻撃的な種類のヒトのがんの1つである。頭頸部扁平上皮がん患者の半数近くが治療後5年以内に再発を経験し、化学療法に対して耐性を示す。したがって、頭頸部扁平上皮がんのための安全で新規な抗癌療法を開発することが緊急の臨床的課題である。ここでは、駆虫薬メベンダゾールを頭頸部扁平上皮がんの治療薬として再利用する可能性を検討する。一般的に使用されている2種類のヒト頭頸部扁平上皮がん細胞株のCAL27およびSCC15を使用して、メベンダゾールがヒト頭頸部扁平上皮がん細胞においてシスプラチンよりも強力な抗増殖活性を発揮することを示す。
メベンダゾールは頭頸部扁平上皮がん細胞の細胞増殖、細胞周期進行および細胞移動を効果的に阻害し、そしてアポトーシスを誘導する。
メカニズム的には、メベンダゾールはELK1/SRF、AP1、STAT1/2、MYC/MAXを含むがん関連経路を制御する。 メベンダゾールはまた、頭頸部扁平上皮がん細胞の細胞増殖の抑制およびアポトーシスの誘導においてシスプラチンと相乗的に作用する。
さらに、メベンダゾールは、CAL27細胞の最終分化およびCAL27細胞の異種移植腫瘍の角質化を促進する。
これらの結果は、メベンダゾールが特定の頭頸部扁平上皮がん細胞の分化を促進しながら増殖を阻害することによってその抗がん活性を発揮し得ることを実証した最初のものである。
駆虫薬のメベンダゾールは、頭頸部扁平上皮がん治療においてシスプラチンなどの他の化学療法薬と組み合わせて使用される安全かつ有効な薬剤として再利用され得ると考えられる。
がん治療以外で使用されている医薬品の抗がん作用をスクリーニングして、がん治療に利用できる薬を見つけようという医薬品再利用においてメベンダゾールは有力な候補として研究されています。以下のような報告もあります。
Repositioning of the anthelmintic drug mebendazole for the treatment for colon cancer.(寄生虫治療薬メベンダゾールの大腸がん治療薬としての再開発)J Cancer Res Clin Oncol. 139(12): 2133-40, 2013年
【要旨】
目的:大腸がんの治療薬として再開発する目的で、臨床的に使用されている1600種類の医薬品を含む多数の物質をスクリニーングした。
方法:2種類の大腸がん細胞株を用い、蛍光微小細胞傷害性検定法(fluorometric microculture cytotoxicity assay)で抗がん活性を検討した。物質の比較には、Connectivity Map解析による遺伝子発現解析、米国がん研究所(NCI)の抗がん剤評価系のデータベース(NCI 60 data mining)、プロテインキナーゼ結合測定を実施した。
結果:2種類の大腸がん細胞において、10μMの濃度で細胞生存率を40%以下に減らす細胞傷害活性を示す物質が68種類スクリーニングされた。これらの物質は遺伝子発現の解析から幾つかの種類に分類され、その一つが寄生虫治療薬のベンゾイミダゾール(Benzimidazole)系の薬物であった。このうちメベンダゾール(Mebendazole)とアルベンダゾール(Albendazole)が臨床で使用されていた。NCIの60種類のがん細胞株を用いた薬剤感受性のデータベースとの比較から、メベンダゾールとアルベンダゾールの類似性は低く、作用機序が異なることが示唆された。Connectivity Map解析による遺伝子発現パターンの比較でも、この2つの類似性は低かった。
さらに、メベンダゾールはBCR-ABLやBRAFを含む幾つかのプロテインキナーゼと相互作用を示したが、アルベンダゾールにはそのような作用は認めなかった。
メベンダゾールはNCA60パネルの大腸がん細胞株の80%に対して抗腫瘍活性を示した。さらに3種類の大腸がん細胞と3種類の非がん細胞での検討から、メベンダゾールの大腸がんに対する選択性が確認された。
結論:メベンダゾールは大腸がん治療薬として再開発する価値がある。
メベンダゾールはがんの代替医療ではかなり有名です。
今年の5月の連休明けにある記事がインターネット上に掲載されました。
タイトルは「がんが全身に転移 – 余命3ヶ月3ヶ月の男性が犬の駆虫薬で完治?」となっています(日刊ゲンダイDIGITAL)。
米国に住む男性は、小細胞肺がんが全身に転移し、手の施しようのない状態になり、余命は3カ月ほどと宣告されました。
その男性は獣医の勧めで犬の駆虫薬のフェンベンダゾールの服用を開始しました。そして3カ月後、PET(放射断層撮影法)スキャンを受けたところ、がんがきれいに消滅していたというのです。
この治療を勧めた獣医は、犬の駆虫薬のフェンベンダゾールが動物実験でがん細胞を死滅させる作用が報告されていることを知っていたので、フェンベンダゾールの服用を勧めたそうです。
フェンベンダゾールとメベンダゾールはベンズイミダゾール系といわれる化合物で、フェンベンダゾールは動物用の駆虫薬で、メベンダゾールは人間用の駆虫薬として使用されています。
人間用のメベンダゾールはがんの代替療法として私も2014年頃からがん治療に使用しており、その有効性を経験しています。
駆虫薬として入手は用意で、副作用も極めて少ない薬です。がんに対する有効性も証明されています。メベンダゾールの消化管からの吸収が低いのが欠点ですが、油の多い食事の後に服用すると吸収率を高めることができますので、ケトン食との併用は有効です。
また、メベンダゾールを分解する薬物代謝酵素を阻害するグレープフルーツや胃薬のシメチジンを併用すると、メベンダゾールの血中濃度を高めることができます。メベンダゾールの抗腫瘍効果については401話で紹介しています。
【BETファミリータンパク質のBRD4がc-Myc遺伝子の転写に関与】
c-Mycは、転写レベルでの調節や、RNAおよびタンパク質の安定性での調節といったように、様々なレベルでの調節を受けています。
c-Myc mRNAはかなり不安定であり、c-Myc遺伝子が強く転写されたても、細胞内でc-Myc mRNAは蓄積しがたく、さらにc-Myc mRNAは,let-7などいくつかのmiRNAによる翻訳の抑制も受けています。
c-Mycタンパク質の58番目のスレオニン残基がGSK-βによってリン酸化を受けると、プロテオソーム分解系によりすみやかに分解されます。
このようにc-Mycタンパク質は、正常細胞では細胞内にあまり多く蓄積しないようにさまざまな調節を受けており、がん細胞はそういったc-Mycタンパク質の量を制限する機構から回避することで細胞内に比較的多くの量のc-Mycタンパク質の蓄積を達成しています。
その最も典型的な例としては、がん細胞がリン酸化されないように58番目のスレオニン残基を変異させることで、c-MycCタンパク質の安定性を増していることがあげられます。
転写レベルでの調節では、c-Myc遺伝子プロモーター上にBRD4(ブロモドメイン含有タンパク質4)という転写調節因子が結合し、転写を促進していることがわかっており、小分子化合物を用いてBRD4の活性を抑制することでc-Mycの発現を低下させ、がんを治療しようとする試みがなされています。
BETファミリータンパク質は高アセチル化ヒストンへの結合を介して、がん遺伝子や抗アポトーシスタンパク質の発現を促進する作用があります。
ブロモドメインはヒストンのアセチル化リシンを認識し,制御タンパク質を集めてクロマチン構造や遺伝子発現を制御する機能が知られているタンパク質ドメインです。
ブロモドメイン繰り返し配列および特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質としてBRD2,BRD3,BRD4,BRDTが知られています。
ヒストンのアセチル化による遺伝子発現の制御には、アセチル化を促進するヒストンアセチル基転移酵素、ヒストンからアセチル基を除去するヒストン脱アセチル化酵素、ヒストンのアセチル化した部分を認識するBETファミリータンパク質の3つが必要ということです。
ヒストンアセチル基転移酵素の「書き屋(Writer)」とヒストン脱アセチル化酵素の「消し屋(Eraser)」と、BETファミリータンパク質の「読み屋(Reader)」の3つの役割を担うタンパク質が、ヒストンアセチル化の制御を行ってます。(下図)
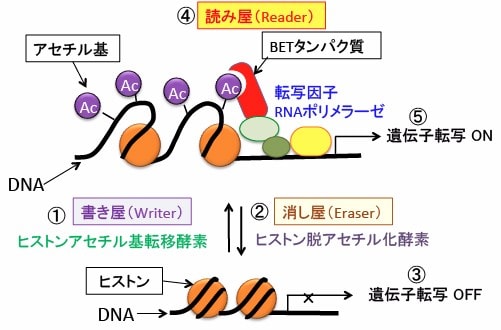
図:「書き屋(Writer)」のヒストンアセチル基転移酵素によってヒストンにアセチル基が結合し(①)、「消し屋(Eraser)」のヒストン脱アセチル化酵素によってアセチル基が除去される(②)。ヒストンアセチル化の少ない部分では遺伝子転写は抑制される(③)。「読み屋(Reader)」のBETファミリータンパク質はヒストンのアセチル化リシンと結合して(④)、遺伝子転写を促進する(⑤)。
ヒストンのアセチル化リシンとBETファミリータンパク質のブロモドメインの結合を阻害する薬剤をがん細胞に投与すると、遺伝子発現パターンが正常細胞に近づくことが知られています。
ヒストンとBETファミリータンパク質の結合を阻害する低分子化合物(BET阻害剤)が、がんや炎症性疾患の治療薬として注目されています。臨床試験が行われているBET阻害剤が幾つかあります。
このようなBET阻害剤は、ある種のがん細胞に投与すると腫瘍促進遺伝子の発現を選択的に抑制することから、がん治療薬としての可能性が期待されています。
【ニトロキソリンはBETタンパク質を阻害する】
抗生物質のニトロキソリンがBETタンパク質を阻害することが報告されています。以下のような論文があります。
Discovery of novel BET inhibitors by drug repurposing of nitroxoline and its analogues.(ニトロキソリンとその類似体の薬物再利用による新規BET阻害剤の発見)Org Biomol Chem. 2017 Nov 15;15(44):9352-9361.
【要旨】
ブロモドメイン含有タンパク質(bromodomain-containing proteins)のBETファミリーは、がん、炎症および心血管疾患を含む多くの疾患の治療に有望な薬物標的であると考えられている。それ故、BET阻害作用のある新規な化合物の開発が注目されている。
安全性および薬物動態が既知の化合物から阻害剤を見出すという薬物再利用戦略は大きな利点を有しており、それ故近年の医薬品開発者の関心を高めている。この薬物再利用戦略を使って、薬物ライブラリーからBRD4特異的阻害作用を有する化合物を探索し、続いてALPHAスクリーニングアッセイ試験を実施した。
FDA承認抗生物質であるニトロキソリンは、BRD4(ブロモドメイン含有タンパク質4)の第一ブロモドメインとアセチル化ヒストン4ペプチドとの間の相互作用を50%阻害濃度(IC50)が0.98μMで阻害することを明らかにした。
ニトロキソリンは、非BETブロモドメイン含有タンパク質に対して阻害作用を示さず、良好な選択性で全てのBETファミリーメンバーを阻害した。従ってニトロキソリンは選択的BET阻害剤と呼べる。
ニトロキソリン-BRD4_BD1複合体の結晶構造に基づいて、ニトロキソリンの作用機構およびBET特異性を決定した。
BET関連疾患の1つであるMLL白血病に対するニトロキソリンの抗がん活性はこれまで研究されていなかったので、我々はニトロキソリンがMLL白血病の治療薬として有効かどうかを試験した。
ニトロキソリンは細胞周期停止とアポトーシスを誘導することによりMLL白血病細胞の増殖を効果的に抑制した。ニトロキソリンの有効性は、少なくとも部分的には、BETの阻害および標的遺伝子転写の抑制によるものである。 BET阻害剤としてのニトロキソリンの発見は、BETファミリー関連疾患の治療のためのニトロキソリンおよびその誘導体の潜在的用途を示唆している。
真核細胞生物では、DNAはヒストンと結合して複合体を形成し、通常は不活性化状態になっています。一般的に、ヒストンの高アセチル化領域では遺伝子の転写が活性化され、低アセチル化領域では転写が不活性であることが知られています。ヒストンのアセチル化は、ヒストンアセチル化転移酵素とヒストン脱アセチル化酵素によって制御されています。これが「書き屋」と「消し屋」です。
BET (bromodomain and extra-terminal)ファミリータンパク質は、ブロモドメインにおいてヒストンのアセチル化されたリシンを認識することにより、転写活性化因子として機能します。BRD4はこのようなBETファミリータンパク質の1つです。
染色体の転座によって偶然できた融合タンパク質が、細胞増殖を刺激してがんができるのは、Bcr-AblやEML4-ALKのキナーゼ活性化の例が良く知られています。上記のBRD4も転座によってNUTというタンパク質との融合タンパク質をつくり、NUT midline carcinoma(NMC)という致死性の高い悪性腫瘍を生じることが知られています。NMCは、若年者(0~70歳、平均17.6歳)に好発し、気道、胸腺、縦隔、気道組織、および膀胱などの正中線上の上皮組織に発生する腫瘍です。BRD4-NUTは、通常は不活性の染色体の一部に働いてアセチル化を亢進させることが知られています。そこで、BETブロモドメインの働きを阻害する薬剤はNUT midline carcinoma(NMC)の治療に効果が期待できます。
【ニトロキソリンはBETタンパク質阻害を介してPD-L1の発現を抑制する】
岡山大学の泌尿器科のグループから以下のような論文が最近報告されています。
The Novel Combination of Nitroxoline and PD-1 Blockade, Exerts a Potent Antitumor Effect in a Mouse Model of Prostate Cancer.(ニトロキソリンとPD-1遮断薬の新規併用は前立腺がんのマウスモデルにおいて強力な抗腫瘍効果を発揮する)Int J Biol Sci. 2019 Mar 9;15(5):919-928.
【要旨】
プログラム細胞死タンパク質1(Programmed cell death protein 1:PD-1)遮断は前立腺がんに対する有望な治療戦略である。ニトロキソリンは、いくつかの種類のがんにおいて有効な抗がん作用を有することが知られている。前立腺がんのマウスの実験モデルにおけるニトロキソリンとPD 1遮断の併用療法の有効性を検討した。
インビトロの実験系において、ニトロキソリンはマウス前立腺がん細胞株RM9-Luc-PSAの生存と増殖を阻害することを見出した。
さらに、ニトロキソリンは、リン酸化PI3キナーゼ、リン酸化Akt(Thr308)、リン酸化Akt(Ser473)、リン酸化GSK-3β、Bcl-2、およびBcl-xLの発現を抑制した。
さらに、ニトロキソリンは培養した前立腺がん細胞および腫瘍組織におけるプログラム細胞死リガンド-1(PD-L1)の発現レベルを抑制した。
マウス前立腺がん同所性移植モデルにおいて、ニトロキソリン+ PD-1遮断は、ニトロキソリンまたはPD-1遮断をそれぞれ単独で使用した場合と比較して、腫瘍増殖を相乗的に抑制し、腫瘍重量、生物発光腫瘍シグナル、および血清中の前立腺特異抗原(PSA)レベルの減少をもたらした。
さらに、ニトロキソリンと PD-1遮断の併用は末梢血中のCD44+CD62L+CD8+ メモリーT細胞の細胞数の増加および骨髄由来抑制細胞の数を減少して、抗腫瘍免疫を有意に増強することを示した。
結論として、我々の実験結果はニトロキソリンとPD-1遮断薬の併用が、前立腺がん患者における有望な治療戦略になる可能性を示唆している。
リンパ球の一種のT細胞は、病原菌やがん細胞を攻撃・排除する働きがあります。しかし、T細胞が暴走して正常な細胞を攻撃すると危険なので、いくつかのブレーキ装置が備わっています。これを「免疫チェックポイント」と呼びます。
がん細胞は、ときに巧みにこの免疫チェックポイントを悪用して、T細胞にブレーキをかけてT細胞からの攻撃を逃れようとするのです。がん細胞によるブレーキがかからないようにする薬が免疫チェックポイント阻害薬です。
細胞傷害性T細胞にはPD-1という受容体が存在します。PD-1はプログラム細胞死1(programmed death-1)の略です。
PD-1のリガンド(受容体に結合して作用する物質)となるPD-L1を抗原提示細胞が持つことによって細胞傷害性T細胞の働きを抑制しています。
つまり、PD-1受容体がリガンドによって刺激されると、T細胞の増殖が停止し細胞死を来すことになります。このようにして細胞傷害性T細胞の過剰な応答を制御しているのです。
細胞傷害性T細胞の働きを阻害するPD-L1はがん細胞にも発現しています。つまり、がん細胞は免疫系の制御システムを利用して、がん組織内の細胞傷害性T細胞の働きを阻止しています。
PD-1受容体は細胞傷害性T細胞を死滅させるスイッチなようなものなので、このスイッチが入らないようにすれば、細胞傷害性T細胞は生き残ってがん細胞の攻撃力を高めることができます。ヒト型抗PD-1モノクローナル抗体のニボルマブ(nivolumab商品名「オプジーボ(Opdivo)」)はPD-1とPD-L1の結合を阻害することによって細胞傷害性T細胞の細胞死を防ぐ薬です。このような免疫チェックポイント阻害剤を使用すると、がん細胞を攻撃する細胞傷害性T細胞の働きを高めることが可能になります。免疫チェックポイント阻害剤にニトロキソリンを併用すると、抗腫瘍効果を高めることができるという報告です。
このPD-L1の発現抑制作用がBETタンパク質の阻害作用による可能性を示唆する研究が米国から報告されています。以下のような報告があります。
BET Bromodomain Inhibition Promotes Anti-Tumor Immunity by Suppressing PD-L1 expression.(BETブロモドメイン阻害はPD-L1発現を抑制することにより抗腫瘍免疫を促進する)Cell Rep. 2016 Sep 13; 16(11): 2829–2837.
【要旨】
抗体を用いてPD-L1シグナル伝達を遮断することによる抗腫瘍免疫の回復はがん治療に有益であることが証明されている。
この研究では、BETブロモドメイン阻害がPD-L1発現を抑制し、卵巣がんにおける腫瘍進行を抑制することを示す。
PD-L1をコードする遺伝子CD274は、BRD4媒介遺伝子転写の直接の標的である。
マウスの実験モデルにおいて、BET阻害剤のJQ1による治療は、腫瘍細胞ならびに腫瘍関連樹状細胞およびマクロファージにおけるPD-L1発現を有意に減少させ、これは抗腫瘍細胞傷害性T細胞の活性の増加と相関していた。 BET阻害剤は細胞傷害性T細胞依存的に腫瘍の進行を抑制した。
以上の結果は、PD-L1シグナル伝達を遮断するための化合物の有効性を実証している。 臨床試験でBET阻害剤は毒性が低く安全性が高いことが証明されているので、薬理学的BET阻害剤はPD-L1発現を標的とする治療戦略となり得ることを示している。
この論文では、BETファミリータンパク質のBRD4の阻害剤がPD-L1の発現を抑制することを報告しています。PD-L1をコードする遺伝子CD274は、BRD4媒介遺伝子転写の直接の標的だからです。
岡山大学泌尿器科のグループの論文では、ニトロキソリンがPD-L1の発現を阻害することを報告していますが、BRD4の関与は考察していません。しかし、ニトロキソリンはBETファミリータンパク質のBRD4を阻害する作用が報告されています。つまり、ニトロキソリンがBETブロモドメインの阻害によってPD-L1発現を抑制することが推測されます(下図)。

図:ヒストンのアセチル化されたリシンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質の一つのBRD4は、ヒストンのアセチル化リシンに結合し、転写因子やRNAポリメラーゼなどをリクルートして(①)、PD-L1をコードするCD274遺伝子の転写を促進する(②)。ニトロキソリンはBRD4の第一ブロモドメインとアセチル化ヒストンの結合を阻害する(③)。その結果、転写因子やRNAポリメラーゼのリクルートが阻害され(④)、CD274遺伝子の転写を抑制し、PD-L1の発現を抑制する(⑤)。
この研究ではマウスの実験ではニトロキソリンを1日に体重1kg当たり15mgを経口投与しています。この量は人間に換算すると2〜3mg/kg/日程度になります。一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。したがって、15mg/kgの7分の1の用量が一つの目安となります(詳しくは293話参照)
ニトロキソリンの尿路感染症の治療に使う量は1日に500から750mgです。したがって、尿路感染症に使用する服用量で十分な抗腫瘍効果が期待できそうです。
以上のような報告から、メベンダゾール(+シメチジン)+ニトロキソリンの併用はがん治療に相乗効果が期待できます。
実際に、今まで10人以上の進行がんの患者さんに処方していますが、副作用は全く経験せず、ある程度の抗腫瘍効果を認めています。試してみる価値がある代替療法です。
| « 659)重曹とク... | 661)メラトニ... » |



