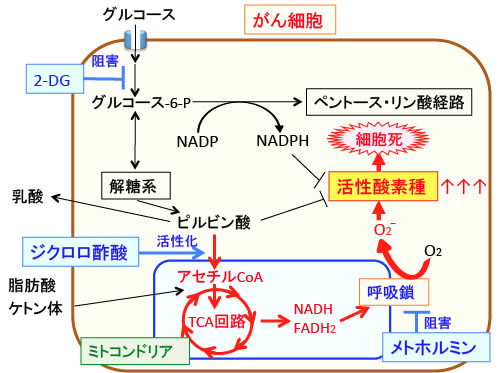
図:がん細胞はミトコンドリアの様々な異常によって活性酸素が出やすい状況になっている。そのため、ミトコンドリアでの代謝を抑え、酸素を使わない解糖系での代謝が亢進している。つまり、がん細胞の解糖系が亢進しているのは、酸化ストレスを高めたくないことが一つの理由になっている。したがって、細胞質の解糖系とミトコンドリアの呼吸鎖を阻害しながら、ピルビン酸脱水素酵素を活性化して無理矢理ミトコンドリアの代謝を活性化すれば、がん細胞は活性酸素の増加とエネルギー(ATP)の産生阻害という2つのメカニズムで死滅することになる。2−DG(2-デオキシグルコース)は解糖系を阻害し、メトホルミンは呼吸鎖を阻害してATP産生を阻害すると同時に活性酸素の産生を増やす。ジクロロ酢酸ナトリウムでピルビン酸脱水素酵素の活性を亢進してミトコンドリアでの代謝を亢進すると、活性酸素の産生が増えるが、2-DGでグルコース-6-P(グルコース-6-リン酸)の産生を抑制するとペントース・リン酸経路におけるNADPHの産生が低下するので還元力が減少し、酸化ストレスは増大してがん細胞は死滅する。呼吸鎖でのATP産生に異常がない正常細胞では、この3つの組合せでダメージを受けにくいので、がん細胞に選択性の高い治療法になる。
417)がん細胞の酸化ストレスを高める方法(その1):ジクロロ酢酸とメトホルミンと2-DG
【がん細胞に選択的に酸化ストレスを高めることができる】
日本では1968年に大気汚染防止法が制定され、様々な規制の強化によって、大気汚染をコントロールしています。
一方、大気汚染に対する規制が甘い国では、排ガスによる環境汚染や健康被害が問題になっています。大気汚染物質によって青空が見れなくなるような国もあります。
排ガスなどに含まれる微粒子物質「PM2.5」などの大気汚染物質が「肺がんの発生リスクを高めることが確実」であることを、世界保健機関(WHO)の専門組織である国際がん研究機関(IARC)が報告しています。
つまり、大気汚染のコントロールが不十分で、汚染物質の発生が大量になれば、そこに住む人の寿命が短くなることは「確実」なのです。
さて、正常細胞とがん細胞では、細胞内での活性酸素の発生において、この大気汚染のコントロール(規制)と同じような違いが存在します。つまり、正常細胞では活性酸素の発生が十分に規制されている状態にあり、がん細胞ではそのような規制が無く活性酸素が出やすい状態なのです。そして、この違いを利用することによって、がん細胞を選択的に死滅させようという治療法が注目されています。
がん細胞ではミトコンドリアを含めいろんな機能に異常が生じていて、活性酸素が出やすい(制御できていない)状態になっています。正常細胞に比べて活性酸素が出やすいというがん細胞の特徴を利用すれば、正常細胞にはダメージを与えずにがん細胞だけに酸化ストレスを高めてがん細胞を死滅させることができるのです。
この治療法を理解するためには、まず、活性酸素とは何か、どのようにして細胞内で活性酸素ができるのかを理解する必要があります。
【活性酸素は細胞成分を酸化してダメージを与える】
全ての物質は原子からできています。原子というのは物質を構成する最小の単位であり、原子核を中心にその周りを電気的に負(マイナス)に帯電した電子が回っているという形で現されます。
通常、電子は一つの軌道に2個づつ対をなして収容されますが、原子の種類によっては一つの軌道に電子が一個しか存在しないことがあります。このような「不対電子」を持つ原子または分子をフリーラジカル(遊離活性基)と定義しています。
本来、電子は軌道で対をなっている時がエネルギー的に最も安定した状態になります。そのためにフリーラジカルは一般的には不安定で、他の分子から電子を取って自分は安定になろうとします。フリーラジカルとは、不対電子をもっているために、非常に反応性の高まっている原子や分子なのです。
「酸化」するというのは活性酸素やフリーラジカルが、ある物質の持っている電子を奪い取ることを意味します。「酸化」の本来の定義は「電子を奪うこと」なのです。一方、ある物質が別の物質から電子をもらうことを「還元」といいます。
したがって、フリーラジカルというのは相手の電子を奪う(酸化する)性質が非常に強い性質のものです。DNAから電子が奪われると誤った遺伝情報が作られ、がん細胞の発生につながります。DNA以外にも、体の土台をなしている蛋白質や脂肪からも電子を奪い酸化して細胞の機能の障害を引き起こし、ひいては組織や臓器の機能の低下を招いて老化が進行し、様々な疾患を引き起こします(図)。
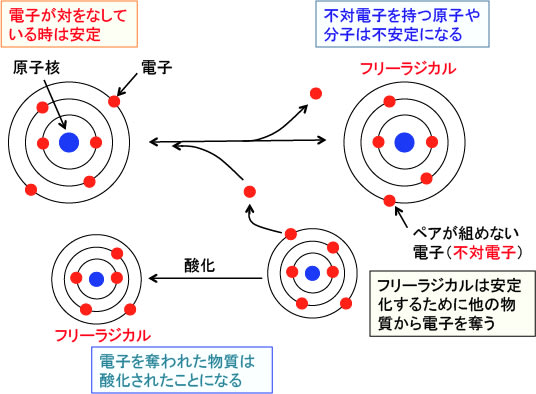
図:不対電子を持っている原子や分子をフリーラジカルという。フリーラジカルは他の物質から電子を奪って安定化するが、電子を奪われた物質(酸化された物質)はフリーラジカルとなってさらに他の物質から電子を奪うようになる。
【酸素呼吸によって活性酸素が発生する】
細胞が生きていくために必要なエネルギー(=ATP)は、細胞内のミトコンドリアで酸素を還元して水になる反応(電子伝達系)を使って産生しています。この過程では1分子の酸素(O2)に4つの電子(e-)を渡して四電子還元され、さらに水素イオン(H+)と結合して水(H2O)になります。
この反応では必ずしも酸素分子に電子がきっちり4個渡されるとは限りません。酸素分子に不完全に電子が渡され、部分的に還元されたものが発生し、これが活性酸素になります。
例えば、1個の電子が渡された場合はスーパーオキシド(O2-)という活性酸素になります。ふつうの酸素分子は16個の電子の持っていますが、スーパーオキシドは17個の電子をもっており、そのうち1個が不対電子になりフリーラジカルとなるのです。
細胞内で発生したスーパーオキシドはスーパーオキシドディスムターゼ (SOD) によって過酸化水素(H2O2)に変換され、過酸化水素はカタラーゼやグルタチオンペルオキシダーゼによって酸素(O2)と水(H2O)に変換されて無害化されます。
過酸化水素自体も強い酸化剤ですが、それが鉄などの金属イオンによって攻撃性の強いヒドロキシラジカル(・OH)に変わります。ヒドロキシラジカルは活性酸素の中で最も反応性が高く、DNAやタンパク質や脂質や糖などあらゆる物質と反応して細胞に傷害を与え、がんや炎症性疾患や動脈硬化や神経変性疾患など多くの病気の原因となっています。このスーパーオキシド、過酸化水素、ヒドロキシラジカルが代表的な活性酸素です(図)。
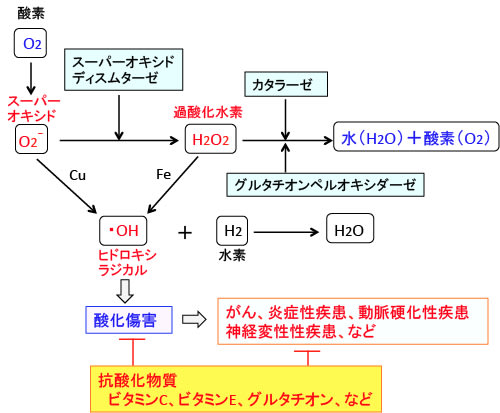
図:細胞の酸素呼吸によって体内で絶えず発生しているスーパーオキシドと過酸化水素は、鉄イオン(Fe)や銅イオン(Cu)と反応してヒドロキシラジカルを発生する。ヒドロキシラジカルは強力な酸化作用を持ち、細胞や組織を酸化して障害を起こし、様々な疾患の発生の原因となる。細胞内にはこれらの活性酸素を消し去る酵素(スーパーオキシドディスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼなど)や抗酸化物質(ビタミンC,ビタミンE,グルタチオンなど)が活性酸素の害から守っている。これらを総合して抗酸化力と言う。
【がん細胞のミトコンドリアは活性酸素がでやすい】
細胞内のミトコンドリアでは、酸素を使ったエネルギー産生の過程で活性酸素が発生します。活性酸素は細胞内のタンパク質や脂質や核酸を酸化してダメージを与え、発がんや老化の原因になります。
正常細胞においては、ミトコンドリアにおける物質代謝やエネルギー産生過程は整然とコントロールされており、活性酸素の発生は最小限に抑えられています。
つまり、正常な細胞内では活性酸素によるダメージが少ない状態に維持されています。
下図に正常細胞における糖質代謝とミトコンドリアにおける呼吸による活性酸素の発生と、活性酸素の消去の関係を示します。
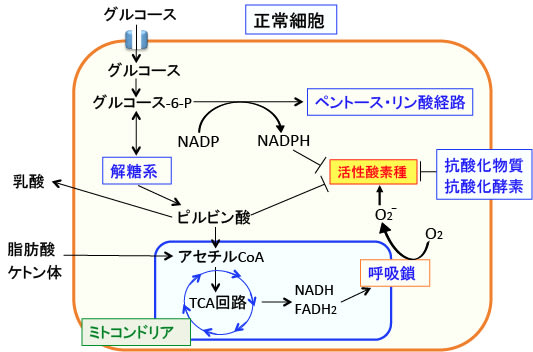
図:細胞内に取り込まれたグルコースは、ヘキソキナーゼでグルコース-6-リン酸(グルコース-6-P)に変換され、さらに解糖系によってピルビン酸になる。酸素が乏しいと嫌気性解糖系によってピルビン酸は乳酸に変換されるが、酸素がある状況では、ピルビン酸はピルビン酸脱水素酵素によってアセチルCoAに変換され、さらにTCA回路で電子伝達体であるNADH(還元型ニコチンアミドアデニンジヌクレオチド)とFADH2(還元型フラビンアデニンジヌクレオチド)が作られ、 NADHやFADH2のもつ電子(水素)は電子伝達系によって酸化される。ミトコンドリアの呼吸鎖では酸素(O2)を還元して、水素と反応させて水になるが、この過程でスーパーオキシドが発生する。ペントース・リン酸経路で産生されるNADPHと解糖系のピルビン酸は活性酸素を消去する作用がある。さらに細胞内には様々な抗酸化物質や抗酸化酵素によって活性酸素は無害な物質で変換されて消去されている。このような細胞内機能の整然とした働きによって、細胞内の酸化ストレスが増大しないようにコントロールされている。
一方、がん細胞ではミトコンドリアに様々な異常が起こっています。ATPを産生する呼吸鎖にも異常が起こっており、酸素を使ったエネルギー産生過程で大量の活性酸素が産生されやすくなっています。
これは、排気ガス処理装置が壊れた自動車が排気ガスをまき散らすのと同じ状態です。
つまり、がん細胞ではミトコンドリアでの酸素消費を増やせば、活性酸素の産生が増えて、酸化ストレスによった細胞が死滅するリスクが高いのです。
がん細胞では、このような酸化ストレスの増加を防ぐために、酸素を使わない解糖系でのエネルギー産生を増やしています。つまり、酸素がある条件でも解糖系でのATP産生を増やし、酸素を使ったミトコンドリアでのATP産生を抑制している理由の一つは、酸化ストレスを高めたくないからです。
ミトコンドリアでのエネルギー産生を抑制するため、効率の悪い解糖系でエネルギー産生を行う必要があるために、グルコースの取込みと解糖系の亢進が起こっているということになります。
またグルコース-6-リン酸からのペントース・リン酸経路での代謝も亢進しており、この系で産生されるNADPHが細胞内の酸化ストレスを軽減するために利用されます。(下図)
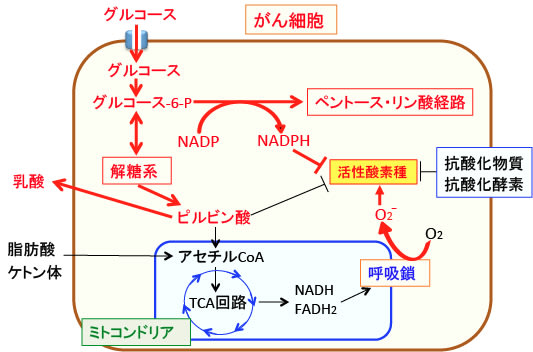
図:がん細胞における糖質代謝の特徴を示している。赤の矢印と文字はがん細胞で活性化あるいは増えていることを示している。がん細胞ではミトコンドリアの呼吸鎖の異常などによって酸素を使ってATPを産生すると活性酸素の産生量が増える状況にある。そこでがん細胞ではミトコンドリアでのATP産生を抑制して酸化ストレスの増大を防いでいる。そのため、非効率的なエネルギー産生系である解糖系が亢進していて乳酸の産生が増えている。また、ペントース・リン酸経路が亢進し、この経路でできるNADPHは活性酸素の消去に使われる。がん細胞ではミトコンドリアでの代謝を抑えているので、脂肪酸やケトン体をエネルギー源として利用することができない。
がん細胞のミトコンドリアでのエネルギー産生を高めるジクロロ酢酸や、がん細胞の抗酸化システムのグルタチオンの産生を阻害するスルファサラジンなどががん治療に使われるのは、がん細胞での活性酸素の産生を高め、酸化ストレスを高めてがん細胞を死滅させることを目的とした方法です。
上記の図から判るように、がん細胞では脂肪酸やケトン体を代謝することはできません。
脂肪酸やケトン体はミトコンドリアで代謝されてATPになるため、これらをエネルギー源にすると活性酸素が増えてしまうからです。つまり、脂肪酸やケトン体をエネルギー源として利用できないわけではないのですが、これらをミトコンドリアで代謝すると活性酸素の産生が増えて、自分の首を絞める結果になるので、使えないということになります。
がん細胞に酸化ストレスを高めてがん細胞を死滅させる方法な多数あります。それらを組み合せることによって、新しいがん治療ができます。
【ジクロロ酢酸はミトコンドリアを活性化する】
解糖系によって生成されるピルビン酸はミトコンドリア内でピルビン酸脱水素酵素複合体によってアセチルCoAに変換されます。
ピルビン酸脱水素酵素はピルビン酸脱水素酵素キナーゼによって不活性化されますが、がん細胞ではこのピルビン酸脱水素酵素キナーゼの活性が亢進しています。
それは、がん細胞で発現が亢進している低酸素誘導因子-1(HIF-1)がピルビン酸脱水素酵素キナーゼの発現を亢進するからです。(下図参照)

図:がん細胞では低酸素やPI3K/Akt/mTORシグナル伝達系の活性化によって低酸素誘導因子-1(HIF-1)の活性が亢進し、HIF-1はピルビン酸脱水素酵素キナーゼや解糖系酵素の発現を誘導する。ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素の活性を阻害するので、ピルビン酸からアセチルCoAへの変換が抑制されてミトコンドリアでの糖代謝は抑制される。
ジクロロ酢酸ナトリウムはミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として25年以上前から使用されています。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。
ジクロロ酢酸ナトリウムを使ってがん細胞におけるミトコンドリア内での酸化的リン酸化を活性化すると、がん細胞のアポトーシス(細胞死)が起こりやすくなることが報告されています。がん細胞の抗がん剤感受性を高める効果も報告されています。
その理由は、がん細胞に無理矢理ミトコンドリアでの代謝を亢進させると、活性酸素が多く産生されて細胞にダメージが起こるからです。
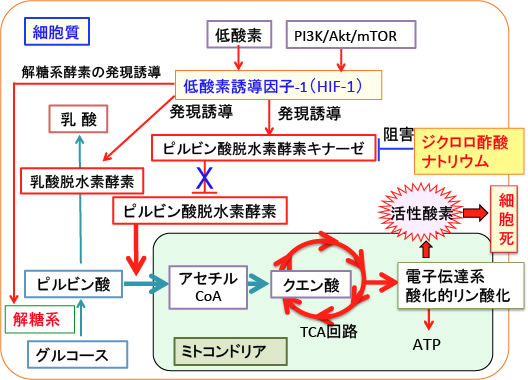
図:ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害する。その結果、ピルビン酸脱水素酵素の活性が亢進してミトコンドリアでの代謝が促進される。その結果、ミトコンドリア内で活性酸素の産生が増加して細胞は死滅する。
【ジクロロ酢酸ナトリウムとメトホルミンの相乗効果】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。糖尿病だけでなくがんの予防や治療の分野でも注目されており、がんの発生を予防する効果やがん細胞の抗がん剤感受性を高める効果が報告されています。
メトホルミンはミトコンドリアの呼吸酵素複合体1(電子伝達複合体1)を阻害してATPの産生を減らし、そのためにAMP:ATP比が上昇するためにAMPKが活性化されます。つまり、メトホルミンはミトコンドリア毒であり、この毒を適量使うと血糖を低下させることができるというメカニズムです。
メトホルミンの抗腫瘍効果については
384話で詳しく解説しています。
さて、その作用機序から、ミトコンドリアの呼吸酵素複合体をメトホルミンで阻害した状態でジクロロ酢酸でがん細胞のミトコンドリアの代謝を亢進すれば、がん細胞に比較的特異的に酸化ストレスを高めることができます。
実際に、ジクロロ酢酸とメトホルミンの相乗効果が報告されています。次のような論文があります。
Dichloroacetate enhances apoptotic cell death via oxidative damage and attenuates lactate production in metformin-treated breast cancer cells.(メトホルミンを投与した乳がん細胞において、ジクロロ酢酸は酸化傷害によるアポトーシスを亢進し、乳酸の産生を抑制する)Breast Cancer Res Treat. 147(3):539-50. 2014年
【要旨】
乳がん細胞における代謝の特徴を明らかにすることは、乳がんの治療法の開発に役立つ。
メトホルミンは乳がんの治療に有用な薬剤であることが明らかになっている。このメトホルミンはミトコンドリアの呼吸酵素複合体Iの働きを阻害して活性酸素の産生を増やし、酸化傷害によって細胞死を誘導する。
呼吸酵素複合体Iの阻害は乳酸産生を増やすことになるが、がん細胞においては解糖系の亢進によって乳酸産生がもともと亢進した状態にあり、乳酸産生が高いほど予後が悪いことが知られている。
メトホルミンはがん治療に効果が期待できるが、乳酸産生を抑制する方法を組み合わせると、メトホルミンの抗がん作用を効率的に高めることができる。
ジクロロ酢酸は、ピルビン酸脱水素酵素キナーゼの活性を阻害することによってミトコンドリアでの代謝を促進する作用によって、乳酸アシドーシスの治療薬として使用されている。
この研究の目的は、メトホルミンとジクロロ酢酸を併用すると、乳がん細胞を死滅させる効果が相乗的に高まるかどうかと、そのメカニズムを検討することである。
乳がん細胞株を用い、メトホルミンとジクロロ酢酸を投与し、細胞死の程度や代謝の変化を解析した。
細胞死と活性酸素産生はフローサイトメトリーやウェスタンブロット法や細胞数測定法などの方法で解析した。細胞の形態学的変化は位相差顕微鏡や共焦点顕微鏡で解析した。
細胞の代謝の変化は、Seahorse XF24アナライザー、乳酸測定、pH測定で検討した。
実験の結果、ジクロロ酢酸とメトホルミンを同時に添加すると、乳がん細胞のアポトーシスは相乗的に増加することが明らかになった。
メトホルミンによって誘導される酸化傷害はジクロロ酢酸によって促進され、ジクロロ酢酸によるピルビン酸脱水素酵素キナーゼ活性の阻害はメトホルミンによって引き起こされる乳酸産生亢進を抑制した。
以上のことから、ジクロロ酢酸とメトホルミンを同時投与すると、酸化傷害を介するカスパーゼ依存性のアポトーシスの誘導を相乗的に亢進し、さらにメトホルミンによる乳酸産生を抑制することが明らかになった。
メトホルミンとジクロロ酢酸の併用は、乳がんの治療効果を高めることが期待できる革新的な治療法となる可能性がある。
この論文の結果をまとめると以下の図のようになります。
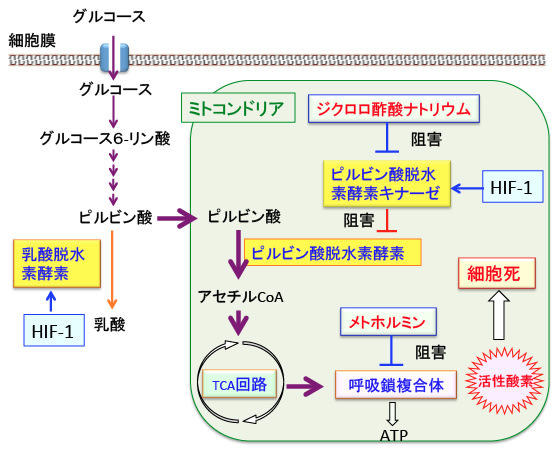
図:がん細胞では、HIF-1(低酸素誘導因子-1)の作用によって乳酸脱水素酵素やピルビン酸脱水素酵素キナーゼ(ピルビン酸脱水素酵素をリン酸化して阻害する酵素)の活性が亢進しているため、ミトコンドリアでのATP産生は低下し、解糖系が亢進して乳酸の産生が増えている。
メトホルミンはミトコンドリアの呼吸酵素複合体1をターゲットにして阻害するため、ATP産生が阻害され、同時に活性酸素の発生が増える。活性酸素が増えるとミトコンドリアが破綻して細胞のアポトーシスが起こる。
メトホルミンでミトコンドリアでのATP産生が低下すると、それを代償するためにAMPK(AMP依存性プロテインキナーゼ)が活性化され、AMPKは解糖系を亢進するので乳酸の産生が増える。乳酸の増加はがん細胞を悪化させる。ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害する作用によってピルビン酸脱水素酵素を活性化してミトコンドリアでのTCA回路を回す。その結果、メトホルミンによって生じる乳酸の産生増加が阻止され、ミトコンドリアでの活性酸素の産生が増えて、アポトーシスが増強される。
また、乳酸の産生が減れば、がん組織の酸性化が軽減され、様々なメカニズムでがん細胞の増殖が抑制できる。つまり、この2つの薬を併用するとがん細胞のアポトーシス誘導が増強できる。
別の研究グループから同様な報告があります。
Sensitization of metformin-cytotoxicity by dichloroacetate via reprogramming glucose metabolism in cancer cells.(がん細胞におけるグルコース代謝の再プログラム化を介するジクロロ酢酸によるメトホルミンの細胞毒性の増強)Cancer Lett. 346(2): 300-308, 2014
【要旨】
がん細胞に対するメトホルミンの細胞毒性を高める目的で、ピルビン酸脱水素酵素キナーゼの阻害剤であるジクロロ酢酸の作用を検討した。
メトホルミンの細胞毒性は主にグルコース利用性と、ペントース・リン酸経路で産生される還元力(NADPH)に依存していた。
一方、ジクロロ酢酸は、ピルビン酸脱水素酵素キナーゼを阻害しミトコンドリアでの呼吸(酸化的リン酸化)を亢進してグルコース代謝を再プログラム化(=正常化)することによってメトホルミンの細胞毒性を増強した。
グルコースとグルタチオンの濃度が高い条件下でも、ジクロロ酢酸とメトホルミンの併用投与は、がん細胞を死滅させた。
ジクロロ酢酸はがん細胞のグルコース代謝を好気的解糖主体の代謝からミトコンドリアでの酸化的リン酸化主体の代謝に再プログラム化することによって、メトホルミンの細胞毒性の感受性を高めることが明らかになった。
グルコース代謝の再プログラミング(reprogramming)というのは、がん細胞の特徴であるワールブルグ効果(酸素があっても解糖系でのグルコース代謝が亢進し、ミトコンドリアでの代謝が低下している)を正常化(初期化)するということです。ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高めることによってミトコンドリアでの呼吸(酸素を使ったATP産生)が活性化され、解糖系でのATP産生は抑制されることになります。
一方、メトホルミンはミトコンドリアの呼吸酵素複合体1の働きを阻害するので、ATP産生は阻害され、活性酸素の発生が増加します。
がん細胞ではもともとミトコンドリアでの酸素を使った代謝が低下しているので、メトホルミン単独では細胞を死滅させる作用が弱いのですが、ジクロロ酢酸でミトコンドリアにおける酸素利用を高めれば、がん細胞は酸化傷害によって死滅するというストーリーです。
ジクロロ酢酸とメトホルミンのがん細胞における作用をまとめると以下のようになります。
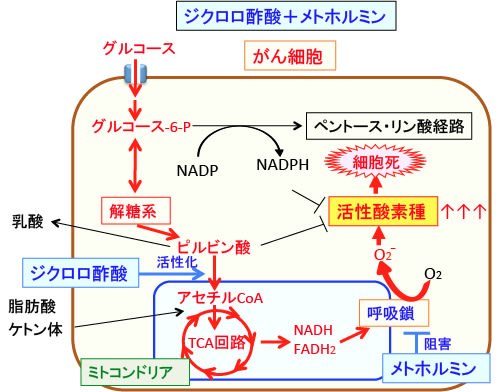
図:がん細胞ではミトコンドリアでの呼吸鎖での活性酸素の産生率が高いので、メトホルミンで呼吸酵素複合体Iが阻害されると、ATPの産生障害と活性酸素の産生増加が起こる。そうなると解糖系が亢進してATP産生を増やそうとするが、ジクロロ酢酸を用いてピルビン酸脱水素酵素を活性化してミトコンドリアでの代謝を活性化すると、乳酸産生は減少し、ミトコンドリアでの活性酸素の産生量はさらに増える。ミトコンドリアでの代謝が亢進するとペントース・リン酸経路での代謝が抑制されてNADPH産生による抗酸化力も低下し、酸化ストレスが亢進してがん細胞は死滅する。脂肪酸やケトン体を増やすとさらにミトコンドリアからの活性酸素の産生量は増加する。
(赤で示した矢印や文字は発現や活性を亢進していることを示す)
【ジクロロ酢酸とメトホルミンと2-デオキシグルコースの相乗効果】
前述の論文のように、メトホルミンによってミトコンドリアでのATP産生が低下すると、がん細胞は解糖系でのエネルギー産生を増やす可能性が指摘されています。
したがって、がん細胞の解糖系を阻害する2−デオキシ-D-グルコースやケトン食の併用はメトホルミンの抗腫瘍効果を高めます。
メトホルミンと2-デオキシグルコースの相乗効果については
368話で紹介しています。
最近の論文でメトホルミンの抗腫瘍効果はグルコースの利用を阻止すると増強することが明らかになっています。以下のような論文があります。
Mechanisms by which low glucose enhances the cytotoxicity of metformin to cancer cells both in vitro and in vivo.(培養細胞および生体内におけるがん細胞に対するメトホルミンの細胞毒性が低グルコースによって増強されるメカニズム)PLoS One. 2014 Sep 25;9(9):e108444. doi: 10.1371/journal.pone.0108444. eCollection 2014.
【要旨】
がん細胞に対するメトホルミンの毒性は細胞の種類によって感受性が異なる。その一つの理由は、細胞を培養するときの培養液に高濃度のグルコースが添加されているためであり、グルコースの濃度が低い条件では、多くのがん細胞に対してメトホルミンの細胞毒性は増強されることが最近の研究で明らかになっている。
0から5mMの低グルコース濃度の条件では、メトホルミンは乳がん細胞株のMCF7とMDAMB231とSKBR3、卵巣がん細胞株のOVCAR3とPA-1に対して細胞毒性を示した。
高濃度のグルコースを含有する通常の培養液での検討では、MDAMB231とSKBR3細胞はメトホルミンの細胞毒性に抵抗性を示すことを以前の研究で示している。
培養液のグルコース濃度を10mM以上にすると、全ての培養細胞株はメトホルミンの細胞毒性に対して抵抗性になった。
培養液の糖の濃度が低グルコース(2.5mM)あるいは高フルクトース(25mM)あるいは高ガラクトース(25mM)の条件では、メトホルミンの添加によってATP産生は顕著に減少した。しかし高グルコース(25mM)の培養液ではATP産生の減少は認めなかった。
メトホルミンによってミトコンドリアでのATP産生が減少するとAMP依存性プロテインキナーゼ(AMPK)が活性化されて解糖系が促進されることによってエネルギー産生低下を代償しようとするメカニズムが作動する。このような代償作用は、培養液の糖を25mMグルコースから2.5mMグルコースや25mMフルクトースや25mMガラクトースに変更することによって減弱させることができる。
この実験結果は、がん細胞のグルコース利用を阻害すると、メトホルミン投与によって刺激される解糖系亢進を抑制して、メトホルミン誘導性のアポトーシスを増強できることを示唆している。
さらに、低グルコースの条件では、メトホルミンはAKTのリン酸化とmTOR(哺乳類ラパマイシン標的タンパク質)の様々なターゲット分子のリン酸化を減らすが、活性化型のリン酸化AMPKの量は減らさなかった。
このように、mTORシグナル伝達系の阻害はAMPK活性化には依存しないことが示唆された。
4T1乳がん細胞をマウスに移植するin vivoの動物実験系を使った研究で、低糖質のケトン食を与えて血中グルコースのレベルを低下させると、メトホルミンによる腫瘍増殖の抑制効果は増強された。
以上の結果は、グルコースの利用を抑制する条件下ではメトホルミンのATP産生抑制と生存シグナル伝達系の阻害効果画が増強することを示している。
25mMというのは450mg/dLです。正常な血糖のレベルは4~6mM(72–108 mg/dL)です。
高血糖という条件だけで、がん細胞の増殖経路は活性化されます。
メトホルミンの抗腫瘍効果はジクロロ酢酸と2-デオキシグルコースの併用によって増強できます。この3種類の組合せは、多くのがん患者さんで実践していますが、副作用はほとんど出ません。
作用機序はトップの図にまとめています。細胞質の解糖系とミトコンドリアの呼吸鎖を阻害しながら、ピルビン酸脱水素酵素を活性化して無理矢理ミトコンドリアの代謝を活性化すれば、がん細胞は活性酸素の増加とエネルギー(ATP)の産生阻害という2つのメカニズムで死滅することになります。


画像をクリックするとサイトに移行します。