がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
822) 発酵豆乳(豆乳ヨーグルト)はトリプル・ネガティブ乳がんの増殖を抑制する
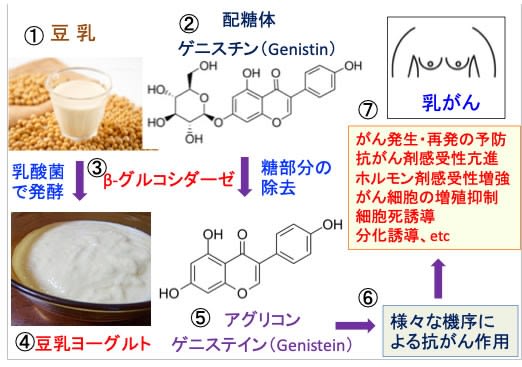
図:豆乳(①)には配糖体のゲニスチン(②)が多く含まれる。乳酸菌を使って豆乳を発酵させると(③)、豆乳ヨーグルトを作れる(④)。乳酸菌のβ-グルコシダーゼによってゲニスチンの糖鎖が除去されるとアグリコンのゲニステインに変換される(⑤)。ゲニステインには様々な機序による抗がん作用がある(⑥)。乳がんに対して、がん発生・再発の予防、抗がん剤感受性亢進、ホルモン剤感受性増強、がん細胞の増殖抑制、細胞死誘導、分化誘導などの様々な抗腫瘍効果を発揮する(⑦)。
822) 発酵豆乳(豆乳ヨーグルト)はトリプル・ネガティブ乳がんの増殖を抑制する
【大豆食品は乳がんや前立腺がんの発生を予防する】
大豆が乳がんを予防するのではないかという考えは、「米国やその他の欧米の国と比べて乳がんの発生頻度が低いアジアの国々では、大豆の摂取量が多い」という事実から出て来ています。いくつかの疫学的研究は、大豆の摂取量が多いと乳がんの発生頻度が低くなることを示しています。
大豆にはイソフラボンが豊富で、この大豆イソフラボンが動物実験で様々な抗がん作用を示すことが示されています。
人体において確実に証明されたわけではありませんが、「大豆の摂取が乳がんの発生予防に有効であること」、「そのがん予防の成分としてイソフラボンが重要であること」が多くの研究で示されています。
大豆イソフラボンには、ゲニステインやダイゼインなどがあり、女性ホルモンのエストロゲンに似た化学構造をしています。このようにエストロゲンに似た作用をする成分が植物中から多く見つかっており、植物エストロゲン(フィト・エストロゲン)と呼ばれています。大豆イソフラボンは植物エストロゲンの代表です。
大豆イソフラボンのダイゼインは腸内細菌によって代謝されてエクオール(Equol)になります。
エクオールは、1932 年にウマの尿から最初に分離され、その後、イソフラボンの代謝産物としてヒトの尿から分離されました。
エクオールは、ゲニステインやダイゼインよりエストロゲン活性が高いため、エクオールは人間の健康に多くの有益な効果をもたらすとして支持されています。
ダイゼインからエクオールへの変換は、一部の腸内微生物のレダクターゼ酵素の作用を介して腸内で起こります。これまでに分析されたすべての動物種はエクオールを生成しますが、人間では30%から50%の人しかエクオールを生成できません。
これが、大豆摂取による健康作用の個人差の原因と考えられています。
エクオールはサプリメントとして販売されています。

図:大豆に含まれるイソフラボン(ゲニステイン、ダイゼイン)は女性ホルモン(エストラジオール)と構造が似ていて、エストロゲン受容体に対して弱い親和性を有する。ダイゼインが腸内細菌で代謝されて生成されるエクオールはエストロゲン受容体に対して強い結合活性を有する。腸内でのエクオールの産生は、30〜50%の人で起こるが、半数以上はエクオールを産生できない。この違いが、大豆イソフラボンの健康作用の個人差の原因と考えられている。
乳がんは体内でエストロゲンの産生量が高い状態で発生しやすいと考えられています。乳腺組織はエストロゲンの作用によって増殖が促進され、その乳腺組織から発生する乳がんの多くもエストロゲンによって増殖が促進されるからです。
エストロゲンの血中濃度が高いときは、大豆イソフラボンなどの植物エストロゲンは抗エストロゲン作用(エストロゲン作用を阻害する)を示し、そのために乳がんの発生を予防するのではないかと考えられています。
抗エストロゲン作用の他にも、大豆イソフラボンは、抗酸化作用や血管新生阻害作用やがん細胞の増殖を抑える作用など、多くの抗がん作用が報告されていて、前立腺がんや胃がんなど多くのがんの予防や治療に有効だと言われています。
米国におけるある疫学研究では、豆乳を1日1回以上摂取する人では前立腺がんの発生頻度が70%減少することが報告されています。大豆イソフラボンのゲニステイン(genistein)、ダイゼイン(daizein)およびその代謝産物はエストロゲン活性を持ち、前立腺がん細胞の増殖を抑制し、アンドロゲン受容体の遺伝子発現を抑制し、動物実験で移植した前立腺がん細胞の発育を抑える効果などが報告されています。
大豆製品の摂取が多い地域では前立腺がんの発生頻度が低いという疫学的研究結果は多数報告されています。
また、前立腺がんの予防に効果があると報告されているザクロジュースや亜麻の種子(flaxseed)も植物エストロゲンが多く含まれています。
ホルモン依存性の乳がんだけでなく、女性ホルモン(エストロゲン)に非依存性のトリプル・ネガティブ乳がんの治療にも大豆イソフラボンが抗腫瘍効果を示すことが報告されています。
【大豆イソフラボンはトリプル・ネガティブ乳がん細胞の増殖を抑える】
以下のような報告があります。
Therapeutic Effects of Dietary Soybean Genistein on Triple-Negative Breast Cancer via Regulation of Epigenetic Mechanisms(エピジェネティックメカニズムの調節を介したトリプルネガティブ乳がんに対する食事大豆ゲニステインの治療効果)Nutrients. 2021 Nov; 13(11): 3944.
【要旨の抜粋】
大豆に多く含まれるゲニステインなどの天然成分の摂取は、乳がんのリスク低下と強く関連している。しかし、生物活性のある食事成分に基づく治療戦略は、乳がん治療ではほとんど研究されていない。
この研究では、2種類のトリプルネガティブ乳がん患者由来がん細胞(BCM-3204 および TM00091)のマウス同所性移植の動物実験モデルを使用して、トリプルネガティブ乳がんに対するゲニステインの抗腫瘍効果を検討した。その結果、ゲニステインの投与が2種類の移植腫瘍モデルで腫瘍の成長を遅らせることを明らかにした。
BCM-3204 PDX から分離されたがん細胞の遺伝子発現の解析により、食事中のゲニステインが複数の腫瘍調節遺伝子発現に有意に影響することが示された。6種類の遺伝子(Cd74, Lpl, Ifi44, Fzd9, Sat1 and Wwc1)のmRNAおよびタンパク質の発現レベルに変化を引き起こした。
イソフラボンは Cd74遺伝子の発現を抑制し、 NF-κB/Bcl-xL/TAp63 シグナル経路を調節し、トリプルネガティブ乳がんに対するゲニステインの治療効果に寄与している可能性がある。
さらに、ゲニステインは、DNAメチルトランスフェラーゼ (Dnmt3b)、10-11 転座 (Tet3) メチルシトシン・ジオキシゲナーゼ、ヒストン脱アセチル化酵素 (Hdac2) などの主要なエピジェネティック関連遺伝子の発現レベルおよびそれらの酵素活性を調節し、ゲノム DNAのメチル化およびヒストンメチル化 (H3K9) レベルを変更できることが示された。
以上の結果から、治療の選の択肢がほとんどないトリプルネガティブ乳がん患者の治療に食事からのゲニステインの使用の可能性を示している。
大豆イソフラボンのゲニステインがエピジェネティック関連遺伝子の発現レベルおよびそれらの酵素活性を調節して、トリプルネガティブ乳がんの増殖を抑える可能性を報告しています。
ゲニステインがDNAのメチル化を阻害し、ヒストンのアセチル化を促進して、がん抑制遺伝子の発現を亢進して抗がん作用を発揮する可能性が報告されています。
【多くのがん細胞でがん抑制遺伝子のサイレンシングが起こっている】
がんの発生を抑える遺伝子として、がん細胞の増殖を抑える遺伝子(がん抑制遺伝子)やDNAの修復をする遺伝子があります。このようながん細胞の発生を抑えてくれる遺伝子のメチル化がおこれば、そのがん抑制遺伝子はオフになり、発がんしやすくなります。
最近の研究で、がん抑制遺伝子の遺伝子発現を調節するプロモーター部分のDNAのメチル化やヒストンの修飾によって、がん抑制遺伝子のサイレンシング(silencing)が起こっていることが多くのがん細胞で認められています。
DNAに傷がついて間違った塩基に変換したり、遺伝子が途中で切れたりすることをDNAの「変異」と呼び、DNA変異を引き起こす物質を変異原物質とよびます。環境中には、たばこ・紫外線・ウイルス・食品添加物など変異原物質が充満しています。
体内でのエネルギー産生や物質代謝の過程や慢性炎症などで発生する活性酸素も変異原性があります。がんの治療で使われる放射線や抗がん剤も変異原作用があり、放射線治療や抗がん剤治療が別の新たながんの発生の原因となることもあります。これを2次がんと言います。
DNAは4種類の塩基(アデニン、グアニン、シトシン、チミン)の配列によってタンパク質のアミノ酸配列を決めているので、この塩基配列に欠損があったり、異なる塩基に置き換わったりすると、アミノ酸配列(つまり、タンパク質の構造)に変化が起こり、細胞の機能がおかしくなります。
一般的に、細胞のがん化は遺伝子の変異によって起こると考えられています。細胞の増殖や分化や死に関連する遺伝子(がん遺伝子やがん抑制遺伝子)に突然変異が起こって、これらの遺伝子の働きに異常が起こるために細胞ががん化するという考えです。
しかし、最近の研究によって、遺伝子の変異とは関係ない、エピジェネティック(epigenetic)な機序によるがん遺伝子やがん抑制遺伝子の発現異常による発がんメカニズムの重要性が指摘されるようになったのです。
【DNAメチル化は遺伝子発現のスイッチをオフにする】
エピジェネティクスというのは、DNAのメチル化やヒストン(DNAと結合しているタンパク質)のアセチル化など、クロマチン(DNAとタンパク質の複合体)の後天的な修飾によって遺伝子発現が制御されることです。
DNAの遺伝情報に基づいてメッセンジャーRNA(mRNA)が転写され、さらにmRNAからタンパク質が合成されます。このように遺伝子情報がタンパク質の合成を介して、細胞の構造や機能に変換される過程を「遺伝子発現」と言います。
遺伝子にはその発現を調節する部分があり、これをプロモーターと言います。遺伝子を使うか使わないかを制御している領域のことです。(下図)

図:細胞の遺伝情報は核の中の染色体に記録されている(①)。遺伝子の本体はデオキシリボ核酸(DNA)で、一つの細胞には46個の染色体があり、合計で約30億塩基対の塩基配列情報がDNAに記録されている(②)。遺伝子DNAがメッセンジャーRNA(mRNA)に転写されてタンパク質が作られるためには、RNAポリメラーゼや転写因子などの転写を促進する複数の因子が遺伝子の転写調節領域(プロモーター)に結合する必要がある(③)。mRNAはリボソームでタンパク質に翻訳されてタンパク質が生成される(④)。このようにして遺伝子情報からmRNAとタンパク質が合成されて細胞の構造や機能に変化が生じる過程を「遺伝子発現」という(⑤)。
遺伝子が発現するためには、DNAからRNAを作るRNAポリメラーゼという酵素や遺伝子発現を調節する転写因子がこのプロモーター領域に結合することが必要です。
このプロモーター領域には、CpG(C はシトシン、Gはグアニン)という配列が繰り返された部分があり、DNAメチル化とは、DNAのCpGという配列の部分でC(シトシン)にメチル基(-CH3)いう分子がつくことです。
プロモーター領域のDNAにメチル化が起こると、RNAポリメラーゼや転写因子が結合できなくなり、遺伝子からmRNAが転写される段階が阻害され、遺伝子発現のスイッチがオフになるのです。このように、エピジェネティスによって遺伝子発現のスイッチが切られることを「遺伝子のサイレンシング(silencing)」と呼ばれています。
細胞が分裂する際にはDNAが複製されますが、このとき、メチル化されているかいないかの状態も複製されます。このDNAのメチル化を行う酵素がDNAメチルトランスフェラーゼ(DNAメチル基転移酵素)です。DNAのシトシン塩基の5位炭素原子にメチル基を付加する酵素で、DNAのメチル化の状態を維持する働きがあります。

図:遺伝子が発現するためには、DNAからRNAを作るRNAポリメラーゼという酵素や遺伝子発現を調節する転写因子がこのプロモーター領域に結合することが必要(①)。このプロモーター領域には、CpG(C はシトシン、Gはグアニン)という配列が繰り返された部分があり、DNAのCpGという配列の部分でC(シトシン)にメチル基(-CH3)が付いてメチルシトシンに変換することをDNAメチル化という(②)。プロモーター領域のDNAにメチル化が起こると、RNAポリメラーゼや転写因子が結合できなくなり、遺伝子からmRNAが転写される段階が阻害され、遺伝子発現のスイッチがオフになる(③)。
DNAのメチル化がたくさん起こっている状態をハイパーメチル化と言いますが、様々な種類のがん細胞において、複数のがん抑制遺伝子のプロモーター部分にハイパーメチル化が起こっていることが報告されています。ハイパーメチル化が起こっているということは、そのがん抑制遺伝子は働いていないということを意味します。つまり、DNAのハイパーメチル化によってがん抑制遺伝子の発現が抑制されると、その細胞はがん化しやすくなります。
逆に、DNAメチル基転移酵素を阻害してDNAメチル化を抑制すると、スイッチがオフになっていたがん抑制遺伝子のスイッチがオンになって、がん細胞の増殖が抑えられる可能性が示唆されています。がん細胞が分裂するときにDNAメチル化の状態はDNAメチル基転移酵素によって維持されますが、この酵素を阻害するとDNAメチル化の状態が維持できなくなるからです。
【細胞の分化を調節するエピジェネティクス】
ヒト遺伝子は約22000種類のタンパク質を作る設計図(遺伝情報)をもっていますが、このゲノムの持つ遺伝情報の発現は、DNAの塩基配列と転写装置だけで制御されているわけではなく、DNAのメチル化やヒストン(DNAに結合するタンパク質)の修飾などによって複雑に制御されています。
「ゲノム(遺伝子)の塩基配列以外のメカニズムで遺伝子発現を制御し、細胞や生体に変化を生じさせる現象」のことを、エピジェネティクス(epigenetics)と言います。
エピジェネティクスの「エピ」はギリシャ語の接頭語で「上にある、別の、後から」という意味で、本来の遺伝情報(DNAの塩基配列)の土台の「上にかぶさる別の遺伝情報」や「後天的に獲得した遺伝情報」という意味を示しています。
例えば、私たちの体を構成する細胞は全て同じ遺伝情報を持っていますが、皮膚や神経や筋肉や肝臓など機能の異なる細胞になれるのは、それぞれの細胞において、使う遺伝子と使わない遺伝子に違いがあるからです。
つまり、一つの細胞において遺伝子の全てが発現しているわけではなく、発現している遺伝子の違いによって細胞の種類が決まります。このように、DNAの塩基配列(=遺伝情報)が同じなのに、使う遺伝子と使わない遺伝子に目印をつけて、細胞に変化を生じさせる現象がエピジェネティクスです。
最近までは、遺伝子の突然変異によるがん遺伝子やがん抑制遺伝子の機能異常が細胞のがん化の主な原因と考える研究者がほとんどでした。しかし、最近の研究によって、遺伝子の変異とは関係ない、エピジェネティック(epigenetic)な機序によるがん遺伝子やがん抑制遺伝子の発現異常による発がんメカニズムの重要性が指摘されるようになりました。
つまり、DNAの突然変異とは別に、DNAのメチル化や、DNAに結合するタンパク質のヒストンの修飾(アセチル化など)によって遺伝子発現が変化し、細胞ががん化するという機序です。
【DNAメチル化の状態は変えることが可能】
DNAの突然変異は不可逆的な変化です。従って、一旦発生すると、その変異が自然に正常に戻ることはなく、細胞分裂するたびにその変異は引き継がれます。遺伝子の突然変異によって起こった遺伝子異常は元に戻すことはできません。
一方、エピジェネティック(epigenetic)な変化は、細胞分裂のDNA複製時にその状態は引き継がれますが、その状態を変えることができます。DNAのメチル化の状態は、DNAメチル基転移酵素(DNA methyltransferase)の働きによって細胞分裂して増えた細胞にも引き継がれます。
がん抑制遺伝子のサイレンシングが起こっていれば、細胞分裂で増えたがん細胞にもDNAメチル基転移酵素の働きによって同じようにがん抑制遺伝子のサイレンシングが引き継がれます。
しかし、DNAメチル基転移酵素の働きを阻害する薬を投与すると、細胞分裂のDNA複製の時にDNAのメチル化が阻害されるため、今までDNAのメチル化で発現が抑制されていたがん抑制遺伝子のスイッチがオンになり、がん細胞の増殖が抑制されたり、がん細胞が死滅するようになります。
細胞のがん化がDNAの突然変異による不可逆的なものであれば、がんの治療はがん細胞を死滅させる方法しか有効ではありません。変異をもったがん細胞は死滅させないことには治療できないからです。しかし、DNAメチル化のようなエピジェネティックな可逆的な変化であれば、がん細胞を死滅させなくても、おとなしくさせることが可能です。つまり、悪者を殺さななくても、再教育して正常(あるいはおとなしい状態)に戻すことができるというわけです。
「がんは遺伝子が変異しているから、栄養療法や食事療法は効果が無い」という意見がありますが、これは細胞のがん化の原因として突然変異だけしか知られていなかったときには正しかったのですが、エピジェネシスによる細胞のがん化が知られるようになってからは、「栄養療法や食事療法でがん細胞の増殖を抑えることができる」ということは可能性が高いと考えられるようになりました。DNAメチル化を阻害する作用がある天然成分が多数報告されており、そのような成分を含む食品や漢方薬ががんの予防や治療に役立つ可能性が指摘されているからです。
【DNAメチル基転移酵素を阻害する天然成分】
緑茶ポリフェノール、大豆イソフラボンのゲニステイン、ウコンのクルクミン、赤ぶどうの皮に含まれるレスベラトロール、アブラナ科野菜のスルフォラファンなど、がん予防効果が報告されている様々な成分について、DNAメチル化やヒストンのアセチル化の調節などエピジェネティックな作用を示す研究結果が報告されています。
大豆に含まれるイソフラボンのゲニステイン(genistein)は女性ホルモン(エストロゲン)様作用によって乳がんや前立腺がんの発生を予防する効果が知られています。さらに、抗酸化作用やシクロオキシゲンーゼ-2阻害作用などの抗炎症作用、細胞内シグナル伝達阻害による増殖抑制作用、血管新生阻害作用など、様々な抗腫瘍作用が報告されています。さらに最近は、ゲニステインにDNAメチル基転移酵素の阻害作用があることが報告されています。
マウスの実験で、妊娠マウスにゲニステインを投与すると、生まれてきた子マウスの遺伝形質の変化が認められるという報告があります。つまり、胎児期の発育過程で、ゲニステインは胎児DNAのメチル化に影響して、遺伝子発現に変化を与える効果があることを示しています。培養がん細胞を使った実験では、DNAメチル基転移酵素の阻害作用によって、ハイパーメチル化されたがん抑制遺伝子の再発現を促進してがん細胞の増殖を抑える効果が報告されています。

図:DNAメチルトランスフェラーゼ(DNAメチル基転移酵素)はDNAのシトシン塩基の5位炭素原子にメチル基を付加する酵素で、DNAのメチル化の状態を維持する。DNAメチルトランスフェラーゼを阻害すると、DNA複製の際にDNAメチル化維持が阻害され、スイッチがオフになっていたがん抑制遺伝子のスイッチがオンになって、がん細胞の増殖が抑えられる。大豆イソフラボンのゲニステインはDNAメチルトランスフェラーゼの活性を阻害する作用が報告されている。
以前はがん抑制遺伝子の働きの低下は遺伝子の突然変異によるものと考えられてきました。しかし、最近の研究で、細胞のがん化の過程で、多くのがん抑制遺伝子のサイレンシング(エピジェネシスによる遺伝子発現の抑制)が起こっていることが明らかになり、DNAメチルトランスフェラーゼを阻害することによってがん抑制遺伝子を再び発現させる方法ががんの予防や治療の手段として注目されるようになり、エピジェネシスをターゲットにしたがん治療薬の開発も盛んに行われています。
食品や生薬のがん予防効果や抗腫瘍効果のメカニズムも、抗酸化作用や免疫増強作用、抗炎症作用、細胞シグナル伝達阻害作用などが主に検討されてきましたが、遺伝子発現に作用して増殖や転移を抑えている可能性は高いようです。DNAメチルトランスフェラーゼの活性阻害作用をもった天然成分を利用すれば、がんとの共存の可能性も高まると思います。
【ゲニステインはエストロゲン受容体αを再活性化する】
以下のような報告があります。
Epigenetic reactivation of estrogen receptor-α (ERα) by genistein enhances hormonal therapy sensitivity in ERα-negative breast cancer(ゲニステインによるエストロゲン受容体α(ERα)のエピジェネティックな再活性化は、ERα陰性乳がんにおけるホルモン療法の感受性を高める)Mol Cancer. 2013 Feb 4;12:9.
【要旨の抜粋】
研究の背景:エストロゲン受容体-α (ERα) 陰性乳がんは、臨床的に悪性度が強く、従来のエストロゲン標的療法に反応しない。大豆イソフラボンであるゲニステインは、乳がんを予防および抑制することが示されており、最近の研究では、ゲニステイン が、特に ERα 陽性乳がん細胞において、エストロゲン拮抗薬であるタモキシフェンの抗がん能力を高めることができることが示唆されている。しかし、ERα 陰性乳がんにおける ゲニステイン の役割は不明のままである。
方法:MTTアッセイ、リアルタイム逆転写ポリメラーゼ連鎖反応アッセイ、ウエスタンブロットアッセイ、免疫沈降アッセイ、免疫組織化学およびエピジェネティックな酵素活性分析によって、乳がん細胞に対するin vitroでの抗腫瘍作用を検討した。異種移植腫瘍および自然発生乳がんマウス モデルを含む前臨床マウス モデルを使用して、in vivo でのゲニステインの有効性を検討した。
結果:ゲニステインは ERα陰性 MDA-MB-231 乳がん細胞において、ERα発現を再活性化することができ、ヒストン脱アセチル化酵素 (HDAC) 阻害剤であるトリコスタチン Aと組み合わせると、この効果が相乗的に増強された。
ゲニステインは、17β-エストラジオールおよびタモキシフェン(エストラジオール拮抗薬)に対する ERα 依存性細胞応答も再感作した。
さらに、ゲニステインはERαプロモーターのクロマチン構造のリモデリングを引き起こし、それによってERαの再活性化に寄与することが明らかになった。食餌性ゲニステインは乳がんの発生を有意に防ぎ、ERα陰性マウス乳房腫瘍の成長を減少させた.ゲニステインは、少なくとも部分的にエピジェネティックなERαの再活性化により、タモキシフェン誘導性の抗がん効果をさらに高めた。
結論:私たちの研究は、大豆ゲニステインがエピジェネティックにERα発現を回復できることを示唆している。私たちの研究の結果は、難治性ERα陰性乳がんにおけるゲニステインと抗ホルモン療法を使用した新しい治療的組み合わせアプローチを明らかにし、乳癌治療により効果的な選択肢を提供する。
エストロゲン受容体が陰性でも、ゲニステインによってエストロゲン受容体の発現を再活性化すると、ホルモン療法による治療効果が期待できるという内容です。
つまり、トリプル・ネガティブ乳がんをルミナルタイプ(ホルモン依存性)に変えてホルモン治療を行うという戦略です。ゲニステインの摂取はホルモン依存性の乳がんだけでなく、トリプル・ネガティブ乳がんに対しても効果が期待できます。
DNAメチル化の他にヒストンのアセチル化も遺伝子発現を促進します。
細胞核内では、DNAはヒストンという球状の蛋白質複合体に巻き付くような状態で存在します。ヒストンはリジンやアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。
遺伝子が転写されるためには、転写因子やRNAポリメラーゼなどの他の蛋白質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。アセチル化というのはアセチル(CH3CO)基が結合することです。 ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制されると考えられています。
ゲニステインはDNAメチル基転移酵素を阻害する作用の他、ヒストンのアセチル化を促進する作用も知られています。前述の論文では、ゲニステインにヒストン脱アセチル化酵素の阻害剤を併用すると抗腫瘍効果が高まることが明らかになっています。
ヒストンのアセチル化と脱アセチル化の反応はヒストンアセチル基転移酵素とヒストン脱アセチル化酵素によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています。再利用薬を用いたがんの代替療法でも、ヒストンアセチル化を高める方法が多数知られています(下図)。

図:ヒストン脱アセチル化酵素によってヒストンのアセチル化が低下すると、ヒストンとDNAが蜜に接着してクロマチンが凝集し、遺伝子転写活性は抑制される(①)。ケトン食で産生されるβ-ヒドロキシ酪酸、アブラナ科植物に含まれるジインドリルメタン、関節リュウマチ治療薬のオーラノフィンはヒストン脱アセチル化酵素を阻害してヒストン・アセチル化を亢進する(②)。アセチルCoAはグルコースや脂肪酸の分解で産生される。ジクロロ酢酸ナトリウムとメトホルミンは細胞内のアセチルCoAの濃度を高め、アセチル-L-カルニチンはアセチル基を供給する(③)。アセチルCoAのアセチル基はヒストンアセチル基転移酵素によってヒストンのアセチル化に使用される(④)。ヒストン・アセチル化によってクロマチンが緩むと遺伝子転写活性が亢進する(⑤)。核内受容体に作用するATRA(オールトランス・レチノイン酸)、ビタミンD3、ピオグリタゾン、ベザフィブラートは細胞分化を誘導する(⑥)。その結果、がん細胞の増殖抑制、アポトーシス誘導、浸潤・転移の抑制が起こる(⑦)。
つまり、ゲニステインに上記の薬剤を併用すると、エピジェネシスによる機序でがん細胞の増殖を抑制できます。
【豆乳を発酵させると抗がん作用が強くなる】
豆乳などの大豆製品には、大豆タンパクやイソフラボンなどの機能性成分が豊富に含まれており、機能性食品のベースとして魅力的な素材です。
前述の様に、大豆の有効成分の中でもイソフラボンが注目されています。イソフラボンは、女性ホルモンの構造に似た構造を持つことが知られており、エストロゲン受容体に結合することによるエストロゲン作用、またはエストロゲンがその受容体に結合するのを阻害することによる抗エストロゲン作用のいずれかを発揮する可能性があります。
さらに、イソフラボンには、エストロゲン受容体とは独立して作用する他の生理学的効果 (チロシンキナーゼ阻害、血管新生阻害作用、ナチュラルキラー (NK) 細胞の活性化、抗酸化効果など)も報告されています。
大豆に含まれるイソフラボンは主にゲニステインとダイゼインです。グリシテインも少量含まれます。これらのイソフラボンは糖が結合したグリコシド(配糖体)として存在します。
グリコシドは腸内の細菌の酵素によって加水分解され、グルコース(ブドウ糖)が除去されてアグリコン(配糖体のうち糖以外の成分)が生成されます。(下図)

図:大豆イソフラボンは主にグルコースが結合した配糖体の形で存在する。腸内細菌のβ-グルコシダーゼで糖部分が除去され、それぞれのアグリコンとして消化管から吸収され、体内組織に分布して様々な薬効を発揮する。
配糖体が体内に吸収されるためには、配糖体からアグリコンに変換されることが重要です。大豆中のイソフラボンはほとんどが配糖体として存在しており、この状態では体内に吸収されません。腸内細菌などの働きによって糖が外れ、アグリコン型のイソフラボンに変換されると、体内に吸収され機能を発揮します。
豆乳を乳酸菌で発酵させると、配糖体型のイソフラボンがアグリコン型のイソフラボンに変換されます。発酵豆乳(豆乳ヨーグルト)は多くの製品が市販されています。
豆乳ヨーグルトは自分で作ることも簡単です。固形成分が8%以上の豆乳を購入して、乳酸菌を入れて室温に放置して発酵させると、1日から2日で豆乳ヨーグルトができます。乳酸がタンパク質を凝固して固まります。
豆乳専用の種菌も販売されていますが、市販されている豆乳ヨーグルトや牛乳で作ったヨーグルトの上澄みや、乳酸菌飲料を適量入れても作れます。乳酸菌の種類によって味や風味や舌触りが異なり、いろんな乳酸菌を試してみると面白いと思います。作り方はインターネットで検索すればすぐ分かります。(下図)

図:タンパク成分が8%以上の豆乳を使うとよく固まる(①)。豆乳ヨーグルト専用の種菌も販売されている(②)。豆乳に乳酸菌を入れて蓋をして室温に放置すると1〜2日で固まり、豆乳ヨーグルトができる(③)。市販されている豆乳ヨーグルトや牛乳で作ったヨーグルトの上澄み液や、乳酸菌飲料を適量入れても豆乳ヨーグルトができる(④)。
腸内細菌叢で乳酸菌が増えると腸内環境が良くなり、免疫力が高まります。乳酸菌は豆乳中の糖質を分解して乳酸に変換するので、糖質制限やケトン食を実践している場合もメリットがあります。
大豆イソフラボンは多くの健康作用を有するので、牛乳で作ったヨーグルトより健康的です。
ミルクプロテインはがん細胞の増殖を促進する作用が強いのですが、大豆プロテインは増殖促進活性が低い点もメリットがあります。
アグリコン型のイソフラボン(ゲニステイン、ダイゼイン)は乳がんや前立腺がんだけでなく、多くのがんの予防にもなります。更年期障害、骨粗鬆症、動脈硬化、高尿酸血症、メタボリック症候群を改善する効果があリます。美容(しみ、脱毛の予防)にも有効です。
私も、最近はヨーグルトを止め、自分で豆乳ヨーグルトを作って毎日食べています。
新刊紹介

| « 821)乳がん治... | 823)ラパマイ... » |



