がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
300)スタチンとメトホルミンとがんのケトン食療法
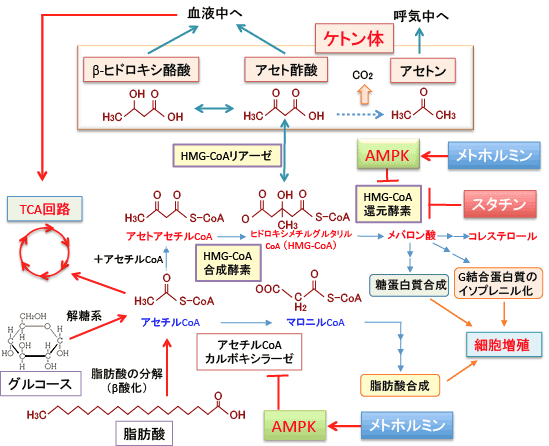
図:ヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害すると、コレステロール合成の抑制だけでなく、がん細胞の増殖を抑える効果も得られる。一方、HMG-CoAはHMG-CoAリアーゼによってアセト酢酸に変換される。AMP活性化プロテインキナーゼ(AMPK)はHMG-CoAの活性を阻害するので、AMPKを活性化するメトホルミンもHMG-CoA還元酵素の作用を阻害する。スタチンやメトホルミンによってHMG-CoA還元酵素を阻害することは、直接的な抗腫瘍作用の他に、糖質制限やケトン食を行っているときは、HMG-CoAからケトン体の合成へ向う経路を亢進することによって抗腫瘍効果を示す可能性が示唆される。メトホルミンによって活性化されるAMPKは脂肪酸合成を阻害してがん細胞の増殖を阻害する効果もある。
300)スタチンとメトホルミンとがんのケトン食療法
【HMG-CoA還元酵素阻害剤の抗がん作用】
コレステロールやステロイドは、アセチルCoAから生成されるメバロン酸(Mevalonic acid)を経て生合成されます。この生合成経路をメバロン酸経路(Mevalonic acid pathway)と言い、このメバロン酸生成の律速酵素である3-ヒドロキシ-3-メチルグルタリルCoA還元酵素(HMG-CoA還元酵素)を阻害すると肝臓でのコレステロール生合成を抑制することができるため、多くのHMG-CoA還元酵素阻害剤が開発され高脂血症治療薬として臨床で使われています。このようなHMG-CoA還元酵素の働きを阻害することによって血液中のコレステロ-ル値を低下させる薬(HMG-CoA還元酵素阻害剤)の総称をスタチン(Statin)といいます。
スタチンにはプラバスタチン(商品名:メバロチン)やシンバスタチン(商品名:リポバス)など多くの製品があり、近年の大規模臨床試験により、高脂血症患者における心筋梗塞や脳血管傷害の発症リスクを低下させる効果が示されています。
メバロン酸はコレステロールの合成に必要なだけでなく、糖たんぱくの合成や、GTP結合タンパク質(Gタンパク質)のイソプレニル化に必要な物質(geranylpyrophophateやfarnesylpyrophosphate)を作ります。GTP結合タンパク質(Gタンパク質)は内在性のGTP加水分解活性をもつタンパク質の総称で、この内、低分子量Gタンパク質群(Ras, Rho,など)は分子量が2万~3万のタンパク質として、これまで100種類以上報告されており、イソプレニル化を受けた後に細胞膜に移行することで、GTP結合型(on)/GDP結合型(off)として細胞内シグナル伝達に関与しています。RasやRhoはがん遺伝子として知られています。HMG-CoA還元酵素を阻害してイソプレノイド生成が低下すると、低分子量Gタンパク質の活性が低下して、増殖活性が低下します。(イソプレノイドはRasなどの低分子Gタンパク質が細胞膜の脂質に接着するときに必要が生体分子で、それができないと活性化できないので、がん細胞の増殖が抑制されるということです。)
スタチンの抗がん作用については多くの基礎研究が行われており、スタチンによるメバロン酸経路の阻害は、がん細胞のシグナル伝達に影響し、がん細胞の増殖や転移の抑制、血管新生阻害、アポトーシス誘導などの抗がん作用が、培養細胞を使った実験や動物実験で報告されています。そこで、スタチンの服用とがんの発生率を検討した大規模臨床試験が多数行われていますが、その結果は肯定と否定の両方があります。
スタチンを長期間服用している人はがんの発生が少ないという報告は多数あります。たとえば、イギリスの研究では、スタチンを服用している人は服用していない人に比べて大腸がんの発生率が43%に減少することが報告されています。そしてスタチンの服用量と服用期間は大腸がんの発生率と逆相関することが示されています(つまり、スタチンの服用量が多いほど、服用期間が長いほど、大腸がんの発生率が低い)。(BMC Gastroenterol 2012 Apr 24; 12:36)
また、20万人以上を対象にしたイスラエルの研究でも、スタチンを服用しているグループではがん全体の発生率が低く、とくに血液腫瘍の発生率が低いことが報告されています。(Prev. Chronic Dis 2012 Aug 9: E137, doi: 10.5888/pcd9.120005)
しかし最近のメタ解析の論文によると「スタチンの服用はがんの発生リスクを低下させる効果は無い」という結論になっています。(Lack of Effect of Lowering LDL Cholesterol on Cancer: Meta-Analysis of Individual Data from 175,000 People in 27 Randomised Trials of Statin Therapy. PLoS ONE 7(1): e29849 )
がんの種類(前立腺がんなど)によってはスタチン単独でがん予防効果が認められていますので、スタチンのがん予防効果はがんの種類によるようです。
【糖質制限・ケトン食療法の抗がん作用のポイントはケトン体の量】
前述のように、ヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害すると、コレステロール合成の抑制だけでなく、がん細胞の増殖を抑える効果も得られます。一方、HMG-CoAはHMG-CoAリアーゼによってアセト酢酸に変換されます(上図参照)。
糖質制限と高脂肪食によるケトン食によるがん治療を行っているとき、ケトン体の産生量を増やすことがポイントになりますが、HMG-CoA還元酵素を阻害すると、HMG-CoAはケトン体産生の経路にいく可能性が高くなるように思われます。つまり、HMG-CoA還元酵素の阻害は、直接的な抗腫瘍効果と、ケトン食療法中はケトン体の産生を高めて間接的に抗腫瘍効果を発揮する可能性が示唆されます。ケトン食の抗がん作用については295話で少し解説しています。
ケトン食が抗がん作用を示すことを報告する論文が最近増えています。以下のような論文が今月報告されています。
Targeting insulin inhibition as a metabolic therapy in advanced cancer: A pilot safety and feasibility dietary trial in 10 patients.(進行がんに対する代謝治療としてのインスリン阻害を目指す治療:10例のがん患者を対象にした安全性を妥当性を評価する予備試験
(Nutrition 28(10): 1028-35, 2012)
米国ニューヨーク州のアルバート・アインシュタイン医科大学の放射線科のグループからの研究
【要旨】
目的:増殖の早いがんの多くは、フッ素の同位体で標識したブドウ糖(18F-fluorodeoxy glucose:フルオロデオキシブドウ糖)を使ったPET(Positron Emission Tomography:陽電子放射断層撮影)検査で陽性を示す。これはがん細胞ではグルコースの取込みが亢進し嫌気性解糖系主体のエネルギー産生を行っていることによる。インスリン分泌を阻害する方法はがんの増殖を抑制することができる。
方法:進行した根治治療不可能ながん患者でPET検査で腫瘍を検出し、Eastern Cooperative Oncology Groupの基準のパフォーマンスステータス(performance status:PS)が0~2で、諸臓器機能が正常で糖尿病が無く、最近の体重減少を認めず、BMI(Body Mass Index)が20kg/m2以上の条件を満たす10例を対象にした。糖質を総カロリーの5%に制限した食事によってインスリン分泌を抑制し、栄養素摂取、体重、血清電解質、βヒドロキシ酪酸、インスリン、インスリン様増殖因子-1と2を測定して経過を観察した。PET検査は、食事療法開始の前と終了時に実施した。
結果:10人の対象者は26~28日間の糖質制限食を実施し、特に副作用を認めなかった。総カロリーの平均は治療開始前より35±6%減少し、体重は平均4%(0.0~6.1%)減少した。食事療法開始前に腫瘍の早い進行を認めていた9例のうち5例で病状安定(stable disease)あるいは部分奏功(partial remission)をPET検査で認めた。この5例は、進行を続けた4例と比較して、3倍の食事性ケトン症(dietary ketosis)を示した。
腫瘍増殖の抑制を認めた5例と進展して4例の間には、カロリー摂取や体重減少の程度には差を認めなかった。ケトン症のレベルは血清インスリンの濃度と逆相関の関係にあった。
結論:この予備試験の結果は、インスリンの分泌を阻害する食事療法(糖質制限によるケトン食)は進行がん患者において安全に実施できる。この食事療法による抗腫瘍効果(病状安定および部分奏功)は、摂取カロリーや体重減少の程度とは関係せず、ケトン症の程度(血中ケトン体の濃度)に相関していた。標準治療の補完療法としてインスリン分泌を抑制する食事療法の有効性についてさらに大規模な臨床試験が望まれる。
インスリンががん細胞の増殖を促進することは十分な根拠があります。したがって、インスリンの分泌を少なくする糖質制限食ががん細胞の増殖を抑制することも多くの動物実験や臨床試験などで示されています。
さらに、ケトン体ががん細胞の増殖を抑制する効果があり、糖質制限と高脂肪食によるケトン食が抗がん作用を示すことも最近多くの研究で明らかになっています。この報告は、進行がんの治療としてケトン食が十分に効果が期待できることを示しています。この研究で最も重要な結果は、血中のケトン体レベルが高いほど、がん細胞の増殖抑制効果が高いという点です。カロリー摂取や体重減少とは関連せず、ケトン体の量のみが奏功率と関連するということです。したがって、糖質制限と高脂肪食によるケトン食を行うとき、ケトン体を増やす工夫が最も重要だということです。
ケトン体を増やすためには、中鎖脂肪を多く摂取し、メトホルミンによってAMP活性化プロテインキナーゼ(AMPK) を活性化し糖新生を抑制する方法は有効です。AMPKはHMG-CoAの活性を阻害するので、AMPKを活性化するメトホルミンはHMG-CoA還元酵素の作用も阻害します(上図)。さらに、長鎖脂肪酸の吸収とβ酸化による分解を促進するために、脂肪分解酵素のリパーゼ、肝臓での長鎖脂肪酸のミトコンドリアへの運搬を促進するL-カルニチンの摂取も有効です。(詳しくは297話参照)
HMG-CoA還元酵素を阻害するとHMG-CoAはケトン体合成の経路に振り向けられることになります。私自身はがんも糖尿病も高脂血症も無いのですが、ケトン食を実践している最中で、メトホルミンとHMG-CoA還元酵素阻害剤のプラバスタチンを服用して尿中ケトン体を測定してみると、ケトン体の量が増えるようです。
メトホルミンとスタチンの併用は極めてポピュラーです。スタチンは世界で最も売上高の高い薬で、世界中でスタチンの処方されている患者は4000万人以上、スタチン全体の薬代としてで世界中で1年間に3兆円以上が使われているということです。
メトホルミンは薬価が安いので、売上額は上位に行きませんが、恐らく最も多くの患者に処方されている薬と言われています。日本ではあまり使用されない傾向にありますが、米国と欧州の糖尿病学会では、メトホルミンを2型糖尿病の第一選択薬に指定しています。そして、米国では、糖尿病患者に多く合併する高脂血症の治療にスタチンを処方することを推奨しています。したがって、メトホルミンとスタチンの併用は糖尿病患者の多くに使用されています。
そこで、スタチンとメトホルミンの併用ががんの発生率にどのような影響があるかという臨床試験も行われています。5000人以上の糖尿病患者を対象に平均5年間追跡調査し、前立腺がんの発生率を比較した臨床試験では、スタチンとメトホルミンの併用投与により、どちらも投与しないグループに比較して前立腺がんの発生率は32%に低下したことが報告されています。(Diabetes Care 35(5): 1002-7, 2012)
上記の論文のようにケトン体を多く産生させると、食事療法だけでがんを縮小できることが臨床試験で明らかになっています。ケトン食療法にメトホルミンとスタチンを併用すると理論的には抗腫瘍効果を高めることができそうです。(ただし、まだ臨床的には実証されていないため、この方法はあくまで自己判断になります。現在、この方法に問題点が無いか、私自身の体で確かめています)
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
| « 299)ハーブ系... | 301)がん治療... » |



