がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
674) イベルメクチン(Ivermectin)の抗がん作用(その2): p21活性化キナーゼ(PAK)阻害作用
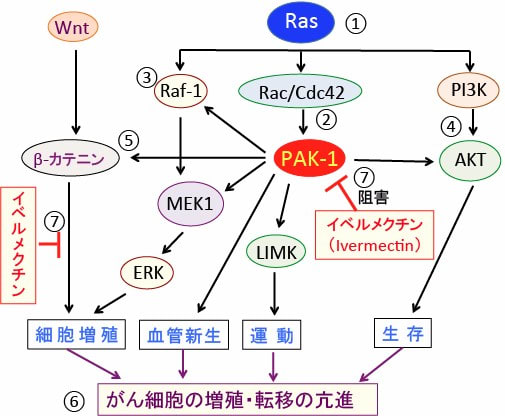
図:低分子量Gタンパク質のRASは細胞外のさまざまな刺激(チロシンキナーゼ受容体やサイトカイン受容体やカルシウムチャネルなど)を受けて細胞増殖や生存を促進するRAFキナーゼ(Raf-1)やPI-3キナーゼ(PI3K)など多数のシグナル伝達系を活性化する(①)。p21活性化キナーゼ(PAK-1)はRacおよびCdc42のような低分子量GTPaseによって活性化される(②)。PAK-1はRasシグナル伝達系の主要な経路であるRaf-1/MEK1/ERK経路(③)とPI3K/AKT経路(④)を活性化する。さらに、PAK-1はβ-カテニンをリン酸化してWNT/β-カテニン経路を活性化する(⑤)。このように、PAK-1は複数のシグナル伝達系の制御に関与し、がん細胞の増殖と転移を促進する(⑥)。寄生虫治療薬のイベルメクチン(Ivermectin)はPAK-1とWNT/β-カテニン経路を阻害する作用によって、抗腫瘍作用を発揮する(⑦)。
674) イベルメクチン(Ivermectin)の抗がん作用(その2): p21活性化キナーゼ(PAK)阻害作用
【グアノシン3リン酸(GTP)は増殖シグナルのスイッチの役割を持つ】
遺伝子の本体であるDNA(デオキシリボ核酸)は4種類の塩基(アデニン、グアニン、シトシン、チミン)の配列で遺伝情報(タンパク質のアミノ酸配列)を保存しています。(下図)

図:DNAは2本のポリヌクレオチド鎖がより合わさった二重らせん構造になっており、そこには4種類の塩基という物質(アデニン、グアニン、シトシン、チミン)が、文字列のように延々と一列に並んでおり、遺伝情報を保存している。2本のポリヌクレオチド鎖はアデニン(Adenine)とチミン(Thymine)、グアニン(Guanine)とシトシン(Cytosine)が水素結合を介して結合して二重らせん構造を形成している。
アデニンとグアニンはプリン塩基と言います。プリン塩基はプリン骨格を持った塩基で、代謝されて尿酸になります。シトシンとチミンはピリミジン塩基と言います。
アデニン(Adenine)とグアニン(Guanine)にリボースが結合したものがアデノシン(Adenosine)とグアノシン(Guanosine)になります(下図)。

アデノシンにリン酸基が1個ついたのがアデノシン1リン酸(Adenosine monophosphate:AMP)、リン酸基が2個ついたのがアデノシン2リン酸(Adenosine diphosphate:ADP)、リン酸基が3個ついたのがアデノシン3リン酸(adenosine triphosphate:ATP)になります。
ATPは2個の高エネルギーリン酸結合を利用して、リン酸1分子が離れたり結合したりすることで、エネルギーの放出と貯蔵を行い、細胞内での物質の合成や輸送、筋肉運動など様々な生命活動のエネルギーとして利用されています。

図:食物の分解(異化)によって生成されるエネルギー(①)を使ってADPにリン酸を結合させてATPが合成される(②)。ATPが加水分解されてリン酸を放出する過程でエネルギーが産生され(③)、生命活動(筋肉の収縮、能動輸送、物質合成など)に使用される(④)。細胞はADPを再利用してATPを再合成している。ATPは瞬時に使用され、ATP ⇆ ADP + りん酸という回路反応を繰り返し、ADPは1日に1000回以上使い回されていてATPに再合成されている。1日に再合成されるATP量は数十kgになる。
一方、グアノシンもリボースに結合したリン酸基の数によって、グアノシン1リン酸(GMP)、グアノシン2リン酸(GDP)、グアノシン3リン酸(GTP)が作られます。
ATP が細胞内でのエネルギー通貨として使われるのに対して、GTP は主として細胞内シグナル伝達やタンパク質の機能の調節に用いられます。
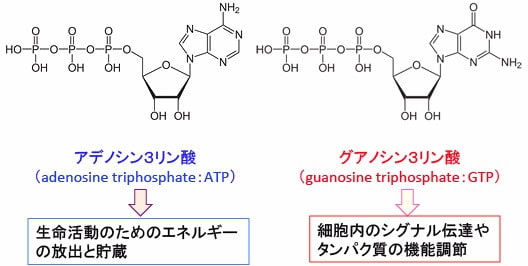
図:アデノシン3リン酸(ATPは)生命活動のためのエネルギーの放出と貯蔵に使用され、グアノシン3リン酸は細胞内のシグナル伝達やタンパク質の機能調節に使用されている。
【GTP結合タンパク質は細胞内シグナル伝達系のスイッチとして働く】
細胞内におけるシグナル伝達においてGTP結合タンパク質(Gタンパク質)が重要な役割を担っています。
GTP結合タンパク質(Gタンパク質)は内在性のGTP加水分解(GTPase)活性をもつタンパク質の総称で、この内、低分子量Gタンパク質群(Ras, Rho,など)は分子量が2万~3万のタンパク質で、これまで100種類以上報告されています。RasやRhoはがん遺伝子として知られています。
Gタンパク質はGTP結合型(on)/GDP結合型(off)として細胞内シグナル伝達に関与しています。
すなわち、Gタンパク質はGDPが結合した不活性型とGTPが結合した活性型の間をサイクル(GTPaseサイクル)することにより、細胞外からの情報を細胞内に伝達します。
RASは21kDaの分子量の単量体GTPaseです。RASサブファミリーの代表はHRAS、KRAS、NRASの3つです。HRASとKRASはラット肉腫ウイルスから分離され、NRASはヒト神経芽細胞腫から分離されました。
RASは細胞外のさまざまな刺激、例えばチロシンキナーゼ受容体やサイトカイン受容体やカルシウムチャネルなどの刺激を受けてGDPが結合した不活性の状態からGTPに結合した活性化の状態に移行します。このGDP/GTP交換反応を促進するのがGEF(guanine-nucleotide exchange factors)です。
またGTPに結合したRASは内在性のGTPaseによりGDP結合型に戻りますが、この反応を促進するのがGTPase-activating proteins(GAP)です。
活性化したGTP結合型のRASは幅広い下流のターゲット(effectors)と相互作用をし、下流のシグナルを活性化します。
そのeffectorとして細胞増殖や生存を促進するRAFキナーゼやPI-3 キナーゼなど多数のシグナル伝達系が知られています。
がん細胞ではRasタンパク質の変異によって、GTPが結合した状態の活性型が持続して、細胞の増殖や運動や生存が促進されています。

図:(左)正常細胞では、低分子量GTP結合タンパク質のRasは、細胞外のさまざまな刺激を受けてGDP/GTP交換反応を促進するGEF(guanine-nucleotide exchange factors)の作用によって(①)、GDPが結合した不活性の状態からGTPに結合した活性化の状態に移行し(②)、シグナル伝達の下流に位置するエフェクターを活性化し、細胞増殖やアポトーシスや遺伝子発現を制御する(③)。GTPに結合したRasは内在性のGTPaseによりGDP結合型に戻るが、この反応はGTPase-activating proteins(GAP)で促進される(④)。
(右)がん細胞では、Rasタンパク質は変異し(Ras*)、スイッチが常時オンの状態になっている(⑤)。GAPによるGTPの分解もできない(⑥)。活性化したGTP結合型のRasは下流のターゲット(エフェクター)と相互作用をし、下流のシグナル伝達系を恒常的に活性化する(⑦)。そのエフェクターとして細胞増殖や生存を促進するRAFキナーゼ(RAF/MEK/ERK経路)やPI-3 キナーゼ(PI3K/AKT/mTORC1経路)など多数のシグナル伝達系が知られている。その結果、がん細胞ではRasタンパク質の変異によって、GTPが結合した状態の活性型が持続して、細胞の増殖と生存が促進されている。
【がん細胞ではRAS変異によってp21活性化キナーゼ(PAK)が活性化している】
がん細胞の特徴として、細胞増殖の亢進、細胞死に対する抵抗性、周囲組織への浸潤や遠隔臓器への転移が挙げられます。
正常細胞は、増殖や細胞死や移動は厳密に制御されており、がん細胞はその制御が壊れて、無制限に増殖し、正常組織に浸潤し破壊して、増大していきます。細胞骨格はこれらのプロセスに必須の役割を担っています。
つまり、がん細胞の浸潤や転移は細胞の運動性に依存しており、細胞の運動性には細胞骨格の動的変化が必要です。
細胞の運動性を制御する細胞骨格の動的変化の背後にあるシグナル伝達経路にはRas関連の低分子量GTAアーゼ(Ras-related small GTPases)と、p21活性化キナーゼ(p21-activated kinases :PAKs)を含むエフェクタータンパク質が関与しています。
PAKキナーゼは酵母やショウジョウバエにも存在するセリン/スレオニンプロテインキナーゼのファミリーであり、哺乳類では6つのアイソフォーム(PAK1〜6)が発見されています。
それらはすべて低分子量GTPaseの RacおよびCdc42の直接の標的です。
細胞骨格の動的変化の制御における役割に加えて、PAKは細胞の生存、分裂、遺伝子転写などの様々な細胞活動を調節することが明らかになっています。
いくつかの成長因子受容体チロシンキナーゼ(インスリン、EGF、PDGF、VEGF受容体など)およびGタンパク質共役受容体からのシグナルは、PAKの活性化につながります。
これらの経路は、PI-3キナーゼ(PI3K)とグアニンヌクレオチド交換因子(GEF)の連続的な活性化を通じて低分子量GTPase のRacおよびCdc42を活性化し、PAKを活性化します。
がん細胞では、PAKの活性化は変異Rasを介して頻繁に起こっています。
Rasは最も一般的に変異しているがん遺伝子の1つであり、MAPキナーゼ経路とPI3キナーゼを活性化し、PAKキナーゼを活性化します。
ヒトがんの70%以上において、PAK-1の活性亢進ががん細胞の増殖に関与していると言われています。

図:受容体チロシンキナーゼ(インスリン受容体、EGF受容体、PDGF受容体、VEGF受容体)およびGタンパク質共役型受容体(G protein coupled receptor : GPCR)からのシグナル(①と②)は、RASおよびPI3Kを活性化し(③)、GDP/GTP交換反応を促進するGEF(guanine-nucleotide exchange factors)の作用によって(④)、Rac/Cdc42はGTP結合型になって活性化し(⑤)、Rac/Cdc42のエフェクターであるp21活性化キナーゼ(PAK-1)を活性化する(⑥)。活性化したPAK-1は細胞の生存と増殖を促進し、がん細胞の増殖と転移を亢進する(⑦)。さらに、PAK-1はRASによるMAPキナーゼ(分裂促進因子活性化タンパク質キナーゼ)経路の活性化を増強する(⑧)。PAK-1の活性化は、RacおよびCdc42を介する以外に、GTPaseに依存しないメカニズムでも起こる。
【PAK阻害はがん細胞の抗がん剤感受性を高め、抗腫瘍免疫を増強する】
がん細胞の多くは、がん遺伝子とそのシグナル伝達経路によって制御されています。これらの経路の分析により、多くのがん治療薬(分子標的薬)が開発されています。
最も成功した薬のいくつかは、プロテインキナーゼを標的にしています。細胞の生存、細胞の増殖、および細胞の移動に重要な役割を果たすプロテインキナーゼは、がん細胞の成長と腫瘍浸潤における役割のため、重要な標的です。
そのようなキナーゼの1つのグループであるPAKキナーゼは、がん治療の標的として有望視されています。
多くの悪性腫瘍において、PAKの過剰な発現や活性化が認められており、PAKをターゲットにした治療法が注目されており、選択的なPAK阻害剤の探索と開発に関する取り組みが進行しています。
PAKキナーゼの阻害ががん細胞の抗がん剤感受性を高め、抗腫瘍免疫を増強することが報告されています。以下のような報告があります。
Inhibition of p21 activated kinase enhances tumour immune response and sensitizes pancreatic cancer to gemcitabine.(p21活性化キナーゼの阻害は、抗腫瘍免疫応答を強化し、ゲムシタビンに対する膵臓がんの感受性を高める)Int J Oncol. 2018 Jan;52(1):261-269.
【要旨】
膵管腺がんは、診断の遅れと効果的な治療の欠如のために高い死亡率を示す。膵管腺がんには独特の免疫抑制性微小環境が存在するため、免疫療法は効果が出にくい。
ゲムシタビンをベースにした化学療法がいまだに主流の治療手段になっているが、生存率の改善はわずかである。したがって、膵管腺がんに対する効果的な治療法の開発が必要である。
膵臓がん細胞に対する免疫応答およびゲムシタビンに対する感受性に対するp21活性化キナーゼ(PAK)の影響を検討した。
膵臓がん細胞をマウスの膵臓の尾部に移植した同所性マウス膵管腺がんモデルを用いた。マウスにPAK阻害剤PF-3758309を投与し、ゲムシタビンを併用する場合と併用しない場合で検討した。
腫瘍の成長を体積と重量で測定した。腫瘍免疫応答は、脾細胞のフローサイトメトリー分析および腫瘍内リンパ球の免疫組織化学染色により検討した。
PF-3758309によるPAKの阻害は、腫瘍の成長を抑制するだけでなく、脾臓および腫瘍内Tリンパ球の数を増やすことにより、がん細胞に対する免疫応答を刺激した。
さらに、in vitroおよびin vivoの実験モデルで、PAK阻害はゲムシタビンと相乗的に膵管腺がん細胞の成長を減少させた。
このようなPAKの阻害による二重の効果により、PAKを標的とした治療は膵管腺がんの治療効果を高める。PAK阻害剤とゲムシタビンの組み合わせは、膵管腺がん治療におけるより効果的な治療アプローチの可能性がある。
膵臓がんは最も悪性度が高くかつ致命的な悪性腫瘍の1つであり、予後は非常に悪く、5年生存率は8%未満です。この悲惨な結果は、主に診断の遅れ、早期の遠隔転移および抗がん剤治療に対する抵抗性によるものです。
膵臓がんの進行は、複数の遺伝的変異の蓄積によって特徴付けられ、Krasがん遺伝子の変異が最も頻度が高く、膵臓がんの95%以上がKras変異を保有しています。
Kras遺伝子内のコドン12、13または61にミスセンス変異が存在すると、Krasタンパク質の生理的不活性化サイクルが破壊され、GTPase活性化タンパク質(GAP)の存在下でも構成的に活性化された状態になります。
Krasは、上皮成長因子受容体(EGFR)のシグナル伝達経路において重要な役割を担うタンパク質です。そのシグナル伝達経路は複雑なカスケードを構成し、がんの発生と進行に関与しています。
Krasの変異による恒常的な活性化は、PAKキナーゼなどのエフェクタータンパク質の活性化によってがん細胞の増殖や転移を促進します。(下図)

図:低分子量Gタンパク質の一種のKRASは、GDP結合型が不活性型で(①)、上皮成長因子受容体などからの刺激を受けてGTP結合型となって活性化され(②)、エフェクタータンパク質に作用して情報を伝達し、細胞の増殖や転移を亢進し、アポトーシス(細胞死)に抵抗性になる(③)。膵臓がんのほとんどの例で、Kras変異によるKrasの恒常的活性化が起こっている。
p21活性化キナーゼ(PAK)はKrasの重要な下流エフェクターであり、細胞増殖、アポトーシス、浸潤/移動および化学療法抵抗性の調節に関与しています。
Krasシグナル伝達の下流エフェクターとして、p21活性化キナーゼ(PAK)は、複数の発がん性シグナル伝達経路の連結部に位置しています。
Krasタンパク質は、その表面に明確な薬物結合ドメインが存在しません。これまでのところ、30年以上にわたる研究にもかかわらず、Krasのタンパク質を直接ターゲットにした薬は開発されていません。
PI3K、AKT、MEKなど、Krasシグナル伝達系の重要な下流のエフェクターを標的とした治療薬が開発されましたが、ほとんどすべてのケースで耐性が急速に出現し、これらの分子標的の効果が低下しました。
この課題を克服するために、Krasタンパク質の新しい下流エフェクターを標的とするアプローチが研究されており、そのような新規エフェクターのファミリーの1つとしてp21活性化キナーゼ(PAK)が注目されています。
PAKはKrasおよびCdc42やRacのような低分子量GTPaseによって、直接的および間接的なメカニズムによって活性化されます。PAKは膵臓がんのさまざまな特徴的なプロセスを仲介する複数の発がん性シグナル伝達経路の中心に位置しています。
膵臓がんには、腫瘍の発生中に独自の免疫応答があります。Krasがん遺伝子は、炎症プロセスを媒介し、腫瘍微小環境内に免疫抑制状態を確立しています。さらに、膵臓がんにおける広範な線維形成反応は、免疫監視に対する生理的障壁としても機能し、抗腫瘍免疫応答の回避と腫瘍の進行につながります。
前述の研究は、PAKの阻害が膵臓がん細胞の増殖抑制だけでなく、抗腫瘍免疫を増強する効果があることを報告しています。
【寄生虫治療薬イベルメクチンはがん細胞の抗がん剤感受性を高める】
寄生虫治療薬のイベルメクチンについては673話で解説しました。
イベルメクチン(ivermectin)はマクロライド類に属する物質で、腸管糞線虫症や糸状虫や疥癬など多くの寄生虫に有効です。
静岡県伊東市内のゴルフ場近くで採取した土壌から大村智博士により発見された新種の放線菌「ストレプトマイセス・アベルメクチニウス(Streptomyces avermitilis)」が生産するアベルメクチンを元に創製されました。大村智博士はこの発見で2015年にノーベル生理学・医学賞を受賞しています。
イベルメクチンががん細胞の抗がん剤感受性を高めることが報告されています。以下のような報告があります。
Ivermectin reverses the drug resistance in cancer cells through EGFR/ERK/Akt/NF-κB pathway.(イベルメクチンは、EGFR / ERK / Akt /NF-κB経路を介して癌細胞の薬剤耐性を逆転させる) J Exp Clin Cancer Res. 2019 Jun 18;38(1):265.
【要旨の抜粋】
背景:がん細胞における薬剤耐性を克服することができる新規薬剤の発見と開発は、臨床的に緊急に必要とされている。この研究では、マクロライド系抗寄生虫薬であるイベルメクチンが、治療薬に対するがん細胞の耐性を阻止できるかどうかを検討した。
方法:化学療法薬のビンクリスチンに耐性のある2つの固形腫瘍細胞株(HCT-8大腸がん細胞とMCF-7乳がん細胞)とアドリアマイシンに耐性の血液腫瘍細胞株(K562慢性骨髄性白血病細胞)を使用した。
In vivoの実験系は、薬剤耐性HCT-8細胞を移植したヌードマウスの固形腫瘍モデルと、薬剤耐性K562細胞を移植したNOD / SCIDマウスの白血病モデルを用いた。
これらのin vitroとin vivoの実験系を用いて、薬剤耐性に対するイベルメクチンの阻害作用を検討した。
結果:イベルメクチンは、正常細胞に対して明らかな細胞毒性を誘発しない非常に低用量で、in vitroおよびin vivoの両方で化学療法薬に対する腫瘍細胞の耐性を劇的に逆転させた。メカニズム的には、イベルメクチンは、P-糖タンパク質の活性を直接阻害するのではなく、主に上皮成長因子受容体(EGFR)の阻害を介してP-糖タンパク質の発現を減少させることにより薬剤耐性を阻止した。イベルメクチンはEGFRの細胞外ドメインと結合し、EGFRとその下流シグナル伝達カスケードERK / Akt /NF-κBの活性化を阻害した。転写因子NF-κBの阻害により、P-糖タンパク質遺伝子の転写が低下した。
結論:これらの発見は、イベルメクチンが腫瘍細胞、特に薬剤耐性がん細胞に対する化学療法薬の抗がん効果を著しく高めることを実証した。したがって、FDA承認の抗寄生虫薬であるイベルメクチンは、化学療法薬と組み合わせて使用して、がん、特に薬剤耐性がんを治療できる可能性がある。
最近、イベルメクチンの抗がん作用に関する報告が増えています。上記の論文は今年の6月の発表です。
多彩なメカニズムで抗がん作用を発揮することが明らかになっています。がん治療に利用する価値があることを示すエビデンスがかなり蓄積していると言えます。
【イベルメクチンは1回の投与で牛皮膚乳頭腫を消滅する】
乳頭腫がイベルメクチンのたった1回の投与で完全に消失するという報告があります。以下の論文はトルコのアンカラ大学(Ankara University)の獣医学部からの報告です。
Ivermectin is an effective treatment for bovine cutaneous papillomatosis.(イベルメクチンは、ウシ皮膚乳頭腫症の効果的な治療法である)Res Vet Sci. 2007 Dec;83(3):360-3.
【要旨】
この研究は、ウシ皮膚乳頭腫症の治療に対するイベルメクチンの有効性を評価する目的で行った。 皮膚乳頭腫症の生後9か月から17か月の24頭のホルスタイン子牛を、グループIに6頭、グループIIおよびIIIに9頭の3グループに分けた。 グループIはコントロール群で治療を受けなかった。 0.2mg/kgの用量のイベルメクチンを、グループIIの動物に1回皮下投与し、グループIIIの動物には15日間隔で2回皮下投与した。
最初のイベルメクチンの投与を0日目として、3か月後まで15日間隔で動物をモニターした。 対照グループ(グループI)では腫瘍の縮小は観察されなかった。 グループIIでは9匹中8匹(88.8%)、グループIIIでは9匹中7匹(77.7%)が3か月の観察期間内に皮膚乳頭腫の完全に消失した。 イベルメクチンは、単回投与または二回投与のいずれかの投与法で皮膚乳頭腫症の治療として有効であると結論付けられた。
牛皮膚乳頭腫症というのは牛パピローマウイルスの感染によって発症する皮膚のイボ(乳頭腫)です。
皮膚乳頭腫ができた9頭の乳牛に、イベルメクチンを一度だけ皮下注射したところ、3か月後に8頭の乳牛から皮膚乳頭腫が消滅してしまった、という結果です。
薬の投与量は体重1 kg 当たり0.2 mg です。この量は、寄生虫を駆除するために人間が通常経口する量と同じです。一回の投与だけで、イボがほとんど大部分 (9割) 消えてしまうということです。
【イベルメクチンはPAKキナーゼを阻害する】
イベルメクチンがPAK-1の活性を阻害することが報告されています。
以下のような報告があります。PAK研究の第一人者の丸田浩博士たちの研究報告です。
Ivermectin inactivates the kinase PAK1 and blocks the PAK1-dependent growth of human ovarian cancer and NF2 tumor cell lines.(イベルメクチンは、キナーゼPAK1を不活性化し、ヒト卵巣がんおよびNF2腫瘍細胞株のPAK1依存性の成長を阻止する)Drug Discov Ther. 2009 Dec;3(6):243-6.
【要旨】
イベルメクチンは、線虫のGABA(γ-アミノ酪酸)受容体を阻害し、哺乳類の対応する受容体には作用しないので、線虫を非常に低用量(0.2 mg / kg)で選択的に死滅する寄生虫治療薬である。
数年前にロシアのグループから、イベルメクチンは、マウスに悪影響を与えることなく、はるかに高い用量(3-5 mg / kg)でマウスのヒトメラノーマおよび他のいくつかのがん異種移植片の成長をほぼ完全に抑制できることが報告された。しかし、その抗がん機序は分子レベルでまだ解明されていない。
イベルメクチンのPAK1阻害作用の可能性に対する最初のヒントは、致死量以下のイベルメクチンが線虫の産卵数を劇的に減少させるという最近の発見であった。
PAK1遺伝子欠損(遺伝子ノックアウト)、またはプロポリスの主要な抗がん成分であるCAPE(カフェ酸フェネチルエステル)やARC(アルテピリンC)などの天然のPAK1阻害剤による治療も、全く同じ効果を引き起こす。この事実は、キナーゼPAK1がイベルメクチンの新しい標的である可能性を示唆している。
このキナーゼは、膵臓がん、結腸がん、乳がん、前立腺がん、NF(神経線維腫症)腫瘍などのヒトのがんの70%以上の増殖に必要である。
この研究では、イベルメクチンがヒト卵巣がんおよびNF2欠損シュワン細胞腫細胞株の発がん性キナーゼPAK1を阻害し、細胞培養におけるPAK1依存性の増殖を抑制することを初めて実証した。50%増殖阻害濃度(IC50)は細胞株に応じて5〜20μMの間であった。
以下のような報告があります。フランスの研究グループからの論文です。
Macrocyclic lactones inhibit nasopharyngeal carcinoma cells proliferation through PAK1 inhibition and reduce in vivo tumor growth.(大環状ラクトンは、PAK1阻害を介して鼻咽頭がん細胞の増殖を阻害し、in vivoでの腫瘍成長を抑制する)Drug Des Devel Ther. 2018 Sep 7;12:2805-2814.
【要旨】
目的:エプスタイン-バーウイルス(Epstein-Barr virus :EBV)に関連するがんである鼻咽頭がんは、ヨーロッパおよび北米では稀であるが、南アジア、北アフリカ、イヌイットなど、世界の一部の地域では公衆衛生上の問題となっている。
鼻咽頭の解剖学的構造と位置のため、原発鼻咽頭がんの治療に手術が使用されることはほとんどない。化学療法と併用または非併用の放射線療法による治療は、原発腫瘍には有効であるが、致命的な再発や転移を防ぐことはできない。
方法:高容量スクリーニングによる新しい治療用分子の検索は、有望な薬剤としてのイベルメクチンを同定した。イベルメクチンは、米国食品医薬品局(FDA)が承認した大環状ラクトンであり、駆虫剤および殺虫剤として広く使用されており、がんに対する有効性も示されている。
結果:この研究では、イベルメクチンが鼻咽頭がん細胞に対してin vitroの実験系で細胞傷害活性を持ち、PAK-1活性の阻害によるMAPK経路の活性化と抑制することを示す。さらに、テストされたすべての大環状ラクトンとPAK1阻害剤は、EBV陽性およびEBV陰性の鼻咽頭がん細胞に対してin vitroで細胞毒性を示す。また、米国食品医薬品局(FDA)が承認した用量でのイベルメクチンの腹腔内反復注射は、有意な毒性がなく、ヌードマウスの皮下に移植した鼻咽頭がんの増殖を減少させることも示した。
結論:大環状ラクトンは、検出可能な有害作用なしにPAK-1を標的とする鼻咽頭がんに対する有望な治療薬と思われる。
以下のような報告があります。中国からの論文です。
Ivermectin Induces Cytostatic Autophagy by Blocking the PAK1/Akt Axis in Breast Cancer (イベルメクチンは乳がん細胞のPAK1 / Akt経路を遮断することにより細胞増殖抑制性オートファジーを誘導する)Cancer Res;2016 Aug 76(15); 4457–69.
【要旨】
乳がんは世界中の女性の間で最も一般的ながんであるが、治療の成功は依然として臨床的課題である。
広範囲の抗寄生虫薬であるイベルメクチンは、多くの研究で抗腫瘍効果が示され、抗がん剤として可能性が報告されている。しかし、その抗がん作用に関する分子メカニズムはまだ十分に解明されていない。
ここでは、in vitroおよびin vivoの両方の実験系において、細胞増殖抑制性オートファジーを活性化することにより、乳がんを抑制するイベルメクチンの作用を報告する。
メカニズム的には、乳がん細胞におけるイベルメクチン誘発性のオートファジーは、ユビキチン化媒介分解経路を介したP21活性化キナーゼ1(PAK1)発現の減少と関連している。
PAK1の阻害は、Aktのリン酸化レベルを低下させ、Akt / mTORシグナル伝達経路を遮断する。乳がんの異種移植腫瘍の実験では、イベルメクチン誘導性の細胞増殖抑制性オートファジーにより、腫瘍の成長が抑制される。
以上の結果から、我々の実験結果は、イベルメクチンを使用して乳がん細胞の増殖を阻害する分子メカニズムを明らかにし、イベルメクチンが乳がん治療の潜在的な選択肢であることを示している。
オートファジー(自食作用)というのは、細胞内のタンパク質を分解してリサイクルする現象です。飢餓状態になったときに、自分の細胞を分解して栄養源にするのが本来の目的ですが、細胞内の異常タンパク質を除去する作用もあります。
がん細胞においては、ダメージを受けたタンパク質を分解して、再利用することによって細胞の生存を維持する効果があります。
このようにオートファジーは細胞を保護する役割がありますが、オートファジーが亢進すると細胞死が起こります。イベルメクチンは後者の細胞増殖抑制性オートファジーを誘導するという研究結果です。
イベルメクチンはPAK-1のユビキチン介在性の分解を亢進し、PAK-1/Akt/mTOR経路を阻害してオートファジーを促進するというメカニズムです。
活性化したAktがシグナル伝達の下流に位置する様々なタンパク質をリン酸化して生存や増殖を制御しています。したがって、PAK-1阻害を介してAkt活性を抑制することはがん細胞の増殖抑制に重要なメカニズムです。

図:セリン/スレオニンキナーゼのAktは、多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こす。PAK-1はAktやRaf/MEK/Erk経路を亢進してがん細胞の増殖や生存を促進する。
また、九州大学の研究グループがイベルメクチンが胆道がんの治療に有効であることを報告しています。この研究ではイベルメクチンがYAP1というタンパク質の働きを阻害することが報告されています(新聞記事は以下のリンクをクリック)
https://www.nikkei.com/article/DGXLASDG22H0Q_S5A221C1000000/
https://news.mynavi.jp/article/20151222-a141/
以上のように、イベルメクチンのPAK阻害作用や抗がん作用は世界中のがん研究者が注目しています。
がん治療のターゲットとしてのPAKの重要性と、その安全性の高さを考慮すると、PAK阻害剤としてのイベルメクチンの利用は極めて有用だと思います。
イベルメクチンは世界中で使用されています。寄生虫疾患には0.2mg/kgの量(60kgで12mg)を1回服用で治療が終了します。日本では12mgの薬価は3000円程度です。寄生虫疾患の場合は1回の投与なので、安価な治療と言えます。
ただし、がん治療に使用するには継続的に服用する必要があります。
海外のジェネリックを使用すると正規品の数分の1になります。また、体内吸収が良いのと、体内半減期が長いので、ある程度服用したあとは数日ごとに12mgの服用で血中濃度を維持できるので、比較的安価に使用できます。
油の多い食事のあとに服用すると吸収を高めることができるので、服用量を減らせます。
脂溶性が高いので血液脳関門を容易に通過できるはずですが、実臨床において中枢神経系抑制を示すことはほとんどありません。これは脳血管内皮細胞に発現しているP糖タンパク質(MDR1)によるイベルメクチンの細胞外汲み出し機能によると考えられています。
しかし、脳腫瘍の場合は、他の部位の固形がんと同じように新生した腫瘍血管によって血流を受けているので、血液脳関門は破綻しており、脳腫瘍にも到達し、正常な脳組織には影響しないと考えられます。
治療に抵抗性を示す膵臓がんや脳腫瘍や悪性黒色腫などに試してみる価値はあります。イベルメクチンにメベンダゾールやニトロキソリンやドキシサイクリンなど感染症に使用されている既存薬との併用も有効です。
「がんを感染症のように治療する」というのは、現実性のある治療法のようです。
◉ イベルメクチン治療については以下のサイトを紹介しています。
| « 673)イベルメ... | 675)カンナビ... » |



