がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
475)ヒストンアセチル化をターゲットにしたがん治療(その1):相乗効果
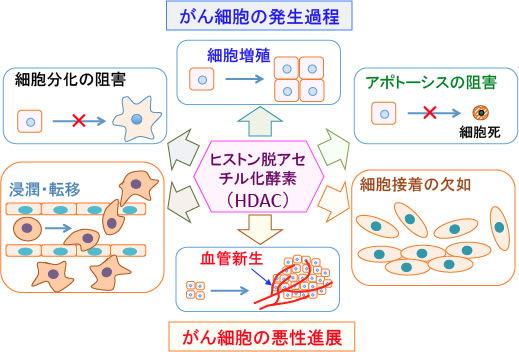
図:ヒストン脱アセチル化酵素(Histone Deacetylase:HDAC)によるヒストン・アセチル化は、がん細胞の発生過程と悪性進展過程の両方に関わる遺伝子の発現に影響する。がん細胞の発生過程においては、無制限の細胞増殖や細胞分化の阻害(脱分化)やアポトーシス阻害に関わる。がん細胞の悪性進展においては、細胞接着の欠如や浸潤・転移や血管新生に関わっている。 (参考:J Histochem Cytochem 62:11–33, 2014のFig.5)
475)ヒストンアセチル化をターゲットにしたがん治療(その1):相乗効果
【ヒストン脱アセチル化酵素阻害だけでは抗腫瘍効果は弱い】
ヒストン脱アセチル化酵素の阻害剤ががん治療薬として既にいくつか使用されています。
ヒストン脱アセチル化酵素を阻害すると、遺伝子の発現に影響するヒストンのアセチル化が亢進して、がん抑制遺伝子など増殖抑制やアポトーシス誘導に作用する遺伝子の発現を亢進することによって抗腫瘍効果を発揮します。
ヒストンのアセチル化や脱アセチル化については後で解説しますが、ヒストン脱アセチル化酵素の阻害だけでは、十分な抗腫瘍効果が認められず、何らかの工夫が必要のようです。
ヒストンアセチル化以外の作用メカニズムの抗がん作用を併用すると、抗腫瘍効果が得られる可能性が高くなります。
ヒストン脱アセチル化酵素の阻害は、がんの代替療法でも、β-ヒドロキシ酪酸(ケトン食で体内で産生される内因性のヒストン脱アセチル化酵素阻害剤)、オーラノフィン(リュウマチの治療薬)、L-カルニチン、アセチル-L-カルニチン、ジインドリルメタン、酪酸(水溶性食物繊維の腸内発酵によって産生)、抗てんかん薬のバルプロ酸ナトリウム(デパケン、セレニカなど)などが利用できます。
これにシクロオキシゲナーゼ-2阻害剤のcelecoxib(セレコックス)や分化誘導作用があるビタミンD3やレチノイドを加えるという治療法も研究されています。
以下のような報告があります。
The Anti-Tumor Effect of HDAC Inhibition in a Human Pancreas Cancer Model Is Significantly Improved by the Simultaneous Inhibition of Cyclooxygenase 2.(ヒト膵臓がんの実験モデルにおいてヒストン脱アセチル化酵素阻害による抗腫瘍効果はシクロオキシゲナーゼ-2の同時阻害によって顕著に増強される)
PLoS One. 2013; 8(9): e75102.10.1371/journal.pone.0075102
PMCID: PMC3770617
この論文では、膵臓がんの実験モデルで、ヒストン脱アセチル化酵素を阻害すると増殖抑制効果が得られるが、ヒストン脱アセチル化酵素阻害(ヒストンのアセチル化の亢進)によってシクロオキシゲナーゼ-2(COX-2)の発現が亢進することを明らかにしています。COX-2はがん細胞の増殖や血管新生を促進する作用があります。そこで、COX-2の阻害剤を同時に投与すると、ヒストン脱アセチル化酵素阻害剤を単独で投与した場合に比べて、抗腫瘍効果が顕著に増強されたという報告です。
レチノイドとヒストン脱アセチル化酵素阻害剤の併用の相乗効果も検討されています。以下のような論文があります。
Retinoic acid and the histone deacetylase inhibitor trichostatin a inhibit the proliferation of human renal cell carcinoma in a xenograft tumor model.(レチノイン酸とヒストン脱アセチル化酵素阻害剤のトリコスタチンaは移植腫瘍の実験モデルでヒト腎臓がん細胞の増殖を阻害する)Clin Cancer Res. 2005 May 1;11(9):3558-66.
がん細胞におけるヒストンの低アセチル化がレチノイン酸受容体β(retinoic acid receptor beta:RARβ)の発現低下に関与していることが指摘されています。レチノイドはレチノイン酸受容体β(RARβ)の発現を誘導しました、この研究では、ヒストン脱アセチル化酵素阻害剤のトリコスタチンaとオール・トランス・レチノイン酸(ATRA)を併用すると、PARβの発現を亢進し、腎臓がん細胞の増殖が抑制され、アポトーシスが誘導されることを報告しています。
この論文の著者らは「ATRAとヒストン脱アセチル化酵素阻害剤の併用療法は、進行した腎臓がんの治療法としてさらに検討される必要がある。」と言っています。
レチノイドとヒストン脱アセチル化酵素阻害剤の併用は臨床試験でも検討されています。
Phase I study of the histone deacetylase inhibitor entinostat in combination with 13-cisretinoic acid in patients with solid tumours.(固形がん患者におけるヒストン脱アセチル化酵素阻害剤のentinostatと13-シスレチノイン酸の第1相試験)Br J Cancer. 2012 Jan 3; 106(1): 77–84. 10.1038/bjc.2011.527
PMCID: PMC3251867
EntinostatはクラスIヒストン脱アセチル化酵素(HDAC)阻害剤で、米国と欧州では進行性乳がんのホルモン療法との併用や固形がんの免疫療法の併用薬として米国のSyndax Pharmaceutical社が開発中の薬で、日本では協和発酵キリン株式会社が日本と韓国における独占的な開発と販売に関してライセンス契約しています。
13-シスレチノイン酸はニキビの治療薬のイソトレチノインです。イソトレチノインについては323話で解説しています。
ヒストン脱アセチル化酵素の阻害とその抗腫瘍効果を高める治療法はがんの代替療法として有望と思われます。これを理解するためには、ヒストンアセチル化やエピジェネティクスについて理解する必要があります。
【細胞の構造や機能は遺伝子発現によって決められる】
私たちの体は様々な機能や形態をもった細胞から成り立っていますが、全ての細胞も元を正せば一つの受精卵が分裂して増えていったものです。
たった一つの受精卵が分裂を繰り返し、生まれたときには数十兆個の細胞から体は構成され、ある細胞は心臓を作り、ある細胞は脳を作り出します。
このように体の臓器や組織を作っていく過程で、個々の細胞が特徴的な機能や形態を獲得していくことを「分化」といいます。肝細胞や心筋細胞や神経細胞などへ分化していった細胞が集まって、肝臓や心臓や脳などの臓器が形成されるのです。
体を構成する細胞は分化により形態や機能が異なっても、すべて同じ遺伝情報を持っています。遺伝子(遺伝情報を担う構造単位で、通常1つの蛋白質を作り出すことができる)の情報は細胞の核の中にある染色体のDNA(デオキシリボ核酸)に書き込まれています。
一つの細胞核に含まれる染色体の一組をゲノムといい、ヒトの場合1ゲノムは46個(22対の常染色体と1対の性染色体)の染色体があります。
1ゲノム中には合計約30億塩基対の塩基配列情報が記録されており、これに含まれる遺伝子の数は22000個程度であることが明らかになっています。
遺伝子(DNA)の情報がmRNA(メッセンジャーRNA)に転写され、さらに蛋白質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います(図)。

図:遺伝情報は細胞の核の中にある染色体のDNA(デオキシリボ核酸)に書き込まれている。DNAは2本のロープがより合わさったような二重らせん構造になっており、そこには4種類の塩基という物質(アデニン、グアニン、シトシン、チミン)が、文字列のように延々と一列に並んでおり、その配列を読み取って体に必要な蛋白質を作り出している。DNAの情報がメッセンジャーRNA(mRNA)に転写され、タンパク質に翻訳される過程を遺伝子発現と言う。
体の中の全ての細胞は同じ遺伝子を持っていますが、細胞の種類によって発現している遺伝子の種類に違いがあります。通常の細胞では全遺伝子の数分の一しか発現しておらず、その種類の違いがそれぞれの細胞の機能の違いの原因なのです。
がんになるとこの遺伝子の発現に異常が起こって、細胞の分化度が低下していきます。これを脱分化といいます。
一般に、分化度の高い(=正常細胞の機能を多く保っている)高分化型のがん細胞は悪性度が低く、脱分化の進んだ低分化や未分化型のがん細胞は増殖が早く転移を起こしやすく予後が不良です。
【遺伝子(DNA)はヒストンに巻き付いている】
人間の1個の細胞の核には、約30億対のヌクレオチドからなるDNA(デオキシリボ核酸)が格納されています。このDNAが遺伝子の本体です。
細胞核内では、DNAはヒストンという球状の蛋白質複合体に巻き付くような状態で存在します。
ヒストンはリシン(リジン)やアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。
ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。
ヒストンによる遺伝子発現の調節は複雑ですが、簡単にまとめると、「ヒストンとDNAの結合は転写に阻害的に働く」ということです。
遺伝子がmRNAに転写されるためには、転写因子やRNAポリメラーゼなどの他の蛋白質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。

図:細胞核内でDNAとタンパク質(ヒストンなど)の複合体をクロマチンという。クロマチンが凝集している部分はDNAが強く折り畳まれており遺伝子転写が抑制されている。一方、クロマチンが緩んでいる部分は、遺伝子の転写が活発になっている。
【ヒストンアセチル化は遺伝子発現を亢進する】
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。アセチル化というのはアセチル(CH3CO)基が結合することです。
ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。

図:ヒストン・アセチル基転移酵素によってヒストン・タンパク質のリシン(リジンとも言う)のアミノ基(-NH2)にアセチル(CH3CO)基が結合するとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになる。その結果、遺伝子の転写が起こりやすくなる。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進(正に制御)し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制(負に制御)されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素(=ヒストンアセチルトランスフェラーゼ)」と「ヒストン脱アセチル化酵素(=ヒストンデアセチラーゼ)」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています(下図)。

図:ヒストンアセチル基転移酵素はヒストンをアセチル化することによってクロマチン構造を緩めて遺伝子転写を活性化する。一方、ヒストン脱アセチル化酵素はヒストンのアセチル化を減らすことによってクロマチン(DNAとヒストンの複合体)を凝集して遺伝子転写を抑制する。
このように、ヒストンのアセチル化などによって遺伝子発現を調節する現象を「エピジェネティクス(epigenetics)」と言います。
がん発症の原因は,がん遺伝子やがん抑制遺伝子の変異,すなわち塩基配列上の変化が蓄積し,細胞増殖,接着,細胞死などの制御が異常になることによると考えられています。さらに、遺伝子の塩基配列の変化を伴わない遺伝子の発現異常,すなわちエピジェネティスの機序による遺伝子発現異常も発がんに大きく寄与していることが近年明らかになってきました。
このようながん細胞における遺伝子発現の変化の中で、遺伝子発現の活性を調節するヒストンアセチル化は重要な役割を果たすと考えられています。
例えば、p21cip1は細胞周期の進行を担うサイクリン依存性キナーゼ(CDK)の活性を抑制するインヒビターの一つで、細胞増殖の停止、分化や老化に関わっており、がん抑制因子として捉えられています。
ヒストン脱アセチル化酵素(histone deacetylase)の阻害は、p21cip1のような細胞周期の進展を阻害する遺伝子の発現を高めることによってがん細胞の増殖を抑える作用が報告されており、ヒストン脱アセチル化酵素阻害剤はがんの治療薬として注目されています。
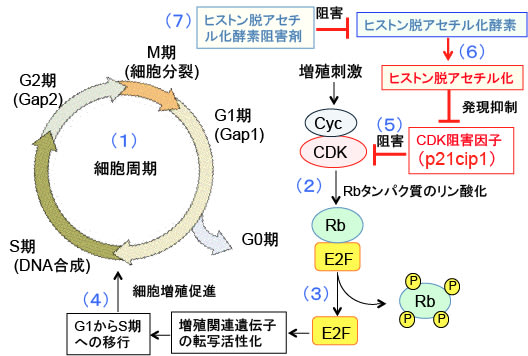
図:(1)細胞が分裂して数を増やしていくとき、細胞周期は4 つの段階に分けられる。すなわち、DNA複製前のG1(Gap1) 期、DNA複製期(S期)、細胞分裂前のG2(Gap2)期、および最後の細胞分裂期(M) 期に分けられる。増殖を休止した状態の細胞はG0期にあると定義される。(2) 増殖刺激は、サイクリン(Cyc)というタンパク質で活性化されるサイクリン依存性キナーゼ(CDK)を活性化してRbタンパク質をリン酸化する。(3)Rbタンパク質は転写因子のE2Fと結合してE2Fの活性を阻害しているが、Rbがリン酸化されるとE2Fと結合できなくなってE2Fがフリーになる。(4)フリーになったE2Fは増殖関連遺伝子の転写を促進することによって細胞周期をG1からS期に移行させて細胞周期を回す。(5)サイクリン依存性キナーゼ阻害因子(CDK阻害因子)のp21cip1は、サイクリン依存性キナーゼ(CDK)を阻害して細胞周期をG1期で停止した状態に維持する。(6)ヒストン脱アセチル化酵素はヒストンの脱アセチル化を促進してp21cip1の発現を抑制する。(7)したがって、ヒストン脱アセチル化酵素阻害剤はp21cip1の発現を亢進して細胞増殖を停止できる。
タンパク質のアセチル化は、ヒストンだけでなく、非ヒストンタンパク質にも起こります。アセチル化を受けるタンパク質には、p53, nuclear factor-κB (NF-κB), p65, CBP, p300, STAT3, tubulin, PC4, GATA factors, nuclear receptors, c-Myc, hypoxia-inducible factor (HIF)-1α, FoxO1, heat-shock protein (Hsp)-90, HMG, E2F, MyoD, Bcr–Abl, the FLT3 kinase, c-Raf kinaseなど多数が知られており、これらの非ヒストンタンパク質のアセチル化は、タンパク質の安定性や局在や他のタンパク質やDNAとの相互作用などに影響して、がん細胞の発生や増殖や転移などに関与しています。
通常、ヒストンや非ヒストンタンパク質のアセチル化はがん細胞の増殖を抑制する方向で働くため、このような作用をもった物質はがんの治療に役立つと考えられています。
すなわち、ヒストン脱アセチル化酵素の阻害剤ががん治療薬として注目され、実際に既に使用されている薬もあります。
【がん細胞はヒストン脱アセチル化酵素の活性が亢進している】
近年、プロテオーム解析(Proteomic analysis)の手法によって、細胞に発現している全てのタンパク質の構造や機能が解析できるようになりました。抗アセチル化リシン抗体や質量分析法やアミノ酸のアイソトープ標識などの方法を組み合わせて細胞内のアセチル化したタンパク質を解析した研究も報告されるようになりました。
ヒストンや非ヒストンタンパク質のアセチル化はヒストン・アセチル基転移酵素とヒストン脱アセチル化酵素のバランスによって動的に制御されています。
細胞のがん化の過程で、ヒストンや非ヒストンタンパク質の脱アセチル化が進むことが明らかになっています。そして、がん細胞ではヒストン・アセチル基転移酵素の発現や活性が低下し、逆にヒストン脱アセチル化酵素の発現と活性が亢進していることが明らかになっています。
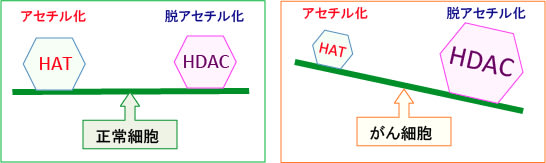
図:ヒストンや非ヒストンタンパク質のアセチル化の状況はヒストン・アセチル基転移酵素(HAT)とヒストン・脱アセチル化酵素(HDAC)のバランスで決まる。がん細胞ではヒストン・アセチル基転移酵素(HAT)の発現や活性が低下し、ヒストン・脱アセチル化酵素(HDAC)の発現や活性が亢進して、タンパク質の脱アセチル化が亢進している。
ヒストン脱アセチル化酵素の活性亢進は様々なヒストンアセチル化によって遺伝子発現に影響し、さらに非ヒストン・タンパク質の働きに影響し、これらの作用によって、がん細胞の脱分化、細胞増殖、浸潤・転移、細胞接着低下、アポトーシス抵抗性、血管新生を亢進し、がんの発生や悪性進展を促進する方向で作用しています。
したがって、ヒストン脱アセチル化酵素を阻害することはがん治療の有力な方法になります。
【ヒストン脱アセチル化酵素はヒトで18種類が知られている】
ヒストン脱アセチル化酵素(HDACs)の遺伝子は酵母からヒトまで高度に保存されており、ヒトでは現在までに18種類のヒストン脱アセチル化酵素が知られています。
タンパク質の構造や機能や細胞内局在や発現パターンや酵母の遺伝子との相同性などから、4つのクラス(Class I, Class IIa, Class IIb, Class III, Class IV)に分けられます。(下表)

クラスIとIIとIVは古典的なHDACで、活性は亜鉛イオン依存性で、ヒドロキサム酸(hydroxamic acid)のように亜鉛イオンとキレートを作る薬剤によって活性が阻害されます。
Class IIIのヒストン脱アセチル化酵素はNAD+依存性のサーチュイン・ファミリーでSIRT1から7まであります。このクラスは亜鉛イオンのキレート剤では活性は阻害されません。メンバーによって細胞内局在が異なります。
古典的HDACsのクラスIとIIとIVは約390アミノ酸からなる脱アセチル化の活性をもつ共通ドメインを持っています。
クラスIのHDACはほとんどの細胞の核に存在し、単純な構造を持ちます。
クラスIIのHDACは核と細胞質を移行し非ヒストンタンパク質のアセチル化を制御しています。
このうち、阻害することによってがん治療効果が期待できるのは、主にクラスIとIIです。
クラスIとIIを阻害する方法として、前述のように、β-ヒドロキシ酪酸(ケトン食で体内で産生される内因性のヒストン脱アセチル化酵素阻害剤)、オーラノフィン(リュウマチの治療薬)、L-カルニチン、アセチル-L-カルニチン、ジインドリルメタン、酪酸(水溶性食物繊維の腸内発酵によって産生)、抗てんかん薬のバルプロ酸ナトリウム(デパケン、セレニカなど)などが利用できます。これに分化誘導作用があるビタミンD3やレチノイドを加えるという治療法も考えられます。(次回に続く)
| « 474)医療大麻... | 476)ヒストン... » |



