がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
613)硫酸ヒドラジン:葬り去られた「がんの特効薬」?
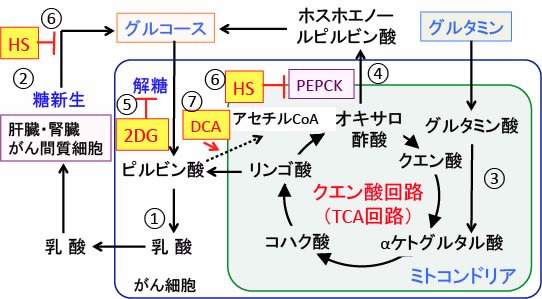
図:がん細胞ではグルコース(ブドウ糖)の取込みが増え、解糖系が亢進し乳酸の産生が増えている(①)。乳酸は肝臓や腎臓やがん組織の間質細胞などで糖新生によってグルコースへ変換されて、がん細胞に再利用される(②)。がん細胞はアミノ酸のグルタミンの取込みも増えており、グルタミン酸からαケトグルタル酸に変換されてTCA回路に入り(③)、その50%くらいが乳酸に変換されると報告されている。がん細胞ではホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)が亢進し、TCA回路のオキサロ酢酸はPEPCKによってホスホエノールピルビン酸に変換されて糖新生に利用される(④)。2-デオキシグルコース(2DG)はがん細胞の解糖系を阻害してグルコースに利用を阻害する(⑤)。硫酸ヒドラジン(Hydrazine Sulfate:HS)はPEPCKを阻害して糖新生を阻害して、グルコースの再利用を阻止する(⑥)。がん細胞はピルビン酸脱水素酵素の活性が抑制されており、ジクロロ酢酸(Dichloroacetate:DCA)でピルビン酸脱水素酵素の活性を亢進すると、がん細胞の乳酸産生を抑制できる(⑦)。がん細胞の解糖系と乳酸産生と糖新生を同時に阻害すると、がん細胞の増殖を抑制し、がん性悪液質を改善できる。
613)硫酸ヒドラジン:葬り去られた「がんの特効薬」?
【糖質制限だけではがん細胞の増殖抑制に限界がある理由】
糖質制限だけではがん細胞の増殖抑制に限界があるのは、糖質と脂質とタンパク質は全て分解されてエネルギーを供給することができるためです。
グルコース(ブドウ糖)の代謝系である解糖系とTCA回路(クエン酸回路)は、アミノ酸や脂肪酸との代謝系から独立しているのではなく、これらグルコースとアミノ酸と脂肪酸の代謝経路の間には生化学的な物質の流れがあり、これらの生命構成成分間の合成(同化)および分解(異化)の経路は密接につながっています(下図)。

図:細胞の主要の代謝経路の関係: グルコースを代謝する解糖系とクエン酸回路(TCA回路)は脂肪酸やアミノ酸の代謝経路と密接に関連し、しかもこれらの経路の多くが逆行できる。したがって、糖質を摂取しなくても、脂肪酸やアミノ酸から体内で糖を合成でき、エネルギー(ATP)や細胞構成成分(細胞膜や核酸など)を作ることができる。これが、糖質制限だけではがん細胞の増殖抑制に限界がある理由になっている。(参考:カラー図解アメリカ版大学生物学の教科書 第1巻細胞生物学, 講談社)
アミノ酸や脂肪酸に由来する炭素骨格はアセチルCoAからTCA回路に入って分解され、エネルギーを産生し(異化)、これらの経路から得られる炭素骨格は細胞の高分子構成成分の合成材料となります(同化)。
つまり、糖質がほとんど含まれていない肉だけを食べても、肉に含まれるタンパク質(分解されてアミノ酸になる)と脂肪(分解されて脂肪酸とグリセロールになる)から、糖もできるのです。
これを糖新生と言います。
このことが、糖質制限を行っても低血糖にはならず、がん細胞の増殖を抑える効果に限界がある理由になっています。
糖質制限やケトン食によるインスリン分泌の低下やケトン体の増加は、がん細胞の増殖抑制に大きく寄与しますが、がん細胞のエネルギー産生や物質合成を完全に止めることができない(多少は抑制されるが)ので、がん細胞の増殖を完全に押さえ込むことには限界があると言わざるを得ません。
糖質制限やケトン食の抗がん作用の限界を克服する手段として、「2-デオキシ-D-グルコースなどを使ってがん細胞の解糖系を阻害する方法」「ジクロロ酢酸などによってミトコンドリアを活性化して乳酸産生を抑制する方法」に加えて、「グルコース利用が阻止された時にがん細胞が行う代謝の変化(代謝適応)をターゲットにする」ことが必要になります。
がん細胞のおけるグルコース非依存性の代謝適応、特にグルタミンの代謝と糖新生について理解することが重要になります。
【解糖系の中間代謝産物から核酸やアミノ酸や脂質が産生される】
解糖はグルコースがピルビン酸に分解される過程で、この酵素反応は細胞質で行われます。解糖では1分子のグルコース(ブドウ糖)から2分子のATPが産生されます。
さらに、解糖系の中間代謝産物は多くの物質(核酸、アミノ酸、脂質、NADPHなど)の生合成系へと流れていきます。
がん細胞が増殖するとき、エネルギー産生と同時に、細胞の構成成分である核酸や脂肪酸やアミノ酸の合成を増やす必要があるため大量のグルコースを取り込んでいます。

図:解糖系の代謝中間産物は、核酸やアミノ酸や脂肪などの細胞構成成分の合成経路に送り込まれる。同化(物質合成)を亢進して、細胞増殖を促進するために、がん細胞はグルコースの取込みを増やしている。
【がん細胞はグルコースを断たれても増殖できる】
一般的にグルコースの取込みの多いがん細胞ほど増殖が早く、悪性度が高く、予後が悪いと言えます。
取り込まれたグルコースはエネルギー産生と細胞を構成する成分の合成に使われるので、グルコースの取込みが多いことは増殖活性が高いことを意味します。
したがって、がん細胞におけるグルコースの取込みや解糖系での代謝を阻害すると、がん細胞の増殖活性を低下させることができます。また、抗がん剤治療や放射線治療にグルコースの取込みや解糖系を阻害する治療を併用すると、抗がん剤や放射線治療の効き目を高めることができます。
がん細胞で亢進している解糖系を阻害する方法に2-デオキシ-D-グルコース(2-DG)があります。
2-DGは、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換されたグルコース誘導体です。
2-DGはグルコース(ブドウ糖)と同じグルコース輸送担体(グルコース・トランスポーター:GLUT)を利用して細胞内に取り込まれ、解糖系の最初のステップのヘキソキナーゼによって2-DG-6リン酸に変換されます。
リン酸化されて2-DG-6リン酸になるとGLUTを通過できなくなり、2-DG-6リン酸はその次の解糖系酵素では代謝できないため細胞内で蓄積します。
蓄積した2-DG-6リン酸はヘキソキナーゼとホスホフルクトース・イソメラーゼをフィードバック阻害するので、正常のグルコース代謝(解糖系やペントースリン酸経路)も阻害されます。
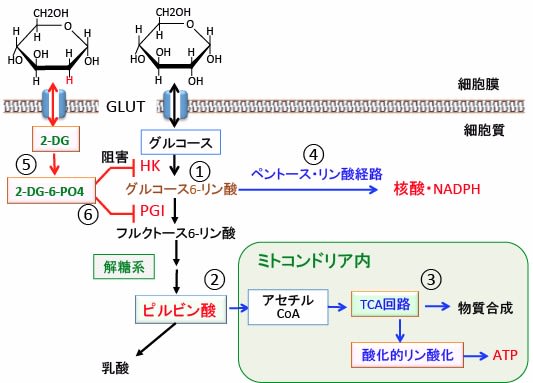
図:グルコース(ブドウ糖)はグルコーストランスポーター(GLUT)を通って細胞内に入りヘキソキナーゼ(HK)でグルコース6-リン酸に変換され(①)、さらに解糖によってピルビン酸まで分解される(②)。ピルビン酸はミトコンドリアに入ってアセチルCoAに変換されTCA回路によって様々な物質を合成し、酸化的リン酸化によってATPを合成する(③)。グルコース6-リン酸はペントースリン酸回路で核酸やNADPHの合成に利用される(④)。2−デオキシ-D-グルコース(2-DG)はグルコースの2位の水酸基(OH)が水素原子(H)に置換したグルコース類縁体で、グルコースと同じようにグルコーストランスポーター(GLUT)を通って細胞内に入り、ヘキソキナーゼ(HK)で6位がリン酸化されて2-デオキシ-D-グルコース-6-リン酸(2-DG-6-PO4)に変換されるが、2-DG-6-PO4はその先の解糖系酵素で代謝できない(⑤)。細胞質内で蓄積した2-DG-6-PO4はヘキソキナーゼ(HK)とホソホグルコース・イソメラーゼ(phosphoglucose isomerase;PGI)をフィードバック阻害するので、解糖系でのグルコース代謝が阻害されてATP産生や核酸やNADPHの産生が低下する(⑥)。
2-デオキシ-D-グルコース(2-DG)でヘキソキナーゼとホソホグルコース・イソメラーゼの酵素活性を阻害し、解糖系とペントースリン酸経路を阻害すると、がん細胞の増殖は抑制されます。
しかし多くの場合、2-DGの抗腫瘍効果は限定的です。
それは、グルコースの利用が制限されると、がん細胞は他の栄養成分(主にアミノ酸)を使ってエネルギー産生と物質合成ができるような代謝適応を行おうとするためです。
グルコースの摂取をゼロにしても人間は生きていけますが、たんぱく質(アミノ酸)は正常細胞の維持に必要なため、通常は体重1kg当たり1g程度のたんぱく質の摂取が必要です。食事からの摂取が不足すると筋肉を分解してアミノ酸を作り出します。
いくつかのアミノ酸(必須アミノ酸)は体内で合成できないので、食事からの摂取が必要です。
グルコースが無い状況でも、がん細胞はたんぱく質由来のアミノ酸を使ってエネルギー産生と物質合成を行い、増殖を続けることが可能になります。
この代謝適応のメカニズムを知ると、2-DGやジクロロ酢酸やケトン食の抗腫瘍効果を高める方法が理解できます。
【がん細胞はホスホエノールピルビン酸カルボキシキナーゼの活性が亢進している】
ホスホエノールピルビン酸カルボキシキナーゼ(phosphoenolpyruvate carboxykinase)という酵素は、オキサロ酢酸を脱炭酸してホスホエノールピルビン酸を合成する酵素で、解糖の逆反応を行い糖新生に関与します。(下図)
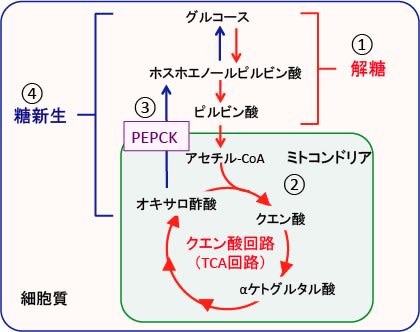
図:細胞内ではグルコースが分解されてピルビン酸に変換される過程を解糖という(①)。解糖で産生されたピルビン酸はミトコンドリアに移行してアセチルCoAに変換されてクエン酸回路(TCA回路)で代謝される(②)。オキサロ酢酸はホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)によってホスホエノールピルビン酸に変換され(③)、グルコースを合成する経路があり、これを糖新生という(④)。
グルコースが欠乏すると、グルタミンをエネルギー産生や物質合成の材料に使うように代謝系が変更されます。
このとき、がん細胞はホスホエノールピルビン酸カルボキシキナーゼを使って、グルコースに依存しないで増殖できることが知られています。以下のような報告があります。
Mitochondrial Phosphoenolpyruvate Carboxykinase Regulates Metabolic Adaptation and Enables Glucose-Independent Tumor Growth.(ミトコンドリアのホスホエノールピルビン酸カルボキシキナーゼは代謝的適応を調節し、グルコースに依存しない腫瘍の増殖を可能にする)Molecular Cell 60, 195–207, 2015年
【要旨】
がん細胞は栄養素が欠乏した状況で増殖するために代謝的に適応する。今回我々は、代謝的ネットワーク分析を組み合わせ、グルコースに依存しないがん細胞の増殖を支える代謝経路を同定した。
グルコースの欠乏は、クエン酸回路(TCA回路)ならびに糖新生の早期段階の経路を変更することによって、グルコースに依存しない細胞増殖を促進した。
グルコースの制限は、ミトコンドリアにおけるホスホエノールピルビン酸カルボキシキナーゼの活性亢進によって、グルタミンからホスホエノールピルビン酸への合成を促進した。
このような状況下では、セリンやプリンの生合成を含めた、通常であればグルコースによって維持されている生合成経路の材料として、グルタミン由来のホスホエノールピルビン酸が使われていた。
ホスホエノールピルビン酸カルボキシキナーゼ(PCK2)の発現は、グルコースが制限された状況下でのin vitroにおける腫瘍細胞の増殖の維持ならびにin vivoでの腫瘍成長の維持に必要だった。
PCK2発現の上昇はいくつかのヒトの腫瘍で観察され、非小細胞性肺がん患者の腫瘍組織でも多く認められた。
我々の研究結果は、ヒトの腫瘍において、グルコースに依存しない細胞増殖を促進し、代謝ストレスへの抵抗性をもたらす、がん細胞の代謝再構成におけるホスホエノールピルビン酸カルボキシキナーゼ(PCK2)の役割を明らかにしている。
ホスホエノールピルビン酸カルボキシキナーゼは、糖新生で働く酵素で、今までは主に肝臓でしか研究されていなかったのですが、がん細胞では、グルコースが利用できない状況では、この酵素を使って、解糖系のホスホエノールピルビン酸を作って、TCA回路での物質合成やエネルギー産生を維持しているということです。(下図参照)

図:(左)細胞内に取込まれたグルコースとグルタミンはクエン酸回路(TCA)回路などでエネルギー産生と物質合成の材料になる。
(右)グルコースが利用できない状況では、グルタミンがαケトグルタル酸に変換してTCA回路を経由し、オキサロ酢酸からホスホエノールピルビン酸になる経路でミトコンドリアでの物質合成が維持される。このときがん細胞では、ホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)の発現が亢進することによってこの経路が促進される。PEPCKは肝臓における糖新生に関わる酵素であるが、がん細胞ではグルコース非依存的な代謝適応の際に利用されている。(Molecular Cell 60, 195–207, 2015年)
このように、がん細胞の代謝系は柔軟性(フレキシビリティ)があるので、代謝をターゲットにしたがん治療には限界があり、がん治療を困難にしている理由になっています。しかし、がん細胞が環境への適応のために使うメカニズムを理解することは、がん治療への新たな可能性を高めることができます。
グルタミンは非必須アミノ酸で、体内で合成されますが、がん細胞の代謝において極めて重要な役割を担っています。
ホスホエノールピルビン酸カルボキシキナーゼ(phosphoenolpyruvate carboxykinase:PEPCK)は、オキサロ酢酸を脱炭酸してホスホエノールピルビン酸を合成する酵素で、解糖の逆反応を行い糖新生に関与します。
がん細胞では、グルコースは主に解糖系で消費され、TCA回路にはあまり利用されません。このような状況で、グルタミンがαケトグルタル酸に変換されてTCA回路での代謝を維持しています。
がん細胞では、グルコースの代謝は解糖系が亢進していますが、ミトコンドリアのTCA回路が働いていないわけではありません。
TCA回路はアミノ酸や核酸や脂肪酸などの物質代謝の中心です。したがって、TCA回路が全く働かない場合は、がん細胞の増殖と生存も維持できません。グルタミンはがん細胞の増殖と生存に、グルコースに次いで重要な栄養素であると認識されています。
【乳酸は糖新生の材料として利用される】
赤血球はミトコンドリアがないので、解糖系でATPを産生し乳酸を生成しています。筋肉でも乳酸が常時産生されています。
1日に体重1kg当たり20mmol/の乳酸が産生されると報告されています。
体重60kgだと1日に1200 mmolです。乳酸(C3H6O3)の分子量は90.08(g/mol)なので、1日に100グラム程度の乳酸が産生されています。
筋肉や赤血球で産生された乳酸は血液で肝臓に運ばれ、乳酸脱水素酵素によってピルビン酸に変換され、グルコースに再生されます。この過程を「糖新生」と言います。
再生されたグルコースは血中に放出されて、筋肉や赤血球などでエネルギー源として再利用されます。
このように、嫌気呼吸の過程において、赤血球や筋肉でグルコースから乳酸を作り、肝臓で乳酸からグルコースに戻すまでの経路をコリ回路(Cori cycle)と言います。これを発見したカール・コリとゲルティー・コリの夫妻にちなんで命名されました。
コリ回路は乳酸によるアシドーシス(酸性血症)を防ぐ働きがあります。
このコリ回路では、1分子のグルコースが解糖系で乳酸になる過程で2分子のATPが産生されますが、乳酸から1分子のグルコースが合成されるのに6分子のATPを消費します。1分子のグルコース当たり4分子のATPが減少するので、コリ回路が働くとエネルギーを消費することになります。(図)
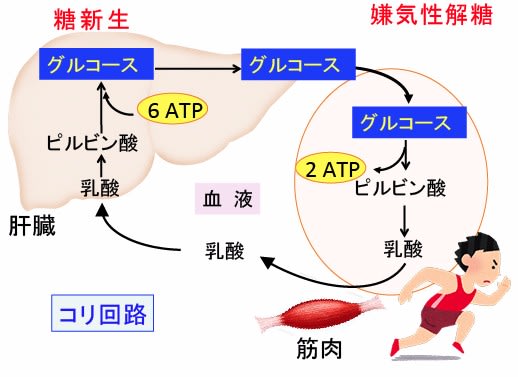
図:激しい運動などで筋肉細胞が嫌気的なグルコース分解を行うと、生成された乳酸が血液の流れに乗って肝臓に運ばれて、糖新生によってグルコースが再生される。肝臓で合成されたグルコースは血中に放出されて赤血球や筋肉で再びエネルギーとして使われる。1分子のグルコース当たり、嫌気呼吸(解糖)で2分子のATPが生成し、糖新生で6分子のATPが消費されるため、正味4分子のATPが減少する。
がん細胞では解糖系でのグルコースの分解が亢進し、乳酸の産生が増えています。そのため肝臓では乳酸からグルコースを合成する糖新生が増えています。その結果、無駄なエネルギーが消費されます。つまり、がん細胞における解糖系の亢進は、生体のエネルギーを無駄に消費させ、体重が減少する原因の一つになっています。(図)
したがって、がん細胞で亢進した解糖系を阻止(あるいは乳酸産生を阻止)することは、体重減少などのがん性悪液質の症状を改善することになります。

図:がん細胞はグルコースの解糖系での代謝が亢進し(赤矢印)、乳酸の産生が増えている。生成された乳酸は肝臓で糖新生によってグルコースに再生され、がん細胞や赤血球や筋肉で再びエネルギーとして使われる(コリ回路という)。1分子のグルコース当たり、解糖で2分子のATPが生成し、糖新生で6分子のATPが消費されるため、正味4分子のATPが減少している。この解糖と糖新生の亢進によるATPの消費(浪費)が、進行がんにおける倦怠感(エネルギー不足)や体重減少の原因の一つになっている。
【がん細胞は乳酸を主要な栄養源として利用している】
がん細胞の2大栄養素はグルコースとグルタミンです。
グルコースは解糖系が亢進して乳酸の産生が増えています。グルタミンもグルタミン酸からαケトグルタル酸に変換されてTCA回路に入り、その50%くらいが乳酸に変換されると報告されています。
このようにして、がん細胞内では、乳酸の産生が増え、モノカルボン酸トランスポーター(MCT)を通って細胞外に移行し、周囲のがん間質細胞(線維芽細胞や炎症細胞)や血流にのって肝臓や腎臓を使って、糖新生でグルコースに変換されて、がん細胞に再利用されます。
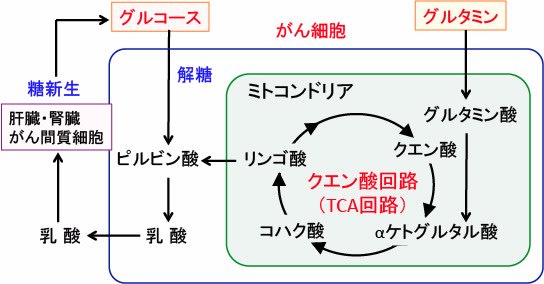
図:がん細胞ではグルコース(ブドウ糖)とグルタミンの取込みが増え、乳酸の産生が増えている。乳酸は肝臓や腎臓やがん組織の間質細胞などで糖新生によってグルコースへ変換され、がん細胞に再利用される。がん細胞は宿主の代謝系をハイジャックして、自分の生存と増殖に利用している。この状況を阻止するためには、がん細胞からの乳酸の産生を抑制すること、糖新生を抑制することが重要である。
この糖新生では宿主(正常細胞)はエネルギーを使って、がん細胞のためにグルコースを再生することになります。2分子の乳酸から1分子のグルコースを作るのに6分子のATPを消費します。つまり、がん細胞は宿主の代謝系をハイジャックし、自分の増殖に利用しているのです。
このがん細胞の代謝を阻止しないと、宿主はがん細胞によって無駄にエネルギーを消費して、体力と栄養を消耗することになります。
糖新生は主に肝臓や腎臓で行われますが、がん組織の間質系細胞(線維細胞や炎症細胞)もがん細胞が放出する乳酸から糖新生でグルコースを産生して、がん細胞の栄養補給を助けていることが報告されています。例えば、以下のような報告があります。単球が乳酸からの糖新生によってがん細胞を養っているという報告です。
Lactate promotes PGE2 synthesis and gluconeogenesis in monocytes to benefit the growth of inflammation-associated colorectal tumor(乳酸は単球におけるプロスタグランジンE2合成と糖新生を促進し、炎症関連の結腸直腸がんの増殖を助ける)Oncotarget. 2015 Jun 30; 6(18): 16198–16214.
がん細胞では解糖系が亢進しています。ヒトのがんの70%以上で、解糖系酵素の発現が亢進していることが知られています。
この解糖系の亢進はがん細胞の増殖や転移を促進する作用があり、したがって、がん細胞の解糖系を阻害することは、がん治療においてメリットがあるというのがコンセンサスになっています。
解糖系の最終産物は乳酸です。乳酸は単に代謝の最終産物に過ぎないと長く考えられていましたが、がん細胞の増殖や転移や浸潤に積極的に関わっていることが明らかになっています。乳酸の産生を減らすことはがん治療において様々なメリットがあります。
この論文では、ヒトの単球細胞ががん細胞が産生する乳酸をモノカルボン酸トランスポーター1(MCT1)を介して取込み、糖新生でグルコースを産生して、がん細胞を養っていることが報告されています。また、乳酸は低酸素誘導因子-1(HIF-1)の活性を亢進して、プロスタグランジンE2の産生を高めて、がん細胞の増殖を促進することも報告しています。
このように、がん細胞が乳酸の産生を増やしていることは、様々なメカニズムでがん細胞の増殖を促進しています。
さらに、がん組織の間質細胞(線維芽細胞や炎症細胞)や肝臓や腎臓で、乳酸からグルコースを合成する糖新生ではエネルギーを消費する同化作用であるため、生体は余分なエネルギーを浪費していることになります。これが、進行がんにおけるエネルギー不足による倦怠感や体重減少の原因の一つになっています。
がん細胞の増殖や転移の阻止だけでなく、進行がんにおける倦怠感や体重減少などのがん性悪液質の症状の改善には「がん細胞における解糖系亢進と乳酸産生」と「腫瘍組織における糖新生」を阻止することが重要であることが理解できます。
メトホルミンがグルタミン代謝を阻害することが知られています。メトホルミンは糖新生を阻害します。
ジクロロ酢酸ナトリウムや2-デオキシグルコースも乳酸産生抑制に有効です。
断食(間歇的断食やプチ断食を含めて)やカロリー制限やケトン食や有酸素運動もミトコンドリアでの代謝を亢進して乳酸産生を減らします。
サプリメントではミトコンドリアの働きを良くするビタミンB1、αリポ酸、L-カルニチン、アセチル-L-カルニチンなどが有効です。
糖新生の阻害には硫酸ヒドラジンも有効です。硫酸ヒドラジンは糖新生の律速酵素のホスホエノールピルビン酸カルボキシキナーゼ(phosphoenolpyruvate carboxykinase:PEPCK)を阻害する作用があります。
【硫酸ヒドラジンはがんの特効薬か偽医療か】
硫酸ヒドラジン(Hydrazine Silfate)はNH2NH2・H2SO4という化学構造で、ヒドラジン(NH2NH2)の硫酸塩です。ヒドラジンは引火性があり、ロケットエンジンの推進剤やミサイルの燃料、エアバッッグの起爆剤、さび防止剤などに使われている一般的な産業化学物質です。

この硫酸ヒドラジンががん患者の衰弱過程を抑制し、腫瘍の成長を阻害することができるということを、米国のジョセフ・ゴ-ルド(Joseph Gold)博士が1968年に報告しています。
ゴールド博士は1975年に、84人の進行がん患者への硫酸ヒドラジンの効果を調べ、70%の患者に体重増加や痛みの軽減を認め、17%に腫瘍の増殖抑制を認めたと報告しています。
ゴールド博士らのその後の研究のまとめで、進行がん患者を対象にした硫酸ヒドラジン治療で、50%くらいは症状の改善を認め、40%くらいは腫瘍の増殖が止まる(病状安定)か縮小する。そして、完全奏功が5〜10%に見られると総括しています。
ロシアでは硫酸ヒドラジンはSehydrinという医薬品として進行がんの治療に使われ、自覚症状の改善や、腫瘍の安定化あるいは縮小が多くの患者に認められています。以下のような報告があります。
Experience of the treatment with Sehydrin (Hydrazine Sulfate, HS) in the advanced cancer patients.(進行がん患者における硫酸ヒドラジン製剤Sehydrinによる治療の経験)Invest New Drugs. 1995;13(1):89-97.
ロシアのセントペテルブルグのペトロフがん研究所(Petrov Research Institute of Oncology, St. Petersburg, Russia)からの研究結果です。
標準治療で効果が得られなくなった740例の進行がん患者を対象にしています。自覚症状の改善は740例中46.6%で認められています。肺がんの場合、腫瘍の縮小は4%でしたが、長期間の病状安定は22%で認められました。
以下の論文は米国のカリフォルニア州のHarbor-UCLA Medical Centerからの報告です。
Hydrazine sulfate influence on nutritional status and survival in non-small-cell lung cancer.(非小細胞性肺がんにおける栄養状態と生存における硫酸ヒドラジンの影響)J Clin Oncol. 1990 Jan;8(1):9-15.
この研究では、切除不能や進行した非小細胞性肺がん患者65例を対象に、無作為化前向きプラセボ対照臨床試験を行っています。
患者は化学療法(シスプラチン、ビンブラスチン、およびブレオマイシン)を受け、併用療法として硫酸ヒドラジン(60mg)の1日3回の経口投与またはプラセボカプセルの投与を受けました。
プラセボ群と比較して硫酸ヒドラジン服用群は、カロリー摂取量およびアルブミン維持率が有意に高い結果でした(P <0.05)。
ECOGパフォーマンスステータスが0から2の患者全体を対象にした場合、生存期間中央値はコントロール群が187日に対して硫酸ヒドラジン服用群が292日でしたが、統計的有意差には達しませんでした。
ECOGパフォーマンスステータスが0から1の全身状態の良好な患者だけを対象にすると、生存期間中央値はコントロール群が209日に対して硫酸ヒドラジン服用群は328日で、統計的有意に生存期間の延長が認められました。
毒性や副作用は両群とも同じレベルでした。
以上の結果から、硫酸ヒドラジンは非小細胞性肺がん患者の栄養状態の改善と生存期間の延長に効果があると言う結論です。
このように、がんの代替医療としての有用性を報告した研究や論文も多くみられ、硫酸ヒドラジン治療はがんの代替医療の分野ではいまだに実施されています。
しかし、米国がん研究所(National Cancer Institute)がスポンサーになった3件の臨床試験では、いずれも有効性が示されませんでした。
そのため、米国がん学会は硫酸ヒドラジンの有効性を疑問視し、米国の正統派医学では否定的な見解が主流を占めています。
しかし、これらの臨床試験には多くの問題と違反があるとゴールド博士は反論しています。つまり、安価で有効性の高い硫酸ヒドラジンをがん治療薬として認めたくない圧力が存在すると主張しています。
硫酸ヒドラジンの発がん性を指摘する研究報告もありますが、米国では硫酸ヒドラジンは栄養補助食品として販売されていますので、服用に伴う危険性(副作用)は低いと考えられます。FDA(米国食品医薬品局)は硫酸ヒドラジンをがん治療薬として使用することは認めていませんし、がんの代替医療としてヒトでの有用性は否定しています。
米国国立がん研究所(NCI)のホームページにも硫酸ヒドラジンの解説は記載されています。有効性に対しては全体的には否定的ですが、一部の臨床試験で効果が示されていることも記述されています。医療イノベーション推進センターのサイトに、米国国立がん研究所(NCI)の硫酸ヒドラジンの解説が日本語訳されています。
http://cancerinfo.tri-kobe.org/pdq/summary/japanese.jsp?Pdq_ID=CDR0000446177
【硫酸ヒドラジンは糖新生を阻害する】
硫酸ヒドラジンは、糖新生過程に働くホスホエノールピルビン酸カルボキシキナーゼ(phosphoenolpyruvate carboxykinase)という酵素を阻害します。この酵素はオキサロ酢酸を脱炭酸してホスホエノールピルビン酸を合成する酵素で、解糖の逆反応を行い糖新生に関与します。

図:細胞内ではグルコースが分解されてピルビン酸に変換される過程を解糖という(①)。解糖で産生されたピルビン酸はミトコンドリアに移行してアセチルCoAに変換されてクエン酸回路(TCA回路)で代謝される(②)。オキサロ酢酸はホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)によってホスホエノールピルビン酸に変換され(③)、グルコースを合成する経路があり、これを糖新生という。硫酸ヒドラジンはPEPCKを阻害することによってがん細胞の糖新生を阻害する(④)。
がん細胞は正常な細胞よりも10倍以上も貪欲にグルコースを摂取します。がん細胞は、肝臓で乳酸から変換されたグルコースを主な糖質として利用しています。がん細胞がグルコースをエネルギー源として使うとき、グルコースを十分に燃焼されず、乳酸が老廃物として蓄積します。この乳酸は肝臓でもう一度グルコースに変換され、そのグルコースがまたがん細胞に利用されて、がん細胞は多量な糖質をどんどん消費していきます。その結果、悪循環が成立してしまいます。
つまり、がん細胞が活発に成長している間、正常な細胞は飢えており、中にはがん細胞に栄養を与えるために分解していくものさえあります。このために、体が消耗し衰弱していくのです。
肝臓が乳酸をグルコースに変換する過程である糖新生を阻害すれば、この悪循環を断ち切ることができるとゴ-ルド博士は考えました。硫酸ヒドラジンは糖新生を阻害する効果があるため、がん性悪液質を改善する効果があると考えたのです。
ゴールド博士は肝臓での糖新生を阻害して、がん細胞へのグルコース供給を断つことが悪液質改善のメカニズムとして提唱しています。
しかし前述のように、糖新生は肝臓だけでなく、がん細胞やがん組織の間質細胞でも起こっています。がん組織での糖新生の阻害は、がん細胞の増殖や転移の阻止や悪液質の軽減に効果が期待できます。
さらに、がん細胞の解糖系を阻害する2-デオキシグルコース、乳酸産生を抑制するジクロロ酢酸、硫酸ヒドラジンとは異なるき機序で糖新生を阻害するメトホルミンなどを併用すると、がん細胞のエネルギー産生と物質合成を阻止して、増殖を抑制できます。
メトホルミンの糖新生阻害作用のメカニズムについてはNatureに報告されています。
Metformin suppresses gluconeogenesis by inhibiting mitochondrial glycerophosphate dehydrogenase.(メトホルミンは、ミトコンドリアのグリセロリン酸デヒドロゲナーゼを阻害することによって糖新生を抑制する。)Nature. 2014 Jun 26;510(7506):542-6.
この報告では、メトホルミンがミトコンドリアのグリセロリン酸デヒドロゲナーゼを非競合的に阻害し、乳酸塩およびグリセロールのグルコースへの変換が減少し、肝臓の糖新生が減少することを示しています。
【ホスホエノールピルビン酸カルボキシキナーゼの阻害はがん幹細胞の物質合成を阻害する】
ホスホエノールピルビン酸カルボキシキナーゼは糖新生より、グルコース由来の物質合成を促進することが報告されています。
Upregulation of cytosolic phosphoenolpyruvate carboxykinase is a critical metabolic event in melanoma cells that repopulate tumors.(細胞質のホスホエノールピルビン酸カルボキシキナーゼの発現亢進は、腫瘍を再増殖させるメラノーマ細胞における重要な代謝事象である)Cancer Res. 2015 Apr 1;75(7):1191-6.
【要旨】
分化した腫瘍細胞における代謝欠損は広範に研究されているが、腫瘍を再増殖させる幹様細胞[腫瘍再増殖細胞:tumor-repopulating cells(TRC)]の代謝特性に関しては、ほとんど注意が向けられていない。
ここでは、3次元の軟らかいフィブリンゲルで培養されたメラノーマ幹様細胞が、糖新生における重要な役割を果たす細胞質酵素のホスホエノールピルビン酸カルボキシキナーゼ(PCK1)を利用してグルコース代謝を再プログラムすることを示す。
意外にも、メラノーマ幹様細胞で発現が亢進したホスホエノールピルビン酸カルボキシキナーゼ(PCK1)は、糖新生は亢進せずに、セリンおよびグリセロール-3-リン酸経路を含む解糖系から派生する代謝経路を促進した。
さらに、この逆行性のグルコース代謝は、解糖系を抑制するのではなく、逆に亢進し、グルコース消費を増やした。
ホスホエノールピルビン酸カルボキシキナーゼ(PCK1)の発現や活性の阻害は、メラノーマ幹様細胞の増殖を減速させ、生体内(in vivo)での腫瘍形成を妨げた。
以上の結果から、我々の研究はメラノーマ幹様細胞の代謝の特徴を明らかにし、治療のターゲットとなる可能性を示した。
がん細胞でホスホエノールピルビン酸カルボキシキナーゼの活性亢進は、解糖系の中間代謝産物から派生する経路を亢進し、核酸やアミノ酸や脂肪やNAHPHの産生を亢進します。さらに、グルコースの取込みを亢進して、解糖系をさらに亢進する結果になるということです。
この論文の結果を下の図にまとめています。

図:がん細胞ではホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)の活性が亢進し、ホスホエノールピルビン酸の産生が増えている(①)。解糖系の経路の中間代謝産物から派生する経路から細胞増殖に必要な物質(核酸、アミノ酸、脂肪、NADPHなど)の合成が亢進している(②)。さらに、グルコースの取込みと解糖系も亢進する(③)。したがって、PEPCKの阻害はがん細胞の増殖に必要な物質合成を抑制できる。
以上のことから、解糖系を阻害する2−デオキシ-D-グルコース、ミトコンドリアを活性化して乳酸産生を減らすジクロロ酢酸、ホスホエノールピルビン酸カルボキシキナーゼを阻害して、糖新生と解糖系から派生する物質合成を阻害する硫酸ヒドラジン、硫酸ヒドラジンと別のメカニズムで糖新生を阻害するメトホルミンを併用すると、がん細胞のエネルギー産生と物質合成を阻害して、増殖を抑制と細胞死誘導の効果が期待できるかもしれません。
私は、開業した2002年から数年間、がん性悪液質の改善およびがん休眠療法の目的で硫酸ヒドラジンを使っていました。(そのころのサイトは今でも残っています。)
しかし、米国での臨床試験で有効性が否定されたのと、乳酸産生の多い進行がんで糖新生だけを阻害すると乳酸アシドーシスの副作用を引き起こす可能性があるのと、食べ物の制限(チラミンの多い食品は食べられない)があったので、使用する機会は少なくなり、この10年間くらいは全く使用していません。
しかし、ホスホエノールピルビン酸カルボキシキナーゼを阻害ががん治療に有効であることが明らかになったので、他に方法がない進行がんの代替療法として試してみる価値はあるかもしれません。乳酸アシドーシスは、解糖系を阻害する2-デオキシグルコースとミトコンドリアを活性化するジクロロ酢酸を併用すると避けられます。
硫酸ヒドラジンの詳細はこちらへ:
| « 612)白花蛇舌... | 614)好中球対... » |



