がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
648)ビタミンD3の抗がん作用(その2):駆虫薬メベンダゾールとビタミンD3とWnt/βカテニン
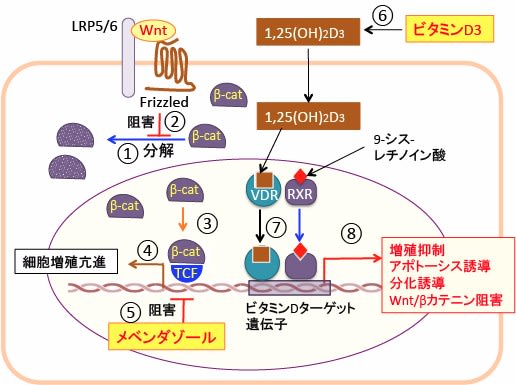
図:細胞質内でβ-カテニン(β-Cat)はリン酸化されてユビチキン化され、プロテアソームで絶えず分解されている(①)。Wntが受容体Frizzledとその共役受容体のLRP5/6に結合してWntシグナルが活性化されるとβ-カテニンの分解が阻止される(②)。その結果、細胞質と核内のβ-カテニンの量が増える(③)。β-カテニンは転写因子のTCF(T-cell factor)の活性を高めて、c-mycやサイクリンD1などのターゲット遺伝子の発現を促進して細胞の増殖を促進する(④)。駆虫薬のメベンダゾールはTCFを活性化するキナーゼのTNIK (Traf2- and Nck-interacting kinase)を阻害してTCFの転写活性を阻害する(⑤)。食品やサプリメントから摂取したビタミンD3は肝臓や腎臓で代謝されて活性型ビタミンD3の1,25ジヒドロキシ・ビタミンD3(1,25(OH)2D3)になる(⑥)。1,25(OH)2D3がビタミンD受容体に結合すると、9-シスレチノイン酸が結合したレチノイドX受容体(RXR)とヘテロダイマーを形成してビタミンD応答配列に結合して、ビタミンDターゲット遺伝子の発現を亢進する(⑦)。発現が誘導される遺伝子は細胞増殖を抑制しアポトーシスを誘導し、分化を誘導する作用がある。さらに、Wnt/β-カテニン経路を阻害する因子の発現も促進する(⑧)。ベンダゾールとビタミンD3はWnt/β-カテニン経路の阻害による抗腫瘍効果において相乗効果が期待できる。
648)ビタミンD3の抗がん作用(その2):駆虫薬メベンダゾールとビタミンD3とWnt/βカテニン
【犬の駆虫薬で進行がんが完治?】
今月の連休中(5月4日)にインターネットのニュースで「がんが全身に転移…余命3カ月の男性が犬の駆虫薬で完治?」というような記事が配信されています。(記事の内容については以下のサイトを参照)
https://www.nikkan-gendai.com/articles/view/life/253187
小細胞肺がんが全身に転移し、「余命3カ月」と宣告された米国の男性が、犬の駆虫薬のフェンベンダゾールを服用してがんが消滅したというニュースです。
フェンベンダゾールなどのベンズイミダゾール系の寄生虫治療薬(駆虫薬)の抗がん作用については10年以上前から報告されています。
多形神経膠腫(glioblastoma multiforme)に対するフェンベンダゾールの効果は2011年に偶然に発見されました。
グリオブラストーマを移植したマウスを使った研究で、マウスにおけるギョウ虫の繁殖を防ぐ目的でフェンベンダゾール(Fenbendazole)を投与したマウスでは移植腫瘍が増大しないことが発見されました。フェンベンダゾールは動物に使われるベンゾイミダゾール系の寄生虫治療薬の一種です。
さらに研究が進められ、ベンゾイミダゾール系薬物の中でメベンダゾールが最も強力にグリオブラストーマの増殖を抑制することが明らかになりました。メベンダゾールは人間に使われるベンゾイミダゾール系駆虫薬です。
さらに、多くのがん細胞株を用いた抗がん作用を有する物質のスクリーニングでも、メベンダゾールが抗がん剤として有用である可能性が報告されています。
以下のような研究があります。
Repositioning of the anthelmintic drug mebendazole for the treatment for colon cancer.(寄生虫治療薬メベンダゾールの大腸がん治療薬としての再開発)J Cancer Res Clin Oncol. 139(12): 2133-40, 2013年
【要旨】
目的:大腸がんの治療薬として再開発する目的で、臨床的に使用されている1600種類の医薬品を含む多数の物質をスクリニーングした。
方法:2種類の大腸がん細胞株を用い、蛍光微小細胞傷害性検定法(fluorometric microculture cytotoxicity assay)で抗がん活性を検討した。物質の比較には、Connectivity Map解析による遺伝子発現解析、米国がん研究所(NCI)の抗がん剤評価系のデータベース(NCI 60 data mining)、プロテインキナーゼ結合測定を実施した。
結果:2種類の大腸がん細胞において、10μMの濃度で細胞生存率を40%以下に減らす細胞傷害活性を示す物質が68種類スクリーニングされた。これらの物質は遺伝子発現の解析から幾つかの種類に分類され、その一つが寄生虫治療薬のベンゾイミダゾール(Benzimidazole)系の薬物であった。このうちメベンダゾール(Mebendazole)とアルベンダゾール(Albendazole)が臨床で使用されていた。NCIの60種類のがん細胞株を用いた薬剤感受性のデータベースとの比較から、メベンダゾールとアルベンダゾールの類似性は低く、作用機序が異なることが示唆された。Connectivity Map解析による遺伝子発現パターンの比較でも、この2つの類似性は低かった。
さらに、メベンダゾールはBCR-ABLやBRAFを含む幾つかのプロテインキナーゼと相互作用を示したが、アルベンダゾールにはそのような作用は認めなかった。
メベンダゾールはNCA60パネルの大腸がん細胞株の80%に対して抗腫瘍活性を示した。さらに3種類の大腸がん細胞と3種類の非がん細胞での検討から、メベンダゾールの大腸がんに対する選択性が確認された。
結論:メベンダゾールは大腸がん治療薬として再開発する価値がある。
メベンダゾールはチュブリン・タンパク質に結合して微小管の重合を阻害する作用によって駆虫作用を示します。メベンダゾールはがん細胞の細胞分裂を阻害する作用により抗腫瘍効果を発揮することが動物実験や臨床例で確認されています。さらに血管内皮細胞増殖因子(VEGF)の受容体(VEGFR-2)の活性化を阻害して血管新生を阻害する作用も報告されています。

図:寄生虫治療に使われるメベンダゾールはチュブリン・タンパク質に結合して微小管の重合を阻害する作用によって駆虫作用を示す。微小管重合阻害剤は抗がん剤としても使用されており、実際にメベンダゾールががん細胞の細胞分裂を阻害する作用により抗腫瘍効果を発揮することが動物実験や臨床例で確認されている。さらに血管内皮細胞増殖因子(VEGF)の受容体(VEGFR-2)の活性化を阻害して血管新生を阻害する作用も報告されている。
大腸がんの転移に対してメベンダゾールを投与した症例が2013年に報告されています。(Acta Oncol 57(3) 427–8, 2013年)
74歳男性の転移した進行性の大腸がんで、ファーストラインの抗がん剤としてカペシタビン+オキサリプラチン+bevacizumabを用い、効果が無くなってからはカペシタビン+イリノテカンによって治療されました。その後、標準的治療が効果を認めなくなった段階で、メベンダゾールが使用されました。
メベンダゾール単独で6週間経過後にCT検査を行うと、肺とリンパ節の腫瘍は完全奏功を示し、肝臓の転移も顕著な縮小を認めました。
しかしながら、肝機能が悪化(ASTとALTの上昇)したので、一時的にメベンダゾールの投与を中止し、肝機能が回復してから半分の量で開始しました。CT検査で腫瘍の縮小を認めました。
治療を中止して3ヶ月後に脳転移を認めたので放射線治療を受け、リンパ節転移が増大したため、メベンダゾールの効果は得られないという判断で治療は終了しています。
さらに5例がメベンダゾールで治療受け1例が部分縮小を認められています。
メベンダゾールは毒性が低く、安価で、駆虫薬として長く使用され安全性が高いためがん治療への応用が期待されています。
メベンダゾールの難点は、消化管からの吸収が極めて低いことです。腸管内の寄生虫に作用すれば目的が達せられるので、消化管からの吸収が悪いのは駆虫薬として利点になりますが、体内のがん細胞に作用させるにはデメリットになります。
ただ、大量に投与することによって肝臓や肺や腎臓や脳などに寄生するエキノコックス症(多包虫症)の治療にも使われるので、多少は体内に吸収されます。
油の多い食事のあとに摂取すると消化管からの吸収を高めることができること、胃薬(胃酸分泌阻害剤)のシメチジンを併用すると分解が阻害されることが知られているので、このような方法で体内濃度を高める工夫をすれば、かなりの抗腫瘍効果が期待できる印象は持っています。ポイントは消化管からの吸収を高め、血中濃度を有効なレベルに高めることができるかです。実際に、食事からの脂肪摂取の多いケトン食との併用は有効性を高めることができます。(メベンダゾールについては401話参照)
【駆虫薬のメベンダゾールはWnt/βカテニンによる遺伝子発現を阻害する】
がん細胞では様々なメカニズムでWnt/β-カテニン・シグナル伝達系が活性化され、核内でのβ-カテニンの量が増加し、その結果、TCf/Lefの転写因子活性が亢進して、がん細胞の増殖を促進しています。したがって、Wnt/β-カテニン・シグナル伝達系の阻害はがん治療のターゲットとして重要視されています。
駆虫薬のメベンダゾールがWnt/β-カテニン・シグナル伝達系の最下流の遺伝子発現レベルで阻害作用を示すことが報告されています。以下のような報告があります。
Comprehensive Modeling and Discovery of Mebendazole as a Novel TRAF2- and NCK-interacting Kinase Inhibitor.(包括的モデリングと新規TRAF2およびNCK相互作用キナーゼ阻害剤としてのメベンダゾールの発見)Sci Rep. 2016 Sep 21;6:33534. doi: 10.1038/srep33534.
【要旨】
TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)は、Wntシグナル系が活性化した結腸直腸癌がんの重要なターゲットの1つである。この研究では、2つのデータセットを選び、望ましい生物医薬品特性を有する新規なTNIK阻害剤を探索するための包括的なモデリング研究を行った。
データセットIを用いて、比較分子類似性指数分析(Comparative Molecular Similarity Indices Analysis :CoMSIA)および可変選択k-最近傍モデル(variable-selection k-nearest neighbor models)を導出し、そこからTNIK阻害剤活性にとって決定的な3D分子場(3D-molecular fields)および2D記述子(2D-descriptors)が明らかにされた。
データセットIIに基づいて、予測的なCoMSIA-SIMCA(Soft Independent Modelling by Class Analogy)モデルを取得し、1,448種類の FDA(米国食品医薬品局)承認の小分子薬物のスクリーニングに使用した。実験的評価の結果、FDA承認の駆虫薬であるメベンダゾールは、解離定数Kd =〜1μMでTNIKキナーゼ活性を選択的に阻害することができることを発見した。その後のCoMSIAおよびkNN分析は、メベンダゾールがTNIKを結合および阻害するのに必要な好ましい分子特性を有することを示した。
理解困難な用語や解析法が並んでいますが、簡単に言うと、コンピュータを使った構造解析や結合活性の解析でメベンダゾールが「TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)」の阻害剤として有用である可能性を報告しています。
がん治療薬の開発では、培養がん細胞(in vitro)や移植腫瘍などを使った動物実験(in vivo)で抗がん活性や安全性や薬物動態が検討されます。
さらに最近は、薬剤の候補物質がデータベース化され、細胞の受容体やシグナル伝達物質の構造のデータベースや、抗がん剤による遺伝子発現パターンのデータベースなど様々な情報をコンピューターを使って探索する方法(in silico)もあります。「in silico」という用語は,「コンピュータ(シリコンチップ)の中で」の意味で、in vitro(試験管内で)やin vivo(生体内で)に対応して作られた用語で、コンピューターを駆使した研究です。
米国では、FDA(米国食品医薬品局)が承認した既存薬や、開発に失敗して製薬企業内で保存されている物質のデーターベースが公開されており、様々な手法で新たな薬効を見つける研究が進んでいます。
TNIK(TRAF-2 and NCK-interacting kinase)はセリン・スレオニンキナーゼで、このキナーゼ活性(タンパク質をリン酸化する活性)は結腸直腸がんの増殖活性の維持に必須であることが報告されています。
Wnt/βカテニン経路の最終段階であるβカテニンとTCFの相互作用において、TNIKはTCFのセリン154をリン酸化します。このリン酸化がβカテニン/TCFの遺伝子転写活性に必要だと言うことです。
したがって、TNIKの阻害剤は大腸がんのようにWnt/βカテニンシグナル伝達系が亢進したがんの治療に有効と考えられており、多くの製薬会社が開発しています。まだ臨床的に使用できるものはありませんが、何十年も前から多くの国で使用されている駆虫薬のメベンダゾールが、TNIKの阻害剤としてかなり有望だという報告です。
【Wnt/β-カテニン経路の活性化はがん患者の予後を悪くする】
以上のような最近の報告から、駆虫薬のメベンダゾールは、微小管重合障害、血管新生阻害、Wnt/βカテニン・シグナル伝達系阻害など、多彩な作用機序で抗腫瘍効果を発揮することが示されてます。メベンダゾールの作用機序を理解するために、Wnt/βカテニン・シグナル伝達系について解説します。
Wntシグナルは種を超えて広く保存されたシグナル伝達経路で、遺伝子発現、細胞増殖、細胞運動、細胞極性などを調節することで、発生や幹細胞の維持、発がんなどに深く関与することが知られています。特にβカテニンを介するWnt/β-カテニン・シグナル伝達系は多くのがん細胞で異常を起こしており、がん治療の重要なターゲットになっています。Wnt/β-カテニン経路が活性化しているがんは予後が悪いという研究結果が多く報告されています。
βカテニンは781個のアミノ酸からなる92kDaのタンパク質で、細胞間接着と遺伝子発現調節の2つの働きを持っています。
細胞のβカテニンの大部分は細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリン(E-Cadherin)と会合体を作っています。このような細胞膜の接着部位のβカテニンはE-カドヘリンとアクチン細胞骨格との連結を助けています。
E-カドヘリンと会合していないβカテニンはすべて細胞質で複数のタンパク質(AXIN、APC、GSK3β、CK1α)からなる大型の分解複合体により分解されています。
しかし、Wnt(ウィント)という分子量約4万の分泌性糖タンパク質が受容体に結合すると、細胞質におけるβ-カテニンの分解が阻止されて細胞質に蓄積し、核内に移行した後, 転写因子のTcf/Lef(T cell factor/ Lymphoid enhancer factor)と複合体を形成し、Tcf/Lefの転写活性を亢進します。つまり、β-カテニンはTcf/Lefの転写活性化補助因子として機能し、Tcf/Lefの標的遺伝子の転写を誘導します。このシグナル伝達系をWnt/β-カテニン経路と言います。(下図)

図:β-カテニンは細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリンに結合し、カドヘリンとアクチン細胞骨格との連結を助けている(①)。E-カドヘリンと会合していないβカテニンはリン酸化され、ユビキチン化をうけて最終的にプロテアソームで分解される(②)。Wntは細胞膜上のFrizzled(7回膜貫通型受容体)と共役受容体である1回膜貫通型LRP5/6(Low-density lipoprotein receptor-related protein5/6)に結合する(③)。Wntが受容体に結合するとβカテニンのリン酸化が抑制され、β-カテニンの分解が阻止される(④)。βカテニンは細胞質に蓄積し核内に移行し(⑤)、転写因子のTcf/Lef(T cell factor/ Lymphoid enhancer factor)と複合体を形成する(⑥)。βカテニンにより活性化される遺伝子群にはc-mycや cyclinD1など細胞の増殖を促進する因子が含まれ(⑦)、その結果、細胞の増殖が亢進する(⑧)。
β-カテニンは細胞膜近傍か細胞質・核のどちらかに局在し、 特に核にあるときは一連の遺伝子発現に影響を与えると考えられています。
Wnt/β-カテニン・シグナル伝達系により活性化される遺伝子群にはc-myc、 c-jun、 cyclinD1など細胞の増殖や転移を促進する因子が含まれます。つまり、Wnt/β-カテニン・シグナル伝達系が活性化されると、がん細胞の増殖や転移が促進されることになります。
したがって、「β-カテニンの細胞質と核内における発現は、患者の予後を悪くする指標となる」ということになります。
【がん細胞ではWnt/β-カテニン経路の異常が高頻度で認められる】
Wnt/β-カテニン経路は極めて複雑で、まだ不明な点も多くあります。簡単にまとめると、次のようになります。
(1)Wntは分子量約4万の細胞外分泌糖タンパク質で、種を超えて保存されており、初期発生における体軸の決定や器官形成を制御しています。これまでに哺乳類において19種類のWnt が同定されています。
(2)Wnt はFrizzledやlow-density lipoprotein receptor related protein(LRP)5/6の受容体を介して細胞内にシグルを伝達し、多様な細胞機能を制御しています。Frizzledは7回膜貫通型受容体でLRP5/6はFrizzledの共役受容体として機能します。
(3)Wnt の非存在下では細胞質内のβ-カテニンのタンパク質量は低く保たれています。これはGSK-3がβ-カテニンをリン酸化し、リン酸化された-カテニンはユビキチン化を受け、最終的にはプロテアソームで分解されるためです。
(4)Wnt が分泌されて細胞膜上のFrizzled と共役受容体であるLRP5/6に結合すると,そのシグナルは細胞内へと伝達され、GSK-3依存性のβ-カテニンのリン酸化を抑制し、低リン酸化状態となったβ-カテニンはプロテアソームによる分解から免れ、細胞質内に蓄積します。
(5)細胞内に蓄積したβ-カテニンは核内に移行し、転写因子Tcf/Lef と複合体を形成して標的遺伝子の発現を促進することによって、種々の細胞機能を制御しています。Tcf/LefはT-cell factor/lymphoid enhancer factorの略です。
(6)Tcf/Lefの標的遺伝子は100種類以上に及び、細胞の増殖、分化、運動、幹細胞多能性維持などの制御に関わっています。c-mycやcyclin D1などの発現を亢進して細胞増殖を促進します。(下図参照)

図:(左)Wntのシグナルが無い状況では、β-カテニンは細胞質内で分解複合体によってリン酸化され(①)、ユビキチン(U)が結合し(②)プロテアソームで分解されている(③)。その結果、Tcf/Lef(T-cell factor/lymphoid enhancer factor)による遺伝子発現が阻止されている(④)。
(右)Wntが受容体のFrizzledとLRP5/6に結合してWntシグナルが活性化されると、分解複合体が不活性化され、β-カテニンのリン酸化が阻止されて(⑤)β-カテニンは分解されなくなり(⑥)、細胞質内で増加し核内に移行して転写因子のTCFに結合し(⑦)、β-カテニン/TCFのターゲット遺伝子の転写を活性化して(⑧)、細胞の増殖を亢進する(⑨)。
βカテニン分解複合体は、AXIN、APC(adenomatous polyposis coli) 、セリン・スレオニンキナーゼのGSK3β(glycogen synthase kinase-3)、CK1α (casein kinase 1α)から構成され、GSK3βとCK1αがβカテニンをリン酸化する。βカテニンがリン酸化されるとβ‑TrCP E3 linker によってユビキチンが結合して、プロテアソームで分解される。(参考:npj Precision Oncology, volume 2, Article number: 5 (2018) )
簡単にまとめると以下のようになります。Wntシグナルが無いとβカテニンが分解され、Wntシグナルがあるとβカテニンの分解が阻止されて、βカテニン/TCFのターゲット遺伝子の転写が亢進して、細胞増殖が亢進することになります。

図:Wntのシグナルが無い場合(①)、β-カテニンは細胞質内でリン酸化され、ユビキチンが結合しプロテアソームで分解されている(②)。その結果、β-カテニン/TCFのターゲット遺伝子の転写は起こらない(③)。Wntが受容体のFrizzledとLRP5/6に結合してWntシグナルが活性化されると(④)、β-カテニンのリン酸化が阻止されてβ-カテニンは分解されなくなり(⑤)、細胞質内で増加して核内に移行して転写因子のTCFに結合し(⑥)、β-カテニン/TCFのターゲット遺伝子の転写を活性化して、細胞の増殖を亢進する(⑦)。
【ビタミンD3はWnt/β-カテニン経路を抑制する】
食事やサプリメントとして摂取したビタミンD3は、肝臓で25位が水酸化されて25(OH)ビタミンD3(カルシジオール:Calcidiol)に変換され、さらに腎臓などで1α位が水酸化されて活性型の1,25(OH)2-ビタミンD3(カルシトリオール:Calcitriol)になります。ビタミンD3は複数のメカニズムでがん細胞の増殖を抑制し、細胞の分化や死(アポトーシス)を誘導します。活性型ビタミンD3は幾つかのメカニズムでWnt/β-カテニン経路を抑制することが報告されています。以下のようなメカニズムが提唱されています。
(1)β-カテニンはビタミンD受容体とも相互作用します。ビタミンDとビタミンD受容体の複合体にβ-カテニンが結合すると、β-カテニンとTcf/Lefの結合を阻止するので、Tcf/Lefの転写活性が抑制され、増殖抑制作用を示すというメカニズムが提唱されています。
(2)β-カテニンは接着分子のE-カドヘリンに結合して細胞間接着に重要は働きを担っています。ビタミンD3はE-カドヘリンの発現を亢進するので、β-カテニンを細胞膜の接着班に取り込むことによって細胞内のβ-カテニンの量を減らすことになります。
(3)ビタミンD3はDickkopf(DKK)-1というタンパク質の発現を亢進します。DKK-1はWntシグナルの細胞外の阻害因子です。
以上のような複数のメカニズムで、活性型ビタミンD3はβ-カテニン/TCFのターゲット遺伝子(c-mycやサイクリンD1など)の発現を抑制し、その結果、がん細胞の増殖を抑制することになると考えられています。(下図参照)

図:活性型ビタミンD3の1,25(OH)2ビタミンD3はビタミンD受容体(VDR)と結合してVDRとβ-カテニンの結合を促進する。その結果、転写因子のTCFとβ-カテニンの結合を阻害するので、β-カテニン/TCFのターゲット遺伝子の転写を抑制する(①)。ビタミンD3と結合したビタミンD受容体はさらにβ-カテニンと結合することによってビタミンDのターゲット遺伝子の転写を活性化する(②)。細胞膜のE-カドヘリンをコードするCDH1遺伝子の発現を促進し、β-カテニンを細胞膜の接着班に取込む(③)。細胞外のWnt阻害因子であるDKK-1の発現を促進することによってWntシグナルを阻害する(④)。このように、活性型ビタミンD3の1,25(OH)2ビタミンD3は様々なメカニズムでβ-カテニン/TCFの転写活性を阻害することによって、細胞増殖を抑制する。(参考:Cancers 2013, 5, 1242-1260)
【ビタミンDはがん組織の微小環境にも作用して抗腫瘍活性を示す】
ビタミンD3は体内で肝臓や腎臓で代謝され、1α,25-dihydroxyvitamin D3 (または calcitriol)という活性型に変換され、この活性ビタミンD3が細胞核の中のビタミンD受容体に結合して、ある種の遺伝子の発現を促進することによって作用を発揮します。
このビタミンD受容体によって発現が亢進される遺伝子には、細胞の分裂を抑制したり、細胞の分化を誘導する働きを持つものがあり、したがって、ビタミンD受容体の活性化は抗腫瘍作用を示します。
このように、ビタミンDの抗腫瘍作用は、がん細胞に対する直接作用が主体と考えられています。さらに、がん組織の線維芽細胞にビタミンD受容体の発現量が高いほどがん患者の予後が良いという報告が大腸がんなどで報告されています。
さらに、多くの免疫細胞にもビタミンD受容体が発現しており、ビタミンDは免疫システムの働きを高めるメカニズムでも抗腫瘍作用を発揮することが報告されています。
がん組織の間質の線維芽細胞のビタミンD受容体の発現量が全生存期間の延長と関連することが報告されています。以下のような報告があります。
Vitamin D receptor expression and associated gene signature in tumour stromal fibroblasts predict clinical outcome in colorectal cancer(腫瘍間質線維芽細胞におけるビタミンD受容体の発現とビタミンD関連遺伝子の発現パターンは結腸直腸がんの臨床転帰を予測する)Gut. 2017 Aug; 66(8): 1449–1462.
【要旨の抜粋】
目的:ビタミンD欠乏症は結腸直腸がんの発生率と死亡率を高めることが指摘されており、ビタミンDは結腸直腸がんに対して抗腫瘍作用を持つことが示唆されている。がんの進行に対して腫瘍間質は強い影響を与える。そこで、我々は活性型ビタミンDの1α,25-ジヒドロキシビタミンD3(1,25(OH)2D3)の結腸直腸がんの間質組織に対する潜在的な効果を調べた。
方法:長期の臨床経過を有する658人の結腸直腸がん患者において、ビタミンD受容体と2種類の1,25(OH)2 D 3標的遺伝子の発現を分析した。患者由来の結腸正常線維芽細胞およびがん関連線維芽細胞の初代培養物に対する1,25(OH)2D3の作用を、コラーゲンゲル収縮および遊走アッセイならびに包括的な遺伝子発現分析を用いて検討した。
結果:腫瘍間質線維芽細胞におけるビタミンD受容体の高発現は、がん細胞における発現量とは無関係に、結腸直腸がんにおけるより良好な全生存および無増悪生存と関連していた。1,25(OH)2D3 は正常線維芽細胞とがん関連線維芽細胞のがん促進作用の活性化を阻害した。
結論:1,25(OH)2D3は、がん間質組織の線維芽細胞の制御を通じて結腸直腸がんに対する抑制効果を有する。したがって、間質性線維芽細胞におけるビタミンD受容体および1,25(OH)2D3関連遺伝子の発現は、結腸直腸がん患者の予後が良好であるという臨床結果を予測する。したがって、ビタミンD受容体アゴニストを用いた結腸直腸がん患者の治療は、がん細胞におけるビタミンンD受容体の発現が無い場合でも効果が期待できる。
様々な基礎研究や疫学研究などから、ビタミンDの欠乏が結腸直腸がんの発症率を高めることが明らかになっており、ビタミンDが結腸直腸がんの予防や治療に役立つことが指摘されています。
がん細胞への直接作用だけでなく、がん組織の間質細胞に対してもビタミンDは作用して抗腫瘍効果を発揮するという報告です。
腫瘍組織のがん関連線維芽細胞のビタミンD受容体発現が強いほど、全生存期間や無増悪生存期間が長いことが示されています。これはがん細胞のビタミンD受容体の発現とは独立した予後因子となっています。
つまり、がん細胞にビタミンD受容体の発現が無くても、がん組織内の線維芽細胞にビタミンD3受容体の発現があれば、ビタミンD投与の意味があるということです。
がん細胞ではビタミンD受容体の発現量が低下していることが多く、これはビタミンDの補充の抗腫瘍作用を制限しています。
腫瘍組織の線維芽細胞のビタミンD受容体の発現が多いと予後が良いということです。つまり、大腸がん細胞における発現量とは独立して、がん細胞関連線維芽細胞におけるビタミンD受容体の発現があればビタミンD投与が有効と言えます。
進行がんの治療においてビタミンD3のサプリメントを1日4000 IU(100μg)以上摂取することは試してみる価値があることは多くの研究結果が示しています。
大腸がんや乳がんではビタミンDの血中濃度が高いほど生存率が高いという疫学や臨床試験の結果が多く出ています。
がん患者さんはビタミンDの血中濃度が低い人が多く、ビタミンDの血中濃度を高めることができれば生存率を高めることができます。
ビタミンD3の血中濃度が低いがん患者のビタミンD濃度を高めるには1日4000 IU(100μg)のビタミンD3の摂取が必要です。(647話参照)
進行がんの場合は、1日10,000 IU (250μg)くらいの摂取は試してみる価値はあります。
さらに、メベンダゾールの併用は有効です。
ビタミンD3はWnt/βカテニン経路の様々な部位で阻害作用を示し、メベンダゾールはWnt/βカテニン経路の最下流のTcf/Lef(T-cell factor/lymphoid enhancer factor)による遺伝子発現を阻止します。
さらに、非ステロイド性抗炎症剤のスリンダクはβカテニンの分解を促進します。(625話参照)
大腸がんや乳がんなどWnt/βカテニン経路の亢進が見られる多くのがんにおいて、1日10,000 IU程度のビタミンD3、油脂の多い食事後のメベンダゾール(5〜10mg/kg/日、あるいはそれ以上) 、メベンダゾールの分解を阻害するシメチジン(800mg/日)、スリンダク(100〜400mg/日)は試してみる価値はあります。
メベンダゾールは日本でも販売されていますが、日本で販売されているのは薬価が高いので自費で使用するとかなりの費用になりますが、海外では安価に販売されています。
(メベンダゾール治療についてはこちらへ)
ビタミンD3のサプリメント:
1カプセル1000 IU/250錠(6300円)
米国:DaVinci Laboratories of Vermont
購入ご希望の方は銀座東京クリニックにお問い合わせください。
| « 647)ビタミンD... | 649)がんで死... » |






