がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
684)高脂血症治療薬シンバスタチンはがん患者の生存率を高める
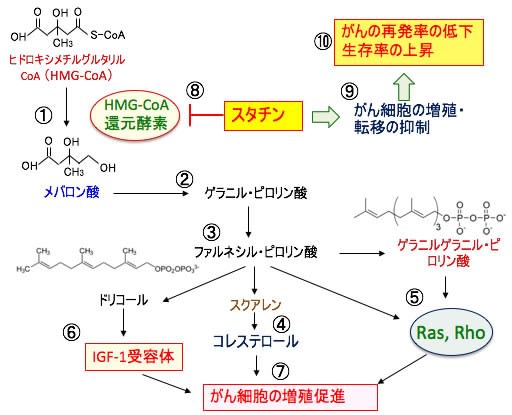
図:コレステロールを合成するメバロン酸経路で産生される中間代謝産物が、がん細胞の増殖の維持と促進に重要な働きを担っている。すなわち、3-ヒドロキシ-3-メチルグルタリル補酵素A(HMG-CoA)がHMG-CoA還元酵素によってメバロン酸に変換され(①)、メバロン酸からゲラニル・ピロリン酸(②)、ファルネシル・ピロリン酸(③)が合成され、さらにコレステロールが合成される(④)。ファルネシル・ピロリン酸からゲラニルゲラニル・ピロリン酸が合成され、このゲラニルゲラニル・ピロリン酸とファルネシル・ピロリン酸は低分子量Gタンパク質のRasやRhoの活性化に必要(⑤)。さらにメバロン酸経路の中間代謝産物はインスリン様成長因子-1(IGF-1)受容体の活性化にも関与する(⑥)。これらはがん細胞の増殖を促進する(⑦)。高脂血症治療薬のスタチンはHMG-CoA還元酵素とHMG-CoAとの結合を競合阻害することによってメバロン酸経路を阻害する(⑧)。メバロン酸経路の阻害は、がん細胞の増殖や転移を抑制し(⑨)、その結果、がんの再発を抑制し、生存率を上昇する(⑩)。脂溶性のスタチンのシンバスタチンの服用が、乳がんや膵臓がんや肺がんや前立腺がんなど多くのがん種で、生存率を高める事が多くの疫学研究で明らかになっている。
684)高脂血症治療薬シンバスタチンはがん患者の生存率を高める
【コレステロールは乳がん細胞の発生と増殖を促進する】
肥満やメタボリック症候群は乳がんの発症リスクを高めます。
肥満やメタボリック症候群は、インスリンやインスリン様成長因子-1(IGF-1)の血中濃度を高めます。インスリンとIGF-1は乳がんだけでなく様々ながんの発症と増殖を促進します。
さらに肥満やメタボリック症候群はコレステロールの血中濃度を高めます。
肥満や高コレステロール血症が乳がんの発生率を高めることは、マウスの乳がん発生の動物実験モデルで、1950年代に最初に報告されています。
(Obesity and the time of appearance of spontaneous mammary carcinoma in C3H mice. Cancer Res. 1953;13:276–278. )
その後も多くの実験系で、高脂肪や高コレステロールの食餌が乳がんの発生や増殖を促進することがマウスの実験で示されています。
このような実験で、脂肪の量を増やさずにコレステロールだけを増やした食餌を与えると乳がんの発生と増殖が促進されることから、コレステロール自体に乳がんを促進する作用があると考えられています。
これは、高脂肪・高コレステロール食による発がん促進作用が、コレステロールの合成を阻害する薬剤(スタチン)によって阻止されることからも支持されています。
このように、コレステロールが乳がんの発生や増殖を促進することが多くの研究で示されていますが、そのメカニズムは単純ではなく、まだ不明な点が多く残されています。
例えば、細胞膜でコレステロールが増えると、細胞膜の流動性に影響し、さらに脂質ラフト(Lipid Raft)の構造にも影響して、その結果、シグナル伝達系にも影響する可能性が指摘されています。
ラフト(Raft)とは筏(いかだ)のことで、細胞膜中に特定の脂質(スフィンゴミエリンやコレステロールなど)とタンパク質(受容体など)が集合した領域(ラフト)が浮かんでいる構造を脂質ラフトと言い、シグナル伝達や物質輸送などで重要な役割を果たしています。細胞内のコレステロールの量が脂質ラフトの働きに影響するということです。
さらに、コレステロールの代謝産物の27-hydroxycholesterolがエストロゲン受容体のリガンドとして作用するので、エストロゲン受容体陽性の乳がん細胞の増殖を亢進するメカニズムも指摘されています。これはScienceに報告されています。
27-Hydroxycholesterol links hypercholesterolemia and breast cancer pathophysiology.(27-ヒドロキシコレステロールは高コレステロール血症と乳がんの病理生理学を結びつける)Science. 2013 Nov 29;342(6162):1094-8.
【要旨】
高コレステロール血症は、エストロゲン受容体(ER)陽性乳がんの危険因子であり、内分泌療法に対する反応の低下と関連している。
ここでは、コレステロールの代謝産物の一つで、エストロゲン受容体とliver X receptor (LXR) のりガンドである27-ヒドロキシコレステロール(27-hydroxycholesterol)が、乳がんのマウスモデルにおいてエストロゲン受容体依存性増殖およびLXR依存性転移を増加させることを示す。
がん細胞に対するコレステロールの作用は、チトクロームP450オキシダーゼのCYP27A1による27-ヒドロキシコレステロールへの変換を必要とし、そしてCYP27A1阻害剤により減弱された。
ヒト乳がん組織では、CYP27A1の発現レベルは腫瘍の悪性度と相関していた。 高悪性度腫瘍では、がん細胞と腫瘍関連マクロファージの両方においてCYP27A1の高発現を認めた。
したがって、血中のコレステロールレベルを低下させること、またはコレステロールから27-ヒドロキシコレステロールへのその変換を阻害することは、乳がんの予防や治療における有効な治療法となりうる。
つまり、がん組織では薬物代謝酵素のCYP27A1の発現や活性が亢進しており、CYP27A1によってコレステロールが27-ヒドロキシコレステロールに変換され、この27-ヒドロキシコレステロールがエストロゲン受容体やliver X receptorのリガンドとして作用してこれらの受容体を刺激して、乳がん細胞の増殖や転移を促進するという事です。(下図)

図:細胞膜でコレステロールが増えると、細胞膜の流動性(①)や脂質ラフト(②)の機能に影響して、シグナル伝達系など細胞機能に影響する。コレステロールはステロイドホルモンに変換される(③)。がん組織で発現が亢進している薬物代謝酵素のCYP27A1によってコレステロールが27-ヒドロキシコレステロールに変換され(④)、この27-ヒドロキシコレステロールがエストロゲン受容体やliver X receptorを刺激して(⑤)、乳がん細胞の増殖や転移を促進する(⑥)。
【コレステロールはアセチルCoAを材料に体内で合成される】
コレステロールは、動物細胞にとっては生体膜の構成物質の一つであり、細胞膜の流動性や機能の調節に重要な働きを行っています。さらにシグナル伝達など様々な生命現象に関わる重要な化合物で、生体内に広く分布します。
コレステロールは食物にも含まれていますが、体内のコレステロールのうち、食事由来は3割程度で、7割くらいは糖質や脂肪酸を材料にして体内(肝臓や皮膚、腸粘膜、副腎、卵巣、精巣など)で合成されています。
コレステロールはアセチルCoA(グルコースや脂肪酸などの分解によって生成される)からメバロン酸を経由して合成されます。この生合成経路をメバロン酸経路と言います。メバロン酸経路の律速酵素は3-ヒドロキシ-3-メチルグルタリルCoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase ;HMG-CoA還元酵素)です。
一連の化学反応系において、全体の反応速度を決定する反応を律速段階と言い、その反応に関わる酵素を律速酵素と言います。律速(りっそく)というのは「速さ」を「律する(制御する)」という意味で、「全体の反応速度を決める」という意味の用語です。
例えば、ボトル(瓶)に水を入れて、逆さまにして水を出すとき、水が出る速さを決めるのは、ボトルの首(ネック)の部分の大きさになります。化学反応においてボトルネックと同じ役割を担うのが律速酵素です。
HMG-CoA還元酵素を阻害すると肝臓でのコレステロール生合成を抑制することができるため、多くのHMG-CoA還元酵素阻害剤が開発され高脂血症治療薬として臨床で使われています。このようなHMG-CoA還元酵素の働きを阻害することによって血液中のコレステロ-ル値を低下させる薬(HMG-CoA還元酵素阻害剤)の総称をスタチン(Statin)といいます(図)。
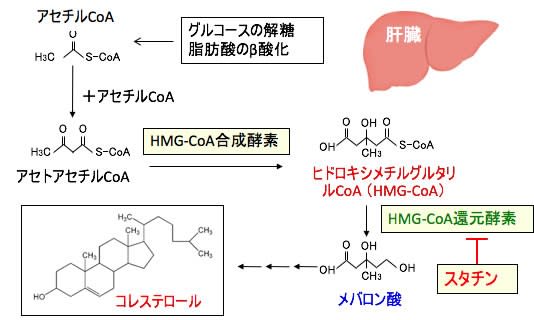
図:スタチンは肝臓においてヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害することによってコレステロール合成を抑制する。
最初のスタチンであるメバスタチンは1973年に青カビの一種から発見され、それ以降、様々な種類のスタチンが開発され、高コレステロール血症の治療薬として世界各国で使用されています。近年の大規模臨床試験により、スタチンは高脂血症患者での心筋梗塞や脳血管障害の発症リスクを低下させる効果があることが明らかにされています。
スタチンのHMG-CoA還元酵素に対する親和性は本来の基質であるHMG-CoAの1000倍以上であるため、HMG-CoA還元酵素を強力に阻害します。
【メバロン酸経路の中間代謝産物ががん細胞の増殖を亢進する】
がん細胞が細胞分裂で細胞の数を増やすためには、細胞膜を構成する脂肪酸やコレステロールの合成を増やす必要があります。さらに、メバロン酸経路で産生される中間代謝産物が、がん細胞の増殖の維持と促進に重要な働きを担っています。そのために、がん細胞ではメバロン酸経路での代謝が亢進しています。
例えば、細胞内シグナル伝達系のスイッチとして働くGTP結合タンパク質の機能にメバロン酸経路の中間代謝産物のゲラニル・ピロリン酸とゲラニルゲラニル・ピロリン酸が必要です。
GTP結合タンパク質(Gタンパク質)は内在性のGTP加水分解(GTPase)活性をもつタンパク質の総称で、この内、低分子量Gタンパク質群(Ras, Rho,など)は分子量が2万~3万のタンパク質で、これまで100種類以上報告されています。RasやRhoはがん遺伝子として知られています。
Gタンパク質はGTP結合型(on)/GDP結合型(off)として細胞内シグナル伝達に関与しています。
すなわち、Gタンパク質はGDP結合不活性型とGTP結合活性型の間をサイクル(GTPaseサイクル)することにより、細胞外からの情報を細胞内に伝達します。
RASは21kDaの分子量の単量体GTPaseです。RASサブファミリーの代表はHRAS、KRAS、NRASの3つです。HRASとKRASはラット肉腫ウイルスから分離され、NRASはヒト神経芽細胞腫から分離されました。
RASは細胞外のさまざまな刺激、例えばチロシンキナーゼ受容体やサイトカイン受容体やカルシウムチャネルなどの刺激を受けてGDPが結合した不活性の状態からGTPに結合した活性化の状態に移行します。このGDP/GTP交換反応を促進するのがGEF(guanine-nucleotide exchange factors)です。
またGTPに結合したRASは内在性のGTPaseによりGDP結合型に戻りますが、この反応を促進するのがGTPase-activating proteins(GAP)です。
活性化したGTP結合型のRASは幅広い下流のターゲット(effectors)と相互作用をし、下流のシグナルを活性化します。
そのeffectorとして細胞増殖や生存を促進するRAFキナーゼやPI-3 キナーゼなど多数のシグナル伝達系が知られています。がん細胞ではRasタンパク質の変異によって、GTPが結合した状態の活性型が持続して、細胞の増殖や運動や生存が促進されています。

図:(左)正常細胞では、低分子量GTP結合タンパク質のRasは、細胞外のさまざまな刺激を受けてGDP/GTP交換反応を促進するGEF(guanine-nucleotide exchange factors)の作用によって(①)、GDPが結合した不活性の状態からGTPに結合した活性化の状態に移行し(②)、シグナル伝達の下流に位置するエフェクターを活性化し、細胞増殖やアポトーシスや遺伝子発現を制御する(③)。GTPに結合したRasは内在性のGTPaseによりGDP結合型に戻るが、この反応はGTPase-activating proteins(GAP)で促進される(④)。
(右)がん細胞では、Rasタンパク質は変異し(Ras*)、スイッチが常時オンの状態になっている(⑤)。GAPによるGTPの分解もできない(⑥)。活性化したGTP結合型のRasは下流のターゲット(エフェクター)と相互作用をし、下流のシグナル伝達系を活性化する(⑦)。そのエフェクターとして細胞増殖や生存を促進するRAFキナーゼ(RAF/MEK/ERK経路)やPI-3 キナーゼ(PI3K/AKT/mTORC1経路)など多数のシグナル伝達系が知られている。その結果、がん細胞ではRasタンパク質の変異によって、GTPが結合した状態の活性型が持続して、細胞の増殖と生存が促進されている。
【GTP結合タンパク質の活性化にはタンパク質のプレニル化が必要】
4種類の塩基からなるDNAが転写されてメッセンジャーRNA(mRNA)となり、20種類のアミノ酸からなるタンパクやペプチドへと翻訳されます。多くのタンパクやペプチドはさらに様々な化学修飾を受けます。これは翻訳後修飾と呼ばれ、タンパクやペプチドの機能発現のスイッチの役割を果たす動的な制御機構であり、様々なアミノ酸上で様々な翻訳後修飾の様式が明らかとなっています。
例えば、リン酸化や糖鎖付加、S-S結合の形成の他にメチル化、プレニル化などの化学修飾や、酵素による切断などが知られています。
プレニル化反応(Prenylation)とは、疎水性のプレニル基を付加する反応のことです。
プレニル基とは、炭素数5のイソプレン単位で構成される構造単位の総称で、各プレニル基にはイソプレン単位数によって下の表のような呼び名がついています。

RasやRhoなどの低分子量Gタンパク質は、そのほとんどでC末端から4番目のアミノ酸残基がシステインであり、このシステインにファルネシル基やゲラニルゲラニル基などの脂肪酸が結合しており、この脂質修飾により細胞膜に直接結合できると考えられています。
すなわち、低分子量Gタンパク質はイソプレニル化(ファルネシル基やゲラニルゲラニル基の結合)を受けた後に細胞膜に移行し、GTP結合型(on)/GDP結合型(off)としてGDP結合不活性型とGTP結合活性型の間をサイクル(GTPaseサイクル)することにより、細胞外からの情報を細胞内に伝達します。

図:タンパク質にファルネシル基やゲラニルゲラニル基が結合すると細胞膜と結合できるようになる。
KRASは、上皮成長因子受容体(EGFR)のシグナル伝達経路において重要な役割を担うタンパク質です。そのシグナル伝達経路は複雑なカスケードを構成し、がんの発生と進行に関与しています。特に、膵臓がんのほとんどでKRAS遺伝子の変異による異常活性化が認められています。KRASはファルネシル化を受けて細胞膜に結合することによって機能を果たすことができます。

図:低分子量Gタンパク質の一種のKRASは、GDP結合型が不活性型で(①)、上皮成長因子受容体などからの刺激を受けてGTP結合型となって活性化され(②)、エフェクタータンパク質に作用して情報を伝達し、細胞の増殖や転移を亢進し、アポトーシス(細胞死)に抵抗性になる(③)。KRASが細胞膜の脂質に接着するときにファルネシル基と結合する必要があり、これができないとKRASは活性化できない(④)。
また、がん細胞の増殖を促進するインスリン様成長因子-1(IGF-1)の受容体の働きにも、メバロン酸経路の代謝産物が必要で、メバロン酸経路の阻害がIGF-1受容体の働きを阻害して、がん細胞の増殖を抑制することが知られています。
このように、がん細胞のメバロン酸経路を阻害することは、がん細胞の増殖を抑制することになります。
【スタチンはメバロン酸経路でのイソプレノイド生成を低下してGTP結合タンパク質の活性を阻害する】
膵臓がんではKRAS遺伝子の変異が高頻度に起こっています。大腸がんや肺がんなど他の多くのがんでも、RASやRhoなどの低分子量GTP結合タンパク質の遺伝子変異による活性化が起こっています。
がん患者のKRAS遺伝子に異常がある場合、EGFRからのシグナル伝達を阻害するセツキシマブ(商品名:アービタックス)などの薬剤を投与しても、下流のKRAS遺伝子から細胞増殖のシグナルが出続けているため、EGFR阻害剤では腫瘍細胞の増殖を抑制できません。
変異したKRASの活性を直接阻害する薬の開発はまだ成功していません。そこで、低分子量Gタンパク質の活性化を阻害する方法として、イソプレニル化の阻害が注目されています。
高コレステロール血症治療薬のスタチンがイソプレノイド生成を阻害して低分子量Gタンパク質の活性化を阻害することができます。(下図)

図:ヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害すると、コレステロール合成の抑制だけでなく、増殖を促進するG結合タンパク質の活性化に必要なファルネシル基やゲラニルゲラニル基の産生ができなくなる。Gタンパク質のイソプレニル化が阻害されるとがん細胞の増殖が抑制される。
前述のように、低分子量Gタンパク質(Ras, Rho,など)はイソプレニル化を受けた後に細胞膜に移行し、GTP結合型(on)/GDP結合型(off)として細胞内シグナル伝達に関与しています。低分子量Gタンパク質のC末端から4番目のアミノ酸残基のシステインに、ファルネシル基やゲラニルゲラニル基などのイソプレノイドが結合し、この脂質修飾により、細胞膜に直接結合できると考えられています。
HMG-CoA還元酵素を阻害してイソプレノイド生成が低下すると、低分子量Gタンパク質の活性が低下して、増殖活性が低下します。
つまり、イソプレノイドはRasなどの低分子Gタンパク質が細胞膜の脂質に接着するときに必要な生体分子で、それができないと活性化できないので、がん細胞の増殖が抑制されることになります。

図:低分子量Gタンパク質の一種のKRASは、GDP結合型が不活性型で(①)、上皮成長因子受容体などからの刺激を受けてGTP結合型となって活性化され(②)、エフェクタータンパク質に作用して情報を伝達し、細胞の増殖や転移を亢進し、アポトーシス(細胞死)に抵抗性になる(③)。HMG-CoAからメバロン酸経路で産生されるファルネシル基(④)はKRASが細胞膜の脂質に接着するときに必要で、これができないとKRASは活性化できない(⑤)。HMG-CoAからメバロン酸を合成するHMG-CoA還元酵素の阻害剤であるスタチンはファルネシル基の産生を阻害することによってKRASの活性化を阻害する(⑥)。
【脂溶性スタチンは乳がん治療後の再発率を低下させる】
前述のように、細胞内でメバロン酸経路は、コレステロールだけでなく細胞の増殖や機能に重要な働きを持つ多くの物質を産生し、その結果、メバロン酸経路の律速酵素であるHMG-CoA 還元酵素の阻害はがん治療への利用が検討されています。
しかし、スタチンによる抗腫瘍効果は薬剤の種類によって異なります。つまり、スタチンには水溶性のものと脂溶性のものがあり、がん細胞に対する効果を期待するには脂溶性のものを使う必要があります。
水溶性スタチンは肝臓細胞膜に存在する有機アニオン輸送担体によって細胞内に取り込まれるので、肝細胞に選択的に取り込まれます。一方、脂溶性スタチンは細胞膜透過性が良いので、あらゆる臓器・組織の細胞内へ移行し得えます。
つまり、肝臓におけるコレステロール産生を抑制する目的では、他の細胞に影響が少ない点で水溶性スタチンの方が良いのですが、がん細胞に取り込まれて、メバロン酸経路を阻害して増殖抑制効果を期待するには脂溶性のスタチンの方が良いのです。
スタチンの中で最も脂溶性の高いのがシンバスタチン(simvastatin)で、乳がんの患者さんがシンバスタチンを服用すると再発率が顕著に低下することが複数の臨床試験で報告されています。
例えば、1996年から2003年の間にデンマークの乳がん登録に報告されたステージIからIIIの浸潤性乳がんの患者18,769人を対象にしたデンマークの全国規模の前向きコホート研究の結果が報告されています。
(Statin Prescriptions and Breast Cancer Recurrence Risk: Danish Nationwide Prospective Cohort Study. J Natl Cancer Inst 2011;103:1461-1468)
この研究では、平均6.8年間追跡して3,419人の再発を認めています。6.8年間で18%の再発率です。
シンバスタチンを服用していた乳がんサバイバーはスタチンを服用していない群に比べて再発リスクが70%に減っていました。この値は、スタチンを服用しない場合に比べて、シンバスタチンを服用すると10年間の追跡で100人あたり10人の再発患者を減らすのに相当するという結果です。
この研究において、水溶性スタチンには再発予防効果は認められませんでした。
脂溶性スタチンが乳がんの予後の改善に有効であることはメタ解析でも指摘されています。
スタチンの使用と乳がんの転帰(再発や死亡)との関連を記述した14件の臨床研究をメタ解析した報告では、脂溶性スタチンを服用していた乳がん患者は、再発や死亡率が30%前後の低下が認められています。この研究でも、水溶性スタチンには再発や死亡を減少させる効果は認められませんでした。
(Impact of statin use on cancer recurrence and mortality in breast cancer: A systematic review and meta-analysis. Int J Cancer. 2016 Sep 15;139(6):1281-8.)
乳がんのホルモン療法の再発予防効果を高める効果も明らかになっています。
スタチンが乳がん細胞の増殖や進行を抑制することは、培養細胞を使ったin vitro実験や動物実験で多数報告されています。人間の研究では、スタチンが乳がんの発症率を低下することは示されていませんが、乳がんの再発率を低下させることは、前述のように多くの研究で支持されています。
HMG-CoA還元酵素は乳がんに発現し,予後関連因子であることが同定されています。したがって、HMG-CoA還元酵素阻害剤のスタチン(特に脂溶性のシンバスタチン)は、乳がん細胞の増殖を抑制する効果が期待できます。
【スタチンは膵臓がん患者の生存率を高める】
スタチンが膵臓がんを含めて多くのがんの死亡率を減らすことは多くの研究で示されています。膵臓がん患者の延命にも有効であることが示されています。
例えば、米国のがん登録データを使って7813人の高齢の膵臓がん患者を解析した結果が報告されています。
(The association of statin use after cancer diagnosis with survival in pancreatic cancer patients: a SEER-medicare analysis.PLoS One. 2015 Apr 1;10(4):e0121783.)
その結果、全ての膵臓がん患者を対象にした場合は、がん診断後のスタチン使用と生存率との間には関連は認めませんでした(ハザード比 = 0.94, 95%信頼区間: 0.89 - 1.01)。しかし、ステージIとIIの膵臓がん患者を対象にした場合は、がん診断後のスタチン使用は死亡率の21%の低下が認められました(ハザード比 = 0.79, 95% 信頼区間: 0.67 - 0.93)。腫瘍摘出手術を受けた膵臓がん患者でも、がん診断後のスタチン使用は同様の生存率の改善が認められました。
この論文の結論は「比較的早期あるいは切除可能が膵臓がん患者において、がん診断後のスタチン使用は生存率を高める」となっています。
この研究では、がん診断前にはスタチンを使用していなくても、がん診断後にスタチンを服用すると膵臓がん患者の生存率を高めることを示しています。ただし、統計的に有意な生存率の改善がみられたのはステージIかIIあるいは切除可能の比較的早期の膵臓がん患者さんでした。
ステージIII以上や切除できない局所進行がんでは、平均余命が半年から1年くらいという状況ですので、スタチンによる統計的有意な生存率改善を得るほどにはスタチンの抗腫瘍効果は強くないということかもしれません。
しかし、進行した膵臓がんでも生存期間を延ばす目的でスタチンを服用するメリットはあることが報告されています。膵臓がん患者における死亡率に対するスタチンとコレステロールの影響を検討した研究があります。(Influence of Statins and Cholesterol on Mortality Among Patients With Pancreatic Cancer. J Natl Cancer Inst. 2016 Dec 31;109(5))
この研究は2142名の膵管腺がん患者を対象に、薬局の記録を使って、スタチンの種類や投与期間や投与量を解析した後ろ向きコホート研究です。死亡率に対するシンバスタチン、ロバスタチン、アトルバスタチン、プラバスタチンおよびロスバスタチンの影響を評価しています。
その結果、いかなるスタチンの使用はいずれも死亡リスクの低下と関連していました。個々のスタチンを評価すると、シンバスタチン(ハザード比 = 0.87,95%信頼区間 = 0.77〜0.98)およびアトルバスタチン(ハザード比 = 0.58,95%信頼区間 = 0.46〜0.72)の死亡率の低下が認められました。
シンバスタチンもアトルバスタチンもともに脂溶性です。
コレステロールは死亡率と関連がなく、スタチンと生存との間の関係を媒介しませんでした。つまり、コレステロールレベルよりスタチンの使用が、膵臓がん患者の死亡リスクの低下と関連していました。スタチン類は、脂質に依存しない機構を介して生存を改善すると思われます。
スタチンが転移を伴う膵臓がん患者の生存期間を延ばす効果が2つの第III相試験のプール分析で示されています。
Statin treatment and outcomes of metastatic pancreatic cancer: a pooled analysis of two phase III studies.(スタチン治療と転移性膵臓がんの転帰:2つの第III相試験のプール分析)Clin Transl Oncol. 2019 Jun;21(6):810-816.
【要旨の抜粋】
背景:転移性膵臓がん患者の生存に対するスタチンの併用療法の影響を評価することを目的とした。
方法:2つの臨床試験(NCT01124786とNCT00844649)の匿名化された患者データのプール分析を実施した。患者サブセット(スタチンを投与した患者またはスタチンを投与しなかった患者)に応じた全生存期間および無増悪生存期間を、カプラン・マイヤー分析およびログランク検定により評価した。全生存期間および無増悪生存期間に潜在的に影響を及ぼすさまざまな要因を、単変量および多変量のCox回帰分析にて検討した。
結果:
この研究では、合計797人の膵臓がん患者が評価された。 156人の患者がスタチンを服用しており、641人がスタチンを服用していなかった。カプラン・マイヤー生存推定値を使用すると、スタチンを投与された患者は、投与されなかった患者と比較して、全生存期間および無増悪生存期間が統計的有意な延長を認めた(それぞれP = 0.008; P <0.001)。
全生存期間に影響を与える要因の多変量解析では、全生存期間の悪化に関連していたのは、パフォーマンス状態の悪化(P <0.001)、スタチン使用なし(P = 0.044)、複数の転移(P = 0.023)であった。
同様に、無増悪生存期間に影響を与える要因の多変量解析では、無増悪生存期間の悪化に関連していたのは、パフォーマンス状態の悪化(P <0.001)、ゲムシタビン化学療法(P = 0.015)、スタチン使用なし(P = 0.048)であった 。
スタチンの使用は全生存期間および無増悪生存期間の改善と関連していた(それぞれP = 0.005; P = 0.040)。
結論:スタチンの使用は、一次化学療法で治療された転移性膵臓がん患者の全生存率の向上と関連することが示された。このスタチンの潜在的な効果を確認するために前向き研究が必要である。
がん患者の死亡率を減少させるスタチンの効果は、乳がんや膵臓がん以外にも、大腸がん、肺がん、前立腺がん、卵巣がん、肝細胞がんなど多くのがんでも報告されています。
例えば、スタチン服用と肺がんの生存率に関して以下のような報告があります。
Effects of statin exposure and lung cancer survival: A meta-analysis of observational studies.(スタチン服用の効果と肺がんの生存:観察研究のメタ解析)Pharmacol Res. 2019 Mar;141:357-365.
【要旨】
スタチン服用は、いくつかのがんの生存率を改善することが報告されている。しかし、肺がん患者のスタチン服用と予後との関連を評価する研究の結果は一致していない。スタチン服用と肺がんの予後との関連性を調査した研究を検討した。主要評価項目は全生存期間であり、二次評価項目はがん特異的生存期間と無再発生存期間であった。これらの結果のハザード比と95%信頼区間を解析した。
99,297人のデータからなる13の研究が特定された。研究は、バイアスのリスクが低から中程度であるとランク付けされた。
メタ分析により、スタチン服用は全生存期間(ハザード比= 0.79、95%信頼区間: 0.72〜0.86)、がん特異的生存期間(ハザード比= 0.83、95%信頼区間: 0.77〜0.89)および無再発生存期間(ハザード比= 0.85、95%信頼区間: 0.81〜0.89)の改善と有意に関連していることが示された。
サブグループ分析では、全生存期間は、肺がんの診断後のスタチン使用者(ハザード比=0.68, 95% 信頼区間:0.51〜0.92)は、診断前の服用者(ハザード比= 0.86、95%信頼区間: 0.81〜0.90)および現在の使用者(ハザード比= 0.79、95%信頼区間: 0.62〜1.02)よりも改善が高かった。
さらに、スタチン使用者は、他のステージの患者よりもステージIV肺がん患者(ハザード比= 0.77、95%信頼区間: 0.74-0.79)でより多くの生存利益を得る可能性が認められた。
スタチン服用は、肺がん患者の生存率の大幅な改善と関連している。今後さらに、肺がん患者におけるスタチンの治療的役割をさらに実証するための研究が必要である。
以下のような報告もあります。
The effect of statins on survival in patients with stage IV lung cancer.(ステージ4の肺がん患者の生存におけるスタチンの効果)Lung Cancer. 2016 Sep;99:137-42.
【要旨】
目的:以前の研究では、特定の悪性腫瘍患者におけるスタチンの抗がん効果が示されている。しかし、スタチンが肺がん患者において死亡率の低下に効果があるかどうかは不明である。肺がんの診断前にスタチンを服用していた場合と服用していなかった場合のステージIV非小細胞肺がん患者の生存率を比較した。
方法:メディケアのがん登録のデータを使用して、2007年から2009年にかけてステージIV非小細胞肺がんと診断された65歳以上の5118人の患者を特定した。交絡因子を調整しながら、全生存率および肺がん関連生存率とスタチン使用の関連を検討した。
結果:全体として、患者の27%が肺がんの診断時にスタチンを服用していた。スタチン服用群での生存期間の中央値は7ヶ月であったが、スタチンを服用していな患者では4ヶ月であった(p <0.001)。ベースラインの患者特性、癌の特性、病期分類、化学療法の使用などの因子を調整したあとのハザード比を解析すると、スタチンの服用は全生存率(ハザード比=0.76、95%信頼区間:0.73-0.79)および肺がん特異的生存率(ハザード比=0.77、95%信頼区間:0.73 -0.81)の有意な改善を認めた。
結論:スタチンの使用は、ステージ4期の非小細胞肺がん患者の生存率を改善し、スタチンの潜在的な抗がん効果を示唆している。今後の研究では、作用機序を解明すると同時に、前向き臨床試験でスタチンの効果を検証する必要がある。
シンバスタチンが卵巣がんのがん幹細胞の性質を阻害して転移を抑制する効果が報告がされています。
Simvastatin interferes with cancer 'stem-cell' plasticity reducing metastasis in ovarian cancer.(シンバスタチンは、がんの「幹細胞」可塑性を妨げ、卵巣がんの転移を抑制する)Endocr Relat Cancer. 2018 Oct;25(10):821-836.
【要旨】
がん起始細胞(cancer-initiating cells)が持つ幹細胞様の細胞可塑性は、がん細胞の転移と進行の原因となっている。ここでは、親油性スタチンであるシンバスタチンが、婦人科悪性腫瘍の中で最も致命的な高悪性度漿液性卵巣がんのがん起始細胞の転移能を阻害するかどうかを検討した。
qPCR、免疫ブロット法、免疫組織化学を使用して、幹細胞性および上皮間葉細胞可塑性(epithelial-mesenchymal cell plasticity)に関与するタンパク質に対するシンバスタチンの作用を検討した。
腫瘍の増殖と転移に対するシンバスタチンの効果は、さまざまなモデル(例えば、スフェロイド形成および移動アッセイ、マトリゲル浸潤アッセイ、3D模倣モデル、およびがん異種移植腫瘍)を使用して評価された。
また、スタチン使用者と非使用者の生存結果を比較することにより、スタチンの臨床的利点を調査した。
これらの実験において、シンバスタチンが幹細胞性および上皮間葉細胞可塑性に関するマーカーの発現パターン(mRNAとタンパク質レベルの両方)を変更し、がん起始細胞の腫瘍塊形成を著しく阻害することを実証した。その結果、がん起始細胞は転移性が低下し、移植腫瘍の増大を抑制した。
シンバスタチンのこのような抗腫瘍作用のメカニズムには、メバロン酸合成依存的な機序でのHippo / YAP / RhoA経路の不活性化の関与が示唆された。
臨床の観点から、スタチン非使用者と比較して、スタチン使用者は生存率と生活の質において良好な結果が認められた。
現在の治療法の多くは高い費用の割に奏功率が低いという問題があり、経口または腹腔内投与のシンバスタチンの使用は、再発性の高悪性度漿液性卵巣がんの治療法として、費用対効果が高く、安全な代替手段を提供する。
【トコトリエノールはスタチンの抗腫瘍効果を増強する】
コレステロール合成やメバロン酸経路の阻害だけの目的であれば、スタチンの使用だけで目的を達成できるようにも思います。
しかし、これには問題もあります。スタチンでHMG-CoAの活性を阻害すると、HMG-CoAの発現を増やしたり、分解を阻止して、HMG-CoAの量を増やすメカニズムが作動するからです。
多くの酵素反応はフィードバック機序で制御されており、HMG-CoAの活性が阻害されると、その産生産物(コレステロールなど)の低下を感知して、細胞はHMG-CoAの量を増やすのです。
コレステロールは多くの生物学的過程で必須な働きを担っているので細胞内のコレステロール量が不足すると細胞機能に支障をきたします。しかし、コレステロールが過剰に合成されると細胞に毒性を示します。従って、細胞内のコレステロールのレベルを感知してコレステロール合成を調節する複雑な仕組みが存在します。
ビタミンEの一種のトコトリエノールがメバロン酸経路を阻害することが報告されています。
Tocotrienols potentiate lovastatin-mediated growth suppression in vitro and in vivo.(in vitroおよびin vivoの実験系において、トコトリエノールはロバスタチンによる増殖抑制を増強する)Exp Biol Med (Maywood). 2007 Apr;232(4):523-31.
【要旨】
3-ヒドロキシ-3-メチルグルタリル補酵素A(HMG-CoA)還元酵素は、メバロン酸経路における律速酵素であり、メバロン酸経路は増殖関連タンパク質の膜固定および生物学的機能のために必須の中間体を提供する。HMG-CoA還元酵素の競合阻害剤であるスタチンは、前臨床試験のレベルではがん細胞の増殖抑制活性を示すが、ヒトにおける臨床応用では、心血管疾患の予防に使用される用量では抗がん作用が認められず、その用量制限毒性によってがん治療への応用が妨げられている。
がん細胞ではHMG-CoA還元酵素の活性は亢進し制御異常な状態にあるが、イソプレノイドによる転写後の発現抑制に対する感受性は保持されている。したがって、このイソプレノイド媒介性の転写後発現抑制は、スタチンによるHMG-CoA還元酵素の阻害作用を増強する。したがって、イソプレノイドとロバスタチンの併用は、がん細胞のHMG-CoA還元酵素の活性を相乗的に抑制し、その結果、がん細胞の増殖も相乗的に抑制する。
イソプレノイドを含むビタミンEの異性体のd-ガンマ-トコトリエノール(d-gamma-tocotrienol)とd-デルタ-トコトリエノール(d-delta-tocotrienol)、およびロバスタチンはマウスの悪性黒色腫細胞B16の増殖を用量依存性に抑制し、その48時間培養の50%増殖阻害濃度は、それぞれ、20±3μM、14±3μM、1.5±0.4μMであった。
ロバスタチン(1μM)とd- ガンマ-トコトリエノール(5μM)の併用投与は細胞増殖を完全に阻止し、その増殖抑制作用はロバスタチン単独(12%)およびd-ガンマ-トコトリエノール単独(8%)によって個別に誘発された阻害の合計をはるかに超えた。
これら2つの薬剤の相乗効果は、ヒトDU145前立腺がん細胞およびヒトA549肺がん細胞においても示された。
C57BL6マウスに、ロバスタチン12.5mg/kg体重、d-デルタ-トコトリエノール62.5 mg/kg体重、または両方の薬剤の混合物を補足した食餌をB16細胞移植後22日間与えた。併用投与群のみが、コントロール群(薬物非投与群)に比べて有意に腫瘍縮小を認めた。
がん細胞のHMG-CoA還元酵素を転写後に抑制するイソプレノイドとの併用は、スタチンの有効投与量を低下させ、がんの化学予防や治療における新規のアプローチを提供し得る。
ビタミンE(vitamin E)は脂溶性ビタミンの1種です。ビタミンEは8種類の異性体から構成されています。 すなわちアルファ (α)、 ベータ (β)、ガンマ (γ)、 デルタ (δ)-tocopherols (トコフェロール)と α、 β、γ、δ-tocotrienols (トコトリエノール:T3)の8種類で、これらは全てビタミンEになります。
ビタミンEはクロマンという環式化合物に炭素数16個の側鎖が付くという構造です。 クロマンにつくメチル基(CH3)の位置によってα、 β、 γ、 δに分けられます。
トコフェロールは二重結合の無い飽和したフィチル(Phytyl)基という脂肪族側鎖が付いています。
一方、トコトリエノールは3個の二重結合をもつ側鎖で、この構造はファルネシル(Farnesyl)基というイソプレノイドになっています。

図:ビタミンEはトコフェロールとトコトリエノールの2種類があり、クロマン(Chromane)というの分子式C9H10Oの環式化合物に炭素数16個の側鎖が付くという構造を持つ。クロマンにつくメチル基(CH3)の位置によってアルファ (α)、 ベータ (β)、ガンマ (γ)、 デルタ (δ)に分けられる。トコフェロールは二重結合の無い飽和した側鎖で、トコトリエノールは3個の二重結合をもつ側鎖で、この構造はイソプレノイドになっている。
トコトリエノールはイソプレノイド構造を持つので、HMG-CoA還元酵素を阻害するのです。
メバロン酸経路を阻害するのはトコトリエノールの方で、トコフェロールにはそのような作用はありません。むしろトコトリエノールのメバロン酸経路阻害作用をトコフェロールは阻害するという報告があります。
したがって、メバロン酸経路阻害作用を目的にトコトリエノールを使用するときはトコフェロールの入っていないものを摂取することが大切です。(市販されているトコトリエノールのサプリメンにはトコフェロールが入っているものが多くあります)
シンバスタチンなどのスタチンを使ったらがん治療を試すとき、デルタ・トコトリエノールの併用は試してみる価値はあると思います。
トコトリエノールはがん細胞の増殖抑制や細胞死(アポトーシス)誘導作用があります。 α型とβ型に比較してγ-トコトリエノールとδ-トコトリエノールの2つが強い抗がん作用を有することが明らかになっています。
トコトリエノールはがん細胞の増殖や浸潤・転移や生存を促進する多様な因子をターゲットにして、これらを阻害するので、強力な抗腫瘍活性を発揮します。
デルタ・トコトリエノールの抗がん作用は臨床試験で確認されています。
手術を控えた膵臓がん患者に200mgから3200mgのδ-トコトリエノールを術前14日間投与してた臨床試験が報告されています。1日量400mg〜1600mgを14日間投与した膵臓がん患者のほとんどで、がん組織中のアポトーシスの増加が認められています。 つまり、1日量400mg〜1600mgのδ-トコトリエノールの服用は膵臓がん細胞を死滅させる可能性を示しています。
メトホルミンもHMG-CoA還元酵素の活性を阻害するので、メトホルミンとシンバスタチンは抗がん作用において相乗効果があります。
このような方法でメバロン酸経路を阻害すると体内でのCoQ10の産生が阻害されるので、CoQ10をサプリメントで補充することが推奨されます。
以上から、シンバスタチン+デルタ・トコトリエノール+メトホルミン+CoQ10の組み合わせは、副作用が少ないがん治療法として試してみる価値があります。特に、シンバスタチンとメトホルミンは安価で安全性の高い医薬品で、デルタ・トコトリエノールとCoQ10も副作用がほとんどないサプリメントです。
新刊紹介

| « 683)腫瘍循環... | 685)メトホル... » |



