がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
525)医療大麻とカンナビジオール(その2):抗精神病作用
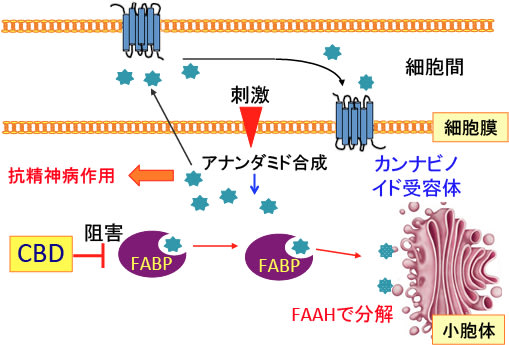
図:神経細胞間で刺激によってアナンダミドが合成され、細胞外に放出されて細胞膜のカンナビノイド受容体に結合して作用を発揮する。一方、細胞内では、アナンダミドは脂肪酸結合タンパク質(fatty acid-binding proteins:FABP)に結合して細胞内を運搬され小胞体の脂肪酸アミドハイドロラーゼ(fatty acid amide hydrolase:FAAH)で分解される。カンナビジオール(CBD)はFABPと結合して、FABPとアナンダミドの結合を阻害する作用がある。その結果、アナンダミドの濃度が高まる。アナンダミドは抗精神病作用を発揮するので、CBDはFABP働きを阻害する機序で抗精神病作用を発揮する。
525)医療大麻とカンナビジオール(その2):抗精神病作用
【大麻の有害性はアルコールやタバコよりも低い】
大麻にある程度の有害性があることは確かです。
しかし、大麻の有害性を議論するときの重要な視点は「有害性の程度」です。もし、大麻の有害性がタバコやアルコールより軽微であれば、有害性を理由に大麻を非合法化する根拠は無くなります。
実際のところ、多くの医学的証拠が、大麻の有害性はアルコールやタバコよりも極端に低いことを明らかにしています。
最近の報告で以下のような論文があります。
Comparative risk assessment of alcohol,tobacco, cannabis and other illicit drugs using the margin of exposure approach.(アルコール、タバコ、大麻およびその他の違法薬物の暴露マージンアプローチを用いた比較リスク評価)Sci. Rep. 5, 8126; DOI:10.1038/srep08126 (2015).
暴露マージン(Margin of Exposure: MOE)は暴露幅とも言います。
暴露幅とは、用量−反応評価の結果から導き出した無毒性量などの閾値(つまり、有害性が出てくる用量)と、通常の摂取量の比で示されます。
日常的に摂取している量の健康に対する悪影響の度合いです。
たとえば、通常の1日のアルコール摂取量が30グラムとして、体に有害に作用するアルコールの1日摂取量が60グラムだとすると、アルコールの暴露幅は2(60÷30)になります。実際のところ、多くの人が日常的に飲酒している量は健康被害が出る量に近いので、アルコールの暴露幅は1〜1.5程度です。
飲酒は日本酒換算で1〜2合程度であれば、血液循環を良くして循環器疾患を予防する効果など適度な飲酒は健康にプラスに作用するという見解もあります。しかし、飲酒量が多くなると肝臓などへの負担や発がん作用などによって有害と考えられています。
がんに関しては、アルコール摂取量と発がんリスクは用量依存的なので、アルコールは少量でも有害と考えられています。
この暴露幅の計算から、最も有害なのはアルコールであり、大麻の有害性はアルコールの100分の1よりもさらに低いと評価されています。
大麻に最も多く含まれるテトラヒドロカンナビノール(THC)の暴露マージン比は150程度です。THCの通常摂取量は10〜20mgです。THCの有害性を示す濃度は1000mg以上ということです。
大麻の場合は、カンナビジオール(CBD)がTHCの有害作用を軽減することが知られており、大麻の有害性はTHC単独よりもさらに低いと言えます。
ニコチンは暴露幅は7〜8程度ですが、タバコはタールの有害性が高いため1日1本でも有害性があるので、タバコの暴露マージンは1以下になると思われます。
つまり、大麻の有害性は、飲酒やタバコの数百分の1という計算になります。

図:有害性を示す摂取量と日常的に接収している量の比(暴露マージン)による有害性の評価を示す。アルコールは通常の飲酒量で多くは有害性を示す用量に達しており、極めて有害性が高い。ニコチンは暴露マージン比は7〜8程度であるが、タバコはタールの毒性によって1日1本でも有害性があるので、タバコの暴露マージンは1以下になると思われる。大麻に含まれるテトラヒドロカンナビノール(THC)の暴露マージンは100以上で、有害性は低い。大麻そのものであれば、暴露マージンはもっと大きい。
出典:Sci Rep. 2015; 5: 8126.
Comparative risk assessment of alcohol, tobacco, cannabis and other illicit drugs using the margin of exposure approach
英国の薬物依存の専門家であるデビッド・ナット(David Nutt)教授の2010年のランセットの論文では、多基準意思決定分析(因子の影響と重要性の加重合計に基づく手法)で薬物の有害性を評価しています。
この論文では、有害性の総合評価はアルコールが最も高く(総合有害スコアは72)、2番目がヘロイン(総合有害スコア55)、3番目がクラックコカイン(総合有害スコア54)となっています。
アルコールは家庭内暴力、児童虐待や交通事故の主要な原因となっており、この論文では、社会に対しても薬物利用者に対してもアルコールが最も有害と結論されています。(484話参照)
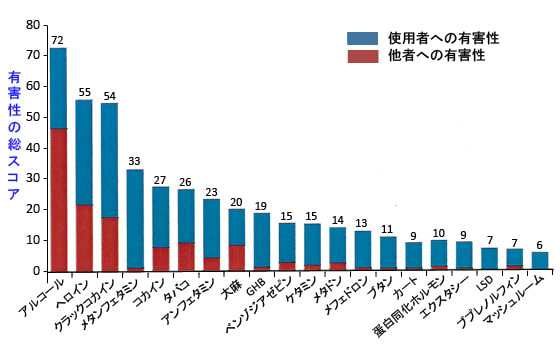
図:20種類の薬物の使用者と他者(社会)への有害性の多基準意志決定分析によるスコア化による評価。スコアが高いものほど有害性が高い。アルコールとタバコは大麻より有害性が高い。(Lancet 2010; 376: 1558-65)
【大麻は暴力を減らす】
アンドリュー・ワイル(Andrew Weil)博士は、病気の自然療法や代替療法の分野では最も影響力の強い研究者です。世界各地の伝統医療に造詣が深く、薬用植物に関しては世界的権威です。
ワイル博士は、1968年にボストン大学医学部で行った大麻吸引の臨床実験のデータをもとに、アメリカの政府機関や州議会や世界保健機関(WHO)などで大麻の医学的な効能について証言や助言を行っています。
このワイル博士が、昭和54年(1979年)の京都地方裁判所での大麻取締法違反事件で証言しています。
その証言の中で、「アルコールは人を攻撃的にさせ暴力的犯罪を引き起こすが、大麻は人々の攻撃性を低下させる」、「大麻を大量に摂取しても急性中毒症状は起こらないし、大麻の過剰摂取で死んだ人はいない」、「ヘロインやモルヒネやアルコールは身体依存が見られるが、大麻には身体依存は生じない」、「普通の医薬品と比較しても大麻の安全性は高い」、「大麻はアルコールやタバコより安全で、しかも多くの病気に対して効果がある」と証言しています。
ワイル博士が35年以上前に発言した事はその後の多くの研究で確認されています。
1990年から2006年までのアメリカ合衆国の50州全ての犯罪率を追跡調査し、医療用大麻を合法化した州での犯罪率の変化を検討した報告があります。その結果、医療大麻法の施行が、殺人や強盗や暴行などの暴力犯罪を増やすことはなく、むしろ、殺人と暴行の犯罪率の減少に関係している可能性が指摘されています。飲酒は暴力犯罪を増やしますが、大麻にはそのようなリスクは無いと言えます。
以下のような報告もあります。
Couples' marijuana use is inversely related to their intimate partner violence over the first 9 years of marriage.(結婚後9年間以上の調査で、夫婦のマリファナ使用は配偶者間の暴力と逆相関する)Psychol Addict Behav. 2014 Sep;28(3):734-42.
米国からの報告です。
intimate partner violence (IPV)は「親密なパートナーの暴力」という意味で、配偶者や恋人の間での暴力です。
この論文では634組の夫婦を対象に、結婚後9年間以上の間の夫婦間の暴力について調査しています。
その結果、夫と妻のマリファナ使用の回数が多いほど、夫による暴力が少ないという結果でした。
夫のマリファナ使用は妻による暴力を減らすこともこの調査で明らかになっています。
夫婦共にマリファナを使用している場合が、夫婦間の暴力が最も少ないという結果でした。
つまり、夫婦がマリファナを吸っていると、家庭内暴力は減るということです。マリファナは人を幸福にし、人の攻撃性を低下させるからだと言えます。
オランダとドイツの研究グループからの調査でも、大麻は攻撃性を弱めることが報告されています。以下のような報告があります。
Subjective aggression during alcohol and cannabis intoxication before and after aggression exposure.(攻撃性刺激の前後におけるアルコールと大麻の使用中の主観的攻撃性)Psychopharmacology. 233: 3331-3340, 2016
Intoxicationは酔っている状態です。つまり、飲酒やマリファナ(大麻)を使用してそれらの薬物の影響が出ている状態(酔っている、ハイになっている状態)です。
このような状況で、人を怒らせるようなことをするとどうなるかという研究です。
身体的な暴力や言葉での暴力に対する反応、コンピューターを使ったマネーゲームのような試験での反応を評価して攻撃性を測定しています。
結論は、アルコールで酔っているときは人をより怒らせ(攻撃性を高める)、マリファナでハイになっているときは、怒りは低下する(攻撃性は弱まる)ということです。
【大麻は統合失調症の症状を緩和する】
大麻の長期的な使用が統合失調症などの精神病の発症リスクを高めるという報告があります。
しかし、最近の報告から、現在のコンセンサスをまとめると以下のようになります。
1)大麻が統合失調症の発症原因となる証拠は現時点では無い。
2)統合失調症の人、あるいは統合失調症になる素因を持っている人(一親等の親族が統合失調症)は大麻使用は有害である。症状の発症を促進し増悪する可能性がある。
3)一方、大麻成分のカンナビジオール(CBD)には抗精神病作用が指摘されており、CBD含有量の多い医療大麻が統合失調症などの精神病に治療に有効という報告がある。(483話参照)
カンナビジオールの抗精神病作用が報告されています。以下のような総説論文があります。2016年11月の論文です。
Cannabidiol as a Potential New Type of an Antipsychotic. A Critical Review of the Evidence.(潜在的な新しいタイプの抗精神病薬としてのカンナビジオール:エビデンスの批評的レビュー。)Front Pharmacol. 2016 Nov 8;7:422. eCollection 2016.
【論文の要約】
抗精神病薬の多くは、有効性が低く、強い副作用を発現する。
したがって、現在使用されている薬とは異なるメカニズムで作用し、有効性が高く、さらに副作用の少ない抗精神病薬が求められている。
このような目的において、内因性カンナビノイド・システムは新規な抗精神病薬の開発のターゲットとして注目されている。
大麻の長期的な使用が統合失調症の発症リスクを高めるという報告は多い。
しかし、統合失調症のリスク要因として大麻の関与に関しては、実際のところコンセンサスは得られていない。
大麻が精神病の発症を促進する成分としてTHCが原因と考えられている。
しかし、THCと同様にCB1に作用する内因性カンナビノイドのアナンダミドが統合失調症の症状を軽減するという報告がある。
一方、カンナビジオールは抗精神病作用報告されており、その作用機序としてアナンダミドの血中濃度の増加が報告されている。
ネズミやアカゲザルの実験では、CBDには抗精神病作用が認められている。
統合失調症治療薬 アミスルプリド(Amisulpride)と比較した臨床試験が行われている。
ランダム化二重盲検試験で、CBDは既存の統合失調症治療薬 アミスルプリド(Amisulpride)と同程度の有効性を示し、しかも副作用はプラセボ群と同程度に極めて低かった。
CBDの効果はアンンダミドの血中レベルと相関していた。つまり、CBDの抗精神病作用はアナンダミドの血中濃度を増やすことによって発現した。
しかし、その他の作用メカニズムも報告されており、CBDの抗精神病作用のメカニズムに関しては、さらに研究が必要である。
人間は大麻を数千年前から利用しており、薬用としては3500年以上前から使用しています。
大麻の主な薬効成分であるΔ9-THCとカンナビジオールは1940年代から知られており、このころ大麻の精神活性作用がΔ9-THCであることが同定されています。
Δ9-THCとカンナビジオールの化学構造は1963〜64年に決定されています。
1990年代にカンナビノイド受容体のCB1とCB2と、その内因性リガンドのアナンダミドと2-アラキドノイル・グリセロールが発見され、内因性カンナビノイド・システムの存在が明らかにされました。
様々な精神疾患に内因性カンナビノイド・システムの異常が想定され、内因性カンナビノイド・システムに作用する薬の精神疾患に対する効果が検討されています。
統合失調症の症状には陽性症状と陰性症状と認知障害の3つがあります。
「陽性症状」は「本来、心の中に無いものが存在する」症状で、幻覚・幻聴・妄想・思考の混乱・異常行動などです。
「陰性症状」は「本来、心の中にあるはずのものが存在しない」症状で、感情や意欲の減退・社会的引きこもり・集中力の低下・無関心などです。
「認知障害」は記憶や注意、思考、判断などの脳の高次機能の低下です。
これらの症状に非特異的な不安症状が伴います。
症例報告やいくつかの臨床試験が実施されており、「カンビジオールは統合失調症における症状の改善に有効で、副作用も少ない」という結果が得られています。
最初の臨床報告はZuardiらの報告(1995年)で、4週間のCBDの投与(〜1500mg/日)で精神病症状の改善が認められました。
Zuardiらはその10年後(2006年)に3例の症例を報告しており、この研究では30日以上にわたって服用量を段階的に増やしています。
3例中1例において、陽性症状と陰性症状の軽度の改善を認めました。副作用は全く認めませんでした。
最初のランダム化二重盲検試験は2012年に報告されています(Leweke et al.)。
42例の統合失調症患者を対象に4週間の試験で、二重盲検でカンナビジオール (600–800 mg/day) か amisulpride (600–800 mg/day)の投与を受けました。
両方の薬は、統合失調症の陽性症状と陰性症状を顕著に改善し、CBDの効果はamisulprideに匹敵しました。しかし、重要な点は、CBDの副作用はamisulprideと比べて極めて少なかったという点です。
CBDはプロラクチン産生や体重増加や錐体外路症状を引き起こしませんでした。
症状の改善はアナンダミドの血中濃度の上昇と関連しており、CBDは内因性カンナビノイドのアナンダミドの量を増やすことによって抗精神病作用を発揮すると考えられています。
【カンビジオールの抗精神病作用の作用機序】
カンビジオールの抗精神病作用の作用機序に関しては、今までに多くの作用メカニズムが報告されていますが、まだ十分に明らかになっていません。
カンナビジオールとΔ9-THCは大麻の最も重要な植物カンナビノイドです。
そこで、この両者が同じ分子ターゲット、すなわちカンナビノイド受容体に作用すると最初は考えられていました。
しかしながら、カンナビジオールはCB1受容体とCB2受容体には結合活性を示さなかったのです。むしろ、合成カンナビノイドのWIN-55212とCP-55940のCB1受容体結合を阻害するアンタゴニストとしての作用を示しました。
カンナビジオールはCB1受容体の細胞内移行を阻害したので、観察されたアンタゴニスト活性は、リガンドの結合阻害ではなく、受容体の細胞内移行の阻害である可能性が示唆されました。
カンナビジオールはCB1受容体の活性部位に作用する競合的阻害剤ではなく、非競合的な他の作用でCB1受容体の働きを阻害しています。
カンナビジオールの抗精神病作用は血中のアナンダミドの上昇と有意な関連が認められており、カンナビジオールがアナンダミドの分解酵素の脂肪酸アミドハイドロラーゼ(fatty acid amide hydrolase: FAAH)の活性を阻害することによって抗精神病作用を発揮する可能性が報告されています。FAAHの阻害はアナンダミドだけでなく、他の脂肪酸エタノールアミド(palmitoylethanolamide や oleoylethanolamide)の分解も阻害します。
In vitroの実験では、マウスの神経芽細胞腫細胞(N18TG2)の細胞膜試料、マウスの脳のミクロゾーム、ラットの脳の細胞膜において、カンナビジオールはFAAHを阻害しました。
さらに、カンナビジオールはアナンダミドのトランスポーターを阻害し、好塩基球系の白血病細胞(RBL-2H3)によるアナンダミドの取込みを阻害しました。
FAAH-like anandamide transporter (FLAT)というアナンダミドのトランスポーターが同定されています。
FLATはFaah-1遺伝子のスプライシング変異によるタンパク質であるため、カンナビジオールはFAAHとFLATの両方のタンパク質の同じような部位に結合して、両方のタンパク質を阻害し、アナンダミドの分解と細胞内取り込みを阻害している可能性があります。
しかしながら、最近の研究では、カンナビジオールはヒトのFAAH酵素を阻害しないことが報告されています(ラットやマウスの酵素は阻害するがヒトの酵素は阻害しない)。しかし、カンナビジオールは、アンナダミドや他のN-アセチルエタノールアミンの細胞内輸送体として作用する脂肪酸結合タンパク質(fatty acid-binding proteins)と結合することが報告されています。
Elmesらは、カンナビジオールは脂肪酸結合タンパク質の結合においてアナンダミドと競合することにおいて、人間においてアナンダミドの分解を減少させると結論づけています。
脂肪酸結合タンパク質がカンナビジオールによって占拠されれば、アナンダミドは小胞体に存在するFAAH(脂肪酸アミドハイドロラーゼ)に輸送されないので、分解されずに、血中のアナンダミドの濃度は上昇するというメカニズムです。
一方、カンナビジオールは5-HT1A受容体を介したセロトニン神経伝達を促進する可能性があります。
カンナビジオールはperoxisome proliferator-activated receptor gamma (PPARγ) ペルオキシソーム増殖因子活性化受容体γに結合します。
PPARγは脂質やグルコースの代謝や炎症反応に関連する遺伝子の発現を制御いますので、PPARγの活性化を介して様々な作用を発揮する可能性が指摘されています。
カンナビジオールがtransient receptor potential vanilloid type 1 receptors (TRPV1Rs)を活性化して抗精神病作用を示すことが報告されています。
結局のところ、カンナビジオールの抗精神病作用のメカニズムに関しては、候補に上がっている受容体やイオンチャネルや酵素は多数ありますが、結論は出ていないという状況です。
統合失調症の様々な動物実験モデルを用いて、カンナビジオールの抗精神病作用が検討されています。
実験結果には部分的に一致しない部分もありますが、カンナビジオール治療はPPI(prepulse inhibition)の障害を軽減し、齧歯類やアカゲザルにおける社会的相互作用行動および認知を改善することが示されています。
注:prepulse inhibition(PPI):先に弱い刺激を加えることで、突然与えられた強い刺激に対する驚愕反応が抑制される現象のこと。情報処理における障害の指標と考えられ、PPIの減少は統合失調症をはじめとする精神疾患と関連することが知られている。
さらに、個別の症例検討やランダム化二重盲検試験の結果から、カンナビジオールの抗精神病作用を示され、副作用も通常の抗精神薬に比べて軽微であることが示されています。
さらに、追加投薬(add-on medication)としてカンナビジオールの有効性を検討していた最近の臨床試験では、まだ論文に発表されていませんが、有望な結果が示されています。
これらの研究結果を確かめるためには、長期の効果や安全性について、より大規模な臨床試験がさらに必要です。
薬理学的な作用機序に関してはまだ不明な点も多く残されていますが、カンナビジオールは今までの薬とは異なる作用機序で統合失調症に対する抗精神病薬としての薬効を発揮し、しかも副作用が少ないという特徴を有しています。
カンナビジオールを投与された統合失調症の患者におけるアナンダミドのレベルの上昇と精神病症状の減少との間の関連から、カンナビジオールが内因性カンナビノイドのアナンダミドを介するメカニズムで抗精神病作用を発揮する可能性が示唆されています。
【カンナビジオールは薬物依存を抑制する】
人間を含めて動物は「気持ちがよい」とか「快感」を求めることが行動の重要な動機になります。
快感を呼び起こす脳内の仕組みとして「脳内報酬系」が知られています。
脳内報酬系は、人や動物の脳において、欲求が満たされたとき、あるいは満たされることが分かったときに活性化し、その個体に快感の感覚を与える神経系です。
腹側被蓋野から側坐核、および、前頭前野などに投射されているA10神経系(中脳皮質ドーパミン作動性神経系)と呼ばれる神経系が脳の快楽を誘導する「脳内報酬系」のメインの経路となっています(図)。

図:中脳の腹側被蓋野にはA10細胞集団と呼ばれるドーパミン作動性ニューロン(神経伝達物質としてドーパミンを放出する神経細胞)が多く存在する。側坐核は快楽中枢の一つ(報酬系)に属する神経核で、腹側被蓋野のドパミン投射を受け、前頭前野に投射して快感を感じる。この神経経路は脳内報酬系と呼ばれている。
A10神経系で主要な役割を果たす神経伝達物質がドーパミンです。ドーパミンはアミノ酸のチロシンから作られるアミンの一種で、人間の脳機能を活発化させ、快感を作り出し、意欲的な活動を作り出す神経伝達物質です。
A10神経系が刺激されると、ドーパミンが放出され、脳内に心地良い感情が生ずると考えられています。
ラットの脳のある部分に電極を差し込み、レバーを押すと脳に電流が流れるような仕組みを作って実験すると、ある部位に電極があると、ラットは猛烈なスピードでレバーを押すことが見つかり、この電極が刺激した脳内の部位が「快楽の中枢」と考えられました。
このような実験から、脳内に非常に強い快感を呼び起こす仕組みがあることが明らかになり、これが脳内報酬系の発見となりました。

図:ラットの脳に電極を埋め込んで、ラットが自分でレバーを押すと電気刺激が起こって電極のある部位の脳を刺激する装置を使った実験を脳内自己刺激という。電極が脳内報酬系を刺激する部位に電極があるとラットはレバーを押し続ける。特に、腹側被蓋野と側坐核を結ぶ内側前脳束に電極を埋め込むと、ラットは猛烈な勢いでレバーを押すようになる。
この脳内報酬系システムは、正常な快感(食事やセックスなどによる)とともに、麻薬や覚せい剤のような薬物による快感や、そのような薬物への依存の形成にも関わることが知られています。
脳内報酬系においてドーパミン放出を促進し快感を生じると、それが条件付け刺激になって依存症や中毒という状態になります。
コカインのような覚せい剤やモルヒネなどの麻薬のように依存性をもつ物質は、ドーパミン神経系(脳内報酬系)を賦活します。
脳内報酬系を活性化するメカニズムは薬によって異なります。
GABA(γアミノ酪酸)作動性ニューロンは脳内報酬系のドーパミンの放出を抑制していますが、モルヒネはGABA作動性ニューロンからのGABAの放出を抑制してドーパミンの産生を増やします。GABA作動性ニューロンを抑制すると中脳腹側被蓋野から出ているA10神経のドーパミン分泌が促進されて快感が増強することになります。
アルコールもGABA神経を抑制してドーパミンの放出を促進します。
ニコチンは興奮性伝達物質のグルタミン酸の腹側被蓋核への分泌を促進してドーパミンの放出を増やします。
このような依存性のある薬物は連用すると、薬剤耐性によって同じ量を摂取しても快感の度合いが次第に小さくなります。そのため、快感を得るためにさらに摂取量を増やすようになります。
さらに、その薬物が入ってこなくなると、ドーパミン神経系が低下し、不安症状やイライラ感などの不快な気分が生じます。これが禁断症状(離脱症状)です。
繰り返し摂取したい欲求を惹起する作用は強化効果や報酬効果といい、依存性薬物や嗜好性の強い食品にも認められます。
油や砂糖などの甘味はネズミの実験でも強化効果が認められています。つまり、「甘味は中毒(依存性)になる」ということは脳内報酬系の活性化という点から証明されています。ネズミの実験では、甘味の強化効果(報酬効果)はコカインより強いことが報告されています。
そこで、報酬系を抑制する薬は、薬物中毒だけでなく、飽食による肥満や生活習慣病の治療に有効という考えで、報酬系を抑制する薬も開発されています。しかし、このような薬はうつ症状や自殺企図を増やす副作用があって実用化は困難なようです。
人間が快感を得る仕組みを抑制することは生きている意味が無いということです。
報酬効果というのは積極的に行動したくなるモチベーションを与えるので、この報酬効果を阻害すると何もやる気が無くなります。
大麻(マリファナ)が多幸感を引き起こすのは報酬系を活性化するからです。大麻に含まれるΔ9-テトラヒドロカンナビノール(THC)が作用するカンナビノイド受容体のCB1はBAGA作動性ニューロンからのGABA放出を抑制して報酬系のドーパミンの放出を増やします。モルヒネやアルコールと似た作用機序です。
THCが脳内報酬系のドーパミンの放出を増やす作用があるので、大麻は依存性を引き起こす可能性があります。
一方、精神作用のないカンナビジオール(CBD)には依存性薬物の報酬効果を減らす作用が知られています。
例えば、CBDがニコチン依存を抑制する効果が報告されています。次のような報告があります。
Cannabidiol reduces cigarette consumption in tobacco smokers: Preliminary findings. (カンナビジオールはタバコ喫煙者のタバコの消費量を減らす:予備調査の結果)Addictive Behaviors 38:2433–2436, 2013年
【要旨】
近年、ニコチン依存における内因性カンナビノイドシステムの関与が指摘されるようになった。
禁煙の意志のある喫煙者を対象に、禁煙におけるカンナビジオール摂取の効果を検討するために、予備的な無作為化二重盲検プラセボ対照試験を実施した。
24名の喫煙者を無作為に2群に分け、カンナビジオールの吸入群とプラセボ(偽薬)の吸入群に分け、喫煙したくなったら吸入をするようにという指示で1週間の検討を行った。
プラセボ群では喫煙したタバコの量に変化は無かった。
一方、CDBを吸入した群では喫煙したタバコの量が40%程度の減少を認めた。このようなCBDによる禁煙効果はCBD吸入終了後のフォローアップ時にも維持された。
これらの小規模な臨床試験による予備的な研究結果は、ニコチン依存の治療にけるCBDの有用性を示唆し、さらに大規模な臨床試験を行う価値があることを示している。
被験者は全て女性で、1日10本以上の喫煙をし、禁煙したいという意志のある人です。タバコを吸いたいと思った時にエアゾルでCBDを吸入します。プラセボ群ではタバコの数は変わらなかったのに、CBDを吸った群ではタバコの本数が40%減少したという結果でした。
CBDがモルヒネ依存を抑制するという報告もあります。
Cannabidiol inhibits the reward-facilitating effect of morphine: involvement of 5-HT1A receptors in the dorsal raphe nucleus.(カンナビジオールはモルヒネの報酬系亢進作用を阻害する:背側縫線核における5-HT1A受容体の関与)Addict Biol. 18(2): 286-96, 2013 年
【要旨】
カンナビジオールは大麻草に含まれる精神作用を持たない物質で、ネズミの実験では様々な中枢神経系に対する作用を示す。
ネズミにおけるヘロイン誘発性のヘロイン探索行動の再発をカンナビジオールが抑制することが示されている。
しかしながら、脳刺激報酬および乱用薬物の報酬促進効果に及ぼすカンナビジオールの影響はまだ検討されていない。
そこで、本研究では、脳内自己刺激(ICSS)法を用いて、脳の報酬系機能とモルヒネやコカインによる報酬系促進効果によるカンナビジオールの作用を調べた。
ラットの内側前脳束(MFB)に刺激電極を挿入し、背側縫線核にガイドカニューレ(マイクロインジェクション装置)を挿入し、電気脳刺激に応答するように訓練した。
低用量のカンナビジオールは脳刺激の補強効果に影響を与えなかったが、高用量のカンナビジオールは内側前脳束(MFB)における脳内自己刺激(ICSS)に必要な閾値周波数を顕著に高めた。
コカインとモルヒネは脳内自己刺激の閾値を低下させた。カンナビジオールはモルヒネの報酬系亢進作用を阻害したが、コカインによる報酬系亢進作用は抑制しなかった。
選択的5-HT1A受容体アンタゴニストのWAY-100635を背側縫線核に注入する前処置を行うと、この作用(カンナビジオールによるモルヒネの報酬系亢進作用の阻害作用)は阻止された。
カンナビジオールはどの用量でも脳内自己刺激試験において強化作用を示さないが、モルヒネの報酬系促進作用を抑制する作用があることが本研究で示された。この作用は背側縫線核における5-HT1A受容体の刺激によることが示された。
これらの結果は、脳内報酬系に対するモルヒネの亢進作用をカンナビジオールが阻止する作用を有し、オピオイドの依存を軽減する目的で臨床使用できる可能性を示唆している。
脳内自己刺激とは、ラットがレバーを押すと、脳内の特定の領域に電気が流れる実験です。ラットの実験で、脳内報酬系の神経系に電極を埋め込んで電気刺激をすると、ラットは盛んにレバーを押して電気刺激を求めたことから、この神経系が活性化すると快感を感じることが発見されました。
電極が腹側被蓋野と側坐核を結ぶ神経線維である内側前脳束を刺激したとき、
ラットのレバー押し行動が非常に亢進されます。
この論文の実験でも、内側前脳束に電極を挿入して報酬系を自己刺激する実験系でモルヒネやカンナビジオールの効果を検討しています。
モルヒネ自身に報酬系を刺激する作用があるので、モルヒネを投与すると脳内自己刺激の閾値が低下します(ラットは少ないレバー押しで十分に満足する)。このようなモルヒネによる脳内報酬系の亢進作用をカンナビジオールが抑制し、そのメカニズムとして背側縫線核のセレトニン受容体の5-HT1A受容体をカンナビジオールが活性化するためというメカニズムを報告しています。
カンナビジオールには5-HT1Aの作動薬としての作用があり、この作用がモルヒネの報酬系抑制作用に関与しているという報告です。
【大麻は脳内報酬系への作用が弱い】
Δ9-テトラヒドロカンナビノール(THC)の精神作用(陶酔感や多幸感など)はCB1受容体を介する作用です。THC単独の製剤より大麻そのものの方が効果が高く、副作用の出現も少ないことが知られています。
その一つの理由がカンナビジオール(CBD)がCB1とTHCの結合を阻害するアンタゴニスト作用を持つことや、セロトニン受容体の5-HT1Aのアゴニストとして作用する機序などが報告されています。
モルヒネもTHCもGABAを放出している神経からのGABAの放出を抑制してドーパミンの産生を増やします。したがって、大麻もモルヒネも同様な機序で脳内報酬系のドーパミン放出を高めて、快感を得ています。
しかし、モルヒネに比べて大麻による脳内報酬系の活性化作用は弱いと言われています。その理由はまだ不明ですが、一つのメカニズムとしてカンナビジオール(CBD)がTHCによる報酬系の活性化を抑制している可能性が指摘されています。CBDがオピオイドやコカインや覚醒剤などの依存の治療に効果があるという報告もあります。
前述のラットの実験では、モルヒネによる脳内報酬系の亢進作用をCBDが抑制し、そのメカニズムとして背側縫線核のセレトニン受容体の5-HT1A受容体をカンナビジオールが活性化するためというメカニズムが報告されています。CBDには5-HT1Aの作動薬としての作用があり、この作用がモルヒネの報酬系抑制作用に関与しているという機序です。
1994年に国立薬物乱用研究所(National Institute of Drug Abuse)のジャック・ヘニングフィールド(Jack Henningfield)博士とカリフォルニア大学のニール・ベノウィッツ(Neal Benowitz)博士がアルコール、ニコチン、コカイン、ヘロイン、カフェインの5つの物質とマリファナを比較した際、離脱症状、耐性、依存性という点においてマリファナは最も低いという結果になりました。
依存性(薬の使用を止められない状態になること)の強さは、強い方からニコチン、ヘロイン、コカイン、アルコール、カフェイン、マリファナの順番です。
離脱症状(連用している薬物を完全に断った時に禁断症状が現れることで、身体依存を意味する)もこれらの中でマリファナが最も弱く、カフェインよりも離脱症状は弱いと薬物乱用の専門家は評価しています。
つまり、大麻は酒やタバコやコーヒーより中毒になりにくいことは医学的に証明されているのです。
大麻はTHCによる脳内報酬系の活性化による多幸感が得られ、CBDなど他の成分によって依存が起こらないようブレーキをかけているような感じです。このような複数の成分による相互作用によって脳内報酬系への活性化作用が適度に制御されていることが大麻に依存性が低いことの理由の一つと言えそうです。
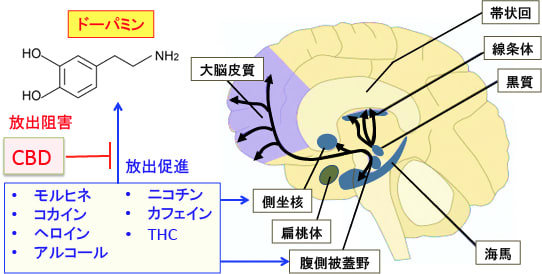
図:中脳の腹側被蓋野にはドーパミン作動性ニューロン(神経伝達物質としてドーパミンを放出する神経細胞)が多く存在する。側坐核は快楽中枢の一つで、腹側被蓋野のドーパミン投射を受け、大脳皮質の前頭前野に投射して快感を感じる。この神経経路は脳内報酬系と呼ばれている。モルヒネ、コカイン、ヘロイン、アルコール、ニコチン、カフェイン、THC(テトラヒドロカンナビノール)などの依存性を生じる薬物は幾つかのメカニズムで脳内報酬系のドーパミン放出を増強して快感を高めるので、依存性が成立しやすくなる。大麻成分のカンナビジオール(CBD)は報酬系のドーパミン放出を抑制することによって薬物依存を抑制する作用が報告されている。大麻(マリファナ)が他の依存性薬物より依存性が軽いのは、THCの報酬系増強作用をCBDが抑制している可能性が指摘されている。
【日本人は大麻に関して間違った情報で洗脳されている】
1月23日(月)の午後9時から生放送
のBSスカパーの「BAZOOKA!!!」で『マイノリティーの主張~大麻編~』に大麻肯定派の一人として、練マザファッカーのラッパーのD.O氏とNPO法人「医療大麻を考える会代表」の前田耕一氏と一緒に番組に出演しました。
そこで、街頭インタビューのビデオがあり、大麻は「中毒性がある」「暴力を振るう」「幻覚を見る」「体を蝕む」など、多くの人が医学的に間違った情報で洗脳されている日本の状況が示されました。
「大麻に関して医学的に誤った情報を流し、国民を洗脳している厚生労働省、恐るべし」という実感を持ちました。
医者や研究者の中にも、医療大麻についてネガティブな意見を述べている人はたくさんいます。その意見を聞くと、自分が洗脳されていることに気がついていないからだと最近は思っています。
大麻関係の医学論文を多数読めば、「医療大麻は必要ない」「娯楽用も医療用も同じ」というようなピントの外れた意見は出て来ないはずです。生半可な知識で断定的に意見を述べていることに対して、「もっと勉強してから意見を述べろ」と思っています。
| « 524)医療大麻... | 526)ジクロロ... » |




