がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
559)がん細胞のATPを枯渇する方法(その2):ドキシサイクリンと高濃度ビタミンC点滴
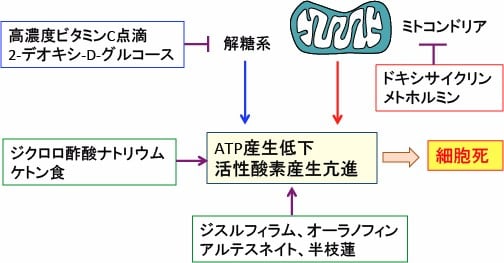
図:細胞質での解糖系とミトコンドリアでの酸素呼吸(酸化的リン酸化)を同時に阻害すれば、エネルギー(ATP)が枯渇して細胞は死滅する。解糖系阻害の方法として高濃度ビタミンC点滴や2-デオキシグルコースがある。ミトコンドリアでのエネルギー阻害にはメトホルミンやドキシサイクリンがある。さらに、酸化ストレスを高める方法としてジクロロ酢酸ナトリウム、ケトン食、ジスルフィアム、オーラノフィン、アルテスネイト、半枝蓮などの併用も有効。これらを組み合せることによってがん細胞に選択的を死滅できる。
559)がん細胞のATPを枯渇する方法(その2):ドキシサイクリンと高濃度ビタミンC点滴
【ミトコンドリアは元は細菌だった】
ミトコンドリアは赤血球以外の全ての細胞に存在する細胞小器官です。1個の細胞当たり平均で300~400個のミトコンドリアが存在します。肝臓や腎臓や筋肉や脳など代謝が活発な細胞には数千個のミトコンドリアが存在し、細胞質の40%程度を占めています。全部で体重の約10%を占めると言われています。
真核細胞のミトコンドリアは好気性細菌のαプロテオバクテリアが原始真核細胞に寄生したものという「細胞内共生説」が定説になっています。
まだ酸素が無い太古の地球に生きていた生物は解糖系のみでエネルギーを得ていました。ところが、海中に発生した藻類が光合成によって吐き出す酸素が大気中に増えていくと、酸素の無い環境で生きていた生物は酸化力の強い酸素に触れることでダメージを受けるようになります。
そのためこの時期には原始真核生物の多くが絶滅し、あるいは酸素の影響を受けることのない深海などに移動していきました。
このような状況で誕生したのが、酸素を使ってATPを生成する好気性細菌です。
そして、約20億年前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。
大気中に増える酸素による悪影響に苦しんでいた嫌気性の原始真核生物にとって、酸素を使ってATPを作り出す好気性細菌との共生は好都合でした。
好気性細菌は生体にダメージを与える酸素をグルコースに結合させ、二酸化炭素と水に分解し、さらにその過程でATPを大量に生成することができるからです。ミトコンドリアは私たちの体を働かせるために必要なATPを1日に数十kg産生しています(557話参照)。
この細胞内共生によって酸素が豊富な環境で生物が急速に進化することになります。(下図)

図:嫌気性の原始真核細胞に好気性細菌のαプロテオバクテリアが食作用で取り込まれ、共生するようになり、ミトコンドリアになった。αプロテオバクテリアに存在していた遺伝子の多くは真核細胞の核内に移動し、ミトコンドリアのたんぱく質の多くは核の遺伝情報によって作られるようになった。
このように、ミトコンドリアはかつて細菌であったため、見かけは細菌に似ています。
直径は1ミクロン(1ミクロンは1000分の1ミリ)以下で、長さは1~4ミクロン程度で、俵型やいも虫様の立体構造をしています。
ミトコンドリアは2枚の膜(内膜と外膜)によって細胞質から隔てられ、内膜は複雑に入り組んで「クリステ」という無数の襞や管を形成しています。内膜が襞上にくびれているのは、表面積を増やすためで、この内膜でATPの産生が行われています。
内膜上に電子伝達系やATP合成にかかわる酵素群などが一定の配置で並んでいます。
マトリックスには、TCA回路に関わる酵素やミトコンドリア独自のDNAなどが含まれています。たんぱく質合成のためにリボソームも持っていてミトコンドリア内でたんぱく合成もできます。そして、ミトコンドリア自身が増殖もします。(下図)

図:細胞内には機能を分担するために、様々な小器官が存在する。ミトコンドリアは酸素を使ってグルコースや脂肪酸やアミノ酸を燃焼してATPを産生する働きや、物質代謝やアポトーシスの制御など多彩は機能を持っている。
【ミトコンドリア蛋白質の一部はミトコンドリアで合成される】
前述のように、約20億年前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。ミトコンドリアは元々は細菌であったので、ミトコンドリア独自のDNAを持ち、自分で分裂して増殖することができます。
α-プロテオバクテリアの頃の遺伝子の大半は細胞の核のDNAに移行しています。しかし、ミトコンドリア固有の遺伝子の一部はミトコンドリア内のDNAに存在しています。
すなわち、ミトコンドリアを構成するタンパク質には、核内DNA にコードされているものと、ミトコンドリア内のDNA にコードされているものがあります。核内DNA にコードされているタンパク質は、細胞質で合成された後、ミトコンドリア外膜と内膜を通過してミトコンドリア内部に輸送されなければなりません。
ミトコンドリアDNA にコードされているミトコンドリア・タンパク質は、核内DNA にコードされているものと比較すると、その種類は少数です。
ミトコンドリアDNAは16,569bpの環状の分子で、D-loopという部位がミトコンドリアDNAの複製や転写を制御しています。ミトコンドリアDNAには37個の遺伝子が存在し、22個のトランスファーRNA(tRNA)と2個のリボゾームRNA(rRNA)の遺伝子と、酸化的リン酸化に関与するたんぱく複合体の85種類のサブユニットのうち13種類のたんぱく質(複合体I,III, IV, Vのサブユニット)を作成する遺伝子が存在します。その他のサブユニットは核のDNAにコードされており、細胞質でたんぱく質に翻訳されて、ミトコンドリアに移行します。
つまり、ミトコンドリアでのATP産生(酸化的リン酸化)が正常に行われるためには、細胞核とミトコンドリアに存在するDNAが必要です。ミトコンドリアDNAを欠損させると、ミトコンドリアでの酸素呼吸(酸化的リン酸化)が起こりません。
ミトコンドリアでは酸素呼吸をするために活性酸素が産生され、そのためにミトコンドリアDNAの損傷が起こりやすくなっています。とくにD-loop領域の異常は多くのがん細胞で見つかると報告されています。この領域の異常はミトコンドリアDNAの複製を妨げるので、ミトコンドリアDNAの量が減少します。
【植物のミトコンドリア毒ががん治療に利用できる】
植物は細胞に毒作用のある化学成分を合成・蓄積することによって動物や鳥や虫からの攻撃を防いでいます。植物が多くの毒を持っているのは、捕食者から自分を守るためです。
このような毒は適量を使うと病気の治療に有効なものもあります。
植物には血液の凝固を阻害して出血しやすくする成分も知られています。これを大量に摂取した動物は出血を起こして死ぬ可能性があり、植物が身を守る一つの毒ですが、このような成分は血栓の予防の治療に使えます。
植物の細胞毒には、ミトコンドリア毒も多く見つかっています。ミトコンドリアの呼吸酵素複合体などを阻害して抗菌作用を示す物質としてガレガのビグアナイド(メトホルミンなど)、赤ブドウなどに含まれるレスベラトロール、牛蒡子に含まれるアルクチゲニンなどが知られています。これらは、ミトコンドリアの呼吸酵素複合体-1を阻害してATP産生を阻害し、さらに活性酸素の発生を増やして酸化ストレスを高める作用が報告されています。
漢方薬でがんが縮小することはあり得無いと思っている人は多いと思います。しかし、ミトコンドリア毒など植物毒を利用すると、がんを縮小する効果が期待できます。実際に標準治療で現在使用されている抗がん剤の中には植物アルカロイドなど植物成分由来のものが多くあります。
【ドキシサイクリンはミトコンドリアのATP産生を阻害する】
ドキシサイクリンはテトラサイクリン誘導体の抗生物質です。テトラサイクリンの有効性と安定性を改善した医薬品で、50年以上前(1960年代後半)にFDAが承認しています。グラム陽性とグラム陰性の両方の細菌に効き、にきびの治療に使われています。
テトラサイクリンは細菌のリボソームの30Sサブユニットに結合して、細菌のタンパク合成を阻害します。この細菌の30Sリボソーム・サブユニットはミトコンドリアの28Sリボソーム・サブユニットと相同性があるため、ミトコンドリアのタンパク質合成を阻害する作用もあり、この作用によってミトコンドリア機能を阻害します。

図:ドキシサイクリンは細菌のリボソームの30Sサブユニットに結合して、ポリペプチド鎖へのアミノ酸の結合を阻害して、細菌のタンパク合成を阻害する。
最近、ドキシシクリンにがん細胞の増殖や腫瘍形成能を阻害する作用が報告されています。以下のような報告があります。
Induction of Mitochondrial Dysfunction and Oxidative Damage by Antibiotic Drug Doxycycline Enhances the Responsiveness of Glioblastoma to Chemotherapy.(抗生物質のドキシサイクリンはミトコンドリアの機能異常と酸化障害を引き起こして、グリオブラストーマの抗がん剤に対する反応性を亢進する)Med Sci Monit. 2017 Aug 26;23:4117-4125.
【要旨】
研究の背景:がん治療において、ミトコンドリアの機能異常を誘導する方法の有効性が指摘されている。抗生物質のドキシサイクリンが、ミトコンドリアをターゲットにすることによって抗がん作用を示すことが報告されている。この研究では、ドキシサイクリンがグリオブラストーマ(膠芽腫)の治療に有効かどうかを検討した。
実験方法:グリオブラストーマの増殖や生存やミトコンドリアでの代謝に対するドキシサイクリンの効果を検討した。40匹のマウスを用いた移植腫瘍の実験系で、テモゾロマイドとドキシルビシンの併用による治療効果を検討した。
結果:ドキシサイクリンは、グリオブラストーマ細胞株に対して、細胞増殖を抑制し、アポトーシス(細胞死)を誘導した。培養細胞の実験系(in vitro)および移植腫瘍の動物実験系(in vivo)で、ドキシサイクリンはグルオブラストーマのテモゾロマイド感受性を亢進した。
作用機序として、ドキシサイクリンはミトコンドリア膜ポテンシャルを低下させ、ミトコンドリアの呼吸を阻害することによってミトコンドリア機能を阻害した。
ドキシサイクリンはミトコンドリアのATP産生を低下させ、ミトコンドリアのスーパーオキシドと細胞内の活性酸素種の量を高め、酸化傷害の指標である8-OHdGと蛋白質のカルボニル化と脂質過酸化を増やした。
これは、ドキシサイクリンはミトコンドリアにおけるエネルギー産生を破綻させ、酸化ストレスを高めて細胞の酸化傷害によって、グリオブラストーマ細胞を死滅させることを示している。
抗酸化剤のN-アセチル-L-システインを投与すると、ドキシサイクリンの増殖抑制とアポトーシス誘導作用が阻止された。これは、ドキシサイクリンがグリオブラストーマに酸化ストレスを高めて抗腫瘍作用を示すことを示している。
結論:我々の研究では、抗生物質のドキシサイクリンが、ミトコンドリアの機能不全および酸化的ストレスを誘導することによって、グリオブラストーマの治療に有効であることを示している。 我々の研究はまた、グリオブラストーマにおけるミトコンドリア代謝の重要性を示している。
ドキシサイクリンはミトコンドリアの酸素呼吸を阻害してATP産生を低下させ、さらに活性酸素の産生を高めて、酸化傷害を引き起こすという結果です。ドキシサイクリンは細胞内エネルギー(ATP)を減少させ、同時に酸化ストレスを高めることによってがん細胞を死滅させるというメカニズムです。
以下のような報告があります。
Doxycycline inhibits the cancer stem cell phenotype and epithelial-to-mesenchymal transition in breast cancer.(ドキシサイクリンは乳がん細胞におけるがん幹細胞の性質と上皮-間葉移行を阻止する)Cell Cycle. 2017 Apr 18;16(8):737-745.
【要旨】
乳がん細胞は乳がん幹細胞から発生し、乳がん幹細胞の足場非依存性の増殖と生存にはミトコンドリア新生が必要であることが示されている。したがって、乳がん治療においてミトコンドリアは重要なターゲットになる。
FDA(米国食品医薬品局)の認可薬であるドキシサイクリンの副作用の一つにミトコンドリア新生の阻害がある。
この研究では、乳がん細胞と乳がん幹細胞の腫瘍形成や浸潤、移動、アポトーシス、がん幹細胞のマーカー、上皮-間葉移行に関連したマーカーに対するドキシサイクリンの作用とそのメカニズムを検討した。さらに、乳がん細胞に対するドキシサイクリンの阻害作用におけるオートファジーの関与を検討した。
我々は、ドキシサイクリンが乳がん細胞と乳がん幹細胞の生存と増殖を阻害し、乳がん細胞の腫瘍形成能と移動と浸潤と上皮-間葉移行を低下させることを明らかにした。
ドキシサイクリン投与は、がん幹細胞のマーカーであるOct4、Sox2、Nanog 、 CD44の発現を有意に低下させた。さらに、ドキシサイクリンはオートファジーのマーカーのLC-3BI とLC-3BIIの発現を低下させ、上皮-間葉移行とがん幹細胞のマーカーに対する作用にオートファジー阻害作用の関与が示唆された。
ドキシサイクリンは乳がん細胞の上皮-間葉移行とがん幹細胞の性質を阻害する作用を有することが示され、乳がん治療に利用できる可能性が示唆された。
ドキシサイクリンが、乳がん幹細胞の幹細胞として能力を維持させる作用と上皮-間葉移行(上皮細胞が線維芽細胞のような間葉系細胞の性質を獲得して周囲組織への浸潤性が高まること)を阻止するという結果です。そのメカニズムとしてミトコンドリアの働きを阻害する作用を指摘しています。
リボソームはmRNAの遺伝情報を読み取ってタンパク質へと変換する細胞内小器官です。細菌は30Sサブユニットよ50Sサブユニットの2つから構成されます。
真核生物のリボソームは少し大きく、40Sサブユニットと60Sサブユニットから構成されます。
細菌とヒトなどの真核生物ではリボソームの構造が異なるため、細菌のリボソームにのみ特異的な阻害剤は、病原細菌に対する毒性は高くヒトに対する毒性が低い抗生物質になります。
そのような抗生物質としてアミノグリコシド系化合物(ストレプトマイシン、ネオマイシン、カナマイシン)やテトラサイクリン、クロラムフェニコール、マクロライド系化合物などがあります。
ドキシサイクリンはテトラサイクリン系の抗生物質です。細菌のリボソームに対する選択性が高いので、副作用は少ないのですが、ミトコンドリアのリボソームにも作用して、ミトコンドリアのタンパク質合成を阻害する作用があるということです。そして、この作用ががん治療に使えるということです。
ミトコンドリアはエネルギー(ATP)産生だけでなく、細胞内カルシウムの恒常性維持、アポトーシス制御、細胞内シグナル伝達系など多くの機能において重要な働きを担っています。
がん細胞は活性酸素の産生を抑えるためにミトコンドリアの酸素呼吸を抑制していますが、ミトコンドリアが破綻して機能が阻害されると、がん細胞は生存できません。
ミトコンドリアを活性化して(酸素呼吸を増やして)、同時にミトコンドリアの呼吸鎖や機能を阻害すると、活性酸素の発生が増え、酸化ストレスが亢進して、がん細胞特異的にミトコンドリアを破綻できることになります。このとき、ドキシサイクリンはミトコンドリアの破綻を促進する効果を発揮します。
【高濃度ビタミンC点滴は解糖系を阻害する】
がん細胞において亢進している解糖系を阻害する方法として2-デオキシ-D-グルコース(2-DG)やケトン食が有効です。
生薬の半枝蓮も解糖系を阻害します。
半枝蓮(はんしれん)は学名をScutellaria barbataと言う中国各地や台湾、韓国などに分布するシソ科の植物です。アルカロイドやフラボノイドなどを含み、抗炎症・抗菌・止血・解熱などの効果があり、中国の民間療法として外傷・化膿性疾患・各種感染症やがんなどの治療に使用されています。
黄色ブドウ球菌・緑膿菌・赤痢菌・チフス菌など様々な細菌に対して抗菌作用を示し、さらに肺がんや胃がんなど種々のがんに対してある程度の効果があることが報告されています。
半枝蓮の抗がん作用のメカニズムとして、がん細胞の解糖系と酸化的リン酸化を阻害してエネルギー産生を低下させ、がん細胞を死滅させる作用が報告されています。すなわち、半枝蓮はミトコンドリアでの活性酸素の産生を増やし、DNAの酸化障害からポリADPリボース合成酵素(PARP)が活性化され、NADを枯渇して解糖系を阻害してATPの産生を低下させるという機序です。解糖系と酸化的リン酸化を阻害してがん細胞のATPを枯渇させて死滅させます。(下図)

図:半枝蓮の成分はがん細胞のミトコンドリアでの活性酸素の産生を増やし、酸化的リン酸化を阻害してATP産生を減らす。さらに、DNAにダメージを与えてポリADPリボース合成酵素(PARP)を活性化し、NADを枯渇して解糖系を阻害する。これらの作用によってがん細胞のATPが枯渇して死滅する。
1回に25〜100グラムという大量のビタミンCを1〜3時間かけて点滴する治療法があります。がん細胞に取込まれたビタミンCが過酸化水素を発生することでDNAやミトコンドリアにダメージを与え、解糖系を阻害してATP産生を阻害することによって抗がん作用を発揮します。
ビタミンCはグルコースと構造が似ており、同じ糖輸送担体(グルコーストランスポーター)によって細胞内に取込まれます。がん細胞はグルコーストランスポーターの発現量が増え、グルコースの取込みが亢進しているので、大量のビタミンCががん細胞に取込まれ、がん細胞が選択的に死滅させることができるという治療法です。
提唱されている作用機序として、ビタミンCによって発生した過酸化水素がDNAにダメージを与えると、ポリADPリボース合成酵素(PARP)が活性化されNADが枯渇し、解糖系もTCA回路も進まなくなります。活性酸素はミトコンドリアにもダメージを与えます。これらの作用で、エネルギーが枯渇して細胞が死滅することになります。この作用機序を下図にまとめています。

図:ビタミンCはグルコーストランスポーターから細胞内に取込まれる。がん細胞はグルコーストランスポーターの発現量が増えているので、がん細胞に高濃度のビタミンCが取込まれる。取込まれたビタミンCはがん細胞内で過酸化水素(H2O2)を発生させて、DNAとミトコンドリアにダメージを与える。DNAのダメージはポリADPリボース合成酵素(PARP)の活性を亢進してNAD+(ニコチンアミドアデニンジヌクレオチド)が減少すると解糖系が阻害される。ミトコンドリアのダメージは酸化的リン酸化でのATP産生を減少させる。この結果、がん細胞内のATPが枯渇してがん細胞は死滅する。
その他に、高濃度ビタミンCが解糖系酵素のグリセルアルデヒド3リン酸脱水素酵素(GAPDH)を酸化傷害で活性を阻害する作用機序がサイエンス(Science)に報告されています。
Vitamin C selectively kills KRAS and BRAF mutant colorectal cancer cells by targeting GAPDH(ビタミンCはグリセルアルデヒド3リン酸脱水素酵素を阻害する機序で、がん遺伝子のKRASとBRAFが変異した結腸直腸がん細胞を死滅させる)Science. 2015 Dec 11; 350(6266): 1391–1396.
【要旨】
ヒトの結腸直腸がんの半分以上において、がん遺伝子のKRASかBRAFの変異が見つかっており、このような変異を持つ結腸直腸がんは抗がん剤治療に抵抗性を示すことが多い。
この論文では、高濃度のビタミンCで処置すると、KRASあるいはBRAFの変異を持つ結腸直腸がんの培養細胞が選択的に死滅することを示す。
この作用は、GLUT1グルコーストランスポーターを介して、ビタミンCの酸化型のデヒドロアスコルビン酸(dehydroascorbate)の取込みが増えるためである。
細胞内のデヒドロアスコルビン酸はビタミンCに還元される過程でグルタチオンを消費して枯渇させるので、デヒドロアスコルビン酸の細胞内取り込み亢進は酸化ストレスを亢進させる。
このようにして活性酸素種が細胞内に蓄積し、グリセルアルデヒド3リン酸脱水素酵素(GAPDH)を不活性化する。
KRASあるいはBRAFの変異したがん細胞は解糖系への依存が高いので、解糖系酵素であるGAPDHの阻害はエネルギーの破綻をきたして死滅する。KRASとBRAFが正常ながん細胞では、GAPDHの阻害で細胞死は起こらない。
動物を使ったin vivoの実験では、高用量のビタミンCはApc/KrasG12Dが変異したマウスの小腸腫瘍の増殖を抑制した。
人間の腫瘍においても同様な結果になるかは不明であるが、KRASあるいはBRAFの変異がある結腸直腸がんの治療にビタミンCの効果を検討する根拠を今回の実験結果は提供している。
KRASとBRAFはがん遺伝子で、これらの遺伝子が変異してがん遺伝子として活性化しているがん細胞が、抗がん剤治療などに抵抗性で予後が不良であることが知られています。
このような変異がある結腸直腸がんは、グルコースの取込みが亢進し、グルコーストランスポーターのGLUT1の発現が多く、解糖系に依存度が高い特徴を持っています。
食事中のビタミンCはナトリウム依存性ビタミンCコトランスポーター(sodium vitamin C cotransporters;SVCTs)か促進性グルコース輸送体(acilitative glucose transporters;GLUTs)を介して細胞膜を通過します。
SVCTはビタミンCをそのまま通過させますが、GLUT(主にGLUT1とGLUT3)はビタミンCの酸化型のデヒドロアスコルビン酸を通過させます。
デヒドロアスコルビン酸は細胞内でグルタチオンやチオレドキシンやNADPHを使ってビタミンCに還元されます。したがって、デヒドロアスコルビン酸を多く取り込んだがん細胞は酸化ストレスが亢進することになります。

図:アスコルビン酸はナトリウム依存性ビタミンCコトランスポーター(sodium vitamin C cotransporters;SVCT)を通って細胞内に入り、酸化型のデヒドロアスコルビン酸はグルコース輸送体(glucose transporters;GLUT)を通って細胞膜を通過する。細胞内でデヒドロアスコルビン酸はグルタチオン依存性のデヒドロアスコルビン酸還元酵素で還元されてアスコルビン酸に変換される。この過程でグルタチオンを消耗するので、酸化ストレスが亢進する。
この論文では、高濃度ビタミンC点滴で細胞内に発生した活性酸素は、解糖系酵素のグリセルアルデヒド3リン酸脱水素酵素(GAPDH)の活性部位のシステイン(C152)を酸化して不活性化することを報告することを報告しています。

図:高濃度ビタミンC点滴で細胞内に発生した活性酸素は、解糖系酵素のグリセルアルデヒド3リン酸脱水素酵素(GAPDH)の活性部位の152番目のシステイン(C152)を酸化して不活性化する。
つまり、高濃度ビタミンC点滴は、がん細胞内の活性酸素の発生を高め、グルタチオンなどの抗酸化システムを低下させ、GAPDHを酸化して不活性化して解糖系を阻害するというメカニズムです。
さらに、DNAの酸化傷害が起こるとポリADPリボース合成酵素(PARP)が活性化されNADが枯渇し、解糖系もTCA回路も進まなくなります。

図:解糖系では1分子のグルコースが2分子のピルビン酸に変換される過程で2分子のNAD+(ニコチンアミドアデニンジヌクレオチド)が消費される。NAD+が枯渇すると解糖系が進まないので、乳酸脱水素酵素でNADHをNAD+に戻している。この乳酸発酵によって細胞は酸素を使わないでATPを産生できる。
正常細胞はGLUTの発現が少ないのでビタミンCの取込みが少なく、過酸化水素を消去するカタラーゼの活性が高いので、高濃度ビタミンC点滴による細胞傷害は起こりにくいと考えられています。
人間に投与した場合でも、このメカニズムが働くのかは不明ですが、超一流のサイエンス(Science)に掲載されているので、信憑性があるメカニズムかもしれません。
いずれにしても、高濃度ビタミンC点滴はがん細胞内の酸化ストレスを高めるメカニズムでがん細胞を死滅させる治療法です。高濃度ビタミンC点滴で治療中に抗酸化性のサプリメントを摂取している人がいますが、これは高濃度ビタミンC点滴の抗腫瘍効果を弱めます。
酸化ストレスを高めるメトホルミン、ジスルフィラム、オーラノフィン、ジクロロ酢酸ナトリウム、半枝蓮、アルテスネイトなどを併用すれば高濃度ビタミンC点滴の抗腫瘍効果を高めることができます。
【高濃度ビタミンC点滴+ドキシサイクリンの相乗効果】
解糖系とミトコンドリアでの酸化的リン酸化を同時に阻害すれば、エネルギー(ATP)が枯渇して細胞は死にます。
解糖系を阻害する2-デオキシ-D-グルコースとミトコンドリアの酸素呼吸を阻害するメトホルミンが相乗的な抗腫瘍効果を示すことが報告されています。
解糖系を阻害するビタミンCとミトコンドリアを阻害するドキシサイクリンの相乗的な抗腫瘍効果が報告されています。
Vitamin C and Doxycycline: A synthetic lethal combination therapy targeting metabolic flexibility in cancer stem cells (CSCs) (ビタミンCとドキシサイクリン:がん幹細胞における代謝柔軟性をターゲットにした相乗効果による致死的治療)
【要旨】
がん幹細胞を根絶させる新規の薬の組合せによる治療法を開発した。
抗生物質のドキシサイクリンの存在下でがん細胞を長期間培養すると、ミトコンドリアにおけるタンパク合成が阻害されて、ミトコンドリアでの酸素呼吸が低下する。
ミトコンドリアDNAでコードされた4種類のミトコンドリアタンパク質(MT-ND3, MT-CO2, MT-ATP6 and MT-ATP8)の発現は、最大で35分の1に顕著に抑制された。
ドキシサイクリンの存在下で生存したがん細胞は、ミトコンドリアでの酸素呼吸が阻害されているので、エネルギー産生は解糖系に強く依存することになり、エネルギー産生において柔軟性が無くなる。
そこで、代謝に作用する2種類の天然成分(ビタミンCとベルベリン)と6種類の承認医薬品(Atovaquone, Irinotecan, Sorafenib, Niclosamide, Chloroquine, and Stiripentol)のドキシサイクリン耐性がん幹細胞への作用を検討した。
これらの天然薬および医薬品とドキシサイクリンを組み合わせると、がん幹細胞を有効に根絶できた。
本研究の結果、ミトコンドリアをターゲットにするドキシサイクリンと、解糖系をターゲットにするビタミンCの組合せは、がん幹細胞を根絶する新規の治療法となる。
がん細胞における代謝上のアキレス腱(=弱点)をターゲットにすることは、がん幹細胞をより有効に飢餓に陥らせる方法になる。
「がん幹細胞と成熟がん細胞」との関係は、「女王蜂と働き蜂」の関係と似ています。がん幹細胞はがん幹細胞の性質を維持した同じ細胞を自己複製すると同時に、成熟したがん細胞を増産して、がん組織の量を増やします。
がん幹細胞はミトコンドリアの量と機能が亢進していることが知られています。
そこで、がん幹細胞を死滅させるためには、解糖系とミトコンドリアの機能を阻止することが必要ということになります。
一般に、がん細胞では、酸素が十分に利用できる状況でもミトコンドリアでの酸素呼吸が抑制され、グルコース(ブドウ糖)の取込みと解糖系が亢進し、乳酸の生成が増えているという物質代謝の特徴を持っています。これを好気性解糖(Aerobic glycolysis)あるいはワールブルグ効果(Warburg effect)と言います。
しかし、がん細胞はこの基本法則を厳密に守っているわけではありません。特にがん幹細胞(Cancer Stem Cell)では、エネルギー産生や物質代謝において、かなりの柔軟性(フレキシビリティ)を持っています。
エネルギー産生には酸素を使わない解糖系とミトコンドリアで酸素を使う酸素呼吸(酸化的リン酸化)があります。
エネルギー産生の材料には、グルコースだけでなく、アミノ酸、脂肪酸、ケトン体、乳酸などを使います。
脂肪酸やケトン体をエネルギー産生に利用するには、ミトコンドリアでの代謝になるので、解糖系が亢進しミトコンドリアでの酸素呼吸が低下しているがん細胞では、脂肪酸やケトン体を利用しにくい状態にあります。
しかし、がん細胞は生存するためには何でもします。
グルコースが枯渇して利用できなくなったり、解糖系が阻害されると、ミトコンドリアでの酸素呼吸によるエネルギー産生を亢進します。
このような代謝の特徴を「代謝の柔軟性(metabolic flexibility)」と言います。がん細胞に代謝の柔軟性がなければ、解糖系を阻害する方法(2-デオキシ-D-グルコースやケトン食)だけで、がん細胞を死滅できます。
しかし、解糖系を阻害するでけでは、がん細胞を死滅できません。代謝の柔軟性によってミトコンドリアを利用してエネルギー産生にスイッチを切り替えることができるからです。
この論文では、ドキシサイクリンを添加した培養液でがん細胞を培養しています。培養液にドキシサイクリンの濃度を少しづつ増やしていくと、ドキシサイクリンがミトコンドリアでの酸素呼吸を阻害するので、解糖系でのエネルギー産生を亢進させます。
そこで、解糖系のエネルギー産生を阻害するビタミンCを添加すると、がん幹細胞は全滅するというメカニズムです。
がん細胞のミトコンドリアでの酸素呼吸を阻害しても解糖系だけで生存し増殖できます。したがって、解糖系とミトコンドリアの機能を同時に阻害すればがん細胞を死滅できます。
解糖系とミトコンドリアの機能を同時に阻害すれば正常細胞にもダメージがきます。
そこで、正常細胞とがん細胞の代謝における違いである、「がん細胞はグルコーストランスポーターの発現が亢進している」、「抗酸化システムを阻害するとがん細胞の方が死に易い」などの特徴を利用すれば、がん細胞に比較的選択的に死滅させることができます。
その組合せとして、解糖系阻害は高濃度ビタミンC点滴や2-デオキシグルコースやジクロロ酢酸があります。ミトコンドリアでのエネルギー阻害にはメトホルミン、ドキシサイクリン、半枝蓮などがあります。さらに、酸化ストレスを高める方法としてアルテスネイト、ジスルフィアム、オーラノフィンなどの併用も有効です。(トップの図)
【がん細胞に選択的に酸化ストレスを高めることができる】
ミトコンドリアでのATP産生は、酸素を還元して水になる反応(電子伝達系)を使って産生しています。この過程では1分子の酸素(O2)に4つの電子(e-)を渡して四電子還元され、さらに水素イオン(H+)と結合して水(H2O)になります。
この反応では必ずしも酸素分子に電子がきっちり4個渡されるとは限りません。酸素分子に不完全に電子が渡され、部分的に還元されたものが発生し、これが活性酸素になります。
このように、ミトコンドリアでは酸素を使ったエネルギー産生の過程で活性酸素が発生します。
正常細胞においては、ミトコンドリアにおける物質代謝やエネルギー産生過程は整然とコントロールされており、活性酸素の発生は最小限に抑えられています。つまり、正常な細胞内では活性酸素によるダメージが少ない状態に維持されています。
下図に正常細胞における糖質代謝とミトコンドリアにおける呼吸による活性酸素の発生と、活性酸素の消去の関係を示します。

図:細胞内に取り込まれたグルコースは、ヘキソキナーゼでグルコース-6-リン酸(グルコース-6-P)に変換され、さらに解糖系によってピルビン酸になる。酸素が乏しいと嫌気性解糖系によってピルビン酸は乳酸に変換されるが、酸素がある状況では、ピルビン酸はピルビン酸脱水素酵素によってアセチルCoAに変換され、さらにTCA回路で電子伝達体であるNADH(還元型ニコチンアミドアデニンジヌクレオチド)とFADH2(還元型フラビンアデニンジヌクレオチド)が作られ、 NADHやFADH2のもつ電子(水素)は電子伝達系によって酸化される。ミトコンドリアの呼吸鎖では酸素(O2)を還元して、水素と反応させて水になるが、この過程でスーパーオキシドが発生する。ペントース・リン酸経路で産生されるNADPHと解糖系のピルビン酸は活性酸素を消去する作用がある。さらに細胞内には様々な抗酸化物質や抗酸化酵素によって活性酸素は無害な物質で変換されて消去されている。このような細胞内機能の整然とした働きによって、細胞内の酸化ストレスが増大しないようにコントロールされている。
一方、がん細胞ではミトコンドリアに様々な異常が起こっています。ATPを産生する呼吸鎖にも異常が起こっており、酸素を使ったエネルギー産生過程で大量の活性酸素が産生されやすくなっています。
これは、排気ガス処理装置が壊れた自動車が排気ガスをまき散らすのと同じ状態です。
つまり、がん細胞ではミトコンドリアでの酸素消費を増やせば、活性酸素の産生が増えて、酸化ストレスによった細胞が死滅するリスクが高いのです。
がん細胞では、このような酸化ストレスの増加を防ぐために、酸素を使わない解糖系でのエネルギー産生を増やしています。つまり、酸素がある条件でも解糖系でのATP産生を増やし、酸素を使ったミトコンドリアでのATP産生を抑制している理由の一つは、酸化ストレスを高めたくないからです。
ミトコンドリアでのエネルギー産生を抑制するため、効率の悪い解糖系でエネルギー産生を行う必要があるために、グルコースの取込みと解糖系の亢進が起こっているということになります。
またグルコース-6-リン酸からのペントース・リン酸経路での代謝も亢進しており、この系で産生されるNADPHが細胞内の酸化ストレスを軽減するために利用されます。(下図)

図:がん細胞における糖質代謝の特徴を示している。赤の矢印と文字はがん細胞で活性化あるいは増えていることを示している。がん細胞ではミトコンドリアの呼吸鎖の異常などによって酸素を使ってATPを産生すると活性酸素の産生量が増える状況にある。そこでがん細胞ではミトコンドリアでのATP産生を抑制して酸化ストレスの増大を防いでいる。そのため、非効率的なエネルギー産生系である解糖系が亢進していて乳酸の産生が増えている。また、ペントース・リン酸経路が亢進し、この経路でできるNADPHは活性酸素の消去に使われる。がん細胞ではミトコンドリアでの代謝を抑えているので、脂肪酸やケトン体をエネルギー源として十分に利用できない。
がん細胞のミトコンドリアでのエネルギー産生を高めるジクロロ酢酸や、がん細胞の抗酸化システムのグルタチオンの産生を阻害するスルファサラジンなどががん治療に使われるのは、がん細胞での活性酸素の産生を高め、酸化ストレスを高めてがん細胞を死滅させることを目的とした方法です。
上記の図から判るように、がん細胞では脂肪酸やケトン体を代謝することを避けています。脂肪酸やケトン体はミトコンドリアで代謝されてATPになるため、これらをエネルギー源にすると活性酸素が増えてしまうからです。
脂肪酸やケトン体をエネルギー源として利用できないわけではないのですが、これらをミトコンドリアで代謝すると活性酸素の産生が増えて、自分の首を絞める結果になるので、使いたくないということになります。
ミトコンドリアでの酸素消費を高めながら呼吸鎖を阻害して活性酸素の産生と高め、ATP産生を阻害すると、がん細胞は酸化ストレスとエネルギー枯渇で死滅できます。がん細胞に酸化ストレスを高めてがん細胞を死滅させる方法な多数あります。それらを組み合せることによって、新しいがん治療ができます。
| « 558)がん細胞... | 560)mTORC1活... » |



