がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
557)アセチル-L-カルニチンは若返り薬?
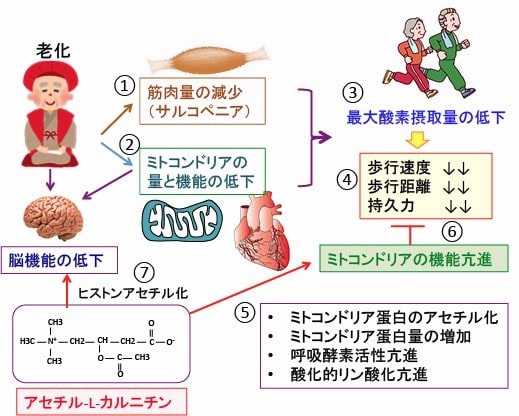
図:体の老化に伴って骨格筋の筋肉量が減少し(①)、心筋や骨格筋のミトコンドリアの量と機能が低下する(②)。その結果、最大酸素摂取量は減少し(③)、運動機能は低下する(④)。アセチル-L-カルニチンはアセチルCoAを増やしてミトコンドリアの蛋白質をアセチル化し、ミトコンドリアの転写や蛋白合成を増やす。その結果、呼吸鎖酵素の活性が亢進して酸化的リン酸化を促進し、ミトコンドリア機能を亢進する(⑤)。その結果、老化に伴う運動機能の低下を阻止する(⑥)。さらに、アセチル-L-カルニチンはヒストンのアセチル化を亢進し、老化によって低下した脳機能(認知機能や記憶力)を良くする。
557)アセチル-L-カルニチンは若返り薬?
【老化に伴ってミトコンドリアのATP産生能は低下する】
私たちの体は加齢に伴って老化します。体の老化を最初に自覚するのは、体力や持久力や俊敏性など運動能力の衰えです。人によっては、物忘れなど脳機能の低下を自覚するようになって老化を意識する場合もあります。
このような老化に伴う運動能力や脳機能(認知機能や記憶力)の低下の原因としてミトコンドリア機能の低下が重要でます。
体の老化に伴って細胞のミトコンドリア機能が低下し、これが、心臓や骨格筋や神経系やその他の臓器の機能低下の主な原因になっています。
心臓や骨格筋や神経系は組織の酸素消費量が多い臓器です。これらの臓器ではミトコンドリアで酸素呼吸(酸化的リン酸化)によってエネルギー(ATP)を産生しています。
老化に伴って、これらの臓器の酸素消費量が減っていきます。ミトコンドリアの働きが低下し、酸素消費が減り、ATP産生量が低下するからです。その結果、運動機能や脳機能が低下します。
したがって、体の老化に伴う生理機能の低下を予防するには、ミトコンドリアの量と機能を高めることが重要と考えられます。
一般に、がん細胞はミトコンドリアを活性化すると死滅しやすくなり、正常細胞はミトコンドリアを活性化すると元気になります。
したがって、ミトコンドリアを活性化する方法は、老化とがんの両方の予防に有効と言えます。
【生命はATPを使ってエネルギーのやり取りを行う】
生物は、細胞が活動するエネルギーとしてATPという物質を使います。ATPはAdenosine Triphosphate(アデノシン3リン酸)の略です。
ATPはアデニンという物質にリボースという糖がついたアデノシンに、化学エネルギー物質のリン酸が3個結合したものです。
アデニンはDNAの遺伝情報に使われる4種類の核酸塩基の一つです。アデニンは火山ガスに含まれるシアン化水素(HCN)の化合によって生まれたとされ、最も古くに地球上に出現した有機化合物の一つと考えられています。
すなわち、アデニンやアデノシンやアデノシン3リン酸(ATP)は生命が生まれる前から存在し、これらの物質とその誘導体は生命活動において重要な働きを行っています。
ATPは分子内に2個の高エネルギーリン酸結合を持ち、ATPがエネルギーとして使用されるとADP(アデノシン2リン酸)とAMP(アデノシン1リン酸)が増えます。リン酸1分子を放出する過程でエネルギーが産生されます。このようにリン酸分子が離れたり、結合したりすることで、エネルギーの放出や貯蔵を行うことができます。
ATPは生物が必要とする活動エネルギーを保存した「エネルギー通貨」のような分子で、エネルギーを要する生物体の反応過程には必ず使用されています(図)。
細胞はグルコース(ブドウ糖)や脂肪酸に保存されているエネルギーをATP分子に捕獲し、筋肉の収縮や能動輸送や物質合成などの細胞の仕事に使っているのです。
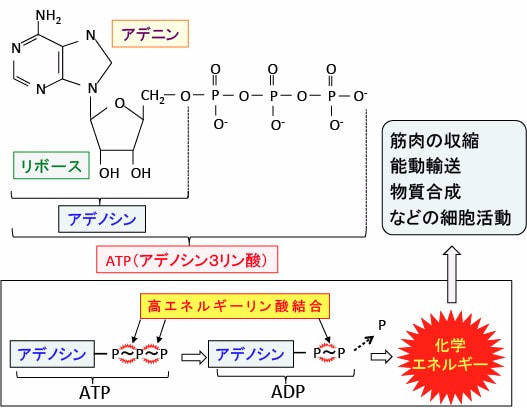
図:ATP(アデノシン3リン酸)は塩基のアデニンにリボースが結合し、そのリボースに3つのリン酸基が並んで結合している。ATPから加水分解によってリン酸基が外れるときにエネルギーが放出される。細胞は化学的な仕事を行うために必要なエネルギーの獲得と移動に関してATPを使用している。
【1日に自分の体重以上のATPを再合成している】
ATPの貯蔵量は少なく数秒程度で使い切ってしまうため、体内ではエネルギーを使って絶えずATP合成が行われています。ATPの産生が止まると、心臓は止まり、数分で死にます。青酸カリ(シアン化カリウム)はミトコンドリアでの酸素呼吸を阻害してATP産生をできなくするので、数分で死に至るのです。
1日に産生されるATPの総量は体重に匹敵する(あるいはそれ以上)と考えられています。
グルコース(ブドウ糖)の分子量は180で、ATPの分子量は507です。
1分子のグルコースがミトコンドリアで酸素を使って完全に分解されると、32〜38分子のATPが産生されます。
グルコース1gは約4キロカロリーの熱量を産生しています。2000キロカロリーを全てグルコースで賄うと500gのグルコースになります。
500グラムのグルコースは2.8モルになり、1モルのグルコースから32モルのATPが作られるとすると約90モルのATPが作られ、これは507g x 90モル=約45kgになります。
つまり、この計算だと1日に45kgのATPを産生していることになります。
ATPの加水分解で得られるエネルギーは、ATP1モル当たり7.3キロカロリーです。
ATP → ADP + リン酸 + 7.3キロカロリー/mol
です。
1日の消費カロリーを2000キロカロリーとすると、274モルのATPが必要になり、274モルのATPは約140kgになります。
いずれにしても、人間は1日に自分の体重に相当する量のATPを産生していることになります。
しかしこれは、ATPをゼロから1日に数十kgを生成しているのではなく、ADPを使い回して、ADPにエネルギーとリン酸を使ってATPを再合成しているだけです。
実際に体内に常時存在するATPは約100グラム程度です。つまり、ATP ⇆ ADP + りん酸という回路反応を繰り返し、ADPは1日に1000回以上使い回されていてATPに再合成されています。

図:食物の分解(異化)によって生成されるエネルギーを使ってADPにリン酸を結合させてATPが合成される。ATPが加水分解されてリン酸を放出する過程でエネルギーが産生され、生命活動に使用される。細胞はADPを再利用してATPを再合成している。ATPは瞬時に使用され、1日に再合成されるATP量は数十kgになる。
【老化に伴って有酸素運動能力が低下する】
骨格筋が収縮するときのエネルギー源はATP(アデノシン三リン酸)で、ATPがADP(アデノシン二リン酸)とリン酸に分解されるときに発生するエネルギーが筋肉の収縮に使用されます。ATPの貯蔵量は少なく、数秒程度で使いきってしまうので、エネルギーを使ってADPをATPに再合成します。
ATP再合成の仕組みにはクレアチンリン酸系、解糖系、有酸素系の3種類があります。
クレアチンリン酸はクレアチンにリン酸が結合した物質で、骨格筋のエネルギー貯蔵物質として働きます。クレアチンキナーゼによってリン酸基が外され、ADPを無酸素的にATPに再合成します。最高の運動強度で約10秒間持続可能で、100メートル競争では主にこの系でエネルギーが産生されます。
解糖系は細胞質でグルコースからピルビン酸を経て乳酸に分解される過程でグルコース1分子あたり2分子のATPを産生します。解糖系は酸素を使わず、最高の運動強度で持続時間は1~2分間程度で、1〜2分程度の中距離走は主に解糖系でエネルギーを産生します。
有酸素系は酸素を使ってミトコンドリアで長時間にわたってATPを産生します。グルコースや脂肪酸などを分解してアセチルCoAが生成され、TCA回路(クエン酸回路)と電子伝達系による酸化的リン酸化によってATPが産生されます。1分子のグルコースあたり32〜38分子のATPが産生されます。
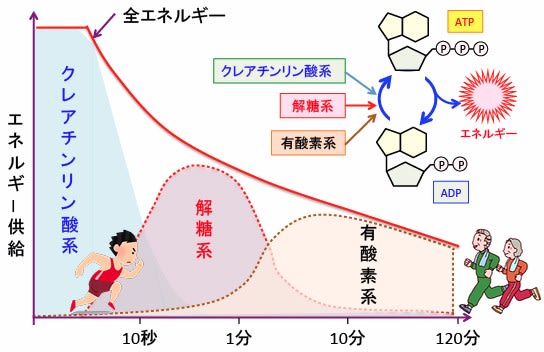
図:ADPからATPの再合成の仕組みにはクレアチンリン酸系、解糖系、有酸素系の3種類がある。最高の運動強度でクレアチニンリン酸系は約10秒間持続可能で、解糖系は1〜2分程度持続できる。この2つは無酸素でATPを再合成できる。2分以上の運動には酸素を使ったミトコンドリアでのATP再合成が必要になる。
主としてこの有酸素系から多くのエネルギーを取り出す運動が有酸素運動であり、有酸素系以外(クレアチンリン酸系と解糖系)からエネルギーを取り出す運動が無酸素運動になります。
運動中に体内に取り込まれる酸素の最大量を「最大酸素摂取量(VO2MAX)」と言います。VO2MAXはV = 量(volume)、O2 = 酸素、MAX = 最大限(maximum)に由来しています。
加齢に伴って最大酸素消費量(VO2MAX)は低下していきます。加齢に伴って骨格筋の筋肉量が減少し、心臓や骨格筋のミトコンドリアの量と機能が低下し、ミトコンドリアでの酸素呼吸が減少するからです。
その結果、歩行速度が遅くなり、歩行距離が短くなり、持久力が低下するのです。
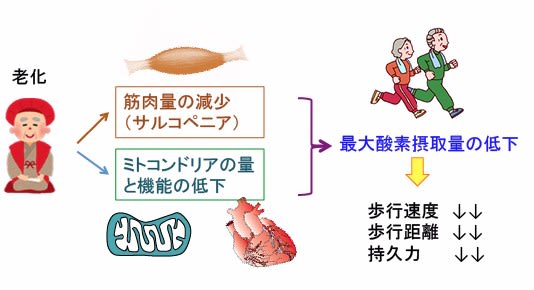
図:加齢に伴って骨格筋の筋肉量が減少し、骨格筋や心筋のミトコンドリアの量と機能が低下する。その結果、最大酸素摂取量は減少し、運動機能は低下する。
【アセチル-L-カルニチンは老化に伴う運動低下を回復させる】
これからの高齢化社会で、できるだけ長い期間自分で動けるようにするには、筋肉量とミトコンドリアの機能を高めることが重要になります。
加齢に伴う筋肉量の減少と筋肉のミトコンドリアの量と機能を維持するためには、日頃から有酸素運動を行うことが重要です。
その他にミトコンドリアの量を増やしたり、機能を高めるようなサプリメントや薬があれば役立ちます。アセチル-L-カルニチン(アセチルカルニチン)がミトコンドリアの機能を高めることが報告されています。以下のような論文があります。
Acetyl-l-carnitine fed to old rats partially restores mitochondrial function and ambulatory activity.( 老齢ラットに給餌されたアセチル-1-カルニチンは、ミトコンドリア機能および歩行活動を部分的に回復させる)Proc Natl Acad Sci U S A. 1998 Aug 4; 95(16): 9562–9566.
【要旨】
老齢のラットにアセチル-l-カルニチンに与えた後に、ミトコンドリア機能および歩行活性を測定した。若齢(3〜5ヶ月齢)および老齢(22〜28ヶ月齢)のラットに、飲料水中にアセチル-1-カルニチンを1.5%(wt / vol)含む飲水を与え、1ヶ月後にし、肝細胞を単離した。
アセチル-l-カルニチンの補充は、ミトコンドリア膜電位の加齢関連低下を有意に逆転させた。年齢とともに有意に低下するカルジオリピンも回復させた。
アセチル-l-カルニチンは、年齢と共に減少する細胞の酸素消費を、若いラットのレベルまで増加させる。しかし、酸素1分子あたりの活性酸素の生成は、未投与の老齢ラットより約30%高い。
アセチル-l-カルニチンを補充した老齢ラットの細胞では、未投与の老齢のラットに比べて、細胞内のグルタチオンおよびアスコルビン酸の量は、それぞれ約30%および50%低かった。これは、アセチルーl−カルニチンの補充は酸化ストレスを高めることを意味している。
老齢のラットの歩行能力(移動距離の平均値として評価)は、幼若動物よりもほぼ3分の1に低下した。
アセチルーl−カルニチンの補充は、若年ラットおよび老齢ラットの両方において、歩行活動を有意に増加させ、その増加は高齢ラットでより大きかった。
したがって、老齢ラットへのアセチル-l-カルニチンの補給は、ミトコンドリア機能および全身代謝活性の多くの指標の年齢関連低下を著しく逆転させるが、酸化ストレスを増加させる可能性がある。
ミトコンドリアを活性化すると、細胞の酸素消費が増え、活性酸素の産生量が増えて細胞の酸化ストレスを高めることになりますが、ミトコンドリアの活性を高めることによって歩行能力を若いレベルに戻すことができます。
つまり、アセチル-l-カルニチンと抗酸化作用のあるサプリメントを摂取すれば、ミトコンドリア機能を高め、活性酸素の害を減らして、抗老化作用が期待できると言えます。
この論文の考察(Discussion)の最後に、R体αリポ酸を投与すると、老齢ラットの細胞の活性酸素の産生を減らし、アセチルカルニチンを投与中でも活性酸素の産生を減らすと記述されています。
R体αリポ酸はピルビン酸脱水素酵素の補酵素として働くので、ミトコンドリアを活性化する作用もあります。ビタミンB1もピルビン酸脱水素酵素の働きに必要です。
したがって、アセチル-l-カルニチンとR体αリポ酸とビタミンB1の併用はミトコンドリアの働きを良くする効果が期待できます。
さらに、ピルビン酸脱水素酵素の活性を高めるジクロロ酢酸ナトリウムやジクロロ酢酸ジイソプロピルアミン(商品名:リバオール)、PGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)を活性化してミトコンドリアの増生を亢進するベザフィブラート、メトホルミン、カロリー制限、ケトン食(βヒドロキシ酪酸)の併用もミトコンドリアの機能を高める方法として有用です。(508話参照)。
【アセチル-L-カルニチンはミトコンドリアのタンパク質のアセチル化を亢進する】
アセチル-L-カルニチンがミトコンドリアや核のタンパク質のアセチル化を促進して、遺伝子発現やタンパク質活性に影響することは良く知られています(後述)。
アセチル-L-カルニチンはアセチルCoAを増やして、ミトコンドリアタンパク質のアセチル化を増やし、酸化的リン酸化を亢進してミトコンドリア機能を高めることが報告されています。以下のような論文があります。アセチル-L-カルニチンは若返り作用があるという内容です。
Mitochondria in the elderly: is acetylcarnitine a rejuvenator? (高齢者のミトコンドリア:アセチルカルニチンは若返り薬?)Adv Drug Deliv Rev. 2009 Nov 30; 61(14): 1332–1342.
【要旨】
内因性のアセチルカルニチンは炭水化物やアミノ酸や脂肪酸やステロールやケトン体などを含む複数の代謝経路において合成されるアセチルCoAの指標であり、主にトリカルボン酸サイクル(TCA回路)によって利用される。
高齢の動物や人においてアセチルカルニチンの補充は、ミトコンドリアの量や機能の維持を含めて、有益な効果を発揮する。
これらの効果は用量依存的であり、短期間の治療でも認められる。
アセチルカルニチンの作用機序を理解するために、我々はこの化合物の代謝と役割を検討する。
我々は、ミトコンドリアタンパク質のアセチル化が、ミトコンドリア遺伝子の発現およびミトコンドリアタンパク質合成の特異的増加をもたらすことを示唆する。
老化したラットの心臓において、この効果は、シトクロムb含有量の増加、呼吸酵素複合体III活性の回復、および酸化的リン酸化を引き起こし、加齢性のミトコンドリア機能の欠損の改善をもたらす。
アセチルカルニチン(アセチル-L-カルニチンと同じ)は加齢に伴うミトコンドリア機能の低下を改善し、そのメカニズムとしてミトコンドリア蛋白質のアセチル化が重要という内容です。この論文の内容を以下の図でまとめています。(この論文のFig3の日本語訳)

図:アセチルカルニチンはカルニチン・アセチルトランスフェラーゼ(CAT)によってコエンザイムA(CoA)にアセチル基を移してアセチルCoAを生成する。アセチルCoAはミトコンドリアのタンパク質をアセチル化し、ミトコンドリアの転写や蛋白合成を増やす。その結果、チトクロームbが増え、呼吸鎖酵素の活性が亢進し、酸化的リン酸化を増やす。その結果、ミトコンドリア機能を亢進する。
以下のような報告があります。
Acetyl-L-carnitine increases mitochondrial protein acetylation in the aged rat heart.(アセチル-L-カルニチンは老齢ラットの心臓におけるミトコンドリアのタンパク質のアセチル化を増やす)Mech Ageing Dev. 2015 Jan;145:39-50.
【要旨】
これまでの研究で、高齢のラットにアセチルカルニチンを投与すると、心臓の筋原線維間ミトコンドリアにおける呼吸鎖複合体IIIの加齢による機能低下を正常化し、虚血/再灌流心臓の機能の回復を促進することを示した。
この報告では、アセチルカルニチンの作用メカニズムとして、ミトコンドリアタンパク質のアセチル化の関与を検討した。
高齢ラットにアセチルカルニチンを投与すると、心臓のアセチルカルニチン含有量を回復させ、ミトコンドリアタンパク質のリジンのアセチル化を増加させ、心臓の筋線維鞘下(subsarcolemmal)および筋原線維間(interfibrillar)のミトコンドリアにおけるリジンアセチル化タンパク質の数を増加させた。
TCA回路、ミトコンドリアのβ酸化、呼吸鎖におけるATP合成に関与する酵素タンパク質に、多くのアセチル化を認めた。
イソクエン酸デヒドロゲナーゼ、長鎖アシル-CoAデヒドロゲナーゼ、呼吸酵素複合体Vおよびアスパラギン酸アミノトランスフェラーゼのアセチル化は、酵素活性を低下させた。
いくつかのタンパク質は、アセチルカルニチンの投与後にのみアセチル化されたので、外因性アセチルカルニチンがアセチル供与体として作用することが示唆された。
アセチルカルニチン投与はミトコンドリアタンパク質の量を変化させた。 31種のタンパク質において2倍以上の量の増加あるいは減少が観察された。
以上の結果から、老化したラットの心臓において、アセチルカルニチンの投与は、タンパク質アセチル化のためのアセチル基を提供し、ミトコンドリアタンパク質の量に影響を及ぼすことが明らかになった。
老化した動物にアセチルカルニチンを投与すると、心臓のミトコンドリアのタンパク質のアセチル化を増やして、ミトコンドリアのタンパク質の量に影響を及ぼすということです。
つまり、アセチルカルニチンによるミトコンドリア機能の活性化の機序には、アセチルカルニチンによるタンパク質のアセチル化が重要だということです。
【アセチル-L-カルニチンはアセチルコリンのアセチル基を供給する】
アセチル-L-カルニチン(Acetyl-L-Carnitine)はL-カルニチン(L-Carnitine)にアセチル基(CH3CO-)が結合した体内成分です。(下図)
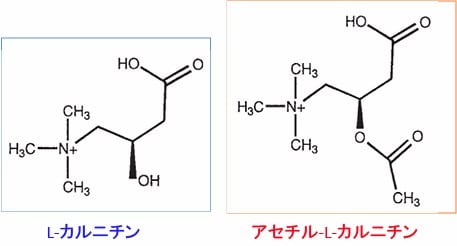
L-カルニチンは生体の脂質代謝に関与するビタミン様物質です。L-カルニチンは脂肪酸と結合し、脂肪酸をミトコンドリアの内部に運搬する役割を担っています。
脂肪酸を燃焼してエネルギーを産生する際には、脂肪酸を燃焼の場であるミトコンドリアに運ばなければなりません。中鎖脂肪酸(炭素の数が8~12個)の場合は直接ミトコンドリアに入ることができますが、長鎖脂肪酸(炭素数が13以上)の場合は、L-カルニチンが結合しないとミトコンドリアの中に入ることができません(下図)。
L-カルニチンは体内で合成されます。食事からは肉に多く含まれます。

図:脂肪酸はミトコンドリアでβ酸化によって分解されてアセチルCoAが作られ、アセチルCoAはTCA回路で代謝されるかケトン体産生に使われる。炭素数が13以上の長鎖脂肪酸はミトコンドリアに入るのにカルニチンの助けが必要であるが、炭素数12以下の中鎖脂肪酸はカルニチンが無くてもミトコンドリアに入れる。
体内のL-カルニチンのうち約1割はアセチル-L-カルニチンの状態で存在しています。アセチル-L-カルニチンは、血液脳関門を通過して脳内に到達しアセチルコリン量を増やします。
つまり、アセチル受容体であるコエンザイムA(CoA)にアセ チル基を転移させてアセチルCoAを生成させ、さらにそれがコリンに受け渡され、最終的にアセチルコリンが生成します。

図:アセチル-L-カルニチンのアセチル基はアセチルコリンの生成に使われる。
アセチルコリンは副交感神経や運動神経の末端から放出される神経伝達物質で、アセチルコリンの減少はアルツハイマー病との関連が指摘されています。
実際に、アセチル-L-カルニチンはアルツハイマー病初期症状の改善や進行を遅らせる効果が報告されています。高齢者の気分変調や抑うつ症状を軽減する効果や、認知能や記憶を改善する効果も報告されています。
アセチル-L-カルニチンは細胞内でL-カルニチンに変換するので、L-カルニチンと同じ効果(脂質の燃焼促進)があります。
さらに、アセチル-L-カルニチンは神経細胞のダメージの軽減や、ダメージを受けた神経細胞の修復・再生を促進する効果が報告されています。
したがって、抗がん剤による神経障害の軽減にも有効です。抗がん剤の効き目を高める効果も報告されています。がん治療にもっと使用されて良いサプリメントの一つです。
【アセチル-L-カルニチンはヒストンアセチル化のアセチル基を供給する】
アセチル-L-カルニチンのアセチル基がミトコンドリアのタンパク質のアセチル化を亢進することは前述しました、さらに、細胞核のヒストンのアセチル化にもアセチルカルニチンのアセチル基が使われることが報告されています。ヒストンのアセチル化は遺伝子発現の調節に重要な働きをしています。以下のような論文があります。
Mitochondrial acetylcarnitine provides acetyl groups for nuclear histone acetylation.(ミトコンドリアのアセチルカルニチンが核のヒストンのアセチル化に必要なアセチル基を供給する)Epigenetics 4(6):399-403, 2009
【要旨】
細胞核のヒストンのアセチル化と脱アセチル化の調整は、染色体DNAと転写装置の相互作用の制御に重要な役割を果たしている。哺乳類の細胞核におけるヒストンのアセチル化に必要なアセチルCoAの供給源については明らかになっていない。
我々は、ミトコンドリアで生成されたアセチルCoAは、カルニチン・アシルカルニチン・トランスロカーゼ(carnitine acylcarnitine translocase)の作用で細胞質に運ばれ、ついで細胞核に運ばれ、核でカルニチン・アセチルトランスフェラーゼ(carnitine acetyltransferase)によってアセチルCoAに変換され、ヒストンのアセチル化のアセチル基の供給源となることを明らかにした。
トランスロカーゼの遺伝的欠損は、ミトコンドリアのアセチルカルニチン依存性の核ヒストンアセチル化を著明に低下させる。これはヒストンのアセチル化にカルニチン依存性のミトコンドリアのアセチル基の重要性を示唆している。
アセチル-CoAはグルコース(ブドウ糖)や脂肪酸の分解で生成されます。
すなわち、グルコースが解糖系で代謝されてピルピン酸が作られ、ピルビン酸がミトコンドリアに入って、ピルビン酸脱水素酵素の働きでアセチル-CoAに変換されてTCA回路に入ります。脂肪酸もミトコンドリアでβ酸化によって分解されてアセチル-CoAに変換されTCA回路に入ります。このとき、グルコースが枯渇しているとアセチル-CoAは肝臓でケトン体生成に使われます。
グルコース枯渇時にアセチル-CoAがケトン体に変換されるのは、アセチル-CoAが細胞膜を通れないので、細胞膜を通過できるケトン体に変換されて脳などの他の組織の細胞にエネルギー産生の原料として運ばれるためです。
細胞核におけるヒストンのアセチル化では、アセチル-CoAのアセチル基が使われますが、このアセチル-CoAはミトコンドリアで作成され、ミトコンドリアから核への運搬にはL-カルニチンが必要ということです。この経路をまとめると以下のようになります。

図:グルコースや脂肪酸の分解によって産生されたミトコンドリア内のアセチル-CoAは、カルニチンアセチルトランスフェラーゼ(CAT)の作用により、L-カルニチンと結合してアセチル-L-カルニチンとしてミトコンドリア外の細胞質に輸送され、さらに細胞核に移行する。核に移行したアセチル-L-カルニチンは、L-カルニチンとアセチル-CoAに分解され、アセチル-CoAはヒストンアセチルトランスフェラーゼ(HAT)の作用によってヒストンをアセチル化する。
【アセチル-L-カルニチンはヒストンアセチル化作用によって抗うつ効果を示す】
アセチル-L-カルニチンはアセチル基を供給する作用によってヒストンやその他のたんぱく質のアセチル化を促進する作用があります。ヒストンのアセチル化はエピジェネシスの機序で遺伝子発現に影響します。
アセチル-L-カルニチンに抗うつ作用があることは良く知られています。この抗うつ作用がヒストンアセチル化作用と関連していることが報告されています。
以下のような論文があります。
L-acetylcarnitine causes rapid antidepressant effects through the epigenetic induction of mGlu2 receptors.(L-アセチルカルニチンはエピジェネシス機序によるmGlu2受容体の発現誘導によって急激な抗うつ効果を引き起こす)Proc Natl Acad Sci U S A. 2013 Mar 19;110(12):4804-9.
【要約】
うつ病性障害(抑うつ障害)の病態生理学に遺伝子発現のエピジェネシス機序が関与していることが知られており、うつ病のユニークな治療法のターゲットになっている。
アセチル化物質のL-アセチルカルニチン(L-acetylcarnitine ;LAC)は副作用が少なく、代謝型グルタミン酸受容体2(type 2 metabotropic glutamate receptors:mGlu2)のエピジェネシス機序による発現誘導によって抗うつ作用を示す。
遺伝的うつ病のラットモデル(Flinders Sensitive Line rats)と環境要因(慢性的に予測できないストレスによって誘導)によるマウスのうつ病モデルの両方の動物実験モデルにおいて、L-アセチルカルニチンは急速で長期間持続する抗うつ作用を示した。
両方の動物実験モデルにおいて、L-アセチルカルニチンは、代謝型グルタミン酸受容体2(mGlu2)をコードするGrm2遺伝子のプロモーター領域に結合するヒストンH3の27番目アミノ酸のリシン(H3K27)のアセチル化のレベルを増やし、さらにNF-κBのp65サブユニットのアセチル化を亢進し、その結果、Grm2遺伝子の転写を促進し、海馬および前頭前皮質におけるmGlu2受容体の量を増やした。
重要な点は、L-アセチルカルニチンの3日間の投与によって、強制水泳試験における無動時間を減らし、蔗糖嗜好を増強した。一方、抗うつ剤のクロリミプラミン(chlorimipramine)は抗うつ作用を現すのに14日間を要した。
さらに、L-アセチルカルニチンの抗うつ作用は耐性が起こらず、薬剤投与を中止した2週間後も抗うつ作用を認めた。
NF-κB阻害剤はL-アセチルカルニチンによって誘導されるmGlu2発現亢進を阻害した。一方、ヒストン脱アセチル化酵素阻害剤はL-アセチルカルニチンによるエピジェネシス機序によるmGlu2発現誘導をさらに増強した。
さらに、mGlu2遺伝子を欠損させたマウスでは、慢性の予期しないストレスによって誘導される抑うつ状態をL-アセチルカルニチンは軽減しなかった。
また、mGlu2とmGlu3受容体の阻害剤(LY341495)の単回注射はL-アセチルカルニチンの抗うつ作用を部分的に阻止した。
L-アセチルカルニチンによる急速で長期間持続する抗うつ作用は、ヒトのうつ病性障害における遺伝子発現のエピジェネシス機序の関与を強く示唆し、作用の早い抗うつ剤の開発においてユニークなアプローチを示している。
抑うつに対する評価法として強制水泳テストがあります。強制水泳テストは、水を張った容器にネズミを入れ呼吸及び浮くために必要な動作以外は動かないでいる無動時間を測定する試験です。
初めは懸命に泳ぎますが、次第にあきらめて無動となりなります。この状態を「絶望状態」と呼び、10分間中の無動であった時間を計測します。
無動時間を短縮する効果は、絶望状態にさせないことを意味するので、抗うつ作用の指標になります。
スクロース嗜好試験と呼ばれる試験もあります。スクロースは蔗糖です。スクロース溶液あるいは通常の水の入ったボトルを同時にマウスにあたえスクロース溶液を飲んだ割合を測定します.通常のマウスは甘いスクロース溶液を好んで飲みますが,うつ状態のマウスではスクロース溶液を飲む割合が少なくなります。スクロース(蔗糖)を好むようになることはうつ状態が軽減したことを意味します。
このような評価法で、L-アセチルカルニチンの抗うつ作用を証明しています。
L-アセチルカルニチンはアセチル-L-カルニチンと同じです。
アセチル-L-カルニチンはすでに複数の臨床試験でうつ病の症状を改善することが報告されています。
気分変調性障害(抑うつ神経症や神経症性抑うつとも呼ばれる比較的軽度の慢性うつ症状)を対象にしたランダム化二重盲検試験で、アセチルカルニチンは抗精神病薬のアミスルピリド(amisulpride)と同等以上の有効性を示すことが報告されています。
アセチルカルニチンは通常のヒストン脱アセチル化酵素阻害剤が示す副作用をほとんど引き起こさないので、安全性が極めて高いと考えられています。
通常、抗うつ薬の効果は十分ではなく、25〜40%のうつ病の患者が抗うつ薬による治療に抵抗性を示しています。しかも、通常の抗うつ薬がうつ病の患者の気分を改善するまでに少なくとも2〜3週間を要しています。したがって、うつ症状が深刻な患者の場合、治療の初期において自殺のリスクがあります。
この研究では、アセチル-L-カルニチンが速効的に抗うつ作用を発揮し、しかも副作用もなく、長期間にわたって良好な有効性を維持することを明らかにしています。
したがって、うつ病治療薬としてアセチル-L-カルニチンの検討を進めるべきであり、人間におけるうつ病の発症におけるエピジェネシシ機序の関与の重要性を検討しなければならない、というのがこの論文の結論です。
がん患者さんは精神的なストレスなどで抑うつ的になります。アセチル-L-カルニチンは抗がん剤による神経障害の予防にも効果があります。がん治療中のサプリメントとてもっと使用する価値があると思います。
【アセチル-L-カルニチンはmGlu2受容体の発現を亢進する】
記憶・学習などの高次脳機能において,グルタミン酸を認識するグルタミン酸受容体(GluR)は、神経細胞間の興奮性神経伝達に重要な役割を担っています。GluR は、イオンチャネル 型受容体(iGluR)と代謝型グルタミン酸受容体(mGluR) の2種類に大別されます。
代謝型グルタミン酸受容体(mGluR)は、我々の脳神経系に広く発現しているGタンパク質共役型受容体(GPCR)です。
記憶や学習・様々な感覚情報処理の分子基盤を担うほか、統合失調症やてんかん・不安などの精神疾患に対する治療薬のターゲットとしても注目されています。
前述の論文では、うつ病では海馬や前頭前皮質のmGlu2(代謝型グルタミン酸受容体2)が減少しており、アセチル-L-カルニチンはヒストン・アセチル化の機序によってmGlu2の発現を増やし、抗うつ作用を発揮するという結果です。
アセチル-L-カルニチンはNF-κBのp65サブユニットのアセチル化を亢進することによって、NF-κBの転写活性を亢進します。
代謝型グルタミン酸受容体2をコードしているGrm2遺伝子のプロモーター領域にはNF-κBに応答する部位(NF-κB–responsive elements)が多数存在するので、Grm2遺伝子の転写が亢進され、結果として脳の海馬と前頭前皮質の領域のmGlut2受容体の量は増えます。
NF-κBの転写活性を阻害するサリチル酸ナトリウム(sodium salicylate)を一緒に投与するとアセチル-L-カルニチンによるmGlu2受容体の発現亢進作用は阻止されました。これは、アセチル-L-カルニチンの作用がNF-κBの転写活性に依存することを支持しています。
この論文で重要な発見は、遺伝性うつ病のFSLラットでは、Grm2遺伝子のプロモーター領域のヒストンアセチル化が低下しており(Grm2遺伝子の転写が抑制されている)、アセチル-L-カルニチンの投与はこの領域のヒストンアセチル化を亢進したことです。
ヒストン脱アセチル化酵素阻害剤(MS-275)はアセチル-L-カルニチンと同様にmGlu2受容体の発現を亢進しました。これは、アセチル-L-カルニチンのヒストンアセチル化亢進作用がmGlu2受容体の発現亢進のメカニズムであることを支持しています。
うつ病の発症にエピジェネシス機序でのmGlu2受容体の遺伝子発現の異常の関与が明らかになっているので、この異常がうつ病治療のターゲットして注目されています。
mGlu2受容体の発現の制御にヒストンアセチル化が重要です。
ヒストン脱アセチル化酵素2(HDAC2)がGrm2遺伝子のプロモーター領域に結合が増えているとヒストンアセチル化が低下してGrm2遺伝子の発現が低下します。
アセチル-L-カルニチンはヒストンアセチル化を亢進してmGlu2受容体を増やして、うつ病の症状を軽減するというメカニズムです。
【L-カルニチンはヒストン脱アセチル化酵素を阻害する】
L-カルニチンは上記のように、長鎖脂肪酸をミトコンドリアへ運ぶのが主な作用ですが、最近の研究で、「L-カルニチンはヒストンのアセチル化を高めて、がん細胞の増殖を抑制する」ことが示されています。L-カルニチンは内因性のヒストン脱アセチル化酵素の阻害剤という報告があります。以下のような論文があります。
L-Carnitine Is an Endogenous HDAC Inhibitor Selectively Inhibiting Cancer Cell Growth In Vivo and In Vitro(L-カルニチンは内因性のヒストン脱アセチル化酵素の阻害剤で、生体内(in vivo)および試験管内(in vitro)でがん細胞の増殖を選択的に阻害する)PLoS One. 2012; 7(11): e49062.
【要旨】
L-カルニチンは、一般的には、脂肪酸を分解してクエン酸回路でATPを産生するために、長鎖脂肪酸のアシル基をミトコンドリアのマトリックスに運搬する役目が知られている。
がん細胞ではATP産生は主に細胞質での解糖系に依存しているというワールブルグの理論に基づいて、我々は、L-カルニチンをがん細胞に投与すると細胞代謝の調節に異常を来して細胞死を誘導するのではないかと予想した。
この研究では、ヒト肝細胞がん細胞株のHepG2とSMMC-7721と、胸腺細胞の初代培養、HepG2を移植したマウスを用いた。
実験にて、以下のことが明らかになった。
(1)培養細胞および移植腫瘍を使った実験系でL-カルニチンはがん細胞の増殖を選択的に抑制した。
(2)L-カルニチンの投与によって、がん細胞においてがん抑制遺伝子のp21cip1遺伝子の発現を選択的に高めたがp27kip1の発現は高めなかった。
(3)L-カルニチンは正常胸腺細胞とがん細胞の両方において、ヒストンのアセチル化を高め、アセチル化したヒストンの量を増やした。
(4)L-カルニチンはヒストン脱アセチル化酵素IとIIの活性部位に結合することによってこの酵素の活性を阻害し、ヒストンのリジンのアセチル化を高めた。
(5)L-カルニチンはp21cip1遺伝子の部分のクロマチンのアセチル化ヒストンの量を増やしたが、p27kip1遺伝子のクロマチンのアセチル化ヒストンの量には影響しなかった。
これらの結果は、L−カルニチンは脂肪酸のアシル基をミトコンドリアに運搬する役目の他に、ヒストン脱アセチル化酵素の内因性の阻害剤としても作用していることが示され、その生理的および病的意義の重要性が示唆された。
人間の1個の細胞の核には、約30億対のヌクレオチドからなるDNA(デオキシリボ核酸)が格納されています。このDNAが遺伝子の本体です。
細胞核内では、DNAはヒストンという球状の蛋白質複合体に巻き付くような状態で存在します。
ヒストンはリシン(リジン)やアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。
ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。
ヒストンによる遺伝子発現の調節は複雑ですが、簡単にまとめると、「ヒストンとDNAの結合は転写に阻害的に働く」ということです。遺伝子が転写されるためには、転写因子やRNAポリメラーゼなどの他の蛋白質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。
アセチル化というのはアセチル(CH3CO)基が結合することです。
ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。
すなわち、ヒストンのアセチル化は遺伝子発現を促進(正に制御)し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制(負に制御)されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素(=ヒストンアセチルトランスフェラーゼ)」と「ヒストン脱アセチル化酵素(=ヒストンデアセチラーゼ)」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています(下図)。
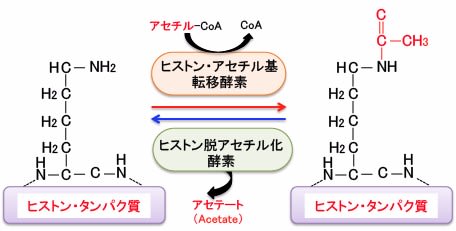
このように、ヒストンのアセチル化などによって遺伝子発現を調節する現象を「エピジェネティクス(epigenetics)」と言います。
がん発症の原因は,がん遺伝子やがん抑制遺伝子の変異,すなわち塩基配列上の変化が蓄積し,細胞増殖,接着,細胞死などの制御が異常になることによると考えられています。さらに、遺伝子の塩基配列の変化を伴わない遺伝子の発現異常,すなわちエピジェネティックな変化も発がんに大きく寄与していることが近年明らかになってきました。
このようなエピジェネティックな変化の中で、遺伝子発現の活性を調節するヒストンアセチル化は重要な役割を果たすと考えられています。
P21cip1は細胞周期の進行を担うサイクリン依存性キナーゼ(CDK)の活性を抑制するインヒビターの一つで、細胞増殖の停止、分化や老化に関わっており、がん抑制因子として捉えられています。
ヒストン脱アセチル化酵素(histone deacetylase)の阻害は、本論文のようにp21cip1のような細胞周期の進展を阻害する遺伝子の発現を高めることによってがん細胞の増殖を抑える作用が報告されており、ヒストン脱アセチル化酵素阻害剤はがんの治療薬として注目されています。
L-カルニチンはヒストン脱アセチル化酵素阻害作用があり、アセチル-L-カルニチンはアセチル基を提供することによってヒストンアセチル化を促進します。
つまり、アセチル-L-カルニチンのサプリメントとしての補充はヒストンアセチル化を亢進して認知機能を良くし、抑うつを軽減し、抗がん作用を発揮する可能性があります。ヒストンアセチル化促進作用が認知機能や記憶力を高めることは多くの報告があります(330話参照)
ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素阻害作用があります。(322話参照)
したがって、ケトン食にアセチル-L-カルニチンを併用すると抗うつ作用と抗がん作用を強化できます。(下図)

図:グルコースや脂肪酸が分解されて産生されるアセチルCoAはミトコンドリアのTCA回路でさらに代謝される。一部はL-カルニチンと結合してアセチル-L-カルニチンになり、ヒストンやその他のたんぱく質をアセチル化する際に使用される。ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害してヒストンのアセチル化を亢進する。ジクロロ酢酸はピルビン酸からアセチルCoAの変換を促進する。アセチル-L-カルニチンとジクロロ酢酸はケトン食(=βヒドロキシ酪酸)の抗がん作用、抗うつ作用、抗老化作用、寿命延長作用を強化することができる。
◎ アセチル-L-カルニチンについてはこちらへ:
| « 556)抗がん剤... | 558)がん細胞... » |




