がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
629)カンナビジオールはオピオイド(モルヒネ)の鎮痛作用を増強し、抗がん剤による神経障害性疼痛を緩和する
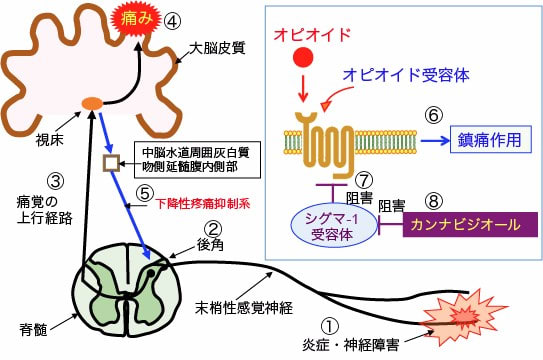
図:神経障害や炎症などによって発生した痛み刺激(①)は、末梢感覚神経から脊髄後角で脊髄の神経細胞に伝達され(②)、さらに脳幹、中脳、視床を経て(③)大脳皮質に達して痛みとして認知される(④)。大脳辺縁系からは下行性のニューロンが、中脳周囲灰白質や吻側延髄腹内側部を通って脊髄の後角に伸び、脊髄後角における末梢神経と脊髄神経の間のシナプス伝達を制御することによって痛みを調節しており、これを下行性疼痛抑制系という(⑤)。オピオイド系鎮痛薬はオピオイド受容体に作用して、感覚神経終末や脊髄後角や下降性疼痛抑制系のシナプスにおける神経伝達物質の放出を抑制する作用機序で鎮痛作用を発揮する(⑥)。シグマ-1受容体はオピオイド受容体の働きを阻害してオピオイドの鎮痛効果を減弱する(⑦)。カンナビジオールはシグマ-1受容体とオピオイド受容体の相互作用を阻害することによってオピオイドの鎮痛効果を増強する(⑧)。
629)カンナビジオールはオピオイド(モルヒネ)の鎮痛作用を増強し、抗がん剤による神経障害性疼痛を緩和する
【末期がん患者の疼痛緩和は不十分】
海外では、末期がん患者の緩和ケアに医療大麻が使用され、その有効性が認められています。日本では大麻取締法が大麻の医療使用も禁止しているため、末期がん患者にも医療大麻は使用できません。
日本の厚生労働省は国会答弁などで大麻の医療使用を認める考えは全くないと言っています。
厚生労働省が医療大麻の使用に反対する理由の一つに「医療大麻を使うメリットが無い」ことを挙げています。現在行われているオピオイド系鎮痛薬を用いた緩和ケアで十分な効果が得られているので、医療大麻を使用する必要はないという見解です。
しかし、本当に末期がん患者の疼痛が満足できるレベルに緩和されているのでしょうか。
私の経験では、オピオイド(モルヒネ)系鎮痛薬を多く使用しても、十分な疼痛コントロールが得られていないがん患者さんは少なくありません。昨年末(2018年12月26日)の新聞に以下のような記事が出ていました。
終末期がん患者36%に痛み=初の全国調査—国立がんセンター
国立がん研究センターは、終末期のがん患者の36%が、死亡する前の1カ月間を痛みがある状態で過ごしていたとする調査結果を発表した。終末期の実態に関する全国調査は初めて。同センターは「苦痛を和らげる緩和ケアの改善が必要だ」と分析している。
同センターは今年2〜3月、2016年にがんで死亡した患者の遺族を対象にアンケートを実施。3204人に質問票を送り、51%に当たる1630人から有効回答を得た。死亡時の患者の年齢は平均78.1歳。回答したのは配偶者が39%、子が40%などだった。
死亡前の1カ月間に痛みが少なく過ごせたかという質問に対し、計52%が「ややそう思う」「そう思う」「とてもそう思う」と回答し、痛みが少なかったと考えられた。半面、「全くそう思わない」「そう思わない」「あまりそう思わない」「どちらともいえない」と回答し、痛みがあったと考えられた人も計36%いた。
精神面のつらさがあったとの回答は36%だった。また、死亡の1週間前になると痛みのある患者は64%に増え、うち28%は強い痛みを抱えていた。
一方、家族の介護負担が大きかったとの回答は42%、患者との死別後に抑うつ症状があるとの回答は17%あった。
緩和ケアでは、医療用麻薬などを用いて苦痛を軽減する。同センターの加藤雅志・がん医療支援部長は「緩和ケアの改善で、痛みのある患者を減らせるはずだ」と話した。
[時事通信社]
つまり、「オピオイド系鎮痛薬を用いた現状の緩和ケアで十分な効果が得られている」という厚生労働省の見解は間違いだということになります。その事実を、厚生労働省直轄の国立がん研究センターが認めているので、否定しようがありません。
そこで、もし医療大麻が末期がん患者の緩和ケアに有効であることを示す十分な根拠があれば、大麻の医療使用を禁止している大麻取締法の第四条は、健康や幸福や生存を追求することを保証した憲法の基本的人権の侵害にあたることになります。
大麻取締法第四条と人権の関係については478話で考察しています。
【がんの緩和ケアにおける医療大麻の有効性】
大麻が食欲を高め、睡眠を良くし、疼痛を緩和し、気分を楽にする(抗うつ作用)などの効果があることが多くの研究で証明されています。
大麻は3000年以上前から医療目的で使用されていました。
2500年くらい前に既に大麻ががんの鎮痛目的で使用されていたことを示す証拠が発見されています。
アジアの中央に位置するアルタイ共和国のウコク高原(Ukok Plateau)の大規模な考古学調査で、永久凍土から古来アルタイ山脈で暮らしていたパジリク人と見られる凍ったミイラが見つかっています。その一つに1993年に発掘された「シベリアの氷の女性(Siberian Ice Maiden)」があります。
「ウコクの王女(Princess of Ukok)」や「アルタイの王女(Altai Princess)」などとも呼ばれています。
今から2500年くらい前に生きていた女性で、「王女(Princess)」となっていますが、実際は祈祷師か巫女のような職業で、病気の治療に関する知識を持っていたことが推測されています。
永久凍土によって保存状態は非常に良く、その後の医学的検査(MRIなど)で、リンパ節転移を伴う乳がんにかかっていたことが判明しています。
さらに、このミイラが発掘された石室から大麻が見つかっています。これは痛み止めとして自らが使用したものと研究者は考えています。ミイラの発見者である考古学者ナターリヤ・ポロスマク(Natalya Polosmak)教授は「この女性は、乳がんの痛みを鎮めるためにマリファナ吸引が欠かせなかったはず」と発表しています。
世界最大の医学情報サイトのMedscapeが、医療大麻の使用に関して、米国の1544人の医師にアンケート調査を2014年4月に行っています。この時点で、米国では21州+ワシントンDCで医療大麻の使用が合法化され、他に10州以上で合法化の動きがある状況です。(2018年末の段階では30州以上で医療大麻の使用が許可されています)
この調査で、多くの医師が医療大麻が合法化され、病気の治療の選択肢の一つとして認められることに賛成すると言っています。
連邦法の規制物質法で大麻はスケジュールI(濫用の危険があり、医療用途が無い)に分類されているため、医学的研究が遅れており、大麻の医療効果に関しては、まだ十分なエビデンスは得られていない状況です。
しかし、医療大麻の合法化する州が増え、最初に合法化したカリフォルニア州(1996年に合法化)から20年が経過し、多くの医者が大麻の薬効を経験的に知るようになり、医療大麻の合法化や研究推進に関して多くの医師が賛成するようになっています。
この調査では以下のような結果が得られています。
69%が「医療大麻はある種の病気や症状の治療に役立つ」
67%が「医療大麻は患者の治療手段の選択肢の一つにするべき」
56%が「国として合法化すべき」
医療大麻がまだ非合法の州の医師の50%が「自分の州でも医療大麻を合法化すべき」
医療大麻の合法化を検討している州の医師の52%が「自分の州でも医療大麻を合法化すべき」と考えています。
がんの専門医と血液疾患の専門医では、82%の医師が「医療大麻は患者の役に立つ」と考えています。これらの専門医では82%の医師が、治療の選択肢として認められるべきだという意見です。
医療大麻は、がん性疼痛や抗がん剤治療の副作用としての吐き気の軽減、食欲増進の目的で使用されています。
医療大麻が最も使われているのは疼痛です。
鎮痛剤として大麻はオキシコドン(oxycodone)のようなモルヒネ系(オピオイド系)の鎮痛薬よりも有効で、しかも依存性になる可能性が低いというメリットがあります。
米国では、医療関係者(医師や看護師など)の多くが、がん患者における吐き気、疼痛、食欲不振の治療に医療大麻あるいは大麻製剤が有用であることを認識しており、小児に使用することも賛成しています。
以下のような報告があります。
Pediatric oncology providers and use of medical marijuana in children with cancer.(小児がん領域の医療従事者と小児がん患者における医療大麻の使用)米国臨床腫瘍学会:2016年6月6日(Abstract 10581)
医療大麻の使用が許可されているイリノイ州、マサチューセッツ州、ワシントン州において、小児がんの治療に関わっている医療従事者(医師、看護師など)の調査です。
回答した301人中、92%が小児がん患者が医療大麻を使用することをサポートする(賛成する)と回答しています。
小児がんの早期のステージでの医療大麻の使用に賛成は34%、末期のステージの患者の緩和ケアに使用することは88%が適切であると回答しています。
つまり、米国では、小児がん患者の治療に携わっている医療従事者の多くは、小児がん患者における医療大麻の使用に肯定的態度を示し、がん患者から頻繁に問い合わせを受けているのが現状です。(496話参照)
米国以上に医療大麻が広く普及しているのがイスラエルです。イスラエルのヘブライ大学で大麻の成分を研究していたラファエル・メコーラム博士らは、大麻の精神活性作用物質であるテトラヒドロカンナビノール(THC)を1964年に初めて抽出し、さらに大麻のもう1つの主成分であるカンナビジオール(CBD)に抗炎症・鎮痛作用があることを発見しました。
この成果を受けてイスラエルでは医療大麻の研究が飛躍的に進み、その有用性が認められ、医療目的での大麻の使用が合法化されています。そのイスラエルから以下のような報告があります。
Prospective analysis of safety and efficacy of medical cannabis in large unselected population of patients with cancer.(選択されていない大規模ながん患者集団における医療大麻の安全性と有効性の前向き解析。)Eur J Intern Med. 2018 Mar;49:37-43. doi: 10.1016/j.ejim.2018.01.023.
【要旨】
研究の背景:がんは主要な死因として公衆衛生上の重大な問題である。進行したがん患者の疼痛および吐き気を緩和することを目的とする緩和的治療は、腫瘍学の基礎である。 2007年にイスラエル保健省は、がん患者の症状の緩和のための医療大麻の使用を承認した。この研究の目的は、医療大麻による治療を受けているがん患者の疫学的特徴を検討し、この療法の安全性および有効性を明らかにすることである。
方法:2015年から2017年の間に医療大麻で治療された2970人のがん患者の治療プログラムの一部として日常的に収集されたデータを分析した。
結果:患者の平均年齢は59.5±16.3歳で、54.6%が女性であった。患者の26.7%は過去に大麻を経験していた。多いがんの種類は、乳がん(20.7%)、肺がん(13.6%)、膵臓がん(8.1%)、結腸直腸がん(7.9%)で、ステージ4のがん患者は51.2%であった。
医療大麻の使用の目的は、睡眠障害(78.4%)、痛み(77.7%、平均強度8/10)、衰弱(72.7%)、吐き気(64.6%)、食欲不振(48.9%)であった。
6ヵ月間のフォローアップ後、902人の患者(24.9%)が死亡し、682人(18.8%)が治療を中止した。残りの1211人(60.6%)が回答し、 回答したがん患者の95.9%が状態の改善を報告し、45人の患者(3.7%)は変化がないと報告し、4人の患者(0.3%)は病状の悪化を報告した。
結論:がん患者の緩和治療としての医療大麻は、副作用が少なく、がんに関連した症状の緩和において、安全で有用な治療法である。
韓国では、2018年に薬物規制法の改正を発表し、サティベックスやエピディオレックスのような大麻から抽出された医薬品を合法化するとしています。
しかし、日本では大麻取締法第四条の規定により、大麻から製造された医薬品の使用は出来ません。
そこで、大麻取締法に規制されない大麻の茎から抽出したカンナビジオール(Cannabidiol:CBD)の薬効と臨床応用が注目されています。てんかんなどの痙攣性疾患に対するCBDの有効性については多くの報告があります。ここでは、がん治療におけるCBDの有効性や有用性について紹介します。
【カンナビジオールは多くの受容体やイオンチャネルをターゲットにする】
大麻(Cannabis sativa)の成分として、現在までに500を超える化合物が分離・同定されています。これらの大麻成分の中に「カンナビノイド」と総称される一群の化合物があります。カンナビノイドは大麻草固有の成分で、他の植物には見つかっていません。
カンナビノイドには、Δ9-テトラヒドロカンナビノール(THC)、カンナビジオール(CBD)、テトラヒドロカンナビヴァリン、カンナビゲロール、カンナビクロメンなど100種類以上が見つかっています。
カンナビジオール(CBD)はΔ9-テトラヒドロカンナビノール(THC)と並んで大麻の主要なカンナビノイドです。
脳内報酬系や薬物依存性において、Δ9-テトラヒドロカンナビノール(THC)はこれらを高める作用があり、カンナビジオール(CBD)は逆に抑える作用があります。したがって、この2種類のカンナビノイドの量の比率によって、脳内報酬系や依存性への効果が異なってくるのです。
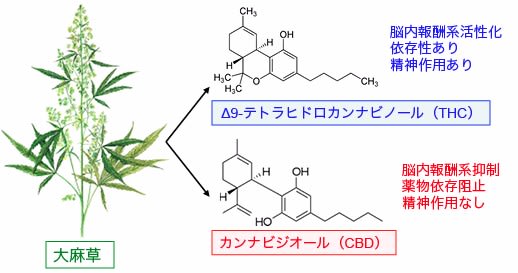
図:大麻の薬効成分の主体は、Δ9-テトラヒドロカンナビノール(THC)とカンナビジオール(CBD)で、この2つは全く異なる作用機序と薬効を示す。THCは脳内報酬系を活性化して依存性があり、精神作用(気分を高揚する作用)がある。一方、CBDには精神作用ななく、脳内報酬系を抑制して薬物依存を阻止する作用がある。
CBDはカンナビノイド受容体のCB1とCB2には作用しないためTHCのような精神作用はありません。その他の受容体(セロトニン受容体の5-HT1Aなど)やイオンチャネル(TRPV1など)に作用して多彩な作用を発揮します。

図:カンナビジオールは様々な受容体に作用して、その働きに影響する。図内の(+)はその受容体にアゴニスト(作動薬)として作用して受容体を刺激する。(−)は拮抗的あるいは阻害的に作用してその受容体の働きを抑制する。内因性カンナビノイドの受容体であるCB1/CB2のアゴニスト(作動薬)に対してカンナビジオールは拮抗作用を示す。さらに、カンナビジオールはCB1とCB2に対して逆アゴニストとして働き、CB1/CB2受容体の働きを阻害する。カンナビジオールはセロトニン受容体の5-HT1A受容体とTRPV1-2バニロイド受容体を活性化する。その他にも様々な受容体やタンパク質と作用して活性化や阻害の作用を示し、これらの総合的な作用によって多彩なメカニズムで抗がん作用を発揮する。(図はBr J Clin Pharmacol 75(2):303-312, 2012年のFigure 2より改変)
【侵害受容性疼痛と神経障害性疼痛】
モルヒネや大麻やカンナビジオールの鎮痛効果のメカニズムを理解するためには、痛みが発生するメカニズムを理解する必要があります。
切り傷や打撲や火傷などで組織が傷害を受けて炎症が起こると、ブラジキニンやヒスタミンやプロスタグランジンなどの炎症性メディエーターと呼ばれる痛みを起こす化学物質が産生され、これらの物質が末梢神経にある「侵害受容器」という部分を刺激することで痛みを感じます。このような炎症や刺激により発生する疼痛は「侵害受容性疼痛」と呼ばれています。誰もが何度も経験している痛みです。
がんや神経変性や物理的傷害などによって末梢神経や中枢神経が障害されて痛みが発生する場合があります。このような神経の直接的な障害による痛みを「神経障害性疼痛」と言います。見た目には傷や炎症はないものの、神経が傷つくことによって起こる痛みです。
神経障害性疼痛の原因として、神経組織へのがん細胞の浸潤、帯状疱疹ヘルペスやHIVなどのウイルスの感染による神経細胞のダメージ、多発性硬化症のような脱髄性疾患、糖尿病などの代謝障害、抗がん剤による神経のダメージ、事故や怪我などによる神経の切断や障害、脊柱管狭窄やヘルニアによる神経の圧迫などがあります。
知覚神経の末端には熱刺激や化学刺激や機械的刺激などそれぞれの刺激に反応する受容体が存在し、それらの受容体が刺激されると、電位依存性Naチャンネルが活性化されて活動電位が発生し、その信号が脊髄を経由して脳に伝達され、脳はこの信号を疼痛と認識します。
脊髄では、感覚神経は後方(後角)に集まります。末梢からの痛みのシグナルは脊髄の後角で別の神経にシナプスを介して伝達されます。
シナプスは神経細胞と神経細胞を結ぶ接合部位で、神経細胞の軸索を伝って刺激(活動電位)がシナプスに達すると、シナプス間隙に神経伝達物質が放出され、それがシナプス後細胞に存在する受容体に結合することによって細胞間の情報伝達が行われます。
脊髄後角の神経細胞に伝達された疼痛シグナルは、上行性に脳幹、中脳、視床を経て大脳皮質と大脳辺縁系に到達します。辺縁系からは下行性の神経細胞が、中脳水道周囲灰白質や吻側延髄腹内側部を通って脊髄の後角に伸びます。この神経伝達系は「下行性疼痛抑制系」と呼ばれ、脊髄後角でのシナプス伝達に作用して、痛みを軽減したり増強したりする役割を持ちます。
すなわち、脊髄後角における末梢神経と脊髄神経の間での痛みの伝達は上位の脳により制御されているのです。特定の脳領域を刺激すると痛みが軽減することが知られています。このように脳内には痛みを軽減する仕組みが備わっており、この仕組みを利用して痛み和らげる薬物がいくつか開発され、臨床で使われています。
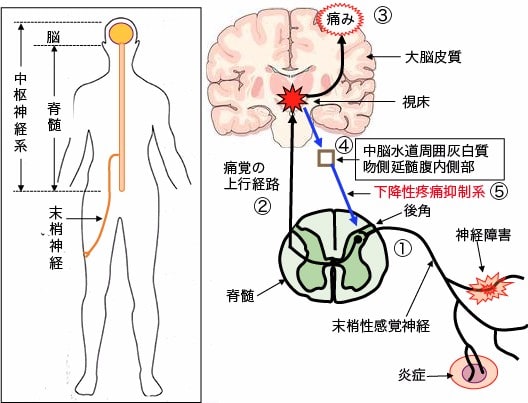
図:神経障害や炎症などによって発生した痛み刺激は、末梢感覚神経から脊髄後角で脊髄の神経細胞に伝達され(①)、さらに脳幹、中脳、視床を経て(②)大脳皮質に達して痛みとして認知される(③)。大脳辺縁系からは下行性のニューロンが、中脳周囲灰白質や吻側延髄腹内側部を通って脊髄の後角に伸び、脊髄後角における末梢神経と脊髄神経の間のシナプス伝達を制御することによって痛みを調節している(④)。これを下行性疼痛抑制系という(⑤)。
【オピオイドはμオピオイド受容体を刺激して鎮痛作用を発揮する】
モルヒネなどのオピオイド系鎮痛剤はオピオイド受容体に作用して効果を発揮します。
オピオイド受容体にはデルタ(δ)、カッパ(κ)、ミュー(μ)などのサブタイプがありますが、モルヒネの鎮痛作用は主にミュー受容体が関与しています。
ミュー(μ)受容体はモルヒネ(Morphine)の頭文字をとってμ受容体と呼ばれるようになった経緯があり、モルヒネの鎮痛作用に最も関連がある受容体です。
オピオイド受容体はGタンパク質共役型受容体(7回膜貫通型受容体)で、神経細胞や免疫細胞に分布しています。
μオピオイド受容体は末梢感覚神経においては、侵害受容線維であるC線維やAδ線維の前シナプス末端部に存在し、リガンド(受容体に結合して作用する作動薬)の結合により膜電位依存性のカルシウムチャネルの機能を抑制し、疼痛伝達物質(サブスタンスPなど)の放出抑制によって鎮痛効果を示します。
中枢神経系では、μオピオイド受容体は脊髄後根、大縫線核、中脳水道周囲灰白質、視床などに局在しています。これは下降性疼痛抑制系において痛覚情報伝達・制御系に関与している部位です。
つまり、モルヒネはμオピオイド受容体に結合することで痛覚の伝達を遮断あるいは痛覚抑制系の増強を介して、鎮痛作用を発現すると理解されています。

図:神経障害や炎症などによって発生した痛み刺激は、末梢感覚神経から脊髄後角で脊髄の神経細胞に伝達され(①)、さらに脳幹、中脳、視床を経て(②)大脳皮質に達して痛みとして認知される(③)。大脳辺縁系からは下行性のニューロンが、中脳周囲灰白質や吻側延髄腹内側部を通って脊髄の後角に伸び、脊髄後角における末梢神経と脊髄神経の間のシナプス伝達を制御することによって痛みを調節しており、これを下行性疼痛抑制系という(④)。オピオイド系鎮痛薬が作用するμオピオイド受容体(⑤)は、感覚神経終末や脊髄後角や下降性疼痛抑制系のシナプスにおける神経伝達物質の放出を抑制する作用機序で鎮痛作用を発揮する(⑥)。
【シグマ-1受容体のアンタゴニストはオピオイドの鎮痛効果を増強する】
近年、鎮痛薬開発においてシグマー1受容体がターゲットとして注目されています。例えば、以下のような報告があります。
Antinociception by Sigma-1 Receptor Antagonists: Central and Peripheral Effects.(シグマ-1受容体アンタゴニストによる抗侵害受容作用:中枢性と末梢性の効果)Adv Pharmacol. 2016;75:179-215.
【要旨】
侵害受容(組織の損傷など侵害刺激を受け取ること)におけるシグマ-1受容体の調節的役割を支持する多くの証拠がある。たとえば、シグマ-1受容体を欠損したマウスでは疼痛が軽減し、シグマ-1受容体の阻害剤は抗侵害受容効果(鎮痛効果)を発揮する。
シグマ-1受容体アンタゴニストの単独およびオピオイドとの併用(オピオイドの鎮痛効果を増強する)における、シグマ-1受容体の阻害剤による抗侵害受容作用は、中枢および末梢部位の両方で報告されている。
中枢レベルでは、行動(動物の疼痛モデル)、電気生理学的(脊髄巻き上げ記録)、神経化学的(神経伝達物質の脊髄放出)レベルおよび分子レベル(NMDAR機能)での知見は、求心性入力の持続によって起こる興奮性の増強を抑制するシグマ-1受容体アンタゴニストの役割を支持する。
組織損傷/炎症または神経損傷後の活動誘発性可塑性変化(中枢性感作)の減衰は、シグマ-1受容体アンタゴニストの中枢性の抑制効果を説明する。
さらに、最近の情報は、シグマ-1受容体が脊髄の後根神経節において高度に発現していることから、末梢性の疼痛制御におけるシグマ-1受容体の関与を示している。
実際、シグマ-受容体アンタゴニストの局所末梢投与は炎症による痛覚過敏を軽減する。
シグマ-1受容体阻害剤はオピオイドによる鎮痛効果を増強する。
全体として、シグマ-1受容体の活性化は疼痛を増強しオピオイドによる抗侵害受容を抑制する。一方、シグマ-1受容体の阻害は疼痛過敏症を抑制し、中枢神経系および末梢神経の両方でオピオイドの鎮痛効果を増強する。
Efficacy of a Novel Sigma-1 Receptor Antagonist for Oxaliplatin-Induced Neuropathy: A Randomized, Double-Blind, Placebo-Controlled Phase IIa Clinical Trial.(オキサリプラチン誘発性神経障害に対する新規シグマ-1受容体アンタゴニストの有効性:無作為化二重盲検プラセボ対照第IIa相臨床試験)Neurotherapeutics. 2018 Jan;15(1):178-189.
【要旨】
この試験では、オキサリプラチン誘発性末梢神経障害の改善におけるMR309の有効性が評価された。第2相、無作為化、二重盲検、プラセボ対照、多施設共同臨床試験で、FOLFOXを投与されている結腸直腸癌患者を対象にMR309(400 mg /日、1サイクルあたり5日投与)の有効性を評価した。評価の指標には、熱感受性および全神経障害スコアの24週間の定量的尺度の変化が含まれた。合計で124人の患者がMR309またはプラセボに1:1で無作為に振り分けられた。
計画された12回のオキサリプラチンサイクルを完了する前に、63人(50.8%)の患者が早期に中止した。がんの進行による早期中止はMR309群はプラセボ群より数なかった(MR309投与群が7.4%、プラセボ群が25.0%、p = 0.054)。
MR309は寒冷疼痛閾値温度を有意に低下させた。総神経障害スコア、健康関連の生活の質の測定、および神経伝導パラメータは両群で同様に変化したが、重度の慢性神経障害を有する患者の割合(有害事象に関する国立がん研究所基準の3以上)は有意に低かった(MR309群で3.0%対プラセボ群で18.2%、p = 0.046)。
投与されたオキサリプラチンの総量は、MR309投与群においてより多かった(MR309投与群で1618.9mgに対してプラセボ群は1453.8mg, p=0.049)。
MR309による間欠的治療はオキサリプラチンによる急性神経障害の減少とオキサリプラチン投与量の増加と関連しており、オキサリプラチンによる慢性的な神経障害に対する潜在的な神経保護的役割を示した。さらに、MR309は許容できる安全性プロファイルを示した。
以上の2つの研究結果は、シグマ-1受容体のアンタゴニスト(阻害剤)はオピオイドの鎮痛効果を増強し、オキサリプラチンによる神経障害性疼痛を軽減することを示しています。
受容体へ作用する薬には二通りあり、一つは受容体の機能を高めるもので「アゴニスト(作用薬あるいは作動薬)」と呼び、もう一つは逆に受容体の機能を阻害することによって効果を発揮する薬で「アンタゴニスト(拮抗薬あるいは遮断薬)」と呼びます。
アゴニストは受容体分子に結合して本来の伝達物質やホルモンと同様の作用を示し、アンタゴニストは受容体とリガンドの相互作用を邪魔して受容体の働きを阻害する物質です(図)。

図:特定の受容体に特異的に結合して細胞機能を作動させる物質をアゴニスト(作動薬)と言い、逆に受容体の働きを弱める物質をアンタゴニスト(遮断薬)と言う。アンタゴニストはアゴニストの作用を弱めたり、受容体の働きを完全に阻害したりする。
Sigma-1受容体は一部のオピオイドや覚せい剤の結合分子でもあることから以前はオピオイド受容体の一つと考えられていました。.しかし近年の研究により,Sigma-1受容体がシャペロンタンパク質としてさまざまなタンパク質に結合し,その機能や発現を調節することが明らかとなってきました。
シグマ1-受容体は223アミノ酸からなる2回膜貫通型タンパク質で、全身で発現しています。
細胞内では小胞体膜に局在しますが,小胞体の中でもとりわけミトコンドリアに接するMAM(mitochondria-associated ER membrane)に豊富に存在しています。MAMは小胞体とミトコンドリアの近接した領域で、様々なタンパク質が局在しており、シグマ-1受容体はこれらの機能分子に結合し、小胞体–ミトコンドリア間のCa2+輸送やエネルギー産生,脂質輸送など多彩な生理機能を調節していると考えられています。
シグマ-1受容体は極めて多彩な働きを担っていますが、その全体像は複雑すぎるのと、まだ不明な部分が多いので省略します。
シグマ-1受容体は神経伝達に関わる幾つかの受容体やチャネルの機能を制御しており、疼痛緩和の医薬品開発のターゲットとして近年注目されています。実際に、シグア-1受容体の阻害剤が鎮痛剤として開発されています。
シグマ-1受容体の阻害剤がオピオイドの鎮痛作用を増強することは1990年代から報告されています。シグマ-1受容体はオピオイド受容体と結合して複合体を形成してオピオイド受容体を阻害しています。したがって、シグマ-1受容体阻害剤はオピオイド受容体の鎮痛効果を増強します。
シグマ-1受容体はオピオイドによる鎮痛作用を阻害する作用がありますが、その理由は不明です。
生体反応は常に刺激(促進)と阻害(抑制)の2つのメカニズムで調節されています。炎症部位で疼痛を起こると、生体は内因性オピオイドを産生して痛みを軽減しようとします。しかし、疼痛は生体に対する侵害であり、痛みが簡単に除去できると困る側面もあります。したがって、内因性オピオイドの鎮痛作用を阻害するメカニズムも存在します。このようなオピオイド受容体の鎮痛作用を阻害するメカニズムとしてシグマ-1受容体が存在するかもしれません。
詳細は省きますが、上記の2つの論文は、シグマ-1受容体のアンタゴニスト(阻害剤)はオピオイド(モルヒネ)の鎮痛効果を増強し、オキサリプラチンなどの抗がん剤による神経障害性疼痛を緩和する効果が期待できることを示唆しています。
【カンナビジオールはモルヒネの鎮痛効果を増強する】
カンナビジオールがシグマ-1受容体を阻害し、モルヒネの鎮痛効果を増強する作用が報告されています。
Cannabidiol enhances morphine antinociception, diminishes NMDA-mediated seizures and reduces stroke damage via the sigma 1 receptor.(カンナビジオールはモルヒネの抗侵害受容を増強し、シグマ1受容体を介してNMDA媒介性発作を減少させ、脳卒中ダメージを軽減する)Mol Brain. 2018 Sep 17;11(1):51.
【要旨】
大麻草(Cannabis sativa)に存在する主要な非精神性化合物であるカンナビジオールは、アルツハイマー病やパーキンソン病などの慢性神経変性疾患、虚血性脳卒中、てんかんなどのけいれん性症候群、精神障害、神経障害性疼痛、ある種のがんなど様々なヒト疾患に対して治療効果が認められている。
カンナビジオールは内在性カンナビノイド受容体CB1およびCB2に直接結合することはなく、多くの研究努力にもかかわらず、その具体的な標的は完全にはまだ同定されていない。
特に、シグマ1受容体の拮抗薬は、N-メチル-D-アスパラギン酸(NMDA)型グルタミン酸受容体(NMDAR)活性を阻害し、前述の疾患の大部分に対して好ましい治療効果を示す。
したがって、我々は、NMDA過活動性が重要な役割を果たす3つの動物モデル、すなわちオピオイド鎮痛の減弱、NMDA誘発性痙攣症候群および虚血性脳卒中に対するカンナビジオールの効果を調べた。
In vitroの実験では、カンナビジオールはNMDA受容体のNR1サブユニットとシグマ-1受容体の調節的結合を阻止し、この作用はシグマ-受容体阻害剤(BD1063 と progesterone)と同じであり、この作用はシグマ-1受容体アゴニストによって阻止された。(注:アゴニストは受容体に結合して活性化する物質)
カンナビジオールまたはBD1063のin vivo投与はモルヒネによる中枢性の鎮痛効果を増強し、NMDA誘発性野痙攣症候群を軽減し、永続的な片側中大脳動脈閉塞により引き起こされる梗塞サイズを縮小した。
そしてカンナビジオールのこれらの効果は、シグマ-1受容体刺激剤(アゴニスト)のPRE084 と PPCCによって減弱し、そしてシグマ-1受容体を遺伝的に欠損するマウス(σ1R-/- mice)では認められなかった。したがって、カンナビジオールはシグマ-1受容体に対して阻害活性を示し、上記の実験状況においてNMDAR過活性の悪影響を軽減する。
前述のように、侵害受容(組織の損傷など侵害刺激を受け取ること)におけるシグマ-1受容体の調節的役割を支持する多くの証拠があります。たとえば、シグマ-1受容体を欠損したマウスでは疼痛が軽減し、シグマ-1受容体の阻害剤は抗侵害受容効果を発揮します。
シグマ-1受容体阻害剤の単独およびオピオイドとの併用(オピオイドの鎮痛効果を増強する)における、シグマ-1受容体の阻害剤による抗侵害受容作用は、中枢および末梢部位の両方で報告されています。
さらに、最近の情報は、シグマ-1受容体が脊髄の後根神経節において高度に発現していることから、末梢性の疼痛制御におけるシグマ-1受容体の関与を示しています。
実際、シグマ-受容体阻害剤の局所末梢投与は炎症による痛覚過敏を軽減します。
シグマ-1受容体阻害剤はオピオイドによる鎮痛効果を増強します。全体として、シグマ-1受容体の活性化は疼痛を増強しオピオイドによる抗侵害受容を抑制します。一方、シグマ-1受容体の阻害は疼痛過敏症を抑制し、中枢神経系および末梢神経の両方でオピオイドの鎮痛効果を増強します。
NMDA(N-methyl-d-aspartate)受容体はイオンチャネル型のグルタミン酸受容体で、中枢神経系における主要な興奮性情報伝達を担っています。
シグマ-1受容体は小胞体膜に発現する 223 アミノ酸残基からなるタンパク質です。
シグマ-1受容体欠損マウスではカプサイシン刺激後の機械刺激に対する反応性が著しく減弱するという報告があります。カプサイシンはグルタミン酸 NMDA 受容体を介して、 侵害刺激を増強します。
実際に、シグマ-1受容体アンタゴニスト は脊髄後角ニューロンのホルマリン刺激によるNMDA 受容体のリン酸化反応を抑制し、痛み を軽減する作用があります。
いろいろとメカニズムは複雑ですが、カンナビジオールはシグマ-1受容体を阻害して、モルヒネの鎮痛効果を増強し、NMDA受容体を介する神経障害を阻害して神経細胞を保護する作用があると考えられます。
以上から、がん患者において、オピオイド鎮痛薬服用中や抗がん剤治療中にカンナビジオールを併用することは有用であると言えます。
さて、医療大麻の問題に戻すと、「大麻取締法が医療大麻の研究や使用を禁止している状態」は憲法違反と言えなくもありません。
多くの進行がんの患者さんが痛みに苦しんで亡くなっており、家族はそれで辛い思いをしています。医療大麻は、その苦痛を減らす効果があることが、最近の多くのエビデンスで明らかになっています。
そうなると、医療大麻を使用できない状況を作り出している日本国を、家族をがんで亡くした人々が、「痛みで苦しんで家族が亡くなったのは医療大麻を認めない国の怠慢のせいだ」と裁判で訴えれば、裁判に勝って賠償金を取れそうな気がします。
誰か、そのような行動を起こす人がいれば、私は協力します。
国を相手に訴訟を起こさなければ、日本における医療大麻の問題は解決しないと思います。
◉ カンナビジオールは抗がん剤の副作用軽減に有効です。(詳しくはこちらへ)
| « 628)メトホル... | 630)カンナビ... » |



