がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
781)がん組織をアルカリにするとがん細胞は死滅する(その2):炭酸脱水酵素阻害剤

図:炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する(①)。細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる(②)。細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素(CO2)を重炭酸イオンと水素イオンに変換する(③)。V型ATPアーゼ(vacuolar ATPase)は細胞内の水素イオン(プロトン)を細胞外に排出する(④)。重炭酸イオンは細胞内に保持される(⑤)。その結果、細胞外pH(pHe)は低下してより酸性化し(⑥)、細胞内pH(pHi)はよりアルカリ化される(⑦)。COX-2阻害剤のセレコキシブはCa IIとCa IXの両方を阻害する(⑧)。プロトンポンプ阻害剤はV-ATPaseを阻害する(⑨)。ジクロロ酢酸ナトリウムはミトコンドリアの代謝を活性化してCO2の産生を増やす(⑩)。重炭酸ナトリウム(重曹)は細胞外の水素イオン(プロトン)を中和する(⑪)。セレコキシブとプロトンポンプ阻害剤とジクロロ酢酸ナトリウムの3種類を併用すると、がん細胞内pHが低下(酸性化)して増殖が低下し死滅する。がん細胞外pH(pHe)がアルカリ化すると、がん細胞の浸潤や転移が抑制され、がん細胞に対する免疫細胞(T細胞やNK細胞)の働きが良くなる。
781)がん組織をアルカリにするとがん細胞は死滅する(その2):炭酸脱水酵素阻害剤
【がん細胞は乳酸産生が増えている】
がん細胞の代謝の特徴は、酸素が十分にあってもミトコンドリアでの酸化的リン酸化によるATP産生が抑制され、酸素を使わないグルコースの分解(解糖系)が亢進していることです。そのため、グルコース(ブドウ糖)の取込みが増え、乳酸の産生が増えています。
解糖系でできたピルビン酸は、嫌気的条件(酸素が無い状態)では乳酸に変換されます。グルコースからピルビン酸まで分解したあと(この過程を解糖という)、酸素があればTCA回路(クエン酸回路)と電子伝達系による酸化的リン酸化によってATPを生成しますが、酸素が無い場合はピルビン酸からさらに乳酸に変換されます。ピルビン酸を乳酸に変換する酵素が乳酸脱水素酵素(Lactate Dehydrogenase; LDH)です。(図)。

図:グルコースが解糖系でピルビン酸(①)まで分解されたあと、酸素があればミトコンドリアでピルビン酸脱水素酵素(Pyruvate Dehydrogenase; PDH)によってアセチルCoAに変換され(②)、TCA回路でさらに代謝され(③)、電子伝達系(呼吸鎖)で酸化的リン酸化によってATPが産生される(④)。酸素が無い条件では、ピルビン酸は乳酸脱水素酵素(Lactate Dehydrogenase; LDH)によって乳酸に変換される(⑤)。がん細胞では、LDHの活性が亢進し、PDHの活性は抑制されており、酸素が十分に使える状況でも、ミトコンドリアでの酸素呼吸(酸化的リン酸化)は抑制され、乳酸産生が亢進している。
がん細胞の場合は、酸素が十分にあっても、ミトコンドリアでの酸化的リン酸化を抑制しているので、乳酸の方に行きます。なぜ、ピルビン酸で止まらないで乳酸に変換されるかというと、その理由は、解糖系で還元されたNADH(還元型ニコチンアミドジヌクレオチド)を酸化型のNAD+に戻すためです。NAD+が枯渇すると解糖系が進行しなくなります。(図)

図:解糖系では1分子のグルコースから2分子のピルビン酸、2分子のATP、2分子のNADH + H+が作られる。乳酸発酵では、NADH + H+を還元剤として用いてピルビン酸を還元して乳酸にする。この乳酸発酵によってNAD+を再生することによって酸素を使わないATP産生(解糖)が続けられる。その結果、乳酸が多く産生される。
解糖系でのグルコースからピルビン酸への代謝で、1分子のグルコースから2分子のATPを産生できます。乳酸発酵によって酸化型NAD(NAD+)を再生することによって、がん細胞は無酸素条件下で生きていけるのです。
【がん細胞は大量のプロトン(水素イオン)を産生している】
解糖系ではグルコースからピルビン酸、ATP、NADH + H+が作られます。嫌気的解糖(乳酸発酵)では、NADH + H+を還元剤として用いてピルビン酸を還元して乳酸に変換します。乳酸に変換する反応によってNAD+を再生することによって解糖系での代謝が続けられます。したがって、解糖系が亢進すると、細胞内で乳酸とプロトン(H+)が増えます。嫌気的解糖の反応をまとめると以下のような化学反応になります。
グルコース+ 2 ADP → 2 ATP + 2 乳酸 + 2 H+ + 2 H2O
水素イオン(H+)が蓄積して細胞内のpHが低下して酸性になると細胞内のタンパク質の活性や働きは阻害され、pH低下が顕著になれば細胞は死滅します。そこで、がん細胞は乳酸や水素イオン(プロトン)を細胞外に積極的に排出しています。
乳酸はモノカルボン酸トランスポーター(MCT)という輸送担体で細胞外に排出され、水素イオンは液胞型プロトンATPアーゼ(vacuolar H+-ATPases)、モノカルボン酸輸送体(monocarboxylate transporter:乳酸-プロトン共輸送体)、Na+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などによって細胞外に放出されます。(図)
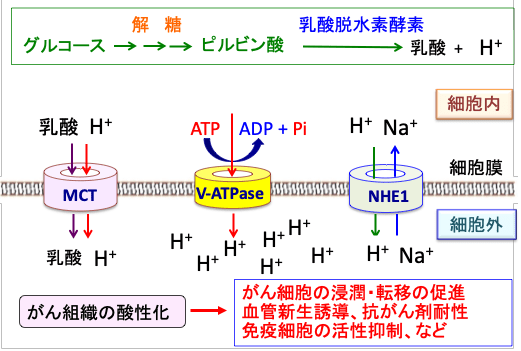
図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。その結果、がん細胞の周囲はpHが低下してがん組織は酸性化している。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される。
がん組織の微小環境は血液やリンパ液の循環が悪いので、水素イオンはがん組織に蓄積します。その結果、がん細胞の周囲の組織は水素イオンの濃度が高くなってpHが低下します。正常の組織のpHは7.3〜7.4程度とややアルカリ性ですが、がん組織の微小環境のpHは6.2〜6.9とより酸性になっています。
がん組織の酸性化した微小環境は、がん細胞の生存にとって様々なメリットを与えます。
組織が酸性化すると正常な細胞が弱り、結合組織を分解する酵素の活性が高まるため、がん細胞が周囲に広がりやすくなり、さらに血管新生が誘導されるので、がん細胞の浸潤や転移が促進されます。
組織が酸性になるとがん細胞を攻撃しにきた免疫細胞の働きが弱ります。
さらに乳酸には、がん細胞を攻撃する細胞傷害性T細胞の増殖や、免疫細胞の働きを高めるサイトカインの産生を抑制する作用があり、がんに対する免疫応答を低下させる作用もあります。
抗がん剤の多くは塩基性なので、酸性の組織では活性が低下するということも指摘されています。
したがって、がん組織の酸性化を抑制しアルカリ化を促進すれば、がん細胞の浸潤や転移を抑制し、さらに抗がん剤治療や免疫療法の効き目を高めることができることになります。さらに、水素イオンの排出メカニズムを阻害してがん細胞内のpHを低下させれば、がん細胞を死滅させることもできます。
これが、がん組織をアルカリ化する「がんのアルカリ療法」ががん治療に役立つ根拠です。がん組織をアルカリにする方法は多数あり、これらを組み合わせて、がん組織をアルカリ化できれば、がん細胞の増殖を抑え、さらにがん細胞を死滅することができます。
【がん細胞内は正常細胞よりもアルカリ性になっている】
特殊な試薬とMRI(磁気共鳴画像診断)を組み合わせた方法で、生体内の組織のpHを測定することができます。このような研究の結果、がん組織が酸性化していることが明らかになっています。正確には、がん細胞内はアルカリ性で、がん細胞外が酸性化しています。
前述のように、がん細胞では解糖系の亢進によって、乳酸と水素イオン(プロトン)の細胞内での産生が亢進しています。したがって、「がん細胞内も酸性化している」と思うかもしれません。しかし事実は逆で、がん細胞内では正常細胞よりアルカリ性になっていることが明らかになっています。そして、細胞内をアルカリにすることが、細胞の発がん過程の初期から起こっており、これが解糖系を亢進する重要な要因になっているのです。つまり、がん細胞でワールブルグ効果(解糖系亢進と酸化的リン酸化の抑制)が成立する前に細胞内のアルカリ化が起こっていることが明らかになっています。
発がん過程における、がん遺伝子やがん抑制遺伝子の様々な関与については多くの研究が行われています。一方、細胞の内外における水素イオン(プロトン)の動態については、最近になってやっと研究が行われるようになりました。
水素イオン指数(pH:potential of hydrogen)は水素イオンの濃度を表す物理量です。pHの読みは「ピーエイチ」(英語読み)、または「ペーハー」(ドイツ語読み)です。pHは水素イオンのモル濃度を mol/Lで表した数値の逆数の常用対数で示したもので、数値が低いほど酸性(プロトン量が多い)、数値が高いほどアルカリ性(プロトン量が少ない)になります。
細胞内のpH(pHi)と細胞外のpH(pHe)のpH勾配は正常細胞とがん細胞では逆になっています。すなわち、正常細胞では細胞内に比べて細胞外の方がよりアルカリ性で、がん細胞では細胞内がアルカリ性で細胞外が酸性になっています。
がん遺伝子を導入して細胞をがん化させる実験で、細胞ががん化する過程で、細胞内のエネルギー産生系がミトコンドリアの酸素呼吸(酸化的リン酸化)から解糖系にシフトします。この実験系で、細胞のがん化が進むにつれて、細胞内がよりアルカリ性になり、細胞外がより酸性になることが示されています。そこで、このpH勾配を少なくする、あるいは正常化する(細胞内を酸性にして、細胞外をアルカリ性にする)ことががん治療のターゲットとして注目されています。
細胞内のpHは、細胞増殖の制御、増殖因子やがん遺伝子の活性、ミトコンドリアの活性、酵素活性、DNA合成、分化など様々な細胞機能に影響しています。正常細胞では細胞内のpH(pHi)は6.99〜7.05とほぼ中性で、がん細胞では細胞内のpH(pHi)は7.12〜7.7とアルカリ性です。一方、細胞外のpH(pHe)は正常細胞が7.3 〜7.4とアルカリ性であるのに対して、がん細胞の細胞外のpH(pHe)は6.2〜6.9と酸性です。したがって、細胞内外のpH勾配は正常細胞とがん細胞では逆になっています(図)。

図:正常細胞では細胞内pH(pHi)は6.99〜7.05とほぼ中性で、細胞外pH(pHe)は7.3〜7.4とアルカリ性になっていて、pHeがpHiより高い。一方、がん細胞では細胞内pH(pHi)は7.12〜7.7とアルカリ性になって、細胞外pH(pHe)は6.2〜6.9と酸性になって、pHi(細胞内)がpHe(細胞外)より高い。
【炭酸脱水酵素は重炭酸緩衝系の働きを高める】
炭酸脱水酵素(Carbonic Anhydrase)は二酸化炭素(CO2)と水(H2O)を炭酸水素イオン(HCO3-)と水素イオン(H+)とに迅速に変換する酵素です。
私たちは酸素を体内に取り込んで、ミトコンドリアで糖や脂肪を分解してエネルギー(ATP)を産生しています。肺から取り込んだ酸素は血液中に拡散し、赤血球中のヘモグロビンに結合して全身の細胞に運ばれます。この酸素呼吸の副産物として細胞内で二酸化炭素(CO2)が産生されますが、これは体外に排出する必要があります。この二酸化炭素は細胞外に拡散し、何種類かの方法で血液中を輸送されます。
10%未満は血漿中に溶けて、約20%はヘモグロビンと結合して運搬され、大半は炭酸(H2CO3)に変換されて輸送されます。
赤血球中に炭酸脱水酵素(Carbonic Anhydrase)があって、二酸化炭素が炭酸と重炭酸イオンに変換する作用を助けます。赤血球中では炭酸脱水酵素はヘモグロビンに次いで多いタンパク質です。
肺では赤血球の炭酸脱水酵素が重炭酸イオンを二酸化炭素に戻す作用を助け、できた二酸化炭素は拡散して肺から排出されます。
この反応は酵素がなくても自然に起こりますが、炭酸脱水酵素は触媒作用によってこの変換速度を100万倍程度に加速することができます。つまり、炭酸脱水酵素は二酸化炭素ガスを血液中に溶解させることによって呼吸によって排出できるようにしています(図)。

図:体内の組織で産生された二酸化炭素(CO2)は拡散して赤血球内で炭酸脱水酵素で重炭酸イオン(HCO3-)に変換されて血清中に溶け込む。重炭酸イオンは肺で赤血球中の炭酸脱水酵素によって二酸化炭素に変換され、肺から排出される。
炭酸脱水酵素は1933年に牛の赤血球から発見されました。その後、体内の全ての細胞に存在することが明らかになっています。哺乳類の炭酸脱水酵素は構造や局在の異なる10種類以上のアイソザイムが知られています。
炭酸脱水酵素は重炭酸緩衝系を促進することによって、体液や細胞内の酸塩基平衡の制御に重要な働きを担っています。つまり、動物においてこの酵素の主たる機能は、二酸化炭素と炭酸水素イオンとを相互変換することで、血液や他の組織の酸-塩基平衡を維持し、組織から効率的に二酸化炭素を運び出す補助をしています。
【炭酸脱水酵素はがん細胞内をアルカリ化する】
解糖系で産生される乳酸やプロトン(水素イオン)は、V型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って細胞外に排出されます。(下図)

図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase:)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。その結果、がん細胞の周囲はpHが低下してがん組織は酸性化している。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される。
二酸化炭素は炭酸脱水酵素によって排出が促進されます。この場合、細胞質内の炭酸脱水酵素IIは二酸化炭素(CO2)と水(H2O)から重炭酸イオン(HCO3-)と水素イオン(H+)を産生し、水素イオンは上記の方法で細胞外に排出され、重炭酸イオンは細胞内に保持されます。
また、細胞膜に存在する炭酸脱水酵素IXは細胞外で二酸化炭素と水から生成される炭酸を重炭酸イオン(HCO3-)とプロトン(H+)にして重炭酸イオンは共輸送体によって細胞内に取り込まれます。(図)

図:炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する(①)。細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる(②)。細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素を重炭酸イオンと水素イオンに変換する(③)。V型ATPアーゼ(vacuolar ATPase)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する(④)。重炭酸イオンは細胞内に保持される(⑤)。その結果、細胞外pH(pHe)は低下してより酸性化し(⑥)、細胞内pH(pHi)はよりアルカリ化される(⑦)。がん細胞は低酸素誘導因子-1(HIF-1)の活性が亢進し、グルコース・トランスポーター(GLUT-1)の発現が増加しグルコースの取り込みが増えている(⑧)。さらにHIF-1は解糖系酵素と炭酸脱水酵素IX(CAIX)の発現も亢進する。炭酸脱水酵素やモノカルボン酸トランスポーター(MCT)やV-ATPaseを阻害すると、がん細胞内pHが低下(酸性化)して増殖が低下し死滅する。がん細胞外pH(pHe)がアルカリ化すると、がん細胞の浸潤や転移が抑制され、がん細胞に対する免疫細胞(T細胞やNK細胞)の働きが良くなる。
この炭酸脱水酵素IXは低酸素誘導因子-1(HIF-1)によって発現が誘導されます。がん細胞ではHIF-1の発現と活性が亢進しているので炭酸脱水酵素IXの発現が亢進しています。HIF-1は解糖系を亢進して乳酸とプロトン(水素イオン)の産生を亢進して細胞外を酸性化します。
さらに、がん細胞では炭酸脱水酵素IXの発現亢進によって、がん細胞内をアルカリ化し、細胞外を酸性にしています。
つまり、がん細胞における低酸素誘導因子-1(HIF-1)の活性亢進が、がん細胞内のアルカリ化とがん細胞外の酸性化を引き起こしていると言えます。
ジクロロ酢酸ナトリウム、炭酸脱水酵素阻害剤、プロトンポンプ阻害剤、炭酸水素ナトリウム(重曹)を併用するとpHeをアルカリ化し、pHiを酸性化して、がん細胞の増殖・浸潤・転移を抑制し、細胞死を誘導できます。
【がん細胞内のアルカリ化は解糖系亢進(ワールブルグ効果)を促進している】
前述のように、細胞内pHと細胞外pHの差は正常細胞ではマイナス(細胞外の方がpHは高い)でがん細胞ではプラス(細胞内の方がpHは高い)になっています。がん細胞において、細胞内pHがアルカリ性で、細胞外が酸性という状況が細胞増殖や血管新生を促進する重要な要因になっています。したがって、がん細胞の細胞内pHを低下(酸性化)させ、細胞外pHを高める(アルカリ化)方法は、有望ながん治療となります。
がん細胞では、解糖系の亢進によって乳酸とプロトン(水素イオン)の産生は亢進しています。しかし、がん細胞では、乳酸とプロトンの細胞外排出能を高めることによって、細胞内をアルカリ性に維持し、細胞外の酸性度を高めています。この細胞外へのプロトンの排出は前述のように、Na+-H+ 交換輸送体1、液胞型ATPアーゼ、モノカルボン酸輸送体、炭酸脱水酵素などのトランスポーターや酵素によって制御されています。
がん遺伝子を導入して細胞のがん化を誘導する実験で、細胞のがん化の過程の初期にNa+-H+ 交換輸送体(NHE1)活性が亢進して、がん細胞内のpHがアルカリ化することが観察されています。この細胞内のアルカリ化は、解糖系での酵素活性を高め、好気的解糖(ワールブルグ効果)を亢進するのです。
解糖系と酸化的リン酸化の活性は細胞内pHに依存していますが、その作用は逆です。細胞内のアルカリ化に伴って、酸素呼吸から解糖に移行するのです。細胞内pH(pHi)がアルカリ化すると解糖系酵素(ホスホフルクトキナーゼ-1や乳酸脱水素酵素など)の活性が亢進することが明らかになっています。
解糖で1分子のグルコースから2分子のプロトンが産生されます。NHE1(Na+-H+ 交換輸送体1)は細胞外のナトリウムイオンと細胞内のプロトンを交換しながら細胞内のプロトンを細胞外に放出する働きを示す交換輸送体です。細胞内pH(pHi)が低下(酸性化)するとNHE1にプロトンが結合して構造が変化し活性化します。NHE1の発現と活性が亢進すると、細胞内はアルカリ化し、細胞外は酸性になります。NHE1の発現が多いほど、予後が悪いことが報告されています。
がん細胞内の解糖系を阻害するとNHE1の活性を抑制できます。また、NHE1の発現は低酸素誘導因子-1(HIF-1)で誘導されるので、HIF-1の活性を抑制すると、NHE1の活性を抑制できます。
モノカルボン酸トランスポーターは乳酸やピルビン酸やケトン体と一緒にプロトン(水素イオン)を受動拡散で排出する共輸送体です。これもHIF-1で誘導されます。
HIF-1はプロトンを細胞外に排出するポンプやトランスポーターや酵素の発現を亢進して、細胞内pHをアルカリ性(7.3以上)に維持しようとしています。したがって、HIF-1の発現や活性を抑えることは、がん組織の酸性化を阻止します。メラトニンやジクロロ酢酸やジインドリルメタンはHIF-1の活性を抑制します。
モノカルボン酸トランスポーターはpHi(細胞内pH)を高め、pHe(細胞外pH)を低下させます。MCTを阻害するとpHiが低下(酸性化)して増殖活性が低下することが示されています。
液胞型プロトンATPアーゼ(V-ATPases)はATPのエネルギーを使ってプロトンを細胞外に排出します。
NHE1やMCTの阻害剤は抗がん作用が期待できるので開発中ですが、まだ臨床で使用できるものはありません。一方、液胞型プロトンATPアーゼ(V-ATPases)は、胃薬として既に使用されているプロトンポンプ阻害剤で阻害できることが報告されています。プロトンポンプ阻害剤で細胞外をアルカリ性にして細胞内を酸性にすると、がん細胞の増殖を抑え、抗がん剤の効き目を高めることができます(780話参照)。
炭酸脱水酵素阻害剤は、すでに使われている薬があります。アセタゾラミド(商品名:ダイアモックス)は炭酸脱水酵素阻害作用によって利尿剤や緑内障の治療に使われています。さらに抗炎症剤のセレコキシブにも炭酸脱水酵素を阻害する作用が明らかになっています。
【炭酸脱水酵素の発現の多いがんは予後が悪い】
炭酸脱水酵素は10種類以上のアイソザイムが存在し、構造や局在が異なります。このうち炭酸脱水酵素IX(carbonic anhydrase IX)は低酸素誘導因子-1によって発現が誘導され、がん細胞内のpHをアルカリ性にする働きを担っています。
HIF-1はグルコーストランスポーター(GLUT-1)の発現を亢進してグルコースの取り込みを促進し、解糖系酵素の発現を誘導して解糖系での糖代謝を亢進します。さらに、HIF-1は炭酸脱水酵素IXの発現を亢進します。
肺がん細胞株を用いたin vitroの実験系で、低酸素で培養してHIF-1の発現を誘導し、GLUT-1と炭酸脱水酵素IXの発現を誘導すると、HIF-1とGLUT-1と炭酸脱水酵素IXの発現レベルに比例して、肺がん細胞の抗がん剤抵抗性が亢進することが報告されています。
Hypoxia-inducible factor 1 promotes chemoresistance of lung cancer by inducing carbonic anhydrase IX expression.(低酸素誘導因子-1は炭酸脱水酵素IXの発現を誘導することによって肺がん細胞の抗がん剤抵抗性を促進する)Cancer Med. 2017 Jan;6(1):288-297.
がん組織の低酸素状態は、増殖・浸潤・転移の促進や治療抵抗性と関連しており、がん患者の予後を悪くしています。
炭酸脱水酵素IXは低酸素誘導因子-1で発現が誘導されます。炭酸脱水酵素IXとがんの悪性度やがん患者の予後との関係が多数報告されており、これらの論文(147件の研究結果)のデータをメタ解析した結果、炭酸脱水酵素の発現が高いほど、再発が多く、生存期間が短くなることが明らかになっています。
Prognostic Significance of Carbonic Anhydrase IX Expression in Cancer Patients: A Meta-Analysis.(炭酸脱水酵素IXの発現レベルはがん患者の予後と関連する:メタ解析)Front Oncol. 2016 Mar 29;6:69.
その他、炭酸脱水酵素IXの発現が高いほど、がん細胞の悪性度が高くなることは前立腺がんなど多くのがん種で報告されています。したがって、HIF-1と炭酸脱水酵素の活性を阻害する治療法は、がん患者の予後を良くできると考えられています。
【がん細胞の細胞内を酸性にするがん治療】
Acetazolamide(商品名:ダオアモックス)は炭酸脱水酵素の非特異的な阻害剤で、利尿作用や緑内障の治療薬として使用されています。Acetazolamideが抗がん剤やmTORC1阻害剤の抗腫瘍効果を高めることが報告されています。
また、シクロオキシゲナーゼー2(COX-2)阻害剤のセレコキシブ(celecoxib)が炭酸脱水酵素の阻害作用があることが報告されています。以下のような報告があります。
The cyclooxygenase-2 inhibitor celecoxib is a potent inhibitor of human carbonic anhydrase II.(シクロオキシゲナーゼ-2阻害剤のセレコキシブはヒト炭酸脱水酵素の強力な阻害剤)Inflammation. 2004 Oct;28(5):285-90.
【要旨】
シクロオキシゲナーゼー2(Cyclooxygenase-2;COX-2)は間質細胞や炎症細胞で発現が亢進している。この誘導性のシクロオキシゲナーゼ・アイソフォームのCOX-2は炎症やある種のがんや虚血の脳組織などで発現が誘導される。
組織の酸性化は炎症において、疼痛や知覚過敏の原因となる。
最近の研究で、COX-2阻害剤のCOX非依存性のメカニズムによる薬効が報告されており、その中に炭酸脱水酵素(carbonic anhydrase)阻害作用がある。
炭酸脱水酵素は亜鉛を活性部位に含む金属酵素で腎臓などの様々な組織や細胞に存在し、酸-塩基バランスに働いている。腎臓には、COX-2の発現量が非常に高い。
セレコキシブは、炭酸脱水酵素阻害剤の代表であるアセタゾラミド(acetazolamide)と同様に、非置換型のスルホンアミド基を持つ特徴的構造を持っている。
本研究では、セレコキシブがナノモルレベルの低濃度でヒト炭酸脱水酵素II(carbonic anhydrase II)を強力に阻害する作用を有することを報告する.
Valdecoxibは比較的弱い活性を示し、炭酸脱水酵素阻害剤に特徴的な非置換型のスルフォンアミド基を有しないRofecoxibは、ヒト炭酸脱水酵素阻害作用を示さなかった。
非置換スルホンアミドのセレコキシブおよびバルデコキシブによるヒト炭酸脱水酵素の阻害作用を示すこれらのデータは、作用機序の解明ならびにCOX-2阻害剤に付随する副作用に重要な意味を有する可能性がある。
アセタゾラミドと同様に、非置換型のスルホンアミド基を持つCOX-2阻害剤のセレコキシブとバルデコキシブは炭酸脱水酵素阻害作用を持つという報告です。

図:COX-2阻害剤のCelecoxibとValdecoxibはAcetazolamideと同様に炭酸脱水酵素を阻害する作用があると報告されている。
がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸と水素イオンの産生が増えています。一方、がん細胞はプロトンの細胞外排出能を高めることによって、細胞内をアルカリ性に維持し、細胞外の酸性度を高めています。
この細胞外へのプロトンの排出は前述のように、Na+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)、液胞型プロトンATPアーゼ(vacuolar H+-ATPases)、H+/Cl− 共輸送体(H+/Cl− symporter)、モノカルボン酸輸送体(monocarboxylate transporter:乳酸-プロトン共輸送体)、ナトリウム依存性Cl−/HCO3− 交換体(Na+-dependent Cl−/HCO3− exchangers)、炭酸脱水酵素(Carbonic anhydrase)、ATP合成酵素(ATP synthase)などのトランスポーターや酵素によって制御されています。
実験で、モノカルボン酸トランスポーター(MCT)と炭酸脱水酵素IXを阻害するとがん細胞内に乳酸とプロトンが蓄積して細胞内pHが低下(酸性化)して死滅するという報告があります。
植物のミノバラン(Terminalia chebula)の実にMCTの阻害作用があるという報告があります。
The Role of Monocarboxylate Transporters and Their Chaperone CD147 in Lactate Efflux Inhibition and the Anticancer Effects of Terminalia chebula in Neuroblastoma Cell Line N2-A. (神経芽細胞腫N2-A細胞における乳酸排出阻害と抗がん作用におけるモノカルボン酸トランスポーターとそのシャペロンタンパク質CD147の役割)European J Med Plants. 2016; 12(4): EJMP.23992.
この論文では、900種類の植物のエキスをスクリーニング(探索)して、ミノバラン(Terminalia chebula)に最も強いMCT阻害活性があったと報告されています。
ミノバランの実は「訶子 (カシ)」という生薬名で漢方でも良く使われています。インド伝統医学のアーユルヴェーダでも頻用されています。
したがって、訶子 (カシ)とアセタゾラミド(ダイアモックス)やセレコキシブ(セレコックス)の併用はがん細胞内を酸性化して死滅できるかもしれません。

図:がん細胞はグルコースの取込みと解糖系の亢進で乳酸と水素イオンの産生が亢進している、生薬の訶子 (カシ)でモノカルボン酸トランスポーター(MCT)を阻害し、アセタゾラミド(ダイアモックス)やセレコキシブ(セレコックス)で炭酸脱水酵素を阻害すると、がん細胞内に乳酸や水素イオンや二酸化炭素を蓄積して細胞内が酸性化して死滅する。
がん細胞の細胞外pH(pHe)をアルカリ化し、細胞内pH(pHi)を酸性化するとがん細胞の増殖を抑え、細胞死を誘導し、抗がん剤治療や免疫療法の効き目を高めることができます。
この目的では、低酸素誘導因子-1(HIF-1)の活性抑制、ミトコンドリアの活性亢進、炭酸脱水酵素阻害、プロトンポンプ阻害、重炭酸ナトリウム(重曹)によるプロトン(水素イオン)の消去、解糖系抑制、モノカルボン酸トランスポーターの活性阻害などを組み合せる治療法が考えられます。これらを副作用の出ない量で服用すると、相乗効果による抗腫瘍効果が期待できます。

図:低酸素誘導因子-1(HIF-1)の活性抑制(ラパマイシン、ジクロロ酢酸ナトリウム)、ミトコンドリアの活性亢進(ジクロロ酢酸ナトリウム)、炭酸脱水酵素阻害(アセタゾラミド、セレコキシブ)、プロトンポンプ阻害(オメプラゾール、エソメプラゾール)、重炭酸ナトリウム(重曹)によるプロトン(水素イオン)の消去、解糖系抑制(ケトン食、2-デオキシグルコース)、モノカルボン酸トランスポーターの活性阻害(訶子)などを組み合せると、がん細胞内のpH(pHi)を酸性化し、細胞外のpH(pHe)をアルカリ化して、がん細胞の増殖・浸潤・転移を抑制し細胞死を誘導できる。
著書紹介:

詳しくはこちらへ:
著書紹介

(くわしくはこちらへ)
| « 780)がん組織... | 782)セレコキ... » |



