がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
355)解糖系を阻害しながらクエン酸回路(TCA回路)を活性化するとがん細胞は死滅する?
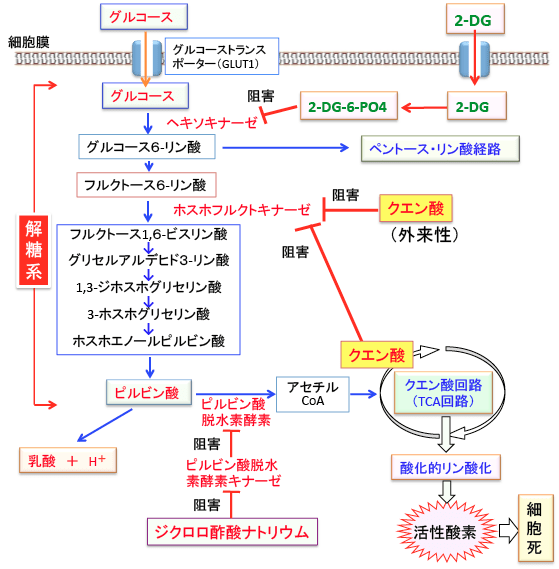
図:クエン酸回路(TCA回路)の産物であるクエン酸は解糖系のホスホフルクトキナーゼをフィードバック阻害する作用がある。したがって、食事や飲料として多量のクエン酸を摂取するとホスホフルクトキナーゼ活性の阻害によって解糖系を抑制できる。2−デオキシグルコース(2-DG)はヘキソキナーゼを阻害するので、この2つ(クエン酸の大量摂取と2-DGの摂取)の組合せは解糖系を効果的に阻害できる。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素の活性を阻害するピルビン酸脱水素酵素キナーゼを阻害する作用によってピルビン酸脱水素酵素の活性を高める。その結果、ミトコンドリアでの酸化的リン酸化が亢進して活性酸素の産生が増え、酸化ストレスの増大によってがん細胞が死滅することが報告されている。がん細胞の代謝の特徴である「解糖系の亢進」と「ミトコンドリアでの酸化的リン酸化の抑制」の2点が阻止されると、がん細胞にとって都合が悪い状況になる。
355)解糖系を阻害しながらクエン酸回路(TCA回路)を活性化するとがん細胞は死滅する?
【がん細胞にとって嫌なこととは】
私たちの体を構成する約60兆個の細胞は、その増殖や細胞死は厳密に制御されており、自分勝手に増殖を繰り返すことはありません。
しかし、細胞増殖を制御する遺伝子に異常が起こると自分勝手に無制限に増殖し転移するがん細胞に変わります。
一旦がん細胞になると、増殖に都合の良い性質も持ったもの(獲得したもの)が生き残る世界になります。つまり、がん細胞の間で生存競争が起こり、増殖に有利な性質を持ったものが生き残り、数を増やしていきます。
このような「増殖に有利な性質」の一つがワールブルグ効果という名称で知られている「がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化が抑制されている」というがん細胞のエネルギー産生における特徴です。
がん細胞が数を増やすためには、取り入れたグルコースをエネルギー産生のためだけでなく、細胞を構成する高分子成分(細胞膜やDNAなど)を合成するための材料として確保する必要があります。つまり、全てのグルコースを水と二酸化炭素に完全に分解するのではなく、一部を核酸や脂質の合成に利用するために、ミトコンドリアでの酸化的リン酸化が抑制されているのです。
材木で家を作るとき、材木を燃やせば火力によるエネルギーを産生できますが、全てを燃やすと家を作る材料が無くなるので、エネルギーが十分にあっても家を作ることはできません。
同様に、がん細胞が数を増やすためには、取り込んだグルコースの一部を細胞構成成分の合成に使う必要があるので、ミトコンドリアでの完全分解は抑制されていると考えることができます。

図:がん細胞はグルコースを分解してエネルギー(ATP)を産生し、その炭素骨格を利用して核酸や脂肪酸などの細胞構成成分を合成する。
細胞が増殖を停止している場合は、細胞分裂のための細胞構成成分を作る必要がないので、取り込んだグルコースのほとんどをATP産生に使えるので、ミトコンドリアで酸素を使って二酸化炭素と水にまで完全に分解することができる。
一方、細胞分裂して増殖している場合は、細胞を増やすために細胞構成成分(細胞膜や核酸など)を合成する材料としてグルコースを使うため、必然的にミトコンドリアでの完全分解は抑制され、解糖系とペントース・リン酸経路でのエネルギー産生と物質合成が亢進することになる。
ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)は活性酸素を産生するので、細胞内の酸化ストレスが高まります。酸化ストレスが強くなると細胞死を引き起こすことになります。したがって、がん細胞は死ににくくするためにミトコンドリアの活性を抑制しているという考えもあります(ミトコンドリアの活性を高めるジクロロ酢酸ナトリウムはがん細胞の酸化ストレスを高めることが抗がん剤作用のメカニズムになっている)。
また、解糖系でできたピルビン酸がミトコンドリアに入らなければ、乳酸に変換されますが、乳酸によって酸性化すると周りの正常細胞にダメージを与えたり、免疫細胞の活性を低下させるなどの作用もあります。
つまり、ワールブルグ効果(解糖系が亢進し、ミトコンドリアでの酸化的リン酸化が抑制されている)はがん細胞が生き残るために非常に好都合なのです。(下図)

図:がん細胞ではグルコース(ブドウ糖)の取り込みと解糖系が亢進し、ミトコンドリアでの酸化的リン酸化が抑制されている。この現象(ワールブルグ効果)は様々な点でがん細胞の増殖や生存に有利な効果を与えている。
以上のように、がん細胞が数を増やしていく上で、「解糖系の亢進」と「ミトコンドリアの活性抑制」はがん細胞にとって有利となります。
逆に、「解糖系の阻害」と「ミトコンドリアでの酸化的リン酸化の促進」は、がん細胞にとっては非常に都合の悪い状況になります。「がん細胞にとって都合の悪いこと」を実施することは、がん治療の戦略として有望だと言えます。
【糖質と脂質とタンパク質の代謝経路は密接に関連している】
グルコースの代謝系である解糖系とTCA回路(クエン酸回路)は、アミノ酸や脂肪酸との代謝系から独立しているのではなく、これらグルコースとアミノ酸と脂肪酸の代謝経路の間には生化学的な物質の流れがあり、これらの生命構成成分間の合成(同化)および分解(異化)の経路は密接につながっています(下図)。

図:細胞の主要の代謝経路の関係:
グルコースを代謝する解糖系とクエン酸回路は脂肪酸やアミノ酸の代謝経路と密接に関連し、しかもこれらの経路の多くが逆行できる。したがって、糖質を摂取しなくても、脂肪酸やアミノ酸から体内で糖を合成でき、エネルギー(ATP)や細胞構成成分(細胞膜や核酸など)を作ることができる。これが、糖質制限だけではがん細胞の増殖抑制に限界がある理由になっている。(糖質制限ではインスリンの分泌抑制によるがん細胞増殖抑制は得られるが、エネルギーを枯渇させる効果は限定的と言える)
アミノ酸や脂肪酸に由来する炭素骨格は解糖系やTCA回路に入って分解され、エネルギーを産生し(異化)、これらの経路から得られる炭素骨格は細胞の高分子構成成分の合成材料となります(同化)。つまり、糖質がほとんど含まれていない肉だけを食べても、肉に含まれるタンパク質(分解されてアミノ酸になる)と脂肪(分解されて脂肪酸とグリセロールになる)から、糖もできるのです。
このことが、糖質制限を行っても、がん細胞の増殖を抑える効果に限界がある理由になっています。糖質制限やケトン食によるインスリン分泌の低下やケトン体の増加は、がん細胞の増殖抑制に大きく寄与しますが、がん細胞のエネルギー産生や物質合成を完全に止めることができない(多少は抑制されるが)ので、がん細胞の増殖を完全に押さえ込むことには限界があると言わざるを得ません。
糖質制限やケトン食の抗がん作用の限界を克服する手段として、「積極的にがん細胞の解糖系を阻害しながら、TCA回路を活性化して酸化ストレスを高める」という方法が提案されています。
解糖系を阻害する方法としては、シリマリン、2-デオキシグルコース、クエン酸などがあります。TCA回路を活性化する方法としてジクロロ酢酸ナトリウムがあります。
ジクロロ酢酸ナトリウムでTCA回路と酸化的リン酸化の反応を活性化すると、ミトコンドリアにおける活性酸素の産生が増えて酸化ストレスが増大します。
さらに、がん細胞における活性酸素の産生量を増やす高濃度ビタミンC点滴とアルテスネイトを併用するとさらにがん細胞の酸化ストレスを高めることができます。
この時に、がん細胞の抗酸化力(グルタチオンなど)を阻害する方法(スルファサラジン)を併用すると、がん細胞は死滅しやすくなります。
【代謝系はフィードバック機構によって制御されている】
解糖系やTCA回路や電子伝達系に関与する酵素の一部は、アロステリック制御によって調節されています。
アロステリック制御というのは、酵素にある物質が結合すると構造変化が起こって機能が変化する現象です。
代謝系のある段階の反応が、その系の下流の産物によって阻害されることをネガティブフィードバック調節と言います。代謝経路でその後に続く産物が高濃度に存在すると、その代謝系での反応がそれ以上必要ないので、酵素活性を阻害して反応を止める制御です。
一方、ある経路の産物が過剰に存在すると、それが他の経路の反応をスピードアップして、過剰に存在する物質を他の経路での代謝に振り替える調節をポジティブフィードバック調節と言います。
解糖系の律速段階の1つのホスホフルクトキナーゼ(フルクトース-6-リン酸をフルクトース-1,6-ビスリン酸に変換)は、
最終生成物のATPによりフィードバック阻害を受け、ADPもしくはAMPによって活性化されます。そして、このホスホフルクトキナーゼはTCA回路(クエン酸回路)の産物であるクエン酸によってもフィードバック阻害を受けます。

図:ある産物が過剰に蓄積した場合に、その産物によって上流の酵素反応が阻害されることによってその産物の合成が止められる(ネガティブフィードバック)。場合によっては、同じ材料(図のC)を使う他の反応系を促進することによって合成が調節される(ポジティブフィードバック)。このような調節は生成物による酵素のアロステリック調節により行われる。
【クエン酸はホスホフルクトキナーゼをフィードバック阻害する】
クエン酸については353話で解説しています。
クエン酸は柑橘類に多く含まれる有機酸で、体内ではTCA回路(クエン酸回路ともいう)でできる物質です。
これが多くできると解糖系の速度を遅くするために、クエン酸が解糖系のホスホフルクトキナーゼをフィードバック阻害します。つまり、クエン酸を多く摂取すると解糖系の活性が抑制されます。
メキシコの小児科医のハラベ医師(Dr. Alberto Halabe Bucay)がクエン酸の大量投与によるがん治療による著効例を論文で報告しています。今まで80人以上の末期がんの患者さんをクエン酸の経口摂取で治療して、多くに効果を認めたと言っています。
そのプロトコールは、1日3回、毎食後に10~15gのクエン酸を摂取する(1日30~45g)という方法です。
クエン酸で胃が刺激になるときは、胃酸の分泌を抑えるオメプラゾール(40mgを1日2回)、胃痛や胃部不快感があるときはさらに1~2gのスクラルファート(アルサルミン)を服用すると良いと言っています。
他にも、クエン酸による解糖系阻害によるがん治療の可能性を解説した論文はいくつかあります。以下のような論文があります。
Effect of citrate on malignant pleural mesothelioma cells: a synergistic effect with cisplatin.(悪性胸膜中皮腫に対するクエン酸の効果:シスプラチンとの相乗効果)Anticancer Res. 29(4):1249-54.2009年
抗がん剤抵抗性のヒト中皮腫細胞株を使った培養細胞レベルでの実験で、クエン酸を添加するとアポトーシスが誘導されること、抗がん剤のシスプラチンの効果を高めることが報告されています。そのメカニズムとして解糖系のフルクトキナーゼの活性を阻害することによってATPの産生が減少することを挙げています。
Citrate induces apoptotic cell death: a promising way to treat gastric carcinoma?(クエン酸はアポトーシスによる細胞死を誘導する:胃がん治療への可能性?)Anticancer Res. 31(3):797-805.2011年
前の論文と同じ研究グループからの報告です。2種類の胃がん細胞株を用いた実験で、クエン酸が胃がん細胞にアポトーシスを誘導することを報告しています。
Understanding the central role of citrate in the metabolism of cancer cells.(がん細胞の代謝におけるクエン酸の中心的役割の理解) Biochim Biophys Acta. 1825(1):111-6. 2012年
同じ研究グループからの総説です。クエン酸を多く摂取するとがん治療に役立つことを解説しています。
このようにクエン酸は解糖系のフルクトキナーゼをフィードバック阻害するので、ATP産生を抑制することになります。
一方で、脂肪酸合成系のアセチルCoAカルボキシラーゼは、前駆体のクエン酸により活性化されます(ポジティブフィードバック)。したがって、クエン酸を多く摂取すると脂肪酸の合成が促進されます。がん治療においては、細胞分裂の材料を作らせないという観点からはがん細胞における脂肪酸合成を阻害する方が良いのですが、脂肪酸を合成するにはATPが必要なため、解糖系を阻害した条件であれば、アセチルCoAカルボキシラーゼの活性化は問題ないと言えます。
【がん細胞の酸化的リン酸化を亢進するとがん細胞は死にやすくなる】
ミトコンドリアでの酸化的リン酸化が低下するとがん細胞が死ににくくなる(アポトーシスに抵抗性になる)ことが知られています。細胞分裂しない神経や筋肉細胞を除いて、正常な細胞は古くなったり傷ついたりするとアポトーシスというメカニズムで死にます。このアポトーシスを実行するときに、ミトコンドリアの電子伝達系や酸化的リン酸化に関与する物質(チトクロームCや活性酸素など)が重要な役割を果たしています。
つまり、がん細胞ではアポトーシスを起こりにくくするために、あえてミトコンドリアにおける酸化的リン酸化を抑え、必要なエネルギーを細胞質における解糖系に依存しているという様に解釈できると言うことです。
実際に、がん細胞のミトコンドリアにおける酸化的リン酸化をジクロロ酢酸ナトリウムという薬で活性化させるとがん細胞にアポトーシス(細胞死)を引き起こすことができることが報告されています。
ミトコンドリアの電子伝達系でエネルギー(ATP)が産生される過程で多量の活性酸素が発生します。すなわち、呼吸で体内に取り込まれた酸素の約2~ 3% は電子伝達系でのエネルギー代謝時に還元されスーパーオキシドアニオン、過酸化水素、ヒドロキシルラジカルおよび一重項酸素などの活性酸素に変わると言われています。
ミトコンドリアは細胞内における活性酸素の主要な発生源になっています。ミトコンドリアから発生する活性酸素は、ビタミンEやビタミンCなどの抗酸化物質や、スーパーオキシドディスムターゼ(SOD)やカタラーゼといった抗酸化酵素によって消去され、活性酸素による障害が起きないようにする防御機構が細胞には備わっています。
しかし、がん細胞ではこれらの抗酸化力(抗酸化物質や抗酸化酵素の量)は低下しています。もともと酸素を使わない代謝系でエネルギーを産生し、ミトコンドリアの酸化的リン酸化の活性が低下していたからです。
がん細胞は活性酸素のダメージによってアポトーシス(細胞死)を起こさないために、ミトコンドリアの活性、すなわち酸化的リン酸化を抑制する必要があると考えられています。酸素を使わない生き方を選ぶ方が、がん細胞にとっては生存に有利になるというわけです。
したがって、がん細胞のミトコンドリアを活性化するジクロロ酢酸ナトリウムはがん細胞の酸化ストレスを高めて、がん細胞にアポトーシスを誘導すると考えられています。
がん細胞の代謝の特徴は、解糖系の亢進とミトコンドリアでのTCA回路や酸化的リン酸化の抑制です。したがって、解糖系を抑制し、ミトコンドリアでの代謝を促進する事は、がん細胞にとっては嫌なことになると言えます。
また、がん細胞の特異的に酸化ストレスを高める高濃度ビタミンC点滴やがん細胞に多く含まれる鉄イオンと反応してフリーラジカルを産生するアルテスネイト、グルタチオンの合成を抑制するスルファサラジンなどを併用すると、がん細胞の酸化ストレスを高めて、がん細胞を死滅させることができます。
つまり、がん細胞の解糖系を阻害する方法(クエン酸、2−デオキシグルコース、ケトン食)、ミトコンドリアでのTCA回路と酸化的リン酸化を活性化するジクロロ酢酸ナトリウム、がん細胞の酸化ストレスを高める高濃度ビタミンC、アルテスネイト、半枝蓮(303話参照)、グルタチオンを枯渇させるスルファサラジンの組合せが、がん細胞のワールブルグ効果を利用したがん治療として効果が期待できる可能性があります。
画像をクリックするとサイトに移行します。
| « 354)3-ブロモ... | 356)ジェーム... » |





