がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
447)抗腫瘍免疫の増強法(その3): 2-デオキシグルコースと免疫原性細胞死
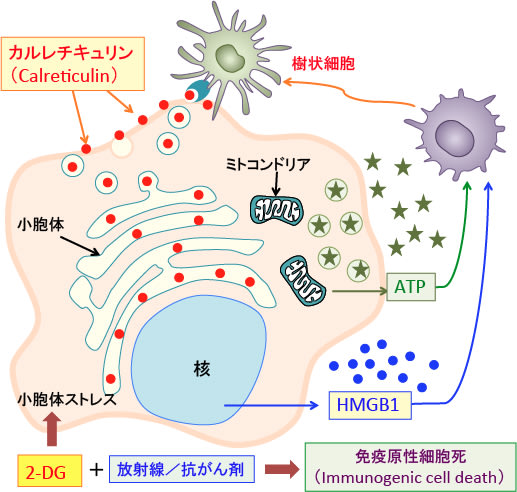
図:細胞がダメージを受けて死滅するとき、細胞内に存在する成分が放出されて炎症細胞や免疫細胞を刺激する。ミトコンドリアのATPや核のHMGB1(High-mobility group box 1 protein)は細胞外に放出されると樹状細胞を刺激する。小胞体のカルレチキュリン(Calreticulin)は細胞表面に出て、樹状細胞に認識され、貪食のシグナルとなり、がん抗原を提示する働きを活性化する。
2-DG(2-デオキシ-D-グルコース)は、タンパク質に糖鎖が着くN-グリコシル化の過程を阻害するので、糖鎖異常の糖タンパク質が小胞体に蓄積して小胞体ストレスを引き起こす。小胞体ストレスの高い状態で放射線や抗がん剤でがん細胞が死滅するとカルレチキュリンが多く露出した死細胞となる。このような免疫応答を引き起こしやすい細胞死を「免疫原性細胞死」という。放射線治療や抗がん剤治療に2-DGを使用すると免疫原性細胞死を誘導してがん抗原に特異的な抗腫瘍免疫を高めることができる。
447)抗腫瘍免疫の増強法(その3): 2-デオキシグルコースと免疫原性細胞死
【放射線治療は全身の抗腫瘍免疫を活性化する】
転移性腫瘍も含め、多くの悪性腫瘍の治療に放射線治療が行われています。限局した腫瘍組織全体に十分な放射線照射ができれば、根治治療にもなります。
多数の転移がある場合でも、疼痛などの症状の原因になっている腫瘍組織に放射線照射を行えば、症状の緩和や延命効果が期待できます。
従来、放射線照射の抗腫瘍効果は、細胞分裂中のがん細胞のDNAにダメージを与えてがん細胞を死滅させる局所的な作用のみと考えられていました。
しかし、最近の研究で、放射線治療が全身の抗腫瘍免疫の活性化の引き金になりうることが明らかになっています。つまり、放射線治療と免疫療法を積極的に併用するメリットが示されています。
局所のがん組織を放射線で照射して、がん細胞が死滅すると、がん抗原が放出されてがん抗原特異的な抗腫瘍免疫が誘導され、照射した部位以外の腫瘍が縮小することが示されています。
このような効果をアブスコパル効果(abscopal effect)と言います。「ab」は「離れた」」「Scopus」は「ターゲット」という意味で、「離れたターゲット(off-target)」に対する効果」ということから、遠隔効果や遠達作用などと日本語訳されています。
したがって、たとえ全身に転移があっても、一部の腫瘍に放射線照射を行い、同時にCTL(細胞傷害性T細胞)やNK細胞の活性を積極的に高める治療は有効です。
この際、免疫抑制性のメカニズム(骨髄由来抑制細胞、制御性T細胞、PD-1/PD-L1、CTLA-4、免疫抑制性のサイトカインやケモカインなど)を十分に抑制できれば、抗腫瘍免疫を増強して腫瘍を縮小できることになります。(下図)

図:①がん組織に放射線照射を行うとがん細胞が死滅してがん抗原が放出される。②がん抗原は樹状細胞やマクロファージなどの抗原提示細胞に取込まれ、ペプチドに分解されて抗原ペプチドとして抗原提示細胞上のMHC(major histocompatibility complex:主要組織適合抗原複合体)に提示される。MHCはがん抗原を介してCTL(細胞傷害性T細胞)上のTCR(T細胞受容体)と反応してCTLを活性化する。③CTLは活性化されるとPD-1(Programmed death-1)が発現する。④がん細胞にはPD-1のリガンドであるPD-L1が発現している。PD-1とPD-L1が結合するとCTLは増殖が抑制される。⑤PD-1とPD-L1の結合をこれらの特異抗体(抗PD-1抗体、抗PD-L1抗体)で阻止するとCTLの抗腫瘍活性を高めることができる。⑥CTLの働きは骨髄由来抑制細胞(myeloid-derived suppressor cell:MDSC)や制御性T細胞(Treg)によっても抑制されている。これらの免疫抑制性の細胞や分子の働きを阻止できれば、がん抗原特異的な抗腫瘍免疫を増強して腫瘍を縮小できる。
【放射線治療とPD-1/PD-L1の阻害は相乗効果がある】
次のような研究があります。
Irradiation and anti-PD-L1 treatment synergistically promote antitumor immunity in mice.(マウスの実験で放射線照射と抗PD-L1抗体の併用は抗腫瘍免疫を相乗的に増強する)J Clin Invest. 124(2):687-95. 2014年
【要旨】
高線量の放射線照射はがん細胞を死滅させ、がん細胞に特異的な免疫応答を引き起こし、局所および遠隔の腫瘍細胞の増殖を抑制する。
しかしながら、放射線治療後も局所再発はしばしば起こり、これは放射線照射による抗腫瘍免疫の誘導が十分に起こっていないことを示唆している。
プログラム細胞死リガンド-1(programmed death-ligand 1:PD-L1; 別名B7-H1)はがん組織において強く発現してT細胞の働きを抑制しているので、このPD-L1の作用を阻止すると、T細胞機能を高めて抗腫瘍免疫を活性化することができる。
この研究では、放射線照射のあとの腫瘍組織ではPD-L1の発現が亢進していることを示した。
抗PD-L1抗体を投与すると、放射線照射後のT細胞依存性の抗腫瘍免疫を増強した。
放射線照射によってダメージを受けた腫瘍組織には、T細胞の働きを抑制する骨髄由来抑制細胞(myeloid-derived suppressor cells:MDSCs)が集積しているが、抗PD-L1抗体の併用によって骨髄由来抑制細胞の腫瘍内集積が抑制された。
さらに、放射線照射と抗PD-L1抗体の併用による細胞傷害性T細胞の活性化は、TNF(腫瘍壊死因子)の殺細胞作用を介して骨髄由来抑制細胞の数を減らした。
以上の実験結果より、放射線照射とT細胞器のとPD-1/PD-L1系の相互作用を理解することは、放射線治療と免疫治療の組合せによる適切な併用療法の確立に役立つ。
がん組織に放射線照射を行うと、がん細胞が死滅してがん抗原が放出され、このがん抗原の情報を抗原提示細胞(樹状細胞やマクロファージ)が細胞傷害性T細胞(CTL)に提示してCTLは活性化され、生き残ったがん細胞を攻撃して排除しようとします。
このような非照射のがん細胞にも免疫細胞の作用が働くことをアブスコパル効果(Abscopal efffect)と言います。
しかし、放射線でダメージを受けたがん組織には、骨髄由来抑制細胞(myeloid-derived suppressor cell:MDSC)が集積し、この骨髄由来抑制細胞は制御性T細胞(Treg)を増やします。ダメージを受けたがん組織ではPD-L1の発現が亢進することが知られています(がんや炎症はPD-L1の発現を亢進する)
骨髄由来抑制細胞と制御性T細胞はともにCTL(細胞傷害性T細胞)の働きを抑制します。
CTLが抗原提示を受けて活性化すると、CTLの働きを抑制するPD-1(programmed death-1)受容体が発現し、CTLの過剰な活性化を抑制するメカニズムが作動します。がん細胞はPD-1のリガンドのPD-L1を多く発現しているので、活性化したCTL(PD-1が発現している)はがん細胞のPD-L1によって死滅することになります。
このようにして、放射線治療によって抗腫瘍免疫が引き起こされても、様々なメカニズム(骨髄由来抑制細胞、制御性T細胞、PD-1/PD-L1など)によって、実際は抗腫瘍免疫が活性化できないメカニズムが作動します。
そこで、CTLのPD-1やがん細胞のPD-L1に対する抗体でPD-1/PD-L1系を働かなくしたり、骨髄由来抑制細胞や制御性T細胞の働きを抑制すると、全身の抗腫瘍免疫を高めることができることになります。
制御性T細胞やPD-1/PD-L1系は、免疫応答が過剰に亢進したり、免疫細胞が自己成分に反応するのを防ぐための制御システムとして必要な働きなのですが、がん細胞はこのメカニズムを利用して免疫システムの攻撃から逃避しています。
【放射線照射や抗がん剤治療は免疫原性細胞死(immunogenic cell death)を起こす】
放射線照射によって全身の抗腫瘍免疫が活性化されるのは、放射線照射による細胞死が免疫誘導を起こす特殊な細胞死を引き起こすからです。
放射線照射と同様に、一部の抗がん剤もがん抗原特異的な抗腫瘍免疫の引き金になります。
免疫応答というのは「自己と非自己を識別して非自己を排除する」というふうに一般に理解されていますが、「体内に発生した危険シグナル(danger signal)を認識して免疫応答を引き起こす」という考え方もあります。
シクロフォスファミドなどの抗がん剤は通常の壊死やアポトーシスに比べて免疫応答を惹起しやすい形でがん細胞を死滅させます。このような細胞死は「免疫原性細胞死(Immunogenic cell death)」と呼ばれています。Calreticulin分子の細胞膜表面への露出など幾つかのメカニズムが明らかになっています。
がん細胞はいろんな遺伝子に変異がおきているので、がん細胞には正常細胞とは異なる抗原(がん抗原)が存在し、これらのがん抗原がTリンパ球などに認識されるとがん細胞を攻撃できるようになります。
免疫原性細胞死を誘導できる抗がん剤として多くのアントラサイクリン系薬(doxorubicin, epirubicin, idarubicinなど)、mitoxantrone、 オキサリプラチン(oxaliplatin)、シクロフォスファミド(cyclophosphamide) 、bortezomibなどが報告されています。
【ダメージ関連分子パターンが免疫応答を刺激する】
体を構成する正常細胞は毎日約200分の1の細胞がアポトーシスで死滅し、組織幹細胞が細胞分裂して組織の細胞を供給しています。
このような生理的な死に対して、体がいちいち反応して炎症や免疫応答を行えば、大変なことになります。しかし、このような生理的な細胞死は、炎症や免疫応答を引き起こさない死に方をするので、問題は起こりません。
一方、何らかのダメージやストレスで細胞が傷害されたときは、それを認識して対応する必要があります。
例えば、神経が熱や痛みを感じるようになっているのは、体に危害を与える傷害を認識してそれを避ける必要があるからです。
同様に、細胞がダメージを受けたとき、そのような細胞からは通常であれば細胞内に隠れている成分が放出され、炎症細胞や免疫細胞を活性化するメカニズムが存在します。
このような炎症を引き起こす細胞内にある成分をDAMPs(damage-associated molecular patterns; ダメージ関連分子パターン)と総称しています。
細胞傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のことです。
DAMPsが細胞外や細胞膜上に露出するような細胞死が起こると、炎症反応が引き起こされ、ダメージを受けた組織の修復が起こります。
このメカニズムは自己免疫疾患などの慢性炎症性疾患の原因ともなります。
しかし、抗がんや放射線を使ったがん治療の場合は、このダメージ関連分子パターン(DAMPs)を誘導する細胞死のメカニズムを利用すると、がん特異免疫を増強できることが知られています。
つまり、放射線照射や一部の抗がん剤が免疫原性の高い細胞死を誘導することが知られており、このような細胞死をもっと効率的に行う手段があれば、がん治療の効果を高めることができます。
DAMPsは、細胞質や核やミトコンドリアや小胞体などに存在する成分が放出されたもので、炎症細胞や免疫細胞を刺激します。例えば、ミトコンドリアのATP, DNA, フォルミルペプチド、核のヒストンやHigh-mobility group box 1 protein(HMGB1)、High-mobility group nucleosome binding protein 1(HMGN1)、細胞質のATPやF-アクチン、小胞体のカルレチキュリン(Calreticulin)などが知られています。(下図)


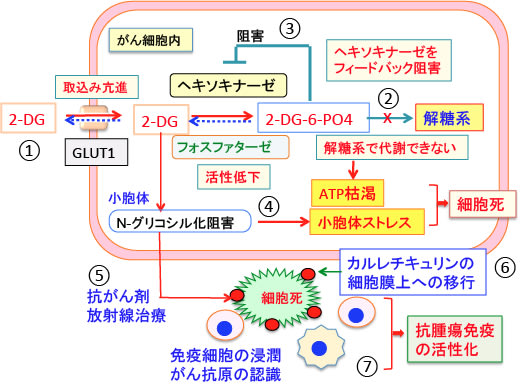
通常の抗がん剤治療は、副作用が耐えられるギリギリの用量で継続的に投与が行われるので、免疫細胞の働きも抑制され、抗腫瘍免疫が作動しにくくなっています。
| « 446)抗腫瘍免... | 448)抗腫瘍免... » |



