がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
317)カロリー制限の寿命延長作用と抗がん作用
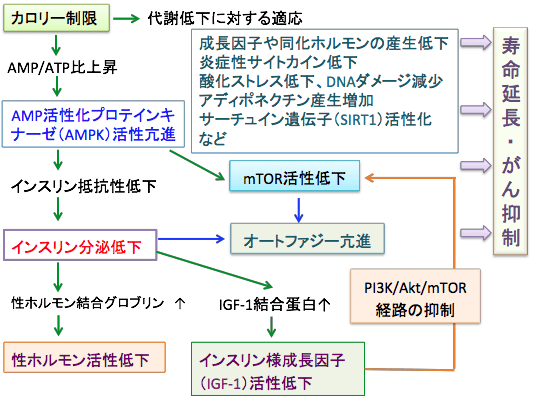
図;カロリー制限による寿命延長やがん抑制のメカニズムは複雑でまだ十分に解明されていない。主な因子として図に示すようにAMP活性化プロテインキナーゼ(AMPK)、インスリンおよびインスリン様成長因子(IGF-1)、PI3K/Akt/mTORシグナル経路、性ホルモン、オートファジー、炎症性サイトカイン、酸化ストレス、アディポネクチン、サーチュイン(SIRT1)遺伝子などの関与が報告されているが、これら以外にもさらに多くの因子が関与し、これらが相互に作用し合って、その総合作用として寿命延長とがん抑制という効果が得られている。これらの因子やそのメカニズムを利用すれば、カロリー制限を行わずにカロリー制限と同じ効果が達成できる可能性がある。
317)カロリー制限の寿命延長作用と抗がん作用
【カロリー制限で寿命が延びる】
寿命延長効果と抗がん作用(がんの発生予防やがん縮小効果)の両方の効果を有する因子や要因はいくつかあります。このような因子の存在は、「超高齢者にはがんが少ない」という事実の理由を説明してくれます。超高齢になるには寿命を延ばす因子や、病気から防御する因子が作動しているはずであり、この因子ががんの発生や進展も防いでいると考えると「超高齢者でがんが少ない」理由を説明しやすいからです。
前回の316話では、脂肪組織から分泌されるアディポネクチンの量が増えると、寿命を延ばし、がんを予防する効果が得られることを解説しました。
アディポネクチン以外にも、AMPK(AMP活性化プロテインキナーゼ)の活性化、インスリンやインスリン様成長因子の産生低下、PI3K/Akt/mTORシグナル伝達経路の阻害、炎症性サイトカインや酸化ストレスの低下、オートファジーの活性化、サーチュイン遺伝子の活性化なども、寿命の延長とがん予防の効果が報告されています。そしてこれらの全てを引き起こすことが報告されているのが、食事からの摂取カロリーを減らす「カロリー制限」です。
栄養障害を起こさずに食事からの摂取カロリーを30~40%程度減らすと、寿命延長効果と抗がん作用が得られることが報告されており、そのメカニズムとして上記のような様々な因子の関与が知られています。
カロリー制限で寿命が延びることが最初に報告されたのは、1935年のことです。ラットに与えるエサのカロリーを30%減らすと寿命が40%延びたという結果が報告されています。
このようなカロリー制限による寿命延長効果は、酵母、線虫、ショウジョウバエなどで認められ、さらに霊長類のアカゲザルでも、カロリー制限によって寿命が延びることが報告されています。
ただし、アカゲザルを使ったカロリー制限食と寿命に関する研究は、米国ウィスコンシン大学のグループと米国立衛生研究所(NIH)のグループが別々に行った結果が報告されていますが、結果は一致していません。
ウィスコンシン大学の研究では、7~14歳のアカゲザルを、食事摂取量を70%に制限したカロリー制限群と食事を制限なく自由に摂取させるコントロール群の2群に無作為に分けて20年間観察しています。アカゲザルの寿命は25~30歳程度で,最長でも40歳程度と考えられています。
2009年の段階で、コントロール群の生存率は50%であったのに対して、カロリー制限食群では80%が生存していました。さらに、カロリー制限食群では、糖尿病やがん、心臓血管系の疾患、脳の萎縮などの老化性疾患の発生率が3分の1程度に低下していたことが報告され、カロリー制限が老化を遅くするという結論が出されています。論文には、コントロール群とカロリー制限食群の、それぞれ同じ27.6歳(一般的な平均寿命)の2匹の写真が掲載されていますが、明らかにカロリー制限食群のサルの方が毛並みや肉付きが良く、見た目が若々しいことが示されています。(Science 325:201-204, 2009年)
一方、米国立衛生研究所(NIH)のグループの研究では、カロリー制限による寿命の延長も老化性疾患(がん、糖尿病、心臓血管系疾患など)の予防効果も認められませんでした。(Nature 489:318-21, 2012年)
このような異なる結果が出たことに対して、カロリー制限食の栄養素の構成や、カロリー制限を始めた年齢の違いなど実験条件の違いで、その効果に差が出た可能性が示唆されています。
つまり、ウィスコンシン大学のグループの研究では、7~14歳の成体(人間で換算すると20~40歳程度)から実験をスタートしているのに対して、NIHの研究では、16~23歳の高齢アカゲザル(人間の50~70歳程度)と1~5歳の若年アカゲザル(人間では3~15歳程度)の2つの群で研究をスタートしています。高齢のサルでは、カロリー制限を開始しても寿命延長効果が出るには遅過ぎた可能性があり、生殖年齢前(成長期)に開始すると、栄養不全によってかえって寿命を短くする可能性が指摘されています。カロリー制限は出生後早い時期に開始しないと効果が無いという考えもありますが、成長期のカロリー制限は様々な疾病の原因になる可能性もあります。
また、NIHの実験とウィスコンシン大学の実験では、エサの内容がかなり異なることが指摘されています。簡単にまとめると、NIHの方がより健康的な食事でした。つまり、ウィスコンシン大学の実験で使われたエサでは、タンパク源はラクトアルブミンで、脂肪はコーン油、糖質はコーンスターチと砂糖が主体で、28.5%が砂糖で、これに精製したビタミンやミネラルを加えた様な内容でした。
一方、NIHの実験で使われたエサは、天然の栄養成分が多く、砂糖は3.9%と少なく、タンパク源や脂肪には魚由来のものも多く含まれ、ω3不飽和脂肪酸が多く、フラボノイドなどの天然の抗酸化物質も多かったということです。特に糖質は両方とも57~61%とほぼ同じレベルですが、砂糖がNIHの研究では3.9%と少なく、ウィスコンシン大学の実験では28.5%と極端に多いということでした。砂糖はインスリンの分泌を高めやすく、さらにインスリン様成長因子の分泌も高めます。インスリンやインスリン成長因子ががんや老化を促進する作用があります。
つまり、ウィスコンシン大学の実験では、エサ自体が健康に悪いものだったために、カロリー制限の効果がより出やすく、NIHの実験では健康的なエサであったために、コントロール群も寿命が延びたためにカロリー制限群との差が出にくかった可能性が示唆されています。(NIH研究ではコントロール群でもウィスコンシン大学の実験より寿命が延びています)
したがって、霊長類におけるカロリー制限の寿命延長効果がNIHの研究で否定されたわけではなく、成人以降にカロリー制限を行うことは寿命延長に効果が十分に期待できると言えます。しかし、厳密なカロリー制限を行わなくても、食事の内容などでカロリー制限と同じような効果が期待できる可能性をNIHの研究結果は示唆しているとも言えます。実際に、糖質制限などでインスリンやインスリン様成長因子-1(IGF-1)のシグナルが阻害されるような食事をすれば、寿命延長やがん予防に効果が期待できる可能性が指摘されています。
【カロリー制限の抗がん作用】
カロリー制限ががん細胞の増殖を抑制することが初めて報告されたのは、1909年です。この年、マウスにがんを移植する実験系で、カロリー制限ががんの増殖を抑制することが報告されている。
その後も、自然発症がん、発がん物質で誘導されるがん、放射線誘導性発がんなど多くの動物実験で、カロリー制限ががんの発生や増殖を抑える効果があることが報告されています。
霊長類では、前述のウィスコンシン大学の実験で、成体から開始した30%のカロリー制限ががんの発生率や死亡率を約半分に減らすことが報告されています。この結果が人間に当てはまるかどうかはまだ不明ですが、カロリー制限によって、発がんに関連する様々な成長因子や増殖因子(インスリン様成長因子-1など)、同化ホルモン(インスリンや性ホルモンなど)、炎症性サイトカイン(TNF-αやIL-6など)の血中濃度は減少し、酸化ストレスの程度を示す指標も低下することが示されていますので、人間においてもカロリー制限ががんの発生や進展を抑制する可能性は高いと考えられています。
【肥満ががんの発生と進展を促進するメカニズム】
日本では、過去40年間で大腸がんの発生率が、男性で9.4倍、女性で4.7倍に増加しているというデータが報告されています。日本における大腸がんの増加の原因として、肉食の増加や、カロリー過剰や運動不足による肥満の関与が指摘されています。多くの疫学研究から、子宮内膜がん、閉経後乳がん、大腸がん、食道腺がん、腎臓がん、膵臓がん、胆のうがん、肝臓がんで、肥満ががんの発生率を増やすことが示されています。閉経前乳がんはBMIと逆相関することが報告されています。
カロリ−制限ががんを抑制するメカニズムを理解するとき、逆の肥満(すなわち、カロリー過剰)ががんの発生や進展を促進するメカニズムを知っておくと役立ちます。(下図)

カロリー過剰になって肥満(脂肪組織の増大)になると、アディポネクチンの産生が低下し、脂肪酸の量が増え、酸化ストレスが高くなります。脂肪組織ではTNF-αやIL-6などの炎症性サイトカインの産生が増え、慢性炎症状態となり、活性酸素やフリーラジカルの産生も増えて酸化ストレスも増大します。
アディポネクチンの血中濃度が低下するとインスリン抵抗性が高くなり、血中インスリン濃度が上昇します。インスリンはそれ自体ががん細胞の増殖を刺激します。インスリン濃度の上昇は乳がん、大腸がん、膵臓がん、子宮内膜がんの発生率を高めることが明らかになっています。
さらに、インスリンは肝臓におけるインスリン様成長因子-1結合蛋白やステロイドホルモン結合グロブリンの産生を減らすことによって、インスリン様成長因子-1(IGF-1)や性ホルモンの活性が高まります。インスリンは卵巣におけるアンドロゲンの産生を高める作用もあります。つまり、インスリンは性ホルモンの活性を高める作用があります。脂肪組織はエストロゲンの産生部位でもあり、アロマターゼ活性によってエストロゲンの産生が高まります。
IGF-1はPI3K/Akt/mTORシグナル伝達系を刺激してがん細胞の増殖や転移を促進します。
このようにして、インスリン、インスリン様成長因子-1、性ホルモン、炎症性サイトカインの血中濃度が高まることによって、がんの発生や進展が促進されることになります。
肥満、特に内臓脂肪が過剰な女性では、閉経後乳がんの発生リスクが高いことが知られていますが、これは、インスリン抵抗性、高インスリン血症、性ホルモン結合グロブリンの低値、フリーの性ホルモンの量の増加などの総合的な作用によると考えられています。
体重を減らすとがんの発生率もがんによる死亡率も減ることが、減量手術(gastric bypass surgery)を受けた患者の追跡調査で明らかになっています。
運動やカロリー制限による体重減少は、体重オーバーや肥満の人における代謝やホルモンの変化を起こして、発がんリスクを低下させます。このメカニズムは肥満ががんの発生を増やすメカニズムと逆です。
具体的には、アディポカインの状態を良くし(アディポネクチンの量を増やし、炎症性サイトカインの量を減らす)、インスリン感受性を高め、血中インスリン濃度を低下させます。脂肪量の減少はアロマターゼ活性を低下させ、エストロゲンの量も減らします。
インスリン濃度の低下は、性ホルモン結合グロブリンの肝臓での産生量を増やすことによってエストロゲンとテストステロンの活性を低下させ、インスリン様成長因子-1(IGF-1)結合蛋白の量を増やすことによってフリーのIGF-1を減らします。体重減少(体脂肪の減少)は、炎症性サイトカインやプロスタグランジンの量も減らし、酸化ストレスやDNAダメージを軽減します。
以上のような総合作用によって肥満を改善することによってがんの発生や進展を抑えることができます。
【カロリー制限による寿命延長と抗がん作用のメカニズム】
実際にカロリー制限で寿命延長やがん予防効果を達成しようとすると、これまでの報告を総合すると、30~40%程度のカロリー制限を行う必要があります。しかし、この程度のカロリー制限を行うと、運動も仕事も支障をきたし、栄養障害のリスクもあります。つまり、カロリー制限を行わなくても、カロリー制限と同じ効果が得られる方法を見つければ良いと言えます。そのためには、カロリー制限が寿命を延ばすメカニズムを理解する必要があります。
つまり、カロリー制限によって寿命が延びるメカニズムに対して、それを刺激・活性化する因子、阻害・抑制する因子があるわけで、促進している因子をさらに高め、抑制している因子を阻害すれば、カロリー制限を行わなくなくても長寿を達成できることになります。
例えば、寿命延長とがん予防効果を促進する因子として、AMPK、アディポネクチン、サーチュイン(SIRT1)、オートファジーなどがあります。これらの因子を活性化する方法はカロリー制限の効果を真似ることができます。
抑制する因子としては、インスリン、インスリン様成長因子-1(IGF-1)、PI3K/Akt/mTORシグナル伝達系、活性酸素などによる酸化ストレス、慢性炎症状態を引き起こす炎症性サイトカインなどがあり、これらの因子の活性や産生を抑えることはカロリー制限の効果を真似ることができます。(下図)

カロリー制限による抗がん作用や寿命延長効果のメカニズムは、上記の肥満の改善による抗がん作用のメカニズムと一部は共通します。つまり、
1)成長因子(IGF-1など)や増殖因子や同化ホルモン(インスリン)の減少
2)活性酸素の減少、内因性抗酸化システムの活性化:酸化ストレスの低下、フリーラジカルによるDNAダメージの減少
3)炎症性サイトカインの低下、抗炎症作用とインスリン感受性を高めるアディポネクチンの産生増加
というメカニズムが共通します。
しかし、カロリー制限にはさらに強力なメカニズムが作用します。
つまり、30~40%のカロリー制限というのは、軽度から中等度の飢餓状態であり、それに対して生体は様々な適応応答(adaptation)を行うために、代謝や防御機能に関与する遺伝子の発現レベルでの変化が生じるのです。
具体的には、生体エネルギーのATPが減少するため、AMP活性化プロテインキナーゼ(AMPK)が活性化し、インスリンやIGF-1の産生減少に伴うPI3K/Akt/mTORシグナル伝達の低下、オートファジーの亢進、サーチュイン遺伝子の活性化などが起こります。
IGF-1は成長ホルモンの作用によって肝臓で産生されますが、ネズミの実験では、カロリー制限でIGF-1濃度が30~40%減ることが報告されています。成長ホルモンの働かないネズミ(成長ホルモンや成長ホルモン受容体の欠損マウス)の研究では、がんの発生率が減少し、成長ホルモンが過剰に発現しているネズミは、IGF-1の濃度が上昇し、寿命が短くなり、がんの発生率が高まることが報告されています。
IGF-1の血中濃度が高いほどがんの発生率が高くなることは、乳がん、前立腺がん、大腸がんで示されています。飢餓状態になるとIGF-1の濃度が成長ホルモン欠損患者と同等レベルまで低下します。
しかし、蛋白摂取量が多いと、長期間のカロリー制限でもIGF-1の量は減らないことが報告されています。摂取カロリー量より蛋白摂取量の方がIGF-1の濃度を高めると言われています。健康な中年男女の研究で、蛋白摂取量が多いと、高度のカロリー制限を長期間行っても、IGF-1が減少しないと報告されています。一方、蛋白摂取量を体重1kg当たり0.75gまでに制限した、厳密な菜食主義者ではIGF-1が低下します。
つまり、がんの食事療法でIGF-1を減らす目的では、タンパク質の摂取量もあまり増やさない方が良いことになります。(312話参照)
AMPKの活性化やmTOR(哺乳類ラパマイシン標的タンパク質)の活性を抑えることも寿命延長とがん抑制の重要なポイントになります。
以上のようにカロリー制限には様々のメカニズムが総合的に作用していますが、カロリー制限で起こる体内の変化を利用することはがんの治療に役立ちます。
例えば、AMPKを活性化する経口糖尿病薬のメトホルミンががんの発生予防や抗がん剤感受性を高めることが報告されています。mTORを阻害するラパマイシンおよびその類縁物質が寿命延長とがん予防の両方の効果を有することが報告されています。このような薬を適切に利用するとがんの治療に役立つ可能性が指摘されています。
一般的に「生命というのは生殖年齢を超えて長生きする理由が無い」と言われています。人間以外の生き物の多くは、生殖年齢後比較的短期間で生命が終わるようにプログラムされているのですが、人間は医学の力で長生きできるようになったと言われています。
したがって、100歳を超えて生きるには、病気や老化に対する強力な防御因子がなくてはならないことになります。このような防御因子に関しては、以前は免疫力や抗酸化力や自然治癒力などと漠然と考えられていましたが、最近は、AMPKやmTORやアディポカイン、サーチュイン、オートファジー、IGF-1など免疫や抗酸化力とはあまり関係ないターゲット分子の重要性が増してきたようです。
単純に免疫力や抗酸化力を高めるという治療法より、これからは、「カロリー制限と関連する因子」をターゲットにした治療法を検討する方が長寿やがん抑制には効果がありそうです。例えば、漢方薬で不老長寿の効果が経験的に知られている代表的な生薬の高麗人参や黄耆の薬効も、AMPKやアディポネクチンやmTORの観点からの研究が増えてきています。(例えば292話参照)
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
| « 316)アディポ... | 318)脂肪酸のβ... » |



