がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
849)体に優しいがん治療(その3):PI3キナーゼ/Aktシグナル伝達系の阻害
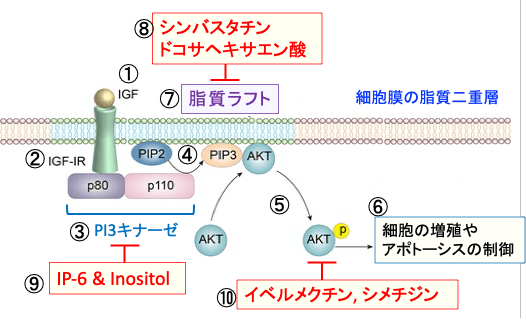
図:インスリン様成長因子-1(IGF-1)はIGF-1受容体(IGF-1R)に結合すると(①と②)、PI3キナーゼ(PI3K)というリン酸化酵素が活性化される(③)。PI3Kは細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素でp80とp110の2つのサブユニットから構成されている。PI3Kはホスファチジルイノシトール4,5-二リン酸(PIP2)の3位のOHをリン酸化してホスファチジルイノシトール3,4,5-三リン酸(PIP3)を生成する(④)。生成したPI3,4,5-三リン酸(PIP3)がAKTをリン酸化して活性化する(⑤)。活性化したAKTは、細胞内のシグナル伝達に関与する様々なタンパク質の活性を調節することによって細胞の増殖や生存(あるいは死)の調節を行う。がん細胞においてはAKTの活性化はがん細胞の増殖・転移を亢進し、アポトーシスに抵抗性にする(⑥)。IGF-1、IGF-1R、PI3K、PIP2、PIP3、AKTのタンパク質は脂質ラフトに集合して、シグナル伝達を効率化している(⑦)。シンバスタチンとドコサヘキサエン酸はがん細胞の脂質ラフトを減少してPI3K/AKTシグナル伝達系を抑制する(⑧)。IP-6 & InositolはPI3キナーゼを阻害する(⑨)。イベルメクチンとシメチジンはAKTの活性化を抑制する(⑩)。これらを組み合わせることによって、がん細胞のPI3k/AKTシグナル伝達系を抑制すると、がん細胞の増殖を抑制し、細胞死を起こしやすくなる。
849)体に優しいがん治療(その3):PI3キナーゼ/Aktシグナル伝達系の阻害
【細胞は脂質二重層で包まれている】
体を構成する個々の細胞は細胞膜で囲まれています。細胞膜は脂質二重層を土台にしてできており、この細胞膜によって細胞外と細胞内が分けられています。
脂質二重層はリン脂質分子が膜状に並んで作られます。リン脂質分子は親水性のリン酸部分と、疎水性の2個の脂肪酸が尻尾のように繋がった構造をしています。
細胞の内外は主に水で満たされているので、リン脂質分子は親水性のリン酸部分(頭部)を外側に、水に反発する疎水性の脂肪酸部分(尾部)を内側にして、3〜6ナノメートル(nm)程度の厚さの2重の層を作って並びます(図)。
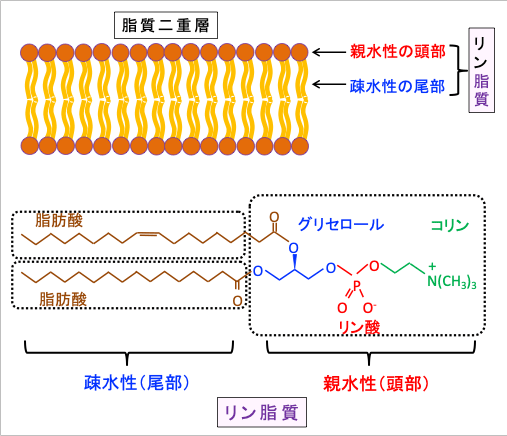
図:リン脂質は親水性のリン酸部分(頭部)と、疎水性の脂肪酸部分(尾部)から構成される。疎水性の尾部は水によってはじかれ、互いに引き付けられて内側に並び、親水性の頭部の領域が水に接する外側に露出して膜状の二重層を形成する。この脂質二重層が細胞膜の基本構造になる。
細胞の内外を分ける細胞膜は脂質二重層を土台にして、その中にタンパク質粒子が浮遊するように移動しています。脂質二重層に浮かぶタンパク質粒子は、受容体や物質を通すチャネルなどとして働きます。細胞膜に埋め込まれたタンパク質や脂質に糖鎖が結合し、細胞の識別や情報交換のマーカーとして細胞機能に影響を与えています。(図)
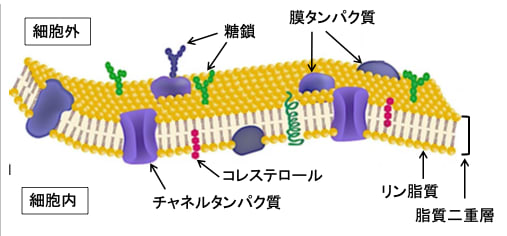
図:細胞膜は脂質の二重膜の海に、膜タンパク質が氷山のように頭を少し出して浮かんだような構造をしている。この構造モデルを流動モザイクモデル(fluid mosaic model)と呼んでいる。
【脂質ラフトはシグナル分子間の相互作用のプラットフォームとして働いている。】
細胞膜はリン脂質を基本成分とする油の膜(脂質二重層)から成り、そこに膜タンパク質が挿入されて出来ています。細胞膜は流動的で、膜タンパク質は生体膜上をダイナミックに移動しています。
細胞膜は均一な構造体ではなく、ところどころに分子の集合体を作っています。このように分子が集まった微小領域を膜マイクロドメイン、あるいは脂質ラフト(lipid raft)と言います。
ラフト(Raft)とは筏(いかだ)のことで、細胞膜中に特定の脂質(スフィンゴミエリンやコレステロールなど)とタンパク質(受容体など)が集合した領域(構造)が存在し、それが脂質ラフトです。
脂質ラフトの部分はコレステロールや飽和脂肪酸が多く、膜の流動性が低下し、海に浮かぶ筏のような構造物を提供し、プラットホームや中継基地のような機能を担っています。
脂質ラフト(膜マイクロドメイン)は膜の内外のシグナル伝達や物質輸送などで重要な役割を果たしています。(下図)
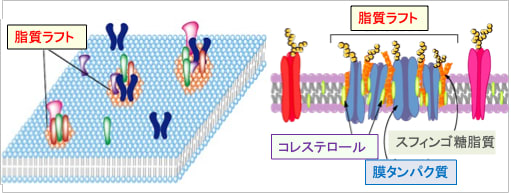
図:細胞膜の脂質分布は均質ではなく、一部の脂質は限局したドメイン(区画)を形成している。これを流動膜に浮かぶ筏(いかだ)になぞらえて脂質ラフトと呼ぶ。脂質ラフトの脂質およびタンパク質組成は周囲の細胞膜とは異なり、コレステロールやスフィンゴ脂質が多く、流動性が低下し、シグナル伝達タンパク質のプラットフォームおよびハブとして機能する。脂質ラフトにはシグナル伝達系のタンパク質が集合し、シグナル分子間の相互作用の場として働いている。
細胞外から細胞内へのシグナル伝達は細胞表面でランダムに発生しているのではありません。シグナルを受け取り、細胞内に効率良くシグナルを伝達するためのネットワークのプラットフォームや中継基地のような構造が存在します。
細胞膜の脂質二重層では、コレステロールとスフィンゴ脂質が集合体を形成して膜マイクロドメイン(脂質ラフト)を作っています。脂質ラフトはステロールとスフィンゴ脂質に富んだ10-200 nmサイズの小さく不均一で非常に動的なドメインであり、細胞機能のコンパートメント化(区画化)を担っています。
脂質ラフトにおけるタンパク質の物理的分離は、シグナル伝達系における調節分子やエフェクター分子へのタンパク質の接近性を調節し、シグナル伝達タンパク質の選別プラットフォームおよびハブとして機能します。
つまり、細胞膜の脂質ラフト上に受容体などの機能性物質が集合することにより、シグナル伝達や物質輸送の窓口として機能しています。シグナル伝達において複数の分子が連続して作用する場合、それらの分子を一箇所に集めることにより、それらの分子が相互作用する確率を高め、一連の反応を速やかに行うことができます。
たとえば、がん細胞ではインスリン様成長因子 I (IGF-I)/ホスファチジルイノシトール 3-キナーゼ (PI3K)/Akt シグナル伝達系の活性が亢進しています。IGF-1がPI3K(PI3キナーゼ)を活性化してAkt (プロテインキナーゼBまたはPKBとしても知られている)をリン酸化して活性化します。
Akt はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。
がん細胞においてはAktの活性化はがん細胞の増殖・転移を亢進し、アポトーシスに抵抗性にします。
このIGF-1/PI3K/Aktに関与する受容体やタンパク質は脂質ラフトに集まって、効率良くシグナル伝達を行なっています。(下図)
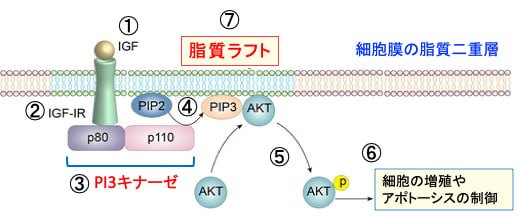
図:インスリン様成長因子-1(IGF-1)はIGF-1受容体(IGF-1R)に結合すると(①と②)、PI3キナーゼ(PI3K)というリン酸化酵素が活性化される(③)。PI3Kは細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素でp80とp110の2つのサブユニットから構成されている。PI3Kはホスファチジルイノシトール4,5-二リン酸(PIP2)の3位のOHをリン酸化してホスファチジルイノシトール3,4,5-三リン酸(PIP3)を生成する(④)。生成したPI3,4,5-三リン酸(PIP3)がAktをリン酸化して活性化する(⑤)。活性化したAktは、細胞内のシグナル伝達に関与する様々なタンパク質の活性を調節することによって細胞の増殖や生存(あるいは死)の調節を行う。がん細胞においてはAktの活性化はがん細胞の増殖・転移を亢進し、アポトーシスに抵抗性にする(⑥)。IGF-1、IGF-1R、PI3K、PIP2、PIP3、Aktのタンパク質は脂質ラフトに集合して、シグナル伝達を効率化している(⑦)。
【ホスファチジルイノシトール・シグナル伝達系とは】
IP3やIP4はジアシルグリセロールと結合したホスファチジルイノシトール4,5-二リン酸やホスファチジルイノシトール3,4,5-三リン酸の形で細胞の膜に存在しています。
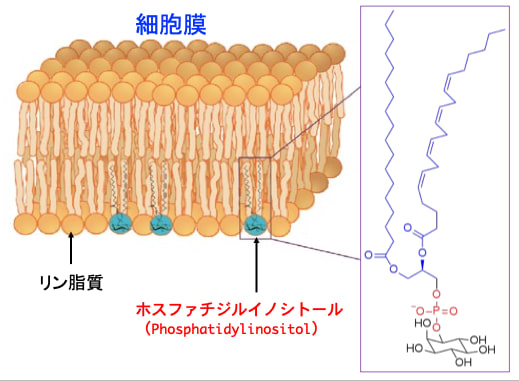
図:細胞膜はリン脂質の2重層で構成される。ホスファチジルイノシトールは負に帯電したリン脂質であり、リン脂質の微量成分を構成する。 ホスファチジルイノシトールは、脂質二重層の細胞質側の脂質層に存在する。 ホスファチジルイノシトールは、膜脂質二重層に埋め込まれた脂肪アシル鎖で構成され、グリセロール骨格を介して細胞質に面するミオイノシトール環に結合している。
ホスファチジルイノシトール(Phosphatidylinositol) は、イノシトール環と、グリセロール骨格を介して結合した2つの脂肪酸鎖からなる小さな脂質分子であり、細胞膜の細胞質面にアンカーされた構造を有します。
ホスファチジルイノシトールは、多数の脂質キナーゼによってイノシトール環の3、4および/または5ヒドロキシ基がリン酸化されます。これにより、多様性に富むPhosphatidylinositol monophosphate (PI3P、PI4P、PI5P)、diphosphate [PI(3,4)P2、PI(3,5)P2 、PI(4,5)P2]、triphosphate [PI(3,4,5)P3]が産生され、これらを一まとめにしてホスフォイノシチド(Phosphoinositide)と呼ばれます。

図:ホスファチジルイノシトール(Phosphatidylinositol) は、イノシトール環と、グリセロール骨格を介して結合した2つの脂肪酸鎖から構成される。ホスファチジルイノシトールは、多数の脂質キナーゼによってイノシトール環の3、4および/または5ヒドロキシ基がリン酸化され、多様性に富むホスフォイノシチド(Phosphoinositide)が生成される。
生存、増殖、分化、DNA損傷応答および遺伝子転写を含む複数の細胞機能は、脂質セカンドメッセンジャーのホスファチジルイノシトールを調節するキナーゼ、ホスファターゼ、およびリパーゼのネットワークによって制御されています。
ホスファチジルイノシトールは、ホスホジエステル結合を介してグリセロールに結合した親水性のイノシトール部分と、疎水性の脂肪酸から構成されます。脂肪酸の部分は主にステアリン酸とアラキドン酸が結合しています。
ホスホリパーゼCによるホスホジエステル結合の加水分解とともに、リン酸基の付加または除去によるイノシトール環の修飾は、多くの細胞においてセカンドメッセンジャーとして働きを担っています。
【IP3はセカンドメッセンジャーとして細胞機能の制御に関わる】
真核細胞は、イノシトール骨格を遍在的に利用して、多様なシグナル伝達分子を生成しています。これは、6炭素のイノシトール環の周りにリン酸基を配置することによって生成されています。
イノシトールリン酸は、20世紀初頭に、主要なリン酸貯蔵庫を構成する植物の豊富な成分としてイノシトールヘキサキスリン酸(IP6、フィチン酸としても知られる)が同定されて以来、生物学的に重要な分子として認識されてきました。これらの物質への関心は、1980年代半ばにIP3(イノシトール1,4,5-三リン酸)が細胞内貯蔵からカルシウムを放出するセカンドメッセンジャーとして発見されたことで高まりました。
これまでに最もよく研究されてきたPhosphoinositideはPI(3,4,5)P3であり、PI3K(ホスファチジルイノシトール3-キナーゼ)によってPI(4,5)P2から合成され、PTENにより脱リン酸化されます。
ホスファチジルイノシトール3-キナーゼ(PI3K)は、細胞膜の構成要素でホスホイノシチドの代謝前駆体であるホスファチジルイノシトールの3'-水酸基をリン酸化するシグナル伝達タンパク質で、広範な細胞活性を調節することによって細胞生存および細胞死を制御する生物活性脂質分子です
PI3KおよびPTENは両方とも、受容体チロシンキナーゼに誘導されるAktシグナル伝達の中心的なメディエーターであり、これらの変異は多くのがん細部で高頻度に認められます。
ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素です。ホスファチジルイノシトール4,5-二リン酸(PIP2)の3位のOHをリン酸化してホスファチジルイノシトール3,4,5-三リン酸(PIP3)を生成する酵素です。PIP3がAktをリン酸化して活性化します。
PTEN(Phosphatase and Tensin Homolog Deleted from Chromosome 10)はイノシトールリン脂質であるホスファチジルイノシトール-3,4,5-三リン酸(PIP3)の脱リン酸化反応を触媒する酵素です。PIP3をPIP2に変化することによってAktの活性化を阻止します。
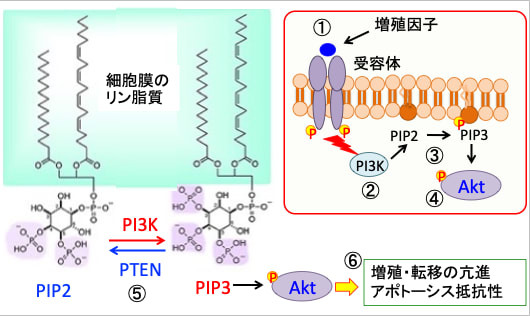
図:インスリン、インスリン様成長因子-1(IGF-1)、成長ホルモンなどの増殖刺激が細胞に作用すると(①)、それらの受容体を介してPI3キナーゼ(PI3K)というリン酸化酵素が活性化される(②)。PI3Kは細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,ホスファチジルイノシトール4,5-二リン酸(PIP2)の3位のOHをリン酸化してホスファチジルイノシトール3,4,5-三リン酸(PIP3)を生成する(③)。生成したPI3,4,5-三リン酸(PIP3)がAktをリン酸化して活性化する(④)。PTENは脱リン酸化する酵素でPIP3をPIP2に変化することによってAktの活性化を阻止する(⑤)。活性化したAktは、細胞内のシグナル伝達に関与する様々なタンパク質の活性を調節することによって細胞の増殖や生存(あるいは死)の調節を行いう。がん細胞においてはAktの活性化はがん細胞の増殖・転移を亢進し、アポトーシスに抵抗性にする(⑥)。
PI3キナーゼ/AKT経路は,細胞外からのシグナルを細胞内に伝える主要な経路の一つで、増殖因子やインテグリンを介した細胞接着など、様々な刺激により活性化され、細胞の生存促進,細胞増殖・大きさの制御、細胞運動、代謝の制御など多くの細胞機能に関与しています。
Aktは多くのがん組織で活性化しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御しています。
がん細胞の生存と増殖はAKTシグナル伝達系の活性に依存度が高いので、AKTシグナル伝達系の阻害はがん細胞の増殖抑制やアポトーシス誘導を引き起こします。
PTENは脱リン酸化する酵素でPIP3をPIP2に変化することによってAktの活性化を阻止します。多くのがん細胞でPTENの変異が起こっています。
【イノシトール-6-リン酸(フィチン酸)は米ぬかや豆やナッツに多く含まれる】
イノシトール(Inositol)は6個の炭素からなるシクロヘキサンの各炭素上の水素原子がヒドロキシ(OH)基に置き換わった構造の物質で、生体内でブドウ糖から生合成され、生体成分として広く存在し、特に穀物の糠(ぬか)や豆に多く含まれています。細胞成長に必要なビタミンB群の一種と考えられており、抗脂肪肝作用が知られています。食品添加物として使用が認められています。
このイノシトールの6個のヒドロキシ(OH)基が全てリン酸化されたのが、イノシトール-6-リン酸です。イノシトール-6-リン酸は別名フィチン酸と呼ばれ、組成式は C6H18O24P6 で、IP6と略記されます。穀物の糠や種子など多くの植物組織に存在する主要なリンの貯蔵形態です。

図:イノシトール(Inositol)の6個のヒドロキシ(OH)基が全てリン酸化されたのがイノシトル-6-リン酸(Inositol Hexaphosphate)で、フィチン酸とも呼ばれる。
穀物の糠には、イノシトール-6-リン酸(IP6)がマグネシウムやカルシウムと強く結合(キレート)して存在します。マグネシウムやカルシウムとキレートした状態(フィチン酸のカルシウム・マグネシウム混合塩)をフィチン(Phytin)と言い、水に不溶性です。米ぬかにはフィチンが10%以上含まれています。
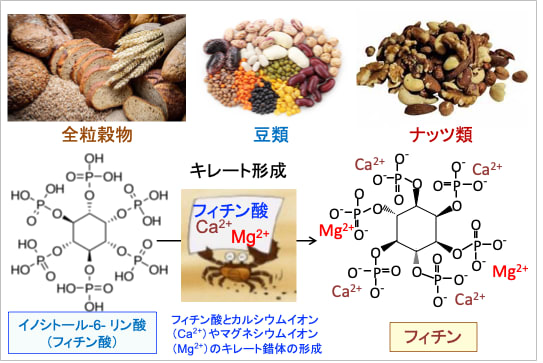
図:イノシトル-6-リン酸(フィチン酸)はカルシウムやマグネシウムと結合した「フィチン」という形態で、全粒穀物(穀物の糠)や種子類(豆やナッツ)に多量に含まれている。
【イノシトール-6-リン酸(IP6)をサプリメントで摂取するメリット】
食物繊維の豊富な食事はがん予防効果があることが報告されていますが、その理由の一つは、食物繊維に含まれるイノシトール-6-リン酸(フィチン酸)に抗がん活性があるからだと言われています。イノシトール-6-リン酸(IP6)は抗酸化作用や免疫力増強(ナチュラルキラー細胞活性の増強)、金属に対する強いキレート作用によって、がん予防効果や美容や健康増進効果が示唆されています。
IP6(イノシトール-6-リン酸)は神経機能を正常に保つ効果があります。イノシトールは、ホスファチジルイノシトールというリン脂質の構成成分です。リン脂質は細胞膜に含まれている成分で、特に神経細胞の膜に多く存在しています。リン脂質は脳細胞に栄養を供給したり、神経の働きを正常に保つ働きを担っています。したがって、リン脂質の構成要素であるイノシトールは、神経の伝達や脳の活動を正常に保つ上で欠かすことのできない成分といえます。
IP6は穀物やマメ類に豊富に含まれていますが、IP6をサプリメントとして摂取することは幾つかの利点があります。
まず第一に、穀物やマメ類に含まれるイノシトール6リン酸(フィチン酸)は、タンパク質やミネラル(カルシウム、マグネシウム、カリウムなど)と結合して複合体を形成しています。これをフィチンと言います。フィチンは水に不溶性で消化管からの吸収が極めて悪いのが特徴です。したがって、食物繊維の形で摂取してもイノシトール6リン酸(IP6)は体の中にほとんど吸収されません。精製したIP6は、食物繊維中のIP6より極めて吸収が良いことが多くの研究で明らかになっています。
イノシトールは、体内でグルコース(ブドウ糖)からも合成されますが、合成量には限界があり、それだけでは十分な量とはいえないため、毎日の食事やサプリメントでイノシトール6リン酸(IP6)を摂取する必要があります。
脂肪肝、肝硬変、高コレステロール血症、動脈硬化症などに対して効果を得るために1日に必要な摂取目安量は500~2000mgとされています。
安全性については、動物実験や人間による臨床試験が多く行われています。その結果、IP-6は極めて安全で、大量に摂取した場合でも副作用は報告されていません。
安価なサプリメントとしてインターネットで入手できます。
【IP6はイノシトールと一緒に服用すると抗がん作用が増強される】
IP6はイノシトールとの同時に摂取したほうが効果が吸収されやすく、さらに抗がん作用が強くなるので、IP6とイノシトールを混ぜたサプリメントががんの予防や治療の目的のサプリメントとして販売されています。
米国のメリーランド大学医学部病理学のシャムスディン教授(AbulKalam M Shamsuddin)は、IP6とイノシトールを一緒に摂取するとその効果が高まること、とくにIP6とイノシトールが4:1で含まれる商品がもっとも抗がん活性が高いこと明らかにし、特許を取得しています。以下の論文はシャムスディン教授の総説論文の一つです。
Protection against cancer by dietary IP6 and inositol(食事からのIP6とイノシトールによるがんに対する保護)Nutr Cancer. 2006;55(2):109-25.
【要旨】
イノシトール6リン酸(IP6)は、天然に存在するポリリン酸化炭水化物であり、多くの植物や、穀物やマメ科植物などの高繊維食に豊富に含まれている。IP6は植物だけでなく、ほとんどすべての哺乳類細胞に含まれており、シグナル伝達、細胞増殖、分化などの重要な細胞機能の調節に重要な役割を担っている。
長い間、IP6は天然の抗酸化物質として認識されてきた。さらに最近は、IP6はがんの発生予防効果と実験的腫瘍の成長、進行、および転移の制御における効果が注目されている。
さらに、IP6は、免疫システムを強化し、病的な石灰化や腎臓結石の形成を防ぐ効果、血清コレステロールの低下、血小板凝集の抑制などの健康作用を有している。
この総説では、IP6の作用を支配する分子メカニズムについて解説する。
外来的に投与されたIP6は急速に細胞に取り込まれ、脱リン酸化されてリン酸基のより少ないイノシトールリン酸を生成する。これらのイノシトールリン酸はシグナル伝達経路に影響を及ぼし、細胞周期を停止させる。
IP6の顕著な抗がん作用は、さまざまな実験モデルで実証された。IP6は細胞増殖の抑制に加えて、悪性細胞の分化も誘導する。
免疫増強作用と抗酸化作用も抗がん作用のメカニズムとして関与している。
ヒトでの予備試験では、IP6とIP6の前駆体分子であるイノシトールの併用が、従来の化学療法の抗がん効果を増強し、がんの転移を抑制し、生活の質を向上することが示されている。IP6とイノシトールは、通常の食事に豊富に含まれ、消化管から効率的に吸収され、安全であるため、がんの予防と治療の目的で期待されている。ヒトでの本格的な臨床試験の開始を正当化するのに十分な証拠があることは明らかである。
イノシトールはIP6の抗がん作用と免疫力増強作用を著明に高めます。イノシトールと適切に組み合わせると、IP6は体内で2分子のIP3に変換されることが報告されています。(下図)

図:イノシトール(①)の6個のヒドロキシ(OH)基が全てリン酸化されたのがイノシトル-6-リン酸(Inositol Hexaphosphate)で、IP6と略記される(②)。イノシトールとIP6を適切に組み合わせると、IP6は体内で2分子のIP3に変換される(③)。IP3はイノシトールに3個のリン酸基が付いた構造で、がん細胞の増殖を抑制する作用がある(④)。
イノシトールはIP6の骨格構造であり、リン原子が結合できる炭素原子を6個持っています。これらの6個の炭素原子が全てリン酸エステル化したものがIP6です。6個の炭素原子のうち3個のみがリン原子と結合したものがIP3と呼ばれます。IP6の抗腫瘍活性に関わっているのは実はこのIP3であると考えられています。つまり、IP6は体内でIP3に変換して抗がん作用を発揮するのです。
培養癌細胞を持いた研究で、IP3はがん細胞増殖のon/offを調節するスイッチの役目を果たしていることが明らかになっています。細胞内のIP3の濃度が低い時には、その細胞はコントロールを失って増殖します。これはがん細胞の特徴です。
がん細胞をIP3の豊富な培養液に入れると増殖を止めます。これは、IP3が細胞の増殖や細胞間コミュニケーションなどの重要な細胞機能を調節する中心的役割を果たしていることを意味しています。
シャムスディン博士は、体内でのIP3が効率的に生成されるために必要なIP6とイノシトールの比率を4:1で投与した場合がもっとも抗がん活性が高いことを示しています。
IP6とイノシトールの組み合わせは、抗酸化作用と免疫力増強作用の効果を持つことが報告されています。特に、がん細胞に対する免疫力の中心であるナチュラルキラー細胞を活性化する作用があります。ナチュラルキラー(NK)細胞というのは白血球の一種であり、がん細胞やウイルスや多くの感染微生物などを殺す役目を果たすので、このような名前がつけられています。ナチュラルキラー細胞はがんや感染症から体を守る重要な役割を果たしている細胞です。
【IP6+イノシトールの抗がん作用に関する研究】
IP6(フィチン酸)を大量に含む穀物や野菜の摂取量が多い人は、IP6ががん抑制遺伝子(p53やWAF-1/p21など)の発現を活性化するため、結腸直腸がんの発生率が低くなります。IP6はがん細胞の増殖を減少させ、細胞分化を増加させることにより、抗がん作用を発揮します。
さらに、IP3やIP4(それぞれ3つと4つのリン酸基を含む)などの低級イノシトールリン酸は、細胞間応答の調節に重要な生物学的役割を果たし、体内のシグナル伝達システムに作用することが知られています。
IP6の抗がん作用に関する研究は多数報告されています。例えば、以下のような報告があります。
Inositol hexaphosphate inhibits cell transformation and activator protein 1 activation by targeting phosphatidylinositol-3' kinase.(イノシトール6リン酸はフォスファチジルイノシトール-3'キナーゼに作用して細胞のがん化と転写因子AP-1の活性化を阻害する)Cancer Res 57(14):2873-2878,1997
【要旨の抜粋】
イノシトール6リン酸(IP6)は植物に最も多く存在するイノシトールリン酸である。哺乳動物の細胞内には10~100マイクロモル(μM)のIP6が存在する。IP-6ががんの予防や治療に有効な物質であることが知られている。
細胞のがん化を促進するプロモーター(フォルボールエステルなど)を細胞に作用させると、activator protein 1 (AP-1)という細胞内の転写因子(遺伝子の発現を制御するタンパク質)が活性化される。
この研究では、上皮細胞成長因子(Epidermal Growth Factor, EGF)で誘導されるフォスファチジルイノシトール-3'(PI-3)キナーゼの活性化をIP6が用量依存的に阻害することを明らかにした。IP-6によるPI-3キナーゼの阻害は、EGFやフォルボールエステルによる細胞のがん化や、細胞外シグナル調節キナーゼ (Extracellular signal-regulated kinases) やAP-1の活性化を阻止する。
以上の結果は、IP-6がPI-3キナーゼを阻害することによって抗腫瘍効果やがん予防効果を発揮しているエビデンスを提供している。PI-3キナーゼ(PI3K)ががん化学予防剤の開発のターゲット分子となる。
1997年頃はフォルボールエステルなどの発がんプロモーターを用いてAP-1を活性化し、このAP-1活性化を抑制するような薬を見つける実験ががん予防の研究領域では多く行われていました。
以下の論文はWnt/βカテニン・シグナル伝達経路に対する作用を検討しています。がん研究でWnt/βカテニン・シグナル伝達経路が研究ターゲットになったのは2000年代以降です。
Preventive Inositol Hexaphosphate Extracted from Rice Bran Inhibits Colorectal Cancer through Involvement of Wnt/β-Catenin and COX-2 Pathways(米ぬかから抽出されたイノシトール6リン酸は、Wnt / β-カテニンおよびCOX-2経路の関与を通じて結腸直腸がんを阻害する)Biomed Res Int. 2013; 2013: 681027.
【要旨の抜粋】
ラットにアゾキシメタンを投与して結腸直腸がんを誘発する実験モデルでイノシトール6リン酸(IP6)のがん予防効果を検討した。オスのSprague Dawleyラットをそれぞれ6匹づつの5つのグループに分けた。ラットはアゾキシメタン(15mg/Kg体重)を2週間の間を置いて2回の腹腔内注射を受けた。
IP 6は、0.2%(w / v)、0.5%(w / v)、1.0%(w / v)の3つの濃度で、飲料水を介して16週間投与された。
結腸直腸がんの発症には、Wnt / β-カテニン・シグナル伝達経路の異常と、シクロオキシゲナーゼ(COX)-2の発現亢進が関係している。β-カテニンとCOX-2の発現は、定量的RT-PCRとウエスタンブロッティングを使用して分析した。
IP 6の投与は、コントロールと比較して、腫瘍の発生率を著しく抑制した。興味深いことに、IP 6の投与により、結腸腫瘍のβ-カテニンとCOX-2も著しく減少した。
したがって、IP6はβ-カテニンとCOX-2の発現を抑制し、腫瘍の発生を抑制する効果を発揮し、有効な抗がん剤として使用できる。
以下のような報告もあります。
Combination of Inositol Hexaphosphate and Inositol Inhibits Liver Metastasis of Colorectal Cancer in Mice Through the Wnt/β-Catenin Pathway.(イノシトール6リン酸とイノシトールの組み合わせは、Wnt /β-カテニン経路を介してマウスの結腸直腸がんの肝転移を阻害する)Onco Targets Ther. 2020; 13: 3223–3235.
イノシトール6リン酸(Inositol hexaphosphate:IP6)とイノシトール(Inositol)は、それぞれがin vitroとin vivoの両方で抗腫瘍効果を示し、IP6とイノシトールの組み合わせは、IP6またはイノシトール単独よりも効果が高いことが多くの実験で明らかになっています。
この研究では、マウスの結腸直腸がん同所性移植モデルを用いて、結腸直腸がんの腫瘍進行および肝転移に対するIP6、イノシトールのそれぞれ単独投与、およびIP6 + イノシトールの併用投与の阻害効果を検討しています。
担がんマウスは、IP6あるいはイノシトールのそれぞれ単独、およびIP6 とイノシトールの併用で治療され、インビボ生物発光イメージングによって腫瘍の大きさを測定しました。6週間の治療後にすべてのマウスを屠殺し、がんの発生と転移をグループ間で比較し、Wnt /β-カテニンに関連する遺伝子の発現を分析しています。
その結果、非治療群に比べて、IP6、イノシトール、およびIP6 + イノシトールによる治療はいずれも肝転移を抑制し、生存期間を延長し、腫瘍重量を減少しました。
腫瘍増殖と転移抑制の効果は、IP6単独およびイノシトール単独投与群に比較して、IP6 + イノシトール併用投与群において顕著でした。
遺伝子発現の解析では、IP6 + イノシトール治療群で、結腸直腸がん細胞で発現が亢進しているWnt /β-カテニンに関連する遺伝子(β-カテニン、Wnt10b、Tcf7、c-Myc)の発現の低下が認められました。
以上の実験結果から、IP6 + イノシトールの併用はそれぞれの単独投与よりも結腸直腸がんの肝転移の抑制に効果が高く、その作用機序として結腸直腸がん細胞に発現が亢進しているWnt /β-カテニンシグナル伝達経路の抑制を指摘しています。
この論文では、マウスの結腸直腸がん同所性移植モデルを用いた実験で、がんの増殖抑制効果はIP6、イノシトールのそれぞれ単独投与よりIP6 + イノシトールの併用投与が大きいことを報告しています。
この抗腫瘍効果において、IP6がWnt /β-カテニンシグナル伝達経路を直接抑制するのか、他のメカニズムでがん細胞の増殖が阻止された結果としてWnt /β-カテニンシグナル伝達経路も間接的に抑制されたのかは不明です。
がん研究が進歩して新しいシグナル伝達系が発見さえると、その新規のメカニズムに対する薬の効果が研究されます。いろんな実験系でIP6の抗腫瘍効果が明らかになっています。
【IP6とイノシトールの組み合わせで、進行がんが消滅?】
IP6とイノシトールの組み合わせはがん治療に効果的であることが知られており、頻繁に報告されています。前述のように、シャムスデン博士は、IP6とイノシトールを適切な比率で組み合わせると、必須の細胞調節因子であるイノシトール1,4,5-三リン酸シグナル伝達分子が生成されることを示しました。彼らは、IP6とイノシトールの組み合わせは、単独の各成分よりも抗がん作用が強いと結論づけています。以下のような症例報告があります。
Inositol hexaphosphate plus inositol induced complete remission in stage IV melanoma: a case report.( イノシトールヘキサホスフェートとイノシトールはステージIV黒色腫で完全寛解を誘発した:症例報告) Melanoma Res. 2019 Jun; 29(3): 322-324.
【要旨】
フィチン酸とも呼ばれるイノシトール六リン酸(IP6)は、穀物やナッツや高食物繊維含有食品に含まれるポリリン酸化炭水化物である。大腸がん、膵臓がん、肝臓がん、前立腺がん、黒色腫など多数の悪性腫瘍のin vitroおよびin vivoの両方の実験系で腫瘍細胞の増殖を阻害することが示されている。イノシトールはIP6の前駆体であり、これも抗がん作用を示す天然化合物である。
標準治療を拒否し、代わりに市販のサプリメントIP6 +イノシトールを試すことを選択した転移性黒色腫の患者の症例報告を提示する。驚いたことに、患者は完全寛解を達成し、3年後も寛解を続けている。
この症例と以前の前臨床試験に基づいて、転移性黒色腫患者におけるIP6 +イノシトールの抗がん作用および免疫刺激効果の調査には、さらなる研究が必要である。
P-6とイノシトールの組み合せは、乳がん、肺がん、大腸がん、前立腺がん、皮膚がん、肝臓がん、脳腫瘍、悪性リンパ腫、白血病、横紋筋肉腫など、ほとんど全ての癌および肉腫に効果があることが、動物実験などで明らかになっています。
安全性については、動物実験や人間による臨床試験が多く行われています。その結果、IP-6は極めて安全で、大量に摂取した場合でも副作用は報告されていません。
がん予防の目的には、1日にIP-6を800-1,200 mg とイノシトールを200-300 mgの摂取が必要です。
がんがある場合や、発がんのリスクが極めて高い場合には、4800~7200 mg のIP-6と1200~ 1800 mg のイノシトールを1日の摂取量として推奨されています。
これらは空腹時に摂取する方が効果的です。食事中のミネラルと結合するためです。
IP-6とイノシトールは抗癌剤や放射線治療など通常のがん治療と一緒に行っても問題は起こりません。むしろ、IP-6とイノシトールはこれらの通常医療の効果を増強する働きがあります。
進行がんの治療にI P6+イノシトールを試してみる価値はあります。
IP6& イノシトールのサプリメントはインターネットで安価に販売されています。
【シンバスタチンは脂質ラフトを減らして増殖を抑制する】
脂質ラフトはコレステロールが豊富です。コレステロールは細胞膜の流動性を低下させるので、海に浮かぶ筏のように、流動性の高い細胞膜においてタンパク質や伝達因子が集合するプラットホームのようなドメイン(区画)を作る場合、コレステロールの存在は重要です。
高脂血症治療薬のシンバスタチンはコレステロールの産生を阻害し、がん細胞の脂質ラフトを減らし、増殖シグナル伝達を抑制することが報告されています。以下のような報告があります。
Cholesterol targeting alters lipid raft composition and cell survival in prostate cancer cells and xenografts.(コレステロール標的化は、前立腺がん細胞および異種移植片における脂質ラフト組成および細胞生存を変化させる)J Clin Invest. 2005 Apr 1; 115(4): 959–968.
【要旨の抜粋】
脂質ラフトは、細胞膜内のコレステロールおよびスフィンゴ脂質に富むマイクロドメインで、細胞膜に結合したタンパク質に由来するリン酸化カスケードを制御する。この研究では、前立腺がん細胞膜の脂質ラフトのコレステロール含有量の変化が、in vitro および in vivo での細胞生存メカニズムに影響を与えるかどうかを検討した。
コレステロール合成阻害剤であるシンバスタチンは、脂質ラフトのコレステロール含有量を低下させ、セリン-スレオニン・キナーゼ のAkt経路を阻害し、前立腺がん細胞のアポトーシスを誘導した。細胞膜にコレステロールを補充すると、シンバスタチンによるAkt阻害とアポトーシス誘導が阻止された。
コレステロールは、正常な前立腺上皮細胞の Akt 活性化も増強した。
SCIDマウスにおける循環コレステロールの上昇は、異種移植腫瘍から単離された脂質ラフトにおけるコレステロール含有量およびタンパク質チロシンリン酸化の程度を増加させた。
コレステロールの上昇は腫瘍の増殖を促進し、Akt のリン酸化を増加させ、異種移植片のアポトーシスを減少させた。
これらの結果は、正常細胞と悪性細胞の両方で膜コレステロールがAktシグナル伝達に関係していることを示しており、前立腺がん細胞の細胞生存が、コレステロールによって制御されたAkt経路に依存する可能性を示唆している。
シンバスタチン治療は、がん 細胞の脂質ラフトのコレステロール含有量を減少させ、ラフトでの Akt リン酸化を阻害します。Aktシグナル伝達がコレステロール依存性メカニズムの制御下にあり、腫瘍細胞におけるこの経路の必須の細胞生存機能が、膜コレステロールレベルの低下および/または脂質ラフト構造の変化によって損なわれることを示しています。
シンバスタチンや他のスタチン系薬剤は、ファルネシル ピロリン酸やゲラニル ピロリン酸など、メバロン酸経路の他の生成物の合成に影響を与えます。これらは、Ras や Rho GTPase などの多数のシグナル伝達タンパク質の翻訳後修飾にも使用されます。
すなわち、シンバスタチンはイソプレノイド合成の阻害によってRas や Rho GTPaseを阻害し、コレステロールの合成阻害によって脂質ラフトを減少させて、増殖シグナル伝達系の活性化を抑制し、細胞死(アポトーシス)を誘導する効果を発揮します。
【オメガ3多価不飽和脂肪酸のDHAとEPAは脂質ラフトの性状を変えて、抗腫瘍効果を発揮する】
食事は、細胞膜の変更に大きな影響を与える可能性があります。細胞膜自体はリン脂質で構成されているため、食物中の脂質が膜構造に影響を与える可能性があります。
哺乳類細胞は、ほとんどの脂肪酸を内因的に生成できますが、オメガ6(n-6) または オメガ3(n-3)脂肪酸を新たに生成するのに必要な酵素を欠いています。したがって、これらの脂質は食事から摂取する必要があり、不可欠であると考えられています。
がん細胞は細胞分裂をして数を増やし、増殖します。細胞数を増やすために、細胞膜に使う脂肪酸の合成が亢進しています。さらに、がん細胞は自分で作った脂肪酸以外に、食事から摂取して血液中に存在する脂肪酸を積極的に取り込んで、細胞膜の合成に使います。
食事からのDHAやEPAの摂取を増やすと、がん細胞の細胞膜にDHAやEPAが多く取り込まれます。
がん細胞の細胞膜に取り込まれたDHAやEPAががん細胞の脂質ラフトの性状を変えることによって、がん細胞の増殖を抑制し、細胞死を誘導する可能性が指摘されています。
以下のような論文があります。
Chemical-physical changes in cell membrane microdomains of breast cancer cells after omega-3 PUFA incorporation.(オメガ3多価不飽和脂肪酸取り込み後の乳がん細胞の細胞膜マイクロドメインの化学的物理的変化)Cell Biochem Biophys. 2012 Sep;64(1):45-59.
【要旨の抜粋】
疫学的および実験的研究は、食事性脂肪酸が乳がんの発症と進行に影響を与えることを示唆している。しかし、オメガ3多価不飽和脂肪酸が乳がんの増殖を抑制するメカニズムは十分に解明されていない。オメガ3多価不飽和脂肪酸は、細胞膜、特に脂質ラフトの構造を変化させる可能性が示唆されている。
この研究では、乳がん細胞(MCF-7およびMDA-MB-231細胞)をアラキドン酸、エイコサペンタエン酸(EPA)、およびドコサヘキサエン酸(DHA)で処理して、これらの脂肪酸が脂質ラフトのリン脂質に組み込まれ、脂質ラフトの構造の化学的および物理的特性を変更できるかどうかを検討した。
私たちのデータは、多価不飽和脂肪酸とその代謝物が細胞膜マイクロドメイン(脂質ラフト)に異なる収率で挿入され、脂質ラフトの構造を特徴付ける飽和脂肪酸の合計パーセンテージを低下させることなく脂肪酸組成を変更できることを示している。
特に、コレステロールと飽和脂肪酸の含有量が最も高いMDA-MB-231細胞では、おそらく立体的な理由から、DHAの取り込みが最も少ないことが観察された。それにもかかわらず、DHAはコレステロールとスフィンゴミエリンの含有量を減らすことができた。
両方の細胞株について、DHA処理は脂質ラフトの約20-30%の減少をもたらした。
結論として、オメガ3多価不飽和脂肪酸は脂質ラフトの生化学的および生物物理学的特徴を変更することができ、おそらくアシル鎖の長さと不飽和結合に関連するさまざまなメカニズムを通じて乳がん細胞の増殖を抑制する。
EPAは主に脂質ラフトリン脂質のアラキドン酸濃度の低下を通じて細胞アポトーシスに寄与する可能性がある。一方DHAは、脂質ラフトの生物物理学的特性を変化させ、コレステロールの含有量とおそらく重要なタンパク質の分布を低下させる可能性がある。
n-3多価不飽和脂肪酸が細胞膜脂質マイクロドメイン組成を変更し、それによって表面受容体から下流のシグナル伝達ネットワークへの細胞外シグナルの中継を有利に調節することがますます明らかになりつつあります。以下のような報告もあります。
(n-3) PUFA alter raft lipid composition and decrease epidermal growth factor receptor levels in lipid rafts of human breast cancer cells.(n-3多価不飽和脂肪酸 はラフト脂質組成を変更し、ヒト乳がん細胞の脂質ラフトにおける上皮成長因子受容体レベルを低下させる) J Nutr. 2007 Mar;137(3):548-53.
【要旨】
n-3系多価不飽和脂肪酸のエイコサペンタエン酸 (EPA) およびドコサヘキサエン酸 (DHA) はMDA-MB-231 ヒト乳がん細胞の増殖を減少させ、アポトーシスを誘導する。そのメカニズムを明らかにするために、脂質ラフトの脂質組成、ならびに上皮成長因子受容体(EGFR)の脂質ラフトの局在化およびリン酸化に対するDHAとEPAの効果を検討した。
n-3系多価不飽和脂肪酸(EPA と DHA の組み合わせ) は、リノール酸の存在下と非存在下で、MDA-MB-231 細胞の増殖をそれぞれ 48 〜62% 阻害した (P < 0.05)。
リノール酸で処理した細胞と比較して、n-3系多価不飽和脂肪酸で処理した後にMDA-MB-231細胞から単離した脂質ラフトに、より多くのEPAおよびDHAが取り込まれた(P < 0.05)。 EPA および DHA 投与は、脂質ラフトのスフィンゴミエリン、コレステロール、およびジアシルグリセロールの含有量を減少させ (P < 0.05)、リノール酸の非存在下では、EPA および DHA は脂質ラフトのセラミド量を増加させた (P < 0.05)。
さらに、EPA+DHA処理細胞では、脂質ラフトの上皮成長因子受容体(EGFR)レベルが著しく低下し、EGFRとp38マイトジェン活性化プロテインキナーゼ(MAPK)の両方のリン酸化が増加した(P <0.05)。 EGFR および p38 MAPK の持続的な活性化は、ヒト乳癌細胞のアポトーシスと関連しているため、我々の結果は、n-3系多価不飽和脂肪酸が細胞膜の脂質ラフトの脂質組成を変更し、EGFR シグナル伝達を変更することによって乳がん細胞の増殖を抑制することを示している。
DHAやEPAを多く摂取すると、脂質ラフトのコレステロールの量を減らし、がん細胞の脂質ラフトとそこに分布する増殖関連タンパク質を減らして、がん細胞の増殖を抑制する可能性を示唆しています。
脂質ラフトはスフィンゴ脂質とコレステロールが豊富で、存在するリン脂質の側鎖は通常、膜の周囲の非ラフト領域と比較して飽和脂肪酸が非常に豊富です。飽和脂肪酸によるリン脂質の濃縮により、ラフト内の脂質の密集が可能になります。
コレステロールと飽和脂肪酸が存在する結果、脂質ラフトは周囲の膜よりも流動性が低くなります。Srcファミリーキナーゼ、Gタンパク質、成長因子受容体、マイトジェン活性化タンパク質キナーゼ(MAPK)など、シグナル伝達に関与する多くのタンパク質、3タンパク質キナーゼ C は主に脂質ラフトに見られ、さまざまなシグナル伝達成分をまとめて (つまり、共局在化)、それらの相互作用を促進することで、シグナル伝達のプラットフォームとして機能しています。
【抗ヒスタミン薬のシメチジンはAktリン酸化を抑制する】
消化性潰瘍の治療に使用される薬剤であるシメチジンは、Aktリン酸化の抑制により胆管がん細胞のアポトーシス死を誘発することが報告されています。以下のような報告があります。
Repurposing cimetidine for cholangiocarcinoma: Antitumor effects in vitro and in vivo(胆管がんのためのシメチジンの転用:in vitroおよびin vivoでの抗腫瘍効果)Oncol Lett. 2017 Mar; 13(3): 1432–1436.
【要旨】
シメチジンはヒスタミン2型(H2)受容体拮抗薬であり、さまざまな種類の悪性腫瘍に対して抗腫瘍効果があることが実証されている。しかし、化学療法抵抗性の胆管腫瘍である胆管がんに対する効果はまだ調査されていない。
本研究では、in vitroおよびin vivoでのシメチジンの抗腫瘍活性を評価した。
胆管がん細胞株を用いた培養細胞の実験で、シメチジンはプロテインキナーゼBシグナル伝達経路の抑制を介してカスパーゼ依存性アポトーシスを誘導する機序で胆管がん細胞の増殖を抑制した。
胆管がん細胞をマウスに移植した動物実験では、シメチジンは観察可能な悪影響なしに胆管細胞の増殖を阻害した。
これらの結果は、シメチジンが胆管がんの治療に効果的な抗腫瘍剤になる可能性があることを示唆している。
生体内アミンであるヒスタミンは、炎症反応や胃酸分泌、アレルギー反応など様々な生理反応に関与しています。ヒスタミンは細胞表面にある受容体に結合することによって細胞にヒスタミンの刺激を伝えます。
ヒスタミンの受容体は現在までに 3 種類のサブタイプ(H1~H3)が見つかっていますが、そのうち H2 受容体は胃酸分泌において中心的な役割を担っており、その拮抗薬であるシメチジンやラニチジンなどは胃酸の分泌を抑える効果により胃炎や消化性潰瘍や逆流性食堂炎などの治療薬として使用されています。
1980 年代後半に デンマークのTonnesen らにより、シメチジンが胃がん患者に対し延命効果を示すことが報告され、その後、大腸がん、悪性黒色腫に対しても同様の効果を示すことが報告されています。
例えば、治癒切除術後5-FU(200mg/日)投与を受けている原発性大腸がん患者(シメチジン800mg/日併用群34例、非併用群30例の計64例)において、平均10.7年の観察期間での10年生存率は、シメチジン併用群で84.6%、シメチジン非併用群で49.8%でした(P<00001)。
たった7日間のシメチジン投与(手術前5日間と手術後2日間)で、大腸がん患者の3年後の死亡率を41%から7%に低下させたという報告もあります。
腎がんにおいても、進行例に対してインターフェロンα+シメチジンを併用した場合、インターフェロン単独よりも抗腫瘍効果が高いことが報告されています。
切除手術を受けた大腸がん患者を対象にした臨床試験のメタ解析によると、シメチジンを服用することによって死亡リスクが0.53に低下すると報告されています。
ヒスタミンにはがん細胞の増殖を促進する作用や、細胞性免疫を抑制するリンパ球(骨髄由来抑制細胞や制御性T細胞)を活性化することなどが報告されており、そのためシメチジンの延命効果は、がん細胞に対するヒスタミンの細胞増殖促進作用を阻害する機序や、がん細胞に対する免疫力を活性化させ る可能性などが指摘されています。
さらに近年では、シメチジンが接着因子 E-セレクチンの発現を抑 制することによりがんの転移を抑制する抑える機序や、インターロイキン 12の発現上昇を介したナチュラルキラー細胞活性化、血管新生阻害作用によって腫瘍組織の増大を阻止する可能性、がん細胞にアポトーシス(細胞死)を誘導する作用など、新たなメカニズムも報告されています。
前述の論文では、胆管がん細胞に対してプロテインキナーゼBを阻害してアポトーシスを誘導するという機序を報告しています。プロテインキナーゼBはAktとも呼ばれます。
【イベルメクチン、アルテスネイト、イトラコナゾール、トコトリエノールはAktのリン酸化を阻害する】
イベルメクチンは、抗寄生虫薬として使用される大環状ラクトンであり、Ser473でのAktリン酸化を大幅に減少させることが示されています。
九州大生体防御医学研究所の研究グループはイベルメクチンが肝内胆管がんの抑制にも効果があることをマウス実験で確認したと発表しています。(プレスリリースはこちら)
Akt / mTORシグナル伝達の阻害作用は抗マラリア薬のアルテスネイト、抗真菌剤であるイトラコナゾール、ビタミンEのトコトリエノールでも報告されています。例えば、トコトリエノールに関して以下のような研究があります。
Tocotrienols target PI3K/Akt signaling in anti-breast cancer therapy.(トコトリエノールは、乳がん治療においてPI3K / Aktシグナル伝達を標的にする)Anticancer Agents Med Chem. 2013 Sep;13(7):1039-47.
PI3K / Aktシグナル伝達経路は、さまざまなタイプのがん細胞の増殖刺激依存性の成長と生存を仲介し、この経路の阻害は腫瘍細胞の成長停止とアポトーシスを引きおこします。
トコトリエノールは、正常細胞の細胞生存率にほとんどまたはまったく影響を及ぼさない治療用量で強力な抗癌活性を示す天然のビタミンEです。メカニズム研究により、トコトリエノールの抗がん効果がPI3K / Aktシグナル伝達の抑制と関連していることが複数の研究で報告されています。
以上のように、IP-6&Inositol、シンバスタチン、ドコサヘキサエン酸、シメチジン、イベルメクチンなどを併用すると、PI3K/AKTシグナル伝達系を効率的に阻害し、がん細胞の増殖を抑制できます。
| « 848)体に優し... | 850)) 体に優... » |



