がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
789)塩基性の抗がん剤はがん細胞内に入れない
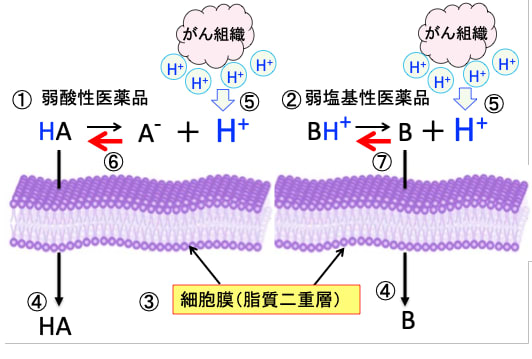
図:弱酸性医薬品(HA)は水素イオン(H+)を放出してイオン化した物質(A-)になる(①)。弱塩基性医薬品(B)は水素イオン(H+)を受け取ってイオン化した物質(BH+)になる(②)。細胞膜の脂質二重層(③)はイオン化していない物質(HAとB)しか通過できない(④)。がん細胞の外側は水素イオンが増えて酸性化している(⑤)。その結果、それぞれの反応式は左側に移行し、弱酸性医薬品は非イオン化型(HA)が増え(⑥)、弱塩基性医薬品はイオン化型(BH+)が増える(⑦)。イオン化していない物質しか脂質二重層を通過できないので、弱塩基性医薬品はイオン化型(BH+)が増えて、がん細胞の外側にトラップ(捕捉)される。抗がん剤の多くは弱塩基性であるため、酸性化したがん組織では、抗がん剤ががん細胞内に入り込めないので、抗腫瘍効果を発揮できない。
789)塩基性の抗がん剤はがん細胞内に入れない
【がん細胞の外側は酸性化している】
がん細胞では解糖系でのグルコース(ブドウ糖)代謝の亢進で、乳酸と水素イオン(H+)の産生が亢進しています。細胞内に乳酸と水素イオンが蓄積すると細胞毒になるので、がん細胞は乳酸と水素イオンをエネルギー(ATP)を使って積極的に細胞外に排出しています。従って、がん組織には乳酸と水素イオンが増え、その結果、がん細胞の周囲は酸性になっています。
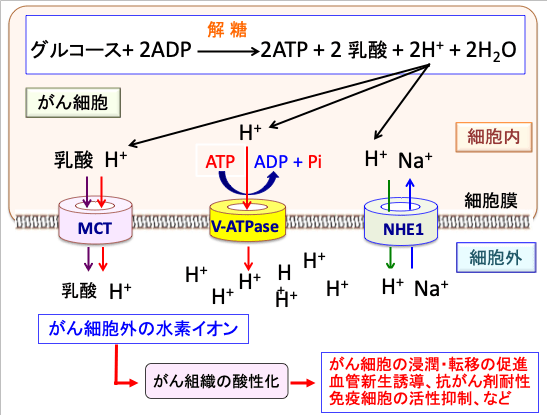
図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える。細胞内の酸性化は細胞にとって有害になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。その結果、がん細胞の周囲はpHが低下してがん組織は酸性化している。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される。
正常な細胞はpHが7.4というややアルカリ側でないと働くことができません。実際に、がん組織ではがん細胞外のpHが6.2〜6.9と酸性になっています。このような酸性の状態では、リンパ球は正常な働きができないため、がん細胞を攻撃することができません。
さらに、アルカリ性の抗がん剤はがん細胞内に入り込むことができなくなります。抗がん剤の多くはアルカリ性の性状を持つものが多いので、抗がん剤治療が効きにくい原因にもなっています。

図:正常細胞では細胞内pH(pHi)は6.99〜7.05とほぼ中性で、細胞外pH(pHe)は7.3〜7.4とアルカリ性になっていて、pHeがpHiより高い。一方、がん細胞では細胞内pHは7.12〜7.7とアルカリ性になって、細胞外pHは6.2〜6.9と酸性になって、pHiがpHeより高い。細胞外が酸性化しているとリンパ球などの免疫細胞の働きが低下し、塩基性の抗がん剤はがん細胞内に入り込めない。
細胞内と細胞外のpH勾配は正常細胞とがん細胞では逆になっています。
上の図に示すように、正常細胞では細胞内より細胞外の方がアルカリになっています。
一方、がん細胞では細胞内より細胞外の方が酸性になっています。
このpH勾配の逆転によって、塩基性(アルカリ性)の抗がん剤はがん細胞内に入り込むことができなくなります。がん細胞より正常細胞の方が抗がん剤を多く取り込む結果になります。
「塩基性の抗がん剤はがん細胞内に入り込むことができなくなる」というのは薬理学におけるイオン・トラッピング(ion trapping)という現象により起こります。
電離(イオン化)した分子は細胞膜の脂質二重層を通過できません。ある物質を水に溶かすと、一部が電離(イオン化)します。イオン化した分子と非イオン化分子の比率は、その分子の解離定数(pKa)と溶液のpHによって決まります。その結果、細胞膜(脂質二重層)で仕切られた細胞の内外では、アルカリ性物質は酸性側にトラップされるという現象が起こります。
トラップ(trap)というのは、この場合は「捕捉する」や「閉じ込める」という意味です。つまり、がん細胞の外側が細胞内より酸性化していると、塩基性抗がん剤は細胞外に留まって、細胞内に入れないのです。
このイオン・トラッピングのメカニズムを理解するには水素イオン指数(pH)、解離定数(pKa)、ヘンダーソン・ハッセルバルヒ(Henderson–Hasselbalch)の式について理解する必要があります。がん組織をアルカリ化すると抗がん剤治療が効きやすくなるメカニズムですので、詳しく説明したいと思います。
【水素イオン指数(pH)は溶液中の水素イオン(H+)の逆数の対数で示す】
「酸」というのは水素イオン(H+)を放出する物質で、「塩基」というのは水素イオン(H+)を受け取る物質です(下図)。
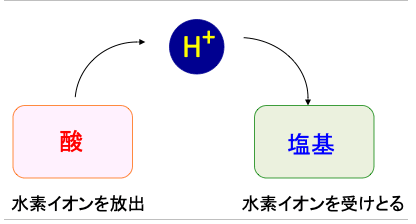
図:酸は水素イオンを放出し、塩基は水素イオンを受け取る
水素イオン指数(pH)というのは、ある分子を水に溶かしたときに、その溶液が酸性かアルカリ性か中性かを示す指標です。溶液の酸性度はプロトン(水素イオン)の濃度によって決まります。
水素イオン濃度(mol/L)は[H+]で示します。pHは[H+]を簡単に表現するための指標です。 pHは次式のように表されます。
pH= −log10[H+]
つまり、水素イオン濃度[H+]が0.001 mol/Lであれば pH=−log1010-3 = 3で、pHが3となります。
水素イオン濃度[H+]が0.01 mol/LであればpHは2です。
水素イオン濃度が高いほどpHは小さい値になります。
pHが1だけ変化したとき,水素イオン濃度(プロトン濃度)は10倍変化します。pHが2の水溶液はpHが3の水溶液の10倍の水素イオン濃度です。
酸や塩基の中には水に溶かしたときすべて解離するもの(強酸および強塩基)と一部しか解離しないもの(弱酸および弱塩基)があります。 多くの薬剤は弱酸性か弱塩基性の性質を示します。
前述のように、酸は水に溶かした時に溶液中に水素イオン(H+)を放出する物質で、塩基は水素イオンを受け取って中和する物質です。
例えば、図に示すアセチルサリチル酸(アスピリン)はカルボン酸(COOH)を持ち、水溶液中では電離して水素イオンを放出し、弱酸性を示します。一方、アンフェタミンは物質中のアミン(NH2)が水素イオンを受けとって溶液中から水素イオンを減らし、弱塩基性(弱アルカリ性)を示します。

図:アセチルサリチル酸(アスピリン)はカルボキシル(COOH)を持ち、水溶液中では電離(イオン化)して水素イオン(H+)を放出するので溶液は酸性になる。アンフェタミンはアミン(NH2)を持ち、溶液中の水素イオンと結合して水素イオンを減らすので、溶液はアルカリ性になる。
【解離定数(pKa)と同じpHで解離状態と非解離状態が1:1になる】
さて,酸の中には水に溶かしたときすべて解離するもの(強酸)と一部しか解離しないもの(弱酸)があります。 酸が解離するとプロトン(水素イオン)を放出して溶液を酸性化しますが,弱酸の場合次式のような解離平衡式に従って解離状態(A-),非解離状態(AH)が共存します。

両辺の濃度の比は酸解離定数(Ka)と呼ばれます。 Kaの定義式は次式の通りです。
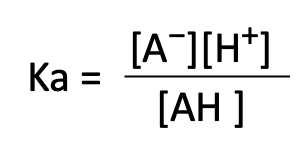
式中[ ]は各成分の濃度(mol/L)を表します。
この式から,その酸のプロトンの放出し易さ(すなわち酸としての強さ)はKaによって表され,また弱酸の解離状態は溶液中の[H+]によって変化することがわかります。
そこで,弱酸の強さを表現するためにpKaという指標を導入します。 pKaの定義式は次式のようになります。pは -log10 を意味します。

例えば酢酸(CH3COOH)のKa は0.0000158(=10-4.8)となりますが,これをpKaで表すと,4.8と簡単に表現できます。 またpKaが小さい程,強い酸であるということになります。 例えば,乳酸のpKaは約3.8ですから,乳酸の方が酢酸より強い酸だということになります。溶液のpHと酸のpKaとの関係は次式のよう変形できます。

つまり、pHは以下の式になります。

これがヘンダーソン・ハッセルバルヒ(Henderson–Hasselbalch)の式です。
[A-]=[AH]のとき、[A-]/[AH]=1となり、Log101=0ですので、pH=pKaとなります。
つまり、pHがpKaと等しいとき,その酸はちょうど半分だけ解離している([A-]/[AH]=1)ことを示します。
例えば酢酸の場合,溶液のpHが4.8付近で解離していない酢酸(CH3COOH)と解離している酢酸イオン(CH3COO-)の比が1:1、つまり50%と50%になります。
そして、 pHが3.8のときには90%以上が酢酸(CH3COOH)の状態だったのが,pH5.8のときには酢酸イオン(CH3COO-)の状態で90%以上存在していることになります。
これは、式を以下のように変化させると理解できます。

pKaが4.8の酢酸はpHが3.8ではpH-pKa= -1なので、[CH3COO-]/[CH3COOH]が10-1で、0.1になります。[CH3COO-]が10%で[CH3COOH]が90%になるということです。溶液のpHと酢酸の解離状態の関係は以下の図のようになります。すなわち、弱酸性の酢酸は溶液のpHが低いほど、非イオン型(CH3COOH)が増え、pHが高いほどイオン化した分子(CH3COOH-)が増えます。
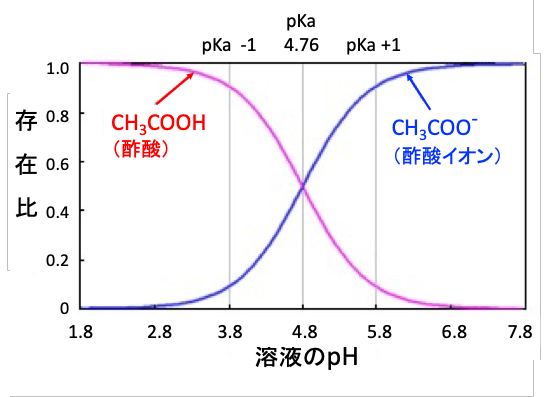
図.溶液のpHと酢酸の解離状態の関係。弱酸性の酢酸はpHがpKaより低いとき(pH<pKa)、非イオン型(CH3COOH)が多くなり、pHがpKaより大きいとき、イオン型(CH3COO-)が多くなる
【弱塩基性の物質は酸性でイオン型が増える】
塩基の定義は水素イオンを受け取る物質です。弱塩基性の物質の場合は以下のようになります。酸性の場合と逆です。

pHがpKaより小さい(pH<pKa)場合は[B]<[BH+]になります。
pHがpKaより大きい(pH>pKa)場合は[B]>[BH+]になります。
つまり、弱塩基性(pKaがアルカリ側)の薬物はpHが酸性ほどイオン化している分子(BH+)が増えます。
上記の説明は一見複雑そうですが、「酸は水素イオンを放出し、塩基は水素イオンを受け取る」と「溶液が酸性ほど水素イオンが多い」という点だけ知っていれば、この関係は理解できると思います。
つまり、下の図の弱酸性のAH ⇄ A- + H+と 弱塩基性の BH+ ⇄ B +H+の2つの平衡状態において、水素イオンが多いほど、この反応は左に移行します。
つまり、弱酸性の物質は酸性になるほど非イオン化(AH)が増え、弱塩基性の物質は酸性になるほどイオン化型(BH+)が増えることになります。
したがって、弱酸性の物質はpHが低くなるほど非イオン型が増え、逆に、弱塩基性の物質はpHが低くなるほど、イオン型(BH+)が増えます。

図:AHとA-の相対量、BH+とBの相対量はpHとpKaの値から計算できる。弱酸性の医薬品の場合は、pHが高くなるほどイオン化した分子が増え、弱塩基性の医薬品の場合は、pHが低くなるほどイオン化した分子が増える。
【イオン化した物質は細胞膜の脂質二重層を通過できない】
細胞は脂質二重層から構成される細胞膜で外界から仕切られています。帯電していない(電荷を持っていない)小さな分子は細胞膜のリン脂質部分を容易に通過できます。しかし、帯電した(イオン化した)分子は細胞膜にリン脂質二重膜を通過できません(図)。帯電した分子はチャネルやトランスポーターなど物質を通過する目的の構造を通る必要があります。
前述のように、溶液のpHが低下する(水素イオンが増える)と、弱酸性の物質は非イオン型が増えるので、細胞膜を通過する物質が増えます。一方、弱塩基性の物質は水素イオンが増えると水素イオンを受け取ってイオン型(BH+)が増えます。つまり、細胞膜を通過できる物質が減ります。

図:イオン化していない物質(HA、B)は細胞膜の脂質二重層を通過できるが、イオン化した物質(A-、BH+)は細胞膜を通過できない。酸性の溶液では水素イオン(H+)の量が多いので、それぞれの反応式で左側に反応が進む。その結果、弱酸性医薬品では非イオン化型(HA)が増え、弱塩基性医薬品はイオン化型(BH+)が増える。したがって、溶液が酸性化すると、弱酸性医薬品は細胞膜を通過できる分子(HA)が増え、弱塩基性医薬品は細胞膜を通過できないイオン化した分子(BH+)が増える。
【弱塩基性抗がん剤は酸性化したがん細胞外にトラップされる】
解糖系の亢進とがん組織内の循環不全によってがん組織は酸性化しています。がん細胞の細胞外pH(pHe)は6.5から6.9の範囲ですが、細胞内pH(pHi)は中性からアルカリ性のままであり、細胞内外のpH勾配は正常細胞とは逆になっています。
固形腫瘍の酸性細胞外空間は、弱塩基の細胞取り込みに対する生理学的障壁を作り出します。これをイオントラッピング(ion trapping)現象と言います。イオントラップは、薬物のイオン化したもの(非透過性)とイオン化していないもの(透過性)の間に大きな透過性の違いがある場合に発生します。(図)

図:塩基(B)は水素イオン(H+)を受けとってBH+となってイオン化する(①)。イオン化していない分子(②)は細胞膜の脂質二重層を通れるが、イオン化した分子は細胞膜を通過できない。弱塩基性抗がん剤は細胞内(③)および細胞外(④)で水素イオンと反応してイオン化される。がん細胞では細胞内より細胞外の方が酸性化している(水素イオンが多い)ので(⑤)、細胞外の分子の方が多くイオン化され、弱塩基性抗がん剤は酸性化した細胞外にトラップされる(⑥)。
ビンクリスチン、ミトキサントロン、ドキソルビシン、ビンブラスチンなど多くの抗がん剤は解離定数が7.5〜9.5の弱塩基性です。例えば、ドキソルビシンは、8.3の塩基性解離定数(pKa)を持つイオン化可能な一級アミンからなるアントラサイクリンです。 pKaが8.3の場合、細胞膜を通過できる非イオン化型の割合は、pH 7.3では約10%、pHが6.3では約1%になります。非イオン化形態の薬物は膜の両側に等分布するため、細胞外環境のより低いpHでより多くの薬物が隔離され、治療効果が低下します。
このように塩基性抗がん剤は、酸性条件下でイオントラッピングを受け、がん細胞内への取込みが大幅に減少することが、培養細胞や動物実験で証明されています。
したがって、弱塩基性の抗がん剤を使用するときは、がん組織の酸性化を改善する重曹(重炭酸ナトリウム)やプロトンポンプ阻害剤を使ったアルカリ療法を併用すると、抗がん剤の治療効果を高めることができます。
著書紹介:

詳しくはこちらへ:
著書紹介

(くわしくはこちらへ)
| « 788)重曹とア... | 790)飢餓が生... » |



