がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
790)飢餓が生物を進化させた(その1):AMP活性化プロテインキナーゼ(AMPK)とmTORC1
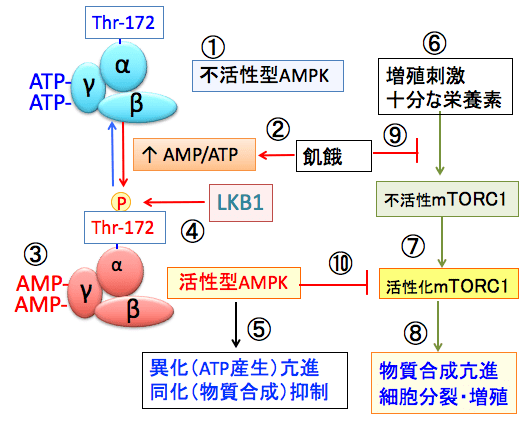
図:AMPK(AMP活性化プロテインキナーゼ)はα、β、γの3つサブユニットから構成されている(①)。飢餓などでATPが減少しAMP/ATP比が上昇すると(②)、γサブユニットに結合していたATPがAMPに置換する(③)。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる(④)。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトする(⑤)。mTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)は、十分な栄養素が存在する条件で、インスリン、インスリン様成長因子などによる増殖刺激(⑥)によって活性化される(⑦)。活性化されたmTORC1はシグナル伝達の下流に存在する様々なキナーゼ(タンパク質リン酸化酵素)などを介して、タンパク質合成や細胞分裂を促進する(⑧)。飢餓は栄養素の不足を引き起こしてmTORC1の活性化を阻止し(⑨)、活性化AMPKはmTORC1活性を阻害する(⑩)。飢餓状態ではAMPKの活性化とmTORC1の活性阻害によって、細胞増殖が抑制される。
790)飢餓が生物を進化させた(その1):AMP活性化プロテインキナーゼ(AMPK)とmTORC1
【約38億年前に地球上に生物が誕生した】
生物とは生命活動を行うことができる生き物です。「外界と膜で仕切られた細胞からできている」、「DNAを持って自分の複製を作ることができる」、「外界から栄養分を取り入れてエネルギーを産生し、物質を分解したり合成する代謝を行う」といった特徴を持っています。「生物」の反対語は「無生物」です。
地球が誕生したのは約46億年前で、その地球に最初の生命(=生物)が出現するのは8億年後の今から約38億年前です。最初の生物は、はっきりした核を持たない(核膜をもった核が無い)原核生物です。これらの生物は、海の中を漂う有機物を利用し、酸素を使わずに生息していました。
約25億年前に光合成を行う藍藻(シアノバクテリア)が登場します。それまで地球上には酸素は存在しませんでしたが、そこに太陽光エネルギーで無機物である二酸化炭素と水からグルコース(ブドウ糖)などの有機物を作り出し、酸素を放出するという光合成を行う真正細菌のシアノバクテリアが出現しました。それまで無酸素状態だった地球大気に大量の酸素分子が放出され、嫌気性生物の多くが絶滅し、酸素を利用した呼吸をする微生物(α-プロテオバクテリア)も誕生しました。
真核細胞の葉緑体やミトコンドリアは、ある種の細菌が原始真核細胞に取り込まれて共生するようになって形成されたものです。光合成を行うシアノバクテリアが原始真核生物と共生して葉緑体となりました。葉緑体は植物に存在する細胞内小器官です。光合成が主要な機能ですが、その他に窒素代謝、アミノ酸合成、脂質合成、色素合成など、植物細胞における代謝の中心となっています。
酸素を用いて呼吸を行うα-プロテオバクテリアが原始真核生物に共生してミトコンドリアになりました。ミトコンドリアは酸素を使って細胞に必要なエネルギーを産生する働きを担っています。
原始真核生物はシアノバクテリアやα-プロテオバクテリアを餌として捕食していたのですが、そのうちに寄生して細胞内小器官へと進化し、共生するようになったのです。

図:約46億年前に地球が誕生し、約38億年前に生命(=生物)が出現した(①)。約25億年前に光合成を行う藍藻(シアノバクテリア)が登場し、地球大気に大量の酸素分子が放出され(②)、酸素を利用した呼吸をする微生物(α-プロテオバクテリア)が誕生した(③)。α-プロテオバクテリアが原始真核生物に細胞内共生して(④)ミトコンドリアになった(⑤)。光合成を行うシアノバクテリアが原始真核生物に共生して(⑥)、葉緑体となった(⑦)。
ミトコンドリアや葉緑体が動物や植物の細胞に細胞内小器官として形成された後、地球上では生物が誕生と絶滅を繰り返しながら進化していきます。
約5億4000万年前には生物が爆発的に多様化し、現生生物の直接的な祖先が誕生しました(カンブリア爆発)。
約2億5千百万年前には、地球規模の激烈な環境変動により生物が大量絶滅しました(ペルム紀・三畳紀絶滅)。
約6600万年前に起きた小惑星衝突を引き金とする環境の変化によって恐竜などが大量絶滅しました(白亜紀・第三紀絶滅)。
その後、哺乳類が進化し繁栄しました。
【生物の進化の初期に飢餓に対する適応能力を獲得した】
全ての生物において、最も優先されるのは種の保存と繁栄です。種の繁栄に有利な性質が進化の過程で淘汰を生き残ることになります。食糧が乏しくなるとすぐ死ぬような生き物は進化の過程で簡単に淘汰されます。栄養やエネルギーの不足に対して抵抗性を持つようなメカニズムを獲得したものが生き残ります。
栄養やエネルギーの不足に対して抵抗性を持つメカニズムとして、AMP活性化プロテインキナーゼ(AMPK)、サーチュイン、オートファジー、転写因子のFOXOファミリー、PGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)などがあります。
これらのメカニズムは酵母や線虫など、かなり下等な生物から存在し、人間を含めて全ての高等生物に基本的メカニズムは維持され、存在しています。つまり、飢餓に対する抵抗性や適応力は生物進化のかなり初期に獲得したと考えられます。
飢餓を生き延びれないと種を維持できないので、酵母や線虫のレベルでこのメカニズムが存在することは当然と言えます。
栄養やエネルギーの不足に対して抵抗性を持つようになるメカニズムは、老化を抑制し、寿命を延ばす効果と密接に関連しています。
食糧が乏しい時には、栄養飢餓に対する抵抗性を高め、代謝を抑制して寿命を延ばし、食糧が十分に入手できるようになったときに生殖活動が行えるように、食糧が乏しい条件(カロリーや栄養素の摂取が不足するとき)では寿命を延ばすメカニズムやストレスに対する抵抗性を高めるメカニズムが進化したと言えます。
食糧が少なくなったとき単に寿命を延ばすだけでなく、食糧が得られるとき生殖活動を再開することが目的であるため、若々しく保つ(老化を抑制する)ことも重要です。すなわち、断食やカロリー制限は寿命を延ばすだけでなく、体を若々しくする効果もあることになります。
実際、カロリー制限食では酸化ストレスや栄養飢餓など様々なストレスに対する抵抗性が増し、体を若い状態に維持し、寿命を延長することが知られています。
【AMP活性化プロテインキナーゼは細胞内のエネルギー状態を知るメカニズム】
飢餓に対応するためには、細胞内のエネルギーや栄養素の量を検知するメカニズムが必要です。このメカニズムは単細胞生物のレベルから必要です。
たとえば、食糧が不足しており、物質合成やエネルギー産生の材料が十分でない状況で細胞増殖のスイッチを入れると、細胞分裂の途中で材料がなくなって、細胞分裂を完結できなくなります。
建築材料を確保できる目処がないのに建物の建築を開始し、材料不足のために途中で工事を中止せざるを得ない状況に陥るのと同じです。
つまり、細胞レベルで、細胞分裂を完結できるレベルのエネルギーと材料があるかを検知する仕組みが必要です。
エネルギーの不足を検知して、細胞増殖を停止するメカニズムの代表がAMP活性化プロテインキナーゼ(AMPK)です。
細胞増殖に必要な材料が十分に存在していることを検知して細胞増殖のスイッチを入れるのがmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)です。
AMPKとmTORC1のシグナル伝達系はクロストーク(シグナル伝達系が相互に影響しあうこと)して、細胞増殖を制御しています。
AMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)は人から酵母まで真核細胞に高度に保存されているセリン・スレオニンキナーゼ(セリン・スレオニンリン酸化酵素)の一種で、代謝物感知タンパク質キナーゼファミリー(metabolite-sensing protein kinase family)のメンバーとして細胞内のエネルギーのセンサーとして重要な役割を担っています。
全ての真核生物は、細胞が活動するエネルギーとしてアデノシン三リン酸(Adenosine Triphosphate :ATP)というヌクレオチドを利用しています。ATPは「生体のエネルギー通貨」と言われ、エネルギーを要する生物体の反応過程には必ず使用されています。ATPがエネルギーとして使用されるとADP(Adenosine Diphosphate:アデノシン-2-リン酸)とAMP(Adenosine Monophosphate:アデノシン-1-リン酸)が増えます。
すなわち、ATP → ADP + リン酸 → AMP+2リン酸というふうに分解され、リン酸を放出する過程でエネルギーが産生されます。
AMPKはこのAMPで活性化されるタンパクリン酸化酵素で、低グルコース、低酸素、虚血、熱ショックのような細胞内 ATP 供給が枯渇する状況において、AMPの増加に反応して活性化されます。
AMPKは細胞内エネルギー(ATP)減少を感知して活性化し、異化の亢進(ATP産生の促進)と同化の抑制(ATP消費の抑制)を誘導し、ATPのレベルを回復させる効果があります。
すなわち、AMPKが活性化すると、糖や脂肪や蛋白質の合成は抑制され、一方、糖や脂肪や蛋白質の分解(異化)が亢進してATPが産生されます。したがって、この効果は運動と同じ効果になり、肥満や2型糖尿病の治療にも有効です。
AMPK は、α,β,γの3つのサブユニットからなるヘテロ三量体として存在し、AMP がγサブユニットに結合することでその複合体が活性化されます。AMP/ATP比の増加、細胞内pHおよび還元状態の変化、およびクレアチン/ホスホクレアチン比の増加がAMPKを活性化することが知られています。
また、レプチンやアディポネクチンなどの肥満関連サイトカインにより活性化されることや、中枢神経系での摂食行動の制御への関与が明らかとなり、個体全体の代謝制御においても重要な役割を担うと考えられています。さらに近年、AMPKががんの発生や増殖を抑制する効果や、がん治療の効果を高める効果が報告されています。

図:AMPK(AMP活性化プロテインキナーゼ)はα、β、γの3つサブユニットからなり(①)、細胞内のATPが減少するとγサブユニットに結合していたATPがAMPに置換する(②)。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる(③)。カルモジュリンキナーゼキナーゼβ (CaMKKβ)もスレオニン172をリン酸化してAMPK活性を亢進する(④)。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトする(⑤)。
【ラパマイシンは哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)を阻害する】
ラパマイシン(Rapamycin)は1970年代にイースター島(モアイ像で有名な南太平洋の島)の土壌から発見されたStreptomyces hygroscopicsという放線菌の一種が産生する有機化合物です。シロリムス(Sirolimus)という別名で呼ばれることもあります。
ラパマイシンは免疫抑制作用があり、米国では臓器移植の際の拒絶反応を防ぐために使用されています。さらに、平滑筋細胞増殖抑制作用や抗がん作用や寿命延長効果が知られています。
平滑筋細胞増殖抑制作用に関しては、狭心症や心筋梗塞の治療に使われる血管内ステントに冠動脈再狭窄予防効果を目的としてラパマイシンを配合したステントが製品化され、心臓カテーテル治療において使用されています。また、リンパ脈管筋腫症の治療薬としても使用されています。
ラパマイシンの生体内のターゲット分子が、哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin)、略してmTOR(エムトール)というタンパク質です。 mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼ(タンパク質のセリンやスレオニンをリン酸化する酵素)で、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。
酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログ(相同体)が見出されてmTOR(哺乳類ラパマイシン標的タンパク質)と命名されました。
mTORにはmTOR複合体1(mTORC1)とmTOR複合体2(mTORC2)の2種類があります。mTORに幾つかの他のタンパク質が結合して複合体を形成しますが、結合しているタンパク質の違いで2種類の複合体ができ、異なる機能を担っています。
mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御をしています。インスリンやインスリン様成長因子(IGF-1)によって活性化されるのはmTORC1の方です。ラパマイシンで阻害されるのもmTORC1の方です。
ラパマイシンは単独でTOR 活性を阻害するのではなく、細胞内でFKBP12(12kDa FK506 binding protein)と結合し,このFKBP12-ラパマイシン複合体がTOR に結合してTOR 活性を阻害します。

図:哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)は複数のタンパク質から構成されるセリン・スレオニン・リン酸化酵素で、インスリンやインスリン様成長因子-1(IGF-1)や上皮成長因子(EGF)や血小板由来増殖因子(PDGF)などの増殖因子によって活性化される。mTORC1はタンパク質翻訳の開始因子であるelF4Eを抑制する4E結合タンパク質(4E-BP1)をリン酸化してその機能を抑制する。また、リボソームの生合成を促進するS6K1をリン酸化して活性化する。これらの作用によってmTORC1はタンパク質合成を促進する。その他、多くの標的タンパク質をリン酸化することによって脂質や核酸の合成を亢進し、細胞内小器官の消化・再利用に重要なオートファジーを抑制する。ラパマイシンはFKBP12と結合し、mTORとraptorの相互作用を阻害することによってmTORC1の活性を阻害する
【mTORC1とAMPKは栄養と増殖シグナルとエネルギー量を感知して増殖を制御する】
細胞の増殖というのは、栄養とエネルギーが利用できる状態にあるときに、新たな細胞構成成分(タンパク質、核酸、脂質など)を合成して、細胞の数を増やす生化学的プロセスのことです。
したがって、増殖するためには、細胞を新たに作る材料(栄養素)とエネルギー(糖質や脂質を酸化して得られるATP)が必要です。増殖因子や成長因子やホルモンなどによって細胞増殖の指令(シグナル)が来たときに、栄養素とエネルギーの供給が十分にある条件で、タンパク質や脂質の合成を促進して細胞増殖を実行するのが哺乳類ラパマイシン標的タンパク質(mTORC1)です。
インスリン、インスリン様成長因子-1(IGF-1)、成長ホルモンなどの増殖刺激が細胞に作用すると、それらの受容体を介してPI3キナーゼ(PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。
活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(あるいは死)の調節を行います。このAktのターゲットの一つがmTORC1です。
Aktは結節性硬化症(Tuberous Sclerosis:TSC)の原因遺伝子産物であるTSC1/TSC2複合体のTSC2をリン酸化して活性を低下させ、低分子 GTPaseの一種である Rheb (Ras Homolog enriched in Brain)の活性を高めます。活性化したRhebは mTOR のキナーゼ触媒ドメインに直接結合してmTORC1のキナーゼ活性を高めます。
アミノ酸は別の経路でmTORC1の活性を高めます。mTORC1の活性化においてアミノ酸(哺乳類では特にロイシン)が必須であり、これはアミノ酸が十分である場合に限り細胞がタンパク合成を開始できる仕組みと言えます。
このようにして、栄養源と増殖シグナルを感知して細胞の成長や分裂を促進するのがmTORC1です。
一方、細胞内のエネルギー低下を感知するのがAMP依存性プロテインキナーゼ (AMPK)です。グルコース欠乏や低酸素などにより細胞内ATP 量が減少すると、AMP/ATP 比の増加に伴いAMPKが活性化されます。AMPKはmTORC1活性を抑制して、異化作用の亢進や細胞成長の停止をもたらし、エネルギー消費の抑制(同化抑制)とエネルギー産生の亢進(異化促進)へと細胞の代謝をシフトさせます。
AMPKはTSC2のリン酸化(活性化)によるmTORC1の間接的な抑制と、mTORC1構成ユニットのRaptorのリン酸化による直接的な阻害のメカニズムでmTORC1活性を低下させ、細胞の増殖を抑制します。
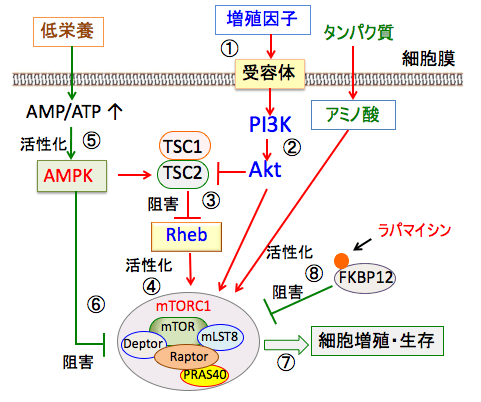
図:インスリンやインスリン様成長因子-1や成長ホルモンなどの増殖刺激が受容体を介して細胞に作用すると(①)、それらの受容体を介してPI3キナーゼ(PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化する(②)。活性化したAktはTSC1/TSC2を阻害してRheb(Ras homolog enriched in brain)を活性し(③)、mTORC1を活性化する(④)。低栄養の場合は、ATPの産生が低下してAMP/ATP比が上昇し、AMP依存性プロテインキナーゼ(AMPK)が活性化される(⑤)。AMPKは、TSC1/TSC2の活性化やmTORC1の直接的な作用によってmTORC1活性を抑制する(⑥)。このようにmTORC1とAMPKは栄養状態と増殖シグナルを感知して細胞の増殖や生存を制御している(⑦)。ラパマイシンはFKBP12と結合し、mTORC1の活性を阻害する(⑧)。
以上のように、細胞の増殖はAMP活性化プロテインキナーゼ(AMPK)によって抑制され、哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)によって促進されます。したがって、がん治療においてはAMPKの活性化とmTOTC1の抑制がターゲットになります。
AMPKの活性化とmTOTC1の抑制は老化を抑制し、寿命を延ばす作用があります。
つまり、AMPKの活性化とmTOTC1の抑制を目標にすると「寿命を延ばすがん治療」を達成できます。
| « 789)塩基性の... | 791)飢餓が生... » |



