がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
590)がんの「クエン酸療法」:クエン酸は多彩なメカニズムでがん細胞の増殖を抑える
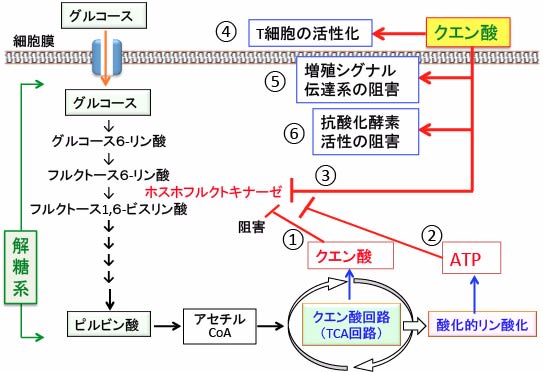
図:解糖系の律速酵素の一つであるホスホフルクトキナーゼ(フルクトース6-リン酸をフルクトース1,6-ビスリン酸に変換する)はグルコース代謝の生成物質であるクエン酸(①)とATP(②)によってフィードバック阻害を受ける。外来性に摂取したクエン酸もホスホフルクトキナーゼを阻害して解糖系を阻害する(③)。さらに、クエン酸はリンパ球のT細胞の活性化(④)、細胞内の増殖シグナル伝達系の阻害(⑤)、スーパーオキシド・ディスムターゼやグルタチオン・ペルオキシダーゼなどの抗酸化酵素の活性に必要な金属(銅、亜鉛、セレニウム)と結合(キレート)して除去するメカニズムで抗酸化酵素の活性を阻害する作用(⑥)なども報告されている。つまり、食事やサプリメントでクエン酸を摂取すると、多彩なメカニズムでがん細胞の増殖を抑える効果が得られる。
590)がんの「クエン酸療法」:クエン酸は多彩なメカニズムでがん細胞の増殖を抑える
【クエン酸はTCA回路で作られる】
クエン酸は柑橘類に多く含まれる有機酸で、体内ではミトコンドリアのTCA回路(クエン酸回路ともいう)でできる物質です。
TCA回路はトリカルボン酸回路(tricarboxylic acid cycle)の略語です。トリカルボン酸とは3つのカルボキシル酸基(COOH)を持つクエン酸のことで、そのため「クエン酸回路」とも言います。TCA回路の1番目の生成物がクエン酸だからです(下図)。

図:TCA回路の最初のステップは、アセチルCoAとオキサロ酢酸からクエン酸が生成される。TCA(Tricarboxylic acid)というのは3つのカルボキシル酸基(COOH)を持つクエン酸のことで、TCA回路はクエン酸回路とも言う。
この回路の発見者のハンス・クレブス(Hans Krebs)の名前をとってクレブス回路とも呼ばれます。クレブス博士はTCA回路の解明で1953年にノーベル賞を受賞しています。

図:グルコースが解糖系で分解されてできたピルビン酸はミトコンドリア内に取り込まれて補酵素A(CoA)と結合してアセチルCoAとなり、TCA回路(クエン酸回路)に入る。2炭素のアセチル基を完全に酸化して2分子の二酸化炭素にする過程で放出される自由エネルギーは電子伝達体のNAD+(ニコチンアミドアデニンジヌクレオチド)とFAD(フラビンアデニンジヌクレオチド)に捕捉され、NADHやFADH2として保存される。これらの高エネルギー電子はミトコンドリア内膜の電子伝達系(呼吸酵素複合体I〜V)でATP産生に使われる。このように、グルコース(ブドウ糖)は細胞質内での解糖と、ミトコンドリアでのTCA回路と電子伝達系(呼吸鎖)によってATPが産生される。
【クエン酸は様々なメカニズムでがん細胞の増殖を抑制する】
メキシコの小児科医のハラベ医師(Dr. Alberto Halabe Bucay)がクエン酸の大量投与によるがん治療による著効例を論文で多数報告しています。80人以上の末期がんの患者さんをクエン酸の経口摂取で治療して、多くに効果を認めたと言っています。
そのプロトコールは、1日3回、毎食後に10~15gのクエン酸を摂取するという方法です。
クエン酸が胃に刺激になるときは、胃酸の分泌を抑えるオメプラゾール、胃痛や胃部不快感があるときはさらにスクラルファート(アルサルミン)を服用すると良いと言っています。
オメプラゾールはがん細胞のプロトンポンプを阻害して、がん組織の酸性化を軽減する効果もあるので、積極的に服用しても良いかもしれません(527話参照)。
他にも、クエン酸による解糖系阻害によるがん治療の可能性を解説した論文はいくつかあります。
以下のような論文があります。
Effect of citrate on malignant pleural mesothelioma cells: a synergistic effect with cisplatin.(悪性胸膜中皮腫に対するクエン酸の効果:シスプラチンとの相乗効果)Anticancer Res. 29(4):1249-54.2009年
抗がん剤抵抗性のヒト中皮腫細胞株を使った培養細胞レベルでの実験で、クエン酸を添加するとアポトーシスが誘導されること、抗がん剤のシスプラチンの効果を高めることが報告されています。そのメカニズムとして解糖系のフルクトキナーゼの活性を阻害することによってATPの産生が減少することを挙げています。
Citrate induces apoptotic cell death: a promising way to treat gastric carcinoma?(クエン酸はアポトーシスによる細胞死を誘導する:胃がん治療への可能性?)Anticancer Res. 31(3):797-805.2011年
前の論文と同じ研究グループからの報告です。2種類の胃がん細胞株を用いた実験で、クエン酸が胃がん細胞にアポトーシスを誘導することを報告しています。
Understanding the central role of citrate in the metabolism of cancer cells.(がん細胞の代謝におけるクエン酸の中心的役割の理解) Biochim Biophys Acta. 1825(1):111-6. 2012年
同じ研究グループからの総説です。クエン酸を多く摂取するとがん治療に役立つことを解説しています。
Dichloroacetate restores drug sensitivity in paclitaxel-resistant cells by inducing citric acid accumulation.(ジクロロ酢酸はクエン酸の蓄積を誘導することによってパクリタキセル抵抗性のがん細胞の薬剤感受性を回復する) Mol Cancer. 2015; 14: 63.
この論文では、抗がん剤のパクリタキセルに抵抗性のがん細胞はミトコンドリアでの酸素呼吸に欠陥があり、ピルビン酸脱水素酵素を活性化してミトコンドリアの酸素呼吸を亢進するジクロロ酢酸を投与するとパクリタキセル抵抗性が抑制されることを示しています。そして、そのメカニズムとして、クエン酸の蓄積が重要であることを示しています。
ジクロロ酢酸はピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAの変換を亢進してTCA回路を促進し、クエン酸の産生を増やします。このクエン酸が蓄積するとパクリテキセルに抵抗性のがん細胞が、パクリタキセルに感受性を回復するという結果です。
最近の論文では次のような論文があります。米国のハーバード大学からの論文です。
Citrate Suppresses Tumor Growth in Multiple Models through Inhibition of Glycolysis, the Tricarboxylic Acid Cycle and the IGF-1R Pathway (クエン酸は解糖系やTCA回路やIGF-1受容体経路の阻害を介した多彩なメカニズムで腫瘍の増殖を抑制する) Sci Rep. 2017; 7: 4537.
この論文では、様々ながん細胞株を用いた実験系(培養細胞と動物実験)でクエン酸が抗腫瘍効果を示すことを報告しています。そのメカニズムとして、①がん細胞の分化誘導、②腫瘍組織内のリンパ球のT細胞の動員と活性化、③インスリン様増殖因子-1(IGF-1)受容体の活性化(リン酸化)の阻害、④AKTリン酸化の阻害、⑤解糖系とTCA回路の両方の抑制など多様なメカニズムでがん細胞の増殖を阻害し、アポトーシスを誘導することを報告しています。
つまり、クエン酸は、免疫系を活性化し、がん細胞の増殖シグナルの伝達系を抑制し、エネルギー産生系を阻害してATPを枯渇するという結果です。
この論文の結論は「食事からのクエン酸の補充はがん治療として有用であるかもしれない(Dietary supplementation with citrate may be beneficial as a cancer therapy. )」となっています。
クエン酸は食品添加物として、その毒性や安全性は多く研究されています。そのような研究から、クエン酸は抗酸化酵素の活性を阻害して、細胞の酸化ストレスを高める作用が報告されています。
活性酸素のスーパーオキシドを消去するスーパーオキシド・ディスムターゼ(SOD)の活性に必要な銅や亜鉛とクエン酸が結合して除去するメカニズムで細胞の酸化ストレスを高めるという報告があります。
また、過酸化水素(H2O2)を除去するグルタチオン・ペルオキシダーゼはその活性にセレニウムが必要ですが、クエン酸はセレニウムと結合して除去し、グルタチオン・ペルオキシダーゼの活性を低下させることが報告されています。(Cytotechnology. 2014 Mar; 66(2): 275–282.)
クエン酸はキレート作用によって金属と結合して除去する作用があります。
キレート(chelate)という言葉は、ギリシャ語の「カニのはさみ」から派生した言葉です。カニのはさみのように物質を挟み込むことを「キレート化する」と言います。
金属と強いキレート作用をもつクエン酸は、体内に吸収された有毒な金属を体外に排泄する効果が知られています。体内では銅や亜鉛やセレニウムとキレートして、スーパーオキシド・ディスムターゼ(SOD)やグルタチオン・ペルオキシダーゼの活性を阻害して酸化ストレスを高めるという機序です。
したがって、クエン酸療法は、がん細胞の酸化ストレスを高める「がんの酸化治療」の効き目を高めると言えます。

図:クエン酸は金属とキレートして結合する作用が強い。「キレート」とは「カニのはさみ」を意味し、カニが両方のはさみで物質を捕まえる姿がイメージされている。
がん治療には1日にクエン酸を体重1kg当たり0.5g程度の服用が良いようです。体重60kgで30グラム程度です。この量を長期間摂取しても、毒性はほとんど無いようです。
実際に、がんの代替療法では「クエン酸療法」はかなりポピュラーです。実践しているがん患者さんは多いようです。臨床的にも効果が認められており、培養細胞や動物実験でも有効性が示され、メカニズムの研究が行われています。
【解糖系はグルコースをピルビン酸にする経路】
クエン酸が解糖系を抑制することを理解するには、まず解糖系を理解する必要があります。
細胞はグルコース(ブドウ糖)を分解してエネルギー(ATP)を産生します。グルコースの分解は細胞質における解糖(かいとう)とミトコンドリアにおけるTCA回路と酸化的リン酸化によって行われます。解糖は酸素を使わないでATPを産生し、ミトコンドリアでの酸化的リン酸化は酸素を使ってATPを産生します(下図)。

図:グルコース(ブドウ糖)を分解してエネルギー(ATP)を産生するとき、細胞質では酸素を使わない(嫌気性)解糖という代謝でATPを産生し、ミトコンドリアでは酸素を使って(好気性)、TCA回路と酸化的リン酸化という経路でATPを産生する。
解糖は1分子のグルコースが2分子のピルビン酸になるまでの過程です。
この反応過程では、グルコース → グルコース-6-リン酸 → フルクトース-6-リン酸 → フルクトース-1,6-ビスリン酸 → 1,3-ビスホスホグリセリン酸(2分子) → 3-ホスホグリセリン酸(2分子) → 2-ホスホグリセリン酸(2分子) → ホスホエノールピルビン酸(2分子) → ピルビン酸(2分子)と変換されます。
この酵素反応は細胞質で行われ、酸素は必要ありません。1分子のグルコースが解糖によって2分子のATPが産生されます。(実際には4分子のATPが産生され、2分子のATPが消費されるので、差し引き2分子という計算になります)
ピルビン酸は酸素の供給がある状態ではミトコンドリア内に取り込まれて、ピルビン酸脱水素酵素の作用でアセチルCoAに変換され、TCA回路と電子伝達系によってさらにATPの産生が行われます。
TCA回路で生成されたNADHやFADH2は、ミトコンドリア内膜に埋め込まれた酵素複合体に電子を渡し、この電子は最終的に酸素に渡され、まわりにある水素イオンと結合して水を生成します。このようにTCA回路で産生されたNADHやFADH2の持っている高エネルギー電子をATPに変換する一連の過程を酸化的リン酸化と呼び、これの酵素反応をおこなうシステムを電子伝達系と呼びます。こうしてつくられたATPはミトコンドリアから細胞質へ出て行き、そこで細胞の活動に使われます。
酸素の供給が十分でない場合は、ピルビン酸は細胞質で乳酸脱水素酵素(LDH)の作用で乳酸に変換されます。この生化学反応を嫌気性解糖(aerobic glycolysis)と言います。運動をして筋肉細胞に乳酸が貯まるのは、酸素の供給が不足して嫌気性解糖が進むからです。
酸素が十分にある状態では、ミトコンドリア内で効率的なエネルギー生産が行われ、2分子のピルビン酸から30分子のATPが作られます。つまり、1分子のグルコースから32分子のATPが作られます。一方、嫌気性解糖系では1分子のグルコースから2分子のATPしか作れません(下図)。
(注;酸化的リン酸化で生成するATPの量は1分子のブドウ糖当たり30〜38分子といろんな説があり確定していませんが、ここでは米国の生物学の教科書の”Life:the Science of Biology”の記述に準拠して32分子にしています)

図:細胞質では酸素を使わない解糖で1分子のグルコースを2分子のピルビン酸に変換する。ピルビン酸はミトコンドリアで酸素を使って水と二酸化炭素に分解される。1分子のグルコースから解糖系だけでは2分子のATPしか産生されないが、ミトコンドリアでの酸素呼吸によって完全に分解されると32分子(解糖での2分子と酸化的リン酸化での30分子)のATPが産生される。
【クエン酸はホスホフルクトキナーゼをフィードバック阻害する】
解糖系やTCA回路や電子伝達系に関与する酵素の一部は、アロステリック制御によって調節されています。アロステリック制御というのは、酵素にある物質が結合すると構造変化が起こって機能が変化する現象です。
「アロステリック」とは 「別の形」 を意味する用語です。酵素の形が変わることで酵素活性が変化することを「アロステリック調節」といいます。
酵素の構造の変化によって、活性が阻害される場合(アロステリック阻害)と促進される場合(アロステリック促進)があります(下図)。
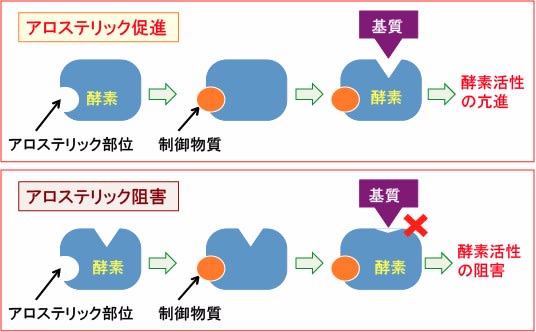
図:酵素のアロステリック部位に制御物質が結合して酵素活性が促進する場合を「アロステリック促進」と言う。一方、酵素のアロステリック部位に制御物質が結合して酵素活性が阻害される場合を「アロステリック阻害」という。
代謝系のある段階の反応が、その系の下流の産物によって阻害されることをネガティブフィードバック調節と言います。代謝経路でその後に続く産物が高濃度に存在すると、その代謝系での反応がそれ以上必要ないので、酵素活性を阻害して反応を止める制御です。
一方、ある経路の産物が過剰に存在すると、それが他の経路の反応をスピードアップして、過剰に存在する物質を他の経路での代謝に振り替える調節をポジティブフィードバック調節と言います(下図)。

図:ある産物が過剰に蓄積した場合に、その産物によって上流の酵素反応が阻害されることによってその産物の合成が止められる(ネガティブフィードバック)。場合によっては、同じ材料(図のC)を使う他の反応系を促進することによって合成が調節される(ポジティブフィードバック)。このような調節は生成物による酵素のアロステリック調節により行われる。
解糖系の律速段階の1つのホスホフルクトキナーゼ(フルクトース-6-リン酸をフルクトース-1,6-ビスリン酸に変換)は、
最終生成物のATPによりフィードバック阻害を受け、ADPもしくはAMPによって活性化されます。そして、このホスホフルクトキナーゼはTCA回路(クエン酸回路)の産物であるクエン酸によってもフィードバック阻害を受けます。
つまり、クエン酸はホスホフルクトキナーゼを阻害することによって解糖系を抑制します。(下図)

図:解糖系の律速酵素の1つのホスホフルクトキナーゼ(フルクトース-6-リン酸をフルクトース-1,6-ビスリン酸に変換)は、 下流の生成物のクエン酸とATPによりフィードバック阻害を受ける。食事やサプリメントから外来性に摂取したクエン酸もホスホフルクトキナーゼを阻害する機序でがん細胞の解糖系を阻害する効果が期待できる。
このようにクエン酸は解糖系のフルクトキナーゼをフィードバック阻害するので、ATP産生を抑制することになります。
一方で、脂肪酸合成系のアセチルCoAカルボキシラーゼは、前駆体のクエン酸により活性化されます。したがって、クエン酸を多く摂取すると脂肪酸の合成が促進されます。がん治療においては、細胞分裂の材料を作らせないという観点からはがん細胞における脂肪酸合成を阻害する方が良いのですが、脂肪酸を合成するにはATPが必要なため、解糖系を阻害した条件であれば、アセチルCoAカルボキシラーゼの活性化は問題ないと言えます。
【がん細胞はクエン酸が少ない】
がん細胞は細胞内のクエン酸の量が少なく、クエン酸の量が少ないがん細胞は、増殖活性が高いことが報告されています。
その理由は、がん細胞ではピルビン酸脱水素酵素の阻害によってミトコンドリアでのTCA回路での代謝が抑制されていることと、クエン酸は細胞質で脂肪酸合成に使用されるからです。
ピルビン酸からアセチル-CoAの変換が抑制されても、がん細胞では、アミノ酸のグルタミンがαケトグルタル酸が還元的カルボキシル化によってクエン酸が作られて脂肪酸合成にいく経路が存在します。
アセチルCoAはミトコンドリアの膜を通れないのですが、クエン酸は膜を通過できます。したがって、ミトコンドリアで産生されたクエン酸は細胞質に移動し、細胞質でアセチルCoAに変換されて脂肪酸の合成に使われます。
急激に増殖するがん細胞のミトコンドリアでは、TCA回路の順行性の代謝に加えて、グルタミン由来のαケトグルタル酸がイソクエン酸脱水素酵素(isocitrate dehydrogenase)による還元的代謝によってTCA回路を逆行してクエン酸を増やしています。
低酸素で増殖するがん細胞は、ミトコンドリア依存性の脂肪酸合成をバイパスするために還元的グルタミン代謝を使うことが報告されています。
グルタミンからαケトグルタル酸の還元的カルボキシル化によってクエン酸が多く作られますが、クエン酸は脂肪酸合成に使われるので、基本的に、がん細胞内のクエン酸濃度は低くなっています。
細胞質内のクエン酸濃度が高くなると解糖系が阻害されてATPが作れなくなるので、がん細胞はクエン酸濃度が低く維持されます。
そこで、食事やサプリメントによるクエン酸の補充が、がん細胞の解糖系の阻害などの機序によって、がん細胞の増殖を抑制できることになります。

図:がん細胞は、グルコースの取込みと解糖系での代謝が亢進し乳酸の産生が亢進している(①)。ミトコンドリアのピルビン酸脱水素酵素の活性が低下して、クエン酸回路(TCA回路)の代謝は低下している(②)。クエン酸は細胞質に出て(③)、ATPクエン酸リアーゼでアセチルCoAに変換されて脂肪酸合成に使われる(④)。グルタミンはαケトグルタル酸に変換されてTCA回路を逆向きに進む還元的カルボキシル化によってクエン酸の産生を増やし、このクエン酸は脂肪酸合成に使われる(⑤)。細胞質のクエン酸は解糖系の律速酵素であるホスホフルクトキナーゼを阻害する作用があるが、がん細胞のクエン酸は脂肪酸合成に使用されるので、細胞質内のクエン酸濃度を低く維持して解糖系の阻害が起こらない(⑥)。
【クエン酸と2-デオキシグルコースとメトホルミンとジクロロ酢酸ナトリウムの相乗効果】
前述のように、クエン酸は金属のキレート作用によってSODやグルタチオン・ペルオキシダーゼ活性を阻害し、酸化ストレスを高めます。したがって、がん細胞の酸化ストレスを高める「がんの酸化療法」の抗腫瘍効果を高めます。
がん細胞は増殖制御の破綻によって細胞増殖活性が亢進しています。細胞の増殖には細胞を作る物質とエネルギー(ATP)の合成を大量に増やす必要があります。この物質合成とエネルギー産生を阻止できればがん細胞の増殖を阻止でき、がん治療に応用できます。
糖尿病治療薬のメトホルミンはミトコンドリアにおけるATP産生と物質合成を阻害して、がん細胞の増殖に必要な代謝産物を減少させて、がん細胞の増殖を停止させることを報告されています。さらにメトホルミンはミトコンドリアの呼吸酵素複合体Iの働きを阻害して、活性酸素の産生を増やします。

図:がん細胞ではミトコンドリアで活性酸素が産生されやすい状況にある。メトホルミンは呼吸鎖を阻害し(①)、エネルギー(ATP)低下によって増殖を抑制し(②)、活性酸素の産生を高めて酸化傷害によって細胞にダメージを与える(③)。
メトホルミンは細胞膜に必要な脂肪酸の合成も抑制します。メトホルミンは炭素がTCA回路に流入するのを抑制し、クエン酸依存性の新規の脂肪酸合成を含めてミトコンドリア依存性の物質合成を阻害することによって、がん細胞の増殖を抑制するというメカニズムが報告されています。
しかしながら、メトホルミンの増殖抑制作用に抵抗性を示すがん細胞も存在します。この場合、TCA回路に非依存的な脂肪酸合成経路の関与が指摘されています。これはグルタミン由来のαケトグルタル酸が還元的カルボキシル化によってクエン酸が作られて脂肪酸合成にいく経路が存在するからです。
そこで、クエン酸の摂取に加えて、解糖系を阻害する2-デオキシ-D-グルコースと、ミトコンドリアの呼吸酵素を阻害してミトコンドリアでのATP産生を減らし、活性酸素の産生を増やすメトホルミン、ピルビン酸脱水素酵素を活性化して酸化的リン酸化を促進することによって活性酸素の産生を増やすジクロロ酢酸ナトリウムを併用すると、がん細胞のエネルギー産生と物質合成(特に脂肪酸合成)を阻止し、活性酸素の産生を亢進して、増殖を抑制し、細胞死(アポトーシス)を誘導できます(下図)。
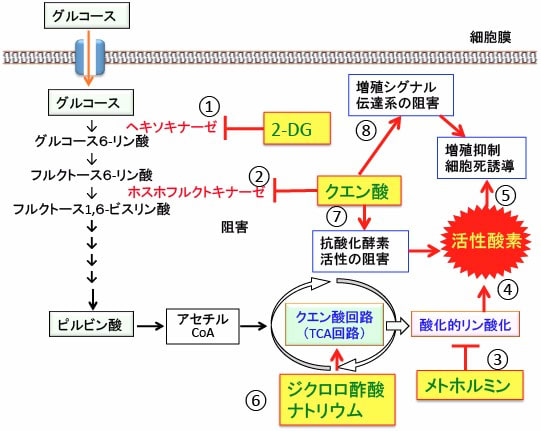
図:2-デオキシ-D-グルコース(2-DG)はヘキソキナーゼを阻害し(①)、クエン酸はホスホフルクトキナーゼを阻害する(②)ことによって、この2つは解糖系を強力に阻害する。メトホルミンは呼吸酵素Iを阻害する(③)ことによってミトコンドリアでの活性酸素の産生を増やす(④)。活性酸素の産生が亢進すると細胞の増殖が抑制され、細胞死(アポトーシス)が誘導される(⑤)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素を活性化してミトコンドリアでの代謝を亢進して活性酸素の産生を高める(⑥)。クエン酸は銅や亜鉛やセレニウムなどの金属をキレート(結合)する作用によって、これらの金属が活性に必要なスーパーオキシド・ディスムターゼ(SOD)やグルタチオン・ペルオキシダーゼなどの抗酸化酵素の活性を阻害して酸化ストレスを高める(⑦)。クエン酸はがん細胞の増殖シグナルを阻害する作用も報告されている(⑧)。これらを組み合せることによって、がん細胞の酸化ストレスを高めて、細胞増殖の抑制と細胞死誘導の効果が得られる。
【柑橘類の摂取ががんを予防する】
クエン酸は、食品の保存料や添加物として広く使用されています。柑橘類にも多く含まれています。クエン酸療法で使用される1日30〜40グラム程度の摂取量では、ほとんど副作用はありません。
ただし、胃腸が弱い人は1回に大量を服用すると、胃腸の刺激による症状が出ます。そのため、胃酸の分泌を抑制するプロトンポンプ阻害剤や、胃粘膜を保護するスクラルファート(アルサルミン)などの併用が必要な場合もあります。
また、大量のクエン酸を長期に摂取すると、歯のエナメル質を腐蝕する可能性があります。
柑橘類はがんを予防する成分の宝庫です。フラボノイドやテルペノイドやカロテノイドなど、多くのがん予防成分が含まれています。クエン酸も多く含まれています。
1990年代に米国立がん研究所が中心となって「がん予防に重要な野菜や果物や香辛料」がまとめられました。そのトップはニンニクで、キャベツ、大豆、生姜、タマネギ、お茶などが上位にランクされています。果物のトップは柑橘類(オレンジ、レモン、グレープフルーツ)で、お茶や玄米やアブラナ科野菜(ブロッコリー、カリフラワー、芽キャベツ)と同じランクになっています。
柑橘類はみかんの仲間です。つまり、ミカン科の常緑樹の果実で、世界中に数百種類もあります。温州みかん、オレンジ、レモン、グレープフルーツ、八朔、ライムなど様々な柑橘類が販売されています。
動物発がん実験を用いて柑橘類に含まれるがん予防成分を研究した結果、モノテルペン類のリモネン(limonene)、フラボノイドのヘスペリジン(hesperidine)、カロテノイドのベータ・クリプトキサンチン(β-cryptoxanthin)、クマリンのオーラプテン(auraptene)、ポリメトキシフラボノイドのノビレチン(nobiletin)、水様性食物繊維のペクチン類などの多彩な成分にがん予防効果が報告されています。
がん予防の作用メカニズムはそれぞれの成分によって異なっています。果皮に多く含まれているリモネンはがん細胞の増殖を抑制しアポトーシスという細胞死を誘導することが、カロテノイド類やフラボノイド類やオーラプテンには抗酸化作用や抗炎症作用などが報告されています。
水様性食物繊維のペクチン類や低分子のオリゴ糖には、ビフィズス菌や乳酸菌などの善玉菌を増やして、腸内環境を改善し免疫機能を高めて抗腫瘍効果を示すことも報告されています。
異なる作用メカニズムを持つがん予防物質を組み合わせて用いると、相乗効果によってがん予防効果が高まります。
食品とがん予防の関連を検討した疫学研究の多くが、柑橘類の摂取ががん予防に有効であると結論づけています。例えば、胃がんの発生率と柑橘類の摂取との関係を検討した14の論文を統計的にまとめた研究によると、柑橘類を多く摂取すると胃がんの発生率が28%減少するという推定が報告されています。(Gastric Cancer 11: 23-32, 2008)
膵臓がんの発生率と柑橘類の摂取の関連を調べた複数の研究論文をまとめて統計的に解析した研究では、柑橘類の摂取が多いほど膵臓がんの発生率が低下することが示されており、柑橘類を多く摂取すると膵臓がんの発生リスクが0.83(95%信頼区間;0.70-0.98)に低下するというデータが報告されています。(Pancreas 38:168-174, 2009)
約13000人のがん患者と、その時期に同じ病院でがんとは別の急性疾患で治療を受けた患者を対照にして、柑橘類とがんの発生率の関連を検討する検討がイタリアとスイスの共同研究で行われています。この研究では、柑橘類をほとんど食べない人に比べて、柑橘類を多く摂取している人のがん発生リスクは、口腔・咽頭がんでは0.47(95%信頼区間:0.36-0.61)、食道がんでは0.42(95%信頼区間:0.25-0.70)、胃がんでは0.69(95%信頼区間:0.52-0.92)、大腸がんでは0.82(95%信頼区間:0.72-0.93)、喉頭がんでは0.55(95%信頼区間:0.37-0.83)でした。乳がん、子宮内膜がん、卵巣がん、前立腺がん、腎臓がんにおいては、柑橘類とがん発生率との間には相関は認めれれませんでした。つまり、この研究では、柑橘類の摂取は消化器系や上部気道系の腫瘍の発生を予防する効果が示唆されています。(Cancer Causes Control 21: 237-42.2010)
宮城県大崎市の住民基本台帳に登録されている40~79歳の住民(42470人)を対象に、あらゆるがんの発生を追跡(1995から2003年)している「大崎コホート」研究でも。柑橘類の消費とがん発生率の関連が調べられています。その結果、柑橘類の1日摂取量が多いほどあらゆるがんの発生率が低下することが示されています。
柑橘類を多く摂取することによって全てのがんの発生リスクは、男性が0.86(95% CI = 0.76-0.98)、女性が0.93(95% CI = 0.79-1.09)、男女総合で0.89 (95% CI = 0.80-0.98)でした。特に、膵臓がん(RR = 0.62, 95% CI = 0.38-1.00)と前立腺がん((RR = 0.63, 95% CI = 0.41-0.97)の発生率の低下が著明でした。また、柑橘類の摂取と同時にたくさんの緑茶を飲用していた人は、がん発生率がさらに低下することが示されています。(Int J Cancer 127(8):1913-1922, 2010)
柑橘類によるがん予防成分としては、今まではフラボノイドやテルペノイドやカロテノイドなどの成分が主に研究対象になっていたのですが、クエン酸のがん予防効果も重要だと思います。
注:クエン酸療法と重曹療法の2つを実践するのも問題ないのですが、クエン酸と重曹(炭酸水素ナトリウム)を一緒に水に溶かして摂取している人がいますが、クエン酸と重曹を一緒に溶解すると、クエン酸の方はクエン酸ナトリウムとして残りますが、重曹(炭酸水素ナトリウム)の方は二酸化炭素と水(=炭酸水)になるので、重曹によるアルカリ化の効果が無くなります。
◯ がんの酸化治療についてはこちらへ:
新刊紹介

(ご購入はこちらへ)
銀座東京クリニックでも販売しています(詳細はこちらへ)
| « 589)酸素ナノ... | 591)シスプラ... » |



