がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
840)アッカーマンシア・ムシニフィラの抗がん作用(その1):大腸粘膜バリアの維持・強化
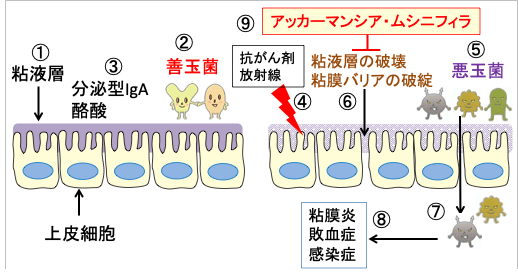
図:正常な大腸粘膜では粘液層(①)が厚く、善玉菌(②)が多く、分泌型IgAや酪酸の量が多い(③)。抗がん剤や放射線照射(④)は腸内細菌叢の変化を起こして悪玉菌が増える(⑤)。粘液層が破壊されて粘膜バリアが破綻し(⑥)、腸管内の病原菌が体内に侵入し(⑦)、粘膜炎や敗血症や全身感染症を引き起こす(⑧)。腸内細菌の一種のアッカーマンシア・ムシニフィラ(Akkermansia muciniphila)は大腸粘膜の粘液産生を増やして粘膜バリアの破綻を防ぐ効果がある(⑨)。
840)アッカーマンシア・ムシニフィラの抗がん作用(その1):大腸粘膜バリアの維持・強化
【腸管上皮細胞は粘液を産生して細菌の侵入を防ぐバリアを作っている】
大腸内には多くの微生物(腸内細菌)が棲みついています。一般に、500種類から1000種類、100兆個から1000兆個におよぶ微生物が存在すると言われています。重量にして1kg以上になります。
これらの腸内微生物は、腸内に常在しているだけでなく、食物繊維の分解によって産生される短鎖脂肪酸、葉酸、ビタミンK、ビタミンB類などのビタミンを宿主に提供し、健康維持に大きく貢献しています。
しかし、こういった有益な腸内細菌も、体内に侵入すれば免疫システムによって外敵とみなされ排除されます。そのため腸内微生物と宿主の両者を空間的に分け隔てるメカニズムが必要であり、それを可能にするのが腸管上皮細胞によって構築される「粘膜バリア」です。
粘膜バリアは物理的バリアと化学的バリアの二つに大別されます。物理的バリアは物理的な壁となって微生物の侵入を防止するバリア(障壁)であり、上皮層を被覆する粘液層、上皮細胞表面に存在する糖鎖の集合体である糖衣、細胞間接着装置である密着結合(タイト・ジャンクション)などがあります。
粘液層は腸管上皮細胞の一つである杯細胞から産生される糖タンパク質のムチンによって構成され、腸管上皮を覆うことで物理的に腸管組織への細菌侵入を防止しています。
化学的バリアは、抗菌活性を発揮することで細菌侵入を抑制する分子群です。ディフェンシンファミリー分子やReg3ファミリー分子などが含まれ,それらの分子は主として腸管上皮細胞の一つであるパネート(Paneth)細胞から産生されます。(下図)

図:腸管腔には多数の腸内細菌が棲みついている(①)。杯細胞(②)から粘液が産生され、粘液層が形成される(③)。パネート細胞(④)からは様々な抗菌物質(⑤)が産生されている。粘膜上皮細胞の間には細胞間接着装置(⑥)があって、上皮間からの細菌の侵入を防いでいる。これらが腸内微生物の体内への侵入を防ぐ粘膜バリアを構築している。
【粘液の主成分のムチンは粘膜の杯細胞から分泌される】
粘液(mucus)とは、生物が産生し体内外に分泌する粘性の高い液体です。一般的にはムチンと総称される糖タンパク質と、糖類、無機塩類などから構成されます。消化管や気管支の内壁などは表面が常時粘液に被われており、それらを粘膜(mucous membrane)と呼んでいます。粘膜や腺から分泌された濃い粘性の流体が粘液です。
消化管や呼吸器や泌尿生殖器などの粘膜上皮にはムチン(mucins)を産生する細胞が存在します。ムチンを含んだ大型で明るく染まる顆粒を細胞体上部に多数充たすため、そこが膨隆し西洋杯(ゴブレット)に似ることから杯細胞(goblet cells)と言われます。杯細胞はムチン分泌性の単細胞腺で、腸絨毛においては吸収上皮細胞間に、気道粘膜においては多列絨毛上皮間に散在しています。

図:腸粘膜の粘膜上皮細胞には、栄養素を吸収する絨毛上皮細胞(①)の間に粘液の主成分のムチンを産生・分泌する杯細胞(②)が存在する。右の2つの写真は、ムチンを紫に特殊染色した腸粘膜の組織像で、ムチンを産生する杯細胞が絨毛上皮細胞間に多数散在することが分かる。
粘液は粘膜上皮の表面を滑らかにし、有害な粒子や外部環境から表面を保護します。呼吸器系では杯細胞は気管、気管支、細気管支に存在します。粘液はほこりやアレルゲンなどの異物や、細菌などの潜在的な病原体を捕捉し、それらによる肺組織の損傷を防ぎます。
消化器系においては、粘液は粘膜上皮の表面を潤滑にして食物の移動をスムーズにするために胃腸管全体で重要です。酸性環境から胃の内層を保護します。腸粘膜では腸管上皮を覆うことで物理的に腸管組織への細菌侵入を防止しています。
ムチンは、コアタンパク質にO-結合型糖鎖が高密度に付加した高分子の粘性糖タンパク質です。O-結合型糖鎖というのはタンパク質のセリンやスレオニン側鎖の水酸基にO-グリコシド結合する構造の糖鎖です。ムチンは基本的には消化管上皮を保護する機能をもつ生体防御物質ですが、腸内の共生細菌に栄養分と棲息環境を提供する共生因子でもあります。
高密度に糖鎖が付加しているムチンは、さまざまな分解酵素に対する耐性が高く、消化管内の微生物や宿主自身の分解酵素から上皮細胞を保護する役割を果たしています。ムチンを産生する遺伝子を欠損したマウスでは、腸上皮細胞に細菌が直接接触するために炎症を惹起し、最終的に大腸がんを自然発症します。
【粘液が少なくなると粘膜のバリア機能が低下する】
消化管粘膜の粘液層は腸管上皮を覆うことで物理的に腸管組織への細菌侵入を防止しています。
大腸では、腸内微生物叢の異常によって腸粘膜バリアのダメージと炎症が起こります。
消化管粘膜上皮層は、粘膜バリアの重要な構成要素です。健康な人では、上皮細胞間の密着結合(タイト・ジャンクション:tight junctions)が腸上皮の透過性を維持する上で極めて重要な役割を果たしています。この上皮細胞間のタイト・ジャンクションが、消化管内に有害物質を隔離しながら栄養素の吸収を可能にしています。
さらに、腸上皮を覆う粘液層も粘膜バリア機能に寄与しています。この層は、糖タンパク質、ムチン、免疫グロブリン、および酪酸で構成されています。
たとえば、ムチン三量体は上皮細胞を内腔毒素から保護するバイオフィルムを構築し、分泌型IgAは粘液層の毒素や病原体を中和できる非常に重要な抗体です。健康な腸内では、ラクトバチルスや連鎖球菌などのいくつかの有益な細菌が分泌型IgAの生合成を促進することが報告されています。
食物繊維の発酵によって産生される酪酸は、ムチン2(MUC2)遺伝子の発現を誘導することによってムチン合成を促進します。さらに、酪酸は腸上皮細胞から放出される抗菌ペプチドであるカテリシジン(cathelicidin)の分泌を促進することができます。
したがって、酪酸産生細菌は、健康な腸内の粘液の生理的組成を維持する上で重要な役割を果たしており、これらのプロセスにより、腸のバリアが十分に維持され、消化管内の病原体に対する宿主の防御が向上します。
しかし、食物繊維の摂取不足、抗生物質の使用、化学療法や放射線療法によって腸内微生物叢に異常が生じると、悪玉菌が増え、粘液層が破壊され、腸上皮の透過性が高まります。さらに、粘膜炎が発生し、バリア機能の低下によって病原菌が体内に侵入して敗血症を引きおこします。(下図)

図:正常な大腸粘膜では粘液層(①)が厚く、善玉菌(②)が多く、分泌型IgAや酪酸の量が多い(③)。食物繊維の摂取不足や抗生物質使用、抗がん剤や放射線照射(④)は腸内細菌叢の変化を起こして悪玉菌が増える(⑤)。粘液層が破壊され(⑥)、腸管内の病原菌が体内に侵入し(⑦)、粘膜炎や敗血症や全身感染症を引き起こす(⑧)
【腸内微生物叢の異常をディスバイオシス(dysbiosis)と言う】
抗生物質の投与や偏った食事や病原体感染などの理由によって、腸内細菌叢(微生物叢)を構成する細菌の種類や数が減少することにより細菌叢(微生物叢)の多様性が低下した状態をディスバイオシス(dysbiosis)と言います。 腸内細菌の総菌数が著しく減少したり、通常は菌数レベルの低い菌種が異常に増加することなどによって、正常な細菌構成が変化した状態です。
最近になって、ディスバイオシスが炎症性腸疾患、肥満、糖尿病などのさまざまな病気と密接な関わりをもつことが明らかとなってきています。
抗がん剤や放射線治療もディスバイオシス(dysbiosis)を引き起こし、腸粘膜の炎症や酸化ストレスを悪化させ、腸粘膜のバリア機能を低下させ、感染症や敗血症の原因になります。以下のような報告があります。
Chemotherapy-driven dysbiosis in the intestinal microbiome(腸内細菌叢における化学療法誘発性のディスバイオシス)Aliment Pharmacol Ther. 2015 Sep;42(5):515-28.
【要旨の抜粋】
背景:化学療法はいくつかの副作用を引き起こし、胃腸の粘膜炎は最も頻繁に見られる副作用の一つである。消化管粘膜炎の病態生理学の検討において、腸内微生物叢の役割については検討されていない。
目的:消化管粘膜炎の病態生理における腸内微生物叢の役割を解明するために、化学療法後の微生物叢の変化を検討するために、ハイスループットDNAシーケンス分析を行なった。
方法:骨髄移植前の骨髄破壊的抗がん剤治療を受け、抗生物質などの他の併用療法を受けていない非ホジキンリンパ腫の28人の患者において、化学療法の前後の糞便サンプルから16SrRNA遺伝子を増幅および配列決定した。
結果:化学療法前に収集されたサンプルと比較して、化学療法後に収集された糞便サンプルは、ファーミキューテス(P = 0.0002)および放線菌(P = 0.002)の量の有意な減少とプロテオバクテリア(P = 0.0002)の量の有意な増加を示した。
結論:この研究は、化学療法によって誘発される消化管粘膜炎の発症に、腸内微生物叢の組成的および機能的不均衡の関与を明らかにしている。腸内微生物叢を標的とした治療法の開発の潜在的な有効性を示唆している。
抗がん剤治療による腸管粘膜炎の発症に腸内細菌叢のディスバイオシスが関与しているという報告です。 放射線治療における倦怠感や下痢の発症にも腸内細菌叢のディスバイオシスの関与が報告されています。以下のような報告があります。
Gut Microbial Dysbiosis May Predict Diarrhea and Fatigue in Patients Undergoing Pelvic Cancer Radiotherapy: A Pilot Study.(腸内微生物性叢のディスバイオシスは、骨盤がん放射線療法を受けている患者の下痢と倦怠感を予測する可能性がある:パイロット研究)PLoS One. 2015; 10(5): e0126312.
【要旨の抜粋】
倦怠感と下痢は骨盤放射線療法の最も頻繁な副作用であるが、その発症メカニズムはほとんどわかっていない。 この研究は、骨盤放射線療法によって誘発される腸内細菌叢の変化(ディスバイオシス)と倦怠感および下痢との間の相関関係を調査した。
11人のがん患者における骨盤放射線療法の5週間の治療中に、一般的な倦怠感スコアは有意に増加し、下痢の患者でより顕著であった。 倦怠感スコアは、血清シトルリン(機能的腸粘膜上皮細胞量の指標)の減少および全身性炎症性タンパク質(ハプトグロビン、オロソムイド、α1-アンチトリプシン、TNF-α)の増加と密接に相関していた。
リポ多糖(LPS)の血清レベルも上昇し、特に粘膜上皮バリアの破綻と内毒素血症を示す下痢の患者で上昇した。 16S rRNA遺伝子の分析により、後に下痢を発症した患者では、放射線治療前に、微生物の多様性、細胞数、およびファーミキューテス門(Firmicutes)/バクテロイデス門(Bacteroidetes)の比率の比率が大幅に変化した。
骨盤放射線療法は、糞便中の微生物生態学にさらなる変化を引き起こし、そのいくつかは下痢の有無にかかわらず患者に特有のものであった。
この研究の結果は、放射線療法前の腸内微生物のディスバイオシスが下痢の発症を予測し、予防的治療の選択肢を導くために利用される可能性があることを示している。
放射線誘発性腸内細菌叢のディスバイオシスは、消化管粘膜炎、下痢、全身性炎症反応、倦怠感などの骨盤放射線照射に関連する副作用の一因となる可能性がある。
化学療法または放射線療法によって誘発される腸内微生物叢の異常(ディスバイオシス)は、腸粘膜バリアの機能障害を引き起こします。 第一に、腸内バリアはLPS産生細菌によって損なわれ、腸粘膜上皮の透過性の増加につながる可能性があります。 第二に、酪酸産生菌の割合が減少することで、粘液層を以前よりも薄くすることができます。 第三に、分泌型IgAの腸内濃度は化学療法または放射線療法後に減少します。

図:抗がん剤や放射線治療は腸内細菌叢の異常(Dysbiosis)を引き起こし(①)、粘膜バリアが破綻し(②)、悪玉菌が優位になって(③)、粘膜の炎症を引き起こす(④)。腸内細菌が体内に侵入して全身感染症を引き起こす(⑤)。
【腸内細菌のAkkermansia muciniphilaは大腸粘膜の粘液産生を増やす】
Akkermansia muciniphila(アッカーマンシア・ムシニフィラ)はVerrucomicrobia門に属するグラム陰性の偏性嫌気性細菌です。2004 年にオランダのワーヘニンゲン(Wageningen )大学でヒトの糞便中の新しいムチン分解微生物を探していたときに発見されました。属名のAkkermansiaは、オランダの著名な微生物学者Antoon Akkermansに由来します。
腸管細胞から分泌されるムチン(糖タンパク質)を唯一の炭素・窒素源として利用するユニークな特徴を持ちます。muciniphila は「ムチンを好む(mucin-loving)」という意味です。 その名前が示すように、結腸壁の粘液を食べて、粘液の絶え間ない再生を刺激することによって大腸の粘液バリアを維持します。(最近の研究では、低レベルの酸素に耐えることができ、周囲空気に 48 時間さらされた後も生存する可能性が報告されています。)

アッカーマンシア・ムシニフィラはヒト、マウス、チンパンジー、馬、豚などの動物の腸管に存在することが確認されています。特に結腸に多く、健康な成人では菌叢全体の0.5–5%を占めます。この細菌は母乳中に存在すると報告されており、生後1カ月の乳児糞便から検出されはじめ、生後1年で成人のレベルに達します。高齢者では量が減ることが知られています。アッカーマンシア・ムシニフィラは、ヒトの腸内で検出可能な上位 20 種の 1 つであることがわかっています
アッカーマンシア・ムシニフィラはムチンに含まれるN-アセチルガラクトサミンやN-アセチルグルコサミン、スレオニンを重要な栄養成分とし、ムチン分解に関与する糖鎖加水分解酵素を持ち、ムチンをエネルギー源として、主にプロピオン酸や酢酸を生産します。
アッカーマンシア・ムシニフィラはヒトミルクオリゴ糖も分解でき、乳児期の腸内定着に関与すると考えられています。
ムチンの分解自体は病原体のような挙動ですが、ムチンを分解することによってムチンの合成を刺激し、腸粘膜の粘液を増やす作用があります。 さらに、この細菌は、ムチンを有益な副産物に変換することにより、宿主の腸内微生物バランスを維持している可能性が報告されています。
アッカーマンシア・ムシニフィラが粘液層に付着する能力は、有益なプロバイオティクスの特徴であると考えられています。腸の粘膜層は、主に上皮細胞を微生物の攻撃から保護し、それを栄養素として使用する微生物に成長エネルギーを提供します。
腸内のアッカーマンシア・ムシニフィラの量が少ないと、粘膜が薄くなり、腸のバリア機能が弱まり、毒素が宿主に侵入しやすくなります。つまり、宿主の免疫調節に関与するだけでなく、腸上皮細胞の完全性と粘液層の厚さを高め、それによって腸の健康を促進します。
さらに、抗がん剤治療や放射線治療によって引き起こされる腸内細菌叢異常(Dysbiosis)による粘膜バリアの破綻を防ぐ作用があるので、がん治療中の患者さんの腸内環境の改善にも有効です。
このように、アッカーマンシア・ムシニフィラは、宿主の代謝機能と免疫応答の改善に重要な価値があることが明らかになり、有望なプロバイオティクスとして注目されています。
【アッカーマンシア・ムシニフィラは抗老化とがん予防効果がある】
アッカーマンシア・ムシニフィラの量が少ないほど、腸のバリアの透過性が高くなり、リポ多糖類(LPS)などの炎症性因子が体内に入る可能性があります。慢性炎症は肥満や糖尿病を引き起こす原因になります。 実際、アッカーマンシア・ムシニフィラの腸内存在量は、正常人と比較して、肥満の人やⅡ型糖尿病の患者では少なく、アッカーマンシア・ムシニフィラのマウスへの投与試験やヒト試験では、肥満やⅡ型糖尿病に対する改善効果が示され、次世代プロバイオティクスとして注目されています。
肥満・糖尿病の原因の1つとして、高脂肪食摂取による腸管バリア機能低下が引き起こす慢性炎症が挙げられていますが、アッカーマンシア・ムシニフィラの外膜タンパク質(Amuc_1100)がトル様受容体-2(TLR-2)を介して腸管バリア機能を強化し、炎症を改善することが報告されています。
さらに、アッカーマンシア・ムシニフィラの分泌する細胞外小胞体が、高脂肪食を投与したマウスの腸管バリア機能の強化や体重の減少に関与することも報告されており、アッカーマンシア・ムシニフィラの抗肥満・抗Ⅱ型糖尿病の作用機構が分子レベルで明らかになってきています。
アッカーマンシア・ムシニフィラは老化やがんの予防にも効果が期待できることが指摘されています。以下のような報告があります。
Oral administration of Akkermansia muciniphila elevates systemic antiaging and anticancer metabolites.(アッカーマンシア・ムシニフィラ の経口投与は、全身のアンチエイジングと抗がん代謝産物を上昇させる)Aging (Albany NY). 2021 Mar 2;13(5):6375-6405
【要旨の抜粋】
人間の腸内におけるアッカーマンシア・ムシニフィラ(Akkermansia muciniphila) の存在は、健康、痩せ、フィットネスに関連している。マウスの実験では、加齢を遅延し、抗肥満および抗糖尿病効果を発揮し、炎症を抑え、がん細胞に対する免疫監視機構を増強するなどの有用な効果が実証されている。
臨床試験では、アッカーマンシア・ムシニフィラの抗糖尿病効果が確認されている。
この研究では、回腸、結腸、肝臓、および血漿の代謝産物組成に対するアッカーマンシア・ムシニフィラ(生菌または低温殺菌した死菌)および他の細菌のマウスへの経口投与による時間依存的効果を調査した。代謝産物組成の解析は、クロマトグラフィーと質量分析法の組み合わせによって実行された。
アッカーマンシア・ムシニフィラは代謝に大きな影響を与え、腸や肝臓でスペルミジンやその他のポリアミンを増加させた。
低温殺菌されたアッカーマンシア・ムシニフィラは、ポリアミン、短鎖脂肪酸、2-ヒドロキシ酪酸、および複数の胆汁酸の腸内濃度の上昇において、生のアッカーマンシア・ムシニフィラよりも効率的であり、循環血液中でも増加した。 これらの代謝産物はすべて、以前は人間の健康に関連しており、アッカーマンシア・ムシニフィラの有益な効果の生化学的基盤を提供している。
スペルミジンは、すべての生物に存在する天然ポリアミンで、細胞の成長と増殖、組織の再生、核酸(DNAとRNA)の安定化、酵素活性の調節、タンパク質翻訳の調節など、多くの生物学的プロセスに関与しています。スペルミジンの外来性補給は、マウスを含むさまざまなモデル動物の加齢および加齢性疾患に様々な有益な効果を発揮します。たとえば、スペルミジンの摂食は寿命を延ばし、心臓と神経を保護し、抗腫瘍性免疫応答を刺激し、メモリーT細胞形成を刺激することで免疫老化を回避する作用があります。
短鎖脂肪酸(酪酸など)やケトン体の2-ヒドロキシ酪酸(βヒドロキシ酪酸)も、抗老化作用と寿命延長効果があります。 つまり、腸内のアッカーマンシア・ムシニフィラを増やすと、抗老化と寿命延長に有効な代謝産物を増やす効果もあるということです。
以上のように、アッカーマンシア・ムシニフィラは人間の腸で最も一般的に見られる細菌の 1 つですが、腸内バリアの維持に欠かせない菌であり、メタボリックシンドロームや糖尿病、肥満などのさまざまな病気の発症に重要な役割を果たしている腸内細菌です。

図:アッカーマンシア・ムシニフィラは生菌も死菌も人間において様々な健康作用を発揮する。 大腸では粘膜バリアを強化し、腸管免疫を高める。コレステロールを低下して動脈硬化を軽減する。脂肪組織の脂肪量を減らし、炎症を軽減する。インスリン抵抗性を低下し、血糖を低下し、糖尿病の発症を防ぐ。脂肪肝や肝炎を軽減する。
いくつかの証拠は、アッカーマンシア・ムシニフィラの低温殺菌がその安定性を高めるだけでなく、さらに重要なことにその有効性を高めることを示しています。アッカーマンシア・ムシニフィラは有益な効果を持つ新しい食品または医薬品サプリメントを開発するための次世代候補として注目されています。アッカーマンシア・ムシニフィラの外膜に存在する特定のタンパク質は、Amuc_1100 と呼ばれ、将来の医薬品開発の強力な候補となる可能性があります。
現在、多くの病気や不健康状態が腸内細菌叢と密接に関連していることが報告されているため、腸内細菌を調節することで宿主の健康を改善することに大きな関心が寄せられています。腸内細菌をターゲットにした病気の予防や治療において、アッカーマンシア・ムシニフィラの役割に注目が集まっています。
◉ アッカーマンシア・ムシニフィラの詳細は以下のサイトで解説しています。
http://www.f-gtc.or.jp/Akkermansia/Akkermansia_muciniphila.html
アッカーマンシア・ムシニフィラは食品(水溶性食物繊維、ポリフェノール類、ドコサヘキサエン酸)、メラトニン、メトホルミン、ケトン食(βヒドロキシ酪酸)などで増やすことができます。
さらにアッカーマンシア・ムシニフィラのプロバイオティクスも米国で販売されています。
がん治療において腸内細菌叢の改善は副作用の軽減と抗腫瘍効果の増強に有効であることが、最近の多くの研究で明らかになっています。具合的には、乳酸菌、酪酸菌、アッカーマンシア・ムシニフィラを増やし、悪玉菌(腐敗菌)を減らし、粘液産生を増やして粘膜バリアを強化し、酪酸などの短鎖脂肪酸を増やすことが目標になります。
以下の製品は米国のPendulum社が販売しているアッカーマンシア・ムシニフィラのプロバイオティクスです。
1カプセルに、Akkermansia muciniphila(アッカーマンシア・ムシニフィラ)を1億個と、水溶性食物繊維のイヌリン435mgを含有します。1個(30カプセル入り)を8000円(税込)で処方しています。
使用(処方)に関するご質問などはメール(info@f-gtc.or.jp)か電話(03-5550-3552)でお問い合わせ下さい。

アッカーマンシア・ムシニフィラのプロバイオティクスは日本では医薬品でもサプリメントとしても承認されていません。当院では、米国でサプリメントとして販売されている製品を、薬監証明を取得して、厚労省の許可を得て輸入し、処方薬として治療目的で使用しています。
| « 839)デヒドロ... | 841) アッカー... » |



