がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
615)がんの酸化治療とフェロトーシス:アルテスネイトと高濃度ビタミンC点滴の相乗効果
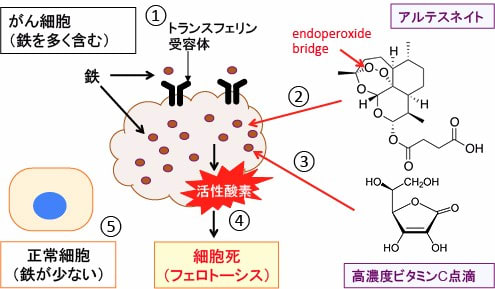
図:がん細胞はトランスフェリン受容体の発現が多く、細胞内に鉄を多く取り込んでいる(①)。抗マラリア薬のアルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し、これは鉄イオンやヘムと反応してフリーラジカルを発生する(②)。高濃度ビタミンC点滴はがん組織やがん細胞内において過酸化水素を発生し、過酸化水素は鉄イオンと反応すると酸化作用の強いヒドロキシル・ラジカルを発生する(③)。鉄イオンを介してがん細胞内で多量に発生した活性酸素は、細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、細胞死(フェロトーシス)を誘導する(④)。正常細胞は鉄の含有量が少ないのでアルテスネイトと高濃度ビタミンC点滴による酸化傷害を受けない(⑤)。その結果、この2つの治療法は相乗効果で、がん細胞に比較的特異的に細胞障害作用を発揮する。
615)がんの酸化治療とフェロトーシス:アルテスネイトと高濃度ビタミンC点滴の相乗効果
【正常細胞とがん細胞の違いががん治療のターゲットになる】
様々ながん治療法は、「がん細胞と正常細胞の違い」をターゲットにします。
例えば、がん細胞は正常細胞に比べて細胞増殖が亢進しているので、DNAの合成や複製の過程、細胞分裂のメカニズム(微小管の働きなど)、増殖シグナル伝達系を阻害すると、がん細胞の増殖を抑え、細胞死を誘導できます。
しかし、正常細胞でも、骨髄細胞や消化管粘膜上皮細胞や免疫組織(リンパ球)や毛根細胞も盛んに細胞分裂を行っているので、細胞増殖を阻害する抗がん剤は、骨髄抑制(白血球減少、血小板減少、貧血)や消化管障害(食欲低下、吐き気、嘔吐、便通障害など)や免疫力低下(リンパ球減少)や脱毛などの副作用が出てきます。
エネルギー代謝と物質合成においてもがん細胞は正常細胞とは異なる特徴を持っています。すなわち、がん細胞では解糖系と乳酸産生の亢進、ミトコンドリアの酸化的リン酸化の抑制という特徴があり、これを好気性解糖やワールブルグ効果と言います。乳酸産生亢進の結果、がん組織は酸性化しています。
がん組織の酸性化は、がん細胞の増殖や転移や血管新生を促進し、免疫細胞の働きを抑制し、抗がん剤が効きにくくなります。
したがって、解糖系の阻害、乳酸産生の抑制、ミトコンドリアの酸化的リン酸化の活性化、がん組織のアルカリ化は、がん細胞の増殖抑制と細胞死誘導に役立ちます。
さらに、がん細胞は細胞内の鉄の含有量が正常細胞に比べて極めて多いという特徴があります。
鉄を利用してがん細胞を死滅させる治療法が提唱されています。「がん細胞に多く含まれる鉄イオンを利用してがん細胞を死滅させる治療法」が「フェロトーシス(Ferroptosis)誘導によるがん治療」となります。
このような正常細胞とがん細胞の違いを数多くターゲットにすると、がん治療の有効性を高め、副作用を軽減できます。ここでは、鉄を利用したがん治療について解説します。
【がん細胞は鉄を多く取り込んでいる】
私たちの体内には、体重60kgで平均4g程度(2~6gくらい)の鉄が存在します。鉄は全て食事から体内に摂取しています。
鉄は酸素などの小さな分子と強く特異的に結合する性質があります。体内の鉄の60%くらいはヘモグロビンのヘムとして存在し、酸素を運搬する働きを担っています。

図:ヘモグロビンはα鎖とβ鎖と呼ばれる2種類のサブユニットから構成される四量体構造をしている。各サブユニットには1つのヘムが結合している。ヘム(Heme)は2価の鉄原子とポルフィリン(IX型プロトポルフィリン)から成る錯体で、赤血球中のヘモグロビンは、ヘムの鉄原子が酸素分子と結合することで酸素を運搬する。
鉄はイオンの価数が変化する遷移金属で、簡単に二価イオン(ferrous: Fe2+)と三価イオン(ferric : Fe3+)の両方の型を行き来するので、電子の移動を伴う生体反応に利用できます。
例えば、NADPHオキシダーゼ、キサンチンオキシダーゼ、リポキシゲナーゼ、チトクロームP450酵素など、活性酸素を産生させるような酵素の活性に必要です。
ATPを生産するミトコンドリアの電子伝達系のタンパク質など電子を輸送する様々なタンパク質にも使われています。ペルオキシソームで過酸化水素(H2O2)を分解するカタラーゼの活性にも鉄が必須です。
このように、鉄イオンは細胞の呼吸、核酸合成、増殖などに必須な補助因子として重要な役割を果たしています。したがって、がん細胞は鉄の需要が増え、鉄の取り込みが増えています。
血液中では鉄イオンはトランスフェリンに結合して細胞まで運ばれます。1つのトランスフェリンに2つの3価鉄(Fe3+)が結合します。 トランスフェリンは細胞膜にあるトランスフェリン受容体と結合し,エンドサイトーシスによって取り込まれ、リソソーム(エンドソーム)内で酸性の環境になると鉄イオンが解離し、2価の鉄(Fe2+)になって細胞内に取り込まれます。
フリーの2価鉄イオンは鉄の利用の主要な器官であるミトコンドリアへの供給に必要な細胞質鉄プール(酸化還元活性のある不安定鉄プール)として蓄積され、DNA合成、細胞周期の制御、ミトコンドリアでのATP産生などに必須の働きを担っています。
利用されない細胞質鉄プールのFe2+は、鉄を介した細胞の損傷を防ぐためフェリチンと結合して酸化還元反応を起こさない三価鉄(Fe3+)として貯蔵されるか、あるいは、フェロポーチンにより細胞外に排出されます。 フェリチンは体内で鉄を貯蔵するタンパク質で、鉄とアポフェリチンによって構成され、多くの鉄イオンの周りをミセルで覆うことによって鉄を貯蔵します。(下図)

図:鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる(①)。ほとんどの細胞の細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシス (Endocytosis)によって細胞内に取り込まれる(②)。エンドソーム(endosome)内の酸性の環境では、鉄イオンはトランスフェリンから離れ、STEAP3の還元酵素活性(ferrireductase activity)によって3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。鉄が離れたトランスフェリンとトランスフェリン受容体は細胞膜に戻り、再利用される(④)。 2価の鉄イオンは2価金属トランスポーター1(divalent metal transporter 1 :DMT1)を通ってエンドソームを出て細胞質に移行し、細胞内の様々な機能に使用される不安定鉄プール(the labile iron pool)に入る(⑤)。鉄イオンは、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など、細胞内の様々な目的で使用される(⑥)。余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に貯蔵される(⑦)。鉄イオンは鉄排出ポンプであるフェロポーチン(ferroportin)によって細胞外に排出される(⑧)。この際、セルロプラスミン(ceruloplasmin)やヘフェスチン(hephaestin)のような酸化酵素によって2価の鉄イオンは3価に酸化され、トランスフェリンによって体内を運搬される。 細胞質の2価鉄イオンは過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシラジカル(・OH)を発生させ、細胞傷害を引き起こす(⑨)。したがって、鉄による細胞傷害を避けるためには、細胞内での鉄イオンの利用や貯蔵や排出の調節が極めて重要となる。
増殖活性の高いがん細胞は、細胞膜のトランスフェリン受容体の発現量が増え、正常細胞に比べて鉄の取込みが増えています。さらに、細胞内の鉄イオンの調節に破綻をきたし、酸化還元活性のあるフリーの2価鉄(Fe2+)が過剰に存在する状況になっています。
【2価鉄イオン(Fe2+)はフリーラジカルを発生して細胞を傷害する】
鉄は様々な生体反応に必須の物質ですが、過剰になると活性酸素発生の触媒作用を発揮することによって細胞の酸化傷害を引き起こし、発がんのリスクを上げることが明らかになっています。
鉄の代謝異常で細胞内に鉄が多く蓄積する遺伝性疾患や、慢性炎症などでフリーの鉄イオンが増える状況では、細胞のがん化が促進することが明らかになっています。
さらに、人間では定期的に除鉄を行うとがん発生が抑制されることが明らかになっています。 1年に2回の定期的瀉血が内臓がんの発生を35%減少させるという論文が2008年に報告されています。(J Natl Cancer Inst. 2008 Jul 16;100(14):996-1002.)
つまり、献血のようにして定期的に瀉血して、体内の過剰な鉄を減らすことはがん予防に有効であることが示されています。
さらに、鉄による酸化傷害を防ぐことは細胞の老化の進行の抑制にも有効です。
2価のフリーの鉄は過酸化水素(H2O2)と反応してより有毒なヒドロキシルラジカルを生じ(フェントン反応)、DNA障害、脂質酸化、細胞死などを引き起こします。
鉄は電子の授受を容易に行いうることから種々の酵素の活性中心として働いており,地球上のほぼすべての生物にとってその生存に必須な元素です。
しかし一方で,二価鉄(Fe2+)が過剰に存在すると,その高い反応性ゆえにフリーラジカルの産生を促進し細胞に対する傷害性をもたらすということです。
つまり、鉄は「両刃の剣」であり、鉄は不足しても過剰でも生体に悪影響を及ぼすため、生体においては鉄の量がつねに適切な量になるよう厳密に調節される必要があるのです。

図:フェントン反応による過酸化水素(H2O2)からのヒドロキシラジカル(HO・)の産生(A)と脂質(ROOH)からの脂質ラジカル(RO・)の産生経路(B)。鉄イオンが関与する酵素は赤で示している。
慢性炎症組織やがん組織では、この鉄イオンの調節に破綻をきたし、フリーの2価鉄(Fe2+)が過剰に存在する状況になっています。
この過剰鉄がフリーラジカルや活性酸素の産生を惹起して細胞毒として働き、細胞の老化やがん化を促進すると考えられています。
したがって、慢性炎症やがんの予防や治療における戦略としては、鉄イオンを減らす方法が考えられます。この方法として、瀉血や鉄のキレート剤の使用があります。
このような方法で鉄を減らせば、慢性炎症やがんの発生や進行を抑えられると考えられています。
しかし一方、がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を死滅させる治療が検討されています。以下のような論文があります。
A Novel Tumor-Activated Prodrug Strategy Targeting Ferrous Iron Is Effective in Multiple Preclinical Cancer Models(2価鉄イオンをターゲットにした新規の腫瘍活性化プロドラッグ戦略は、複数の前臨床癌モデルにおいて有効である)J Med Chem. 2016 Dec 22; 59(24): 11161–11170.
プロドラッグ(Prodrug)というのは、それ自体には薬理活性は無く、体内あるいは目標部位に到達してから何らかの変換を受けた後に薬理活性をもつ化合物に変換され、効果を発揮(活性化)する化合物です。
がん細胞および腫瘍組織微小環境には2価鉄イオン(Fe2+)が大量に蓄積しているので、この2価鉄イオンと反応して活性型に変換するプロドラッグは、がん細胞への毒性を高め、正常細胞への毒性を減らすことができるという新規の治療法について考察しています。
【鉄が介在する細胞死をフェロトーシスという】
前述のように、2価の鉄イオン(Fe2+)は、細胞内の様々な機能に使用される不安定鉄プール(the labile iron pool)として存在しますが、このフリーの2価鉄は酸化還元活性があるので、過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシルラジカル(・OH)を発生させ、さらに脂質と反応して脂質ラジカルを発生させて強い細胞傷害を引き起こします。
正常細胞に比べてがん細胞は、不安定鉄プールにおける2価鉄イオンの量が極めて多いので、2価鉄イオンと反応してヒドロキシルラジカルや脂質ラジカルを発生させる化合物は、正常細胞にダメージ(酸化傷害)を与えず、がん細胞に特異的にダメージを与えることができます。
がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を死滅させる治療が検討されています。鉄が関与するフェロトーシス(ferroprosis)という細胞死の存在とメカニズムが明らかになってきたからです。
細胞死のメカニズムとして,アポトーシス,ネクローシス,オートファジーなどが知られています。
アポトーシス(Apoptosis)はミトコンドリアのチトクロームCやタンパク分解酵素のカスパーゼが関与する細胞死です。カスパーゼは、基質であるタンパク質をアスパラギン酸残基の後で切断するシステインプロテアーゼの総称です。アポトーシスの実行や炎症性サイトカインの活性化に関与するタンパク分解酵素です。
カスパーゼは初め不活性型の前駆体のプロ・カスパーゼ(pro-Caspase)として発現しますが、Fas などの細胞死受容体や各種の傷害刺激などに反応して速やかに切断され、活性型となります。
アポトーシスの過程においては、誘導型カスパーゼ(Initiator caspase)と実行型カスパーゼ(Executioner caspase/Effector caspase)に大別されます。
誘導型カスパーゼ(Caspase-2、8、9、10)は実行型カスパーゼ(Caspase-3、6、7)を切断・活性化することによりアポトーシスのシグナルをスタートさせます。実行型カスパーゼは、多くの細胞内タンパク質を分解し、アポトーシスの実行へと導きます(下図)。これらのカスパーゼの阻害剤はアポトーシスによる細胞死を阻止します。

図:細胞死受容体(Fas と TNFR)のリガンド(FasLとTNF)による活性化(外因性経路)は、カスパーゼ8 および カスパーゼ10を活性化する(①)。ダメージを受けたミトコンドリアから放出されるシトクローム c はカスパーゼ-9 を活性化する(内因性経路②)。これらのカスパーゼはイニシエーターカスパーゼ(Initiator caspase)と呼ばれ、下流のエクセキューショナーカスパーゼ(Executioner caspase)のpro-caspase3とpro-caspase 7を切断して活性化する(③)。活性化したカスパーゼ3とカスパーゼ7は細胞内タンパク質を消化してアポトーシスを実行する。
一方、脳梗塞や心筋梗塞の様な虚血や、火傷や毒物による細胞傷害では、壊死(ネクローシス)という細胞死を起こして、細胞が崩壊して炎症反応が引き起こされます。炎症反応を引き起こすことによって、生体に異常事態を知らせ、防御や修復を促進することができます。
オートファジー(autophagy)は細胞内の構成成分を分解するための細胞機能で、このオートファジーが関与するプログラム細胞死をオートファジー細胞死と呼んでいます。
このように細胞はいろんなメカニズムや方法で死滅します。細胞死のメカニズムはこの3つだけではありません。最近、フェロトーシス(Ferroptosis)という細胞死が提唱されています。フェロトーシスでは、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。
細胞内の鉄に依存する機構であり,ほかの金属類には依存しません。「フェロ(Ferro)」は「鉄」という意味です。
カスパーゼ阻害剤はアポトーシスの細胞死を阻止できますが、フェロトーシスは阻止できません。
鉄に結合して反応性を阻害するキレート剤や、フリーラジカルを消去する抗酸化剤(ビタミンEなど)はフェロトーシスを阻止しますが、アポトーシスは阻止できません。
つまり、フェロトーシスは鉄のキレート剤や抗酸化剤で阻止され、カスパーゼ阻害剤では阻止できない点でアポトーシスと区別される細胞死です。

図:鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる(①)。ほとんどの細胞の細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシスによって細胞内に取り込まれる(②)。エンドソーム内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。2価の鉄イオンはエンドソームを出て細胞質に移行し、細胞内の様々な機能に使用される不安定鉄プールに入り、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など、細胞内の様々な目的で使用される(④)。余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に3価の鉄イオン(Fe3+)として貯蔵される(⑤)。細胞質の2価鉄イオンはフェントン反応によって酸化作用の強いヒドロキシルラジカルや脂質ラジカルを発生させ、過酸化脂質の蓄積を引き起こし(⑥)、フェロトーシスによる細胞死を誘導する(⑦)。鉄のキレート剤や抗酸化剤はフェロトーシスを阻害する(⑧)。
【アルテミシニン誘導体は抗マラリア薬として開発された】
がん細胞にフェロトーシス(ferroptosis)を誘導する物質としてアルテミシニン誘導体が近年注目されています。アルテミシニンは青蒿(セイコウ)というキク科の薬草から見つかっています。
青蒿(Artemisia annua)は中国伝統医学でマラリアなど様々な感染症や炎症性性疾患の治療に古くから使用されていました。
抗マラリア作用の活性成分がアルテミシニン(Artemisinin)で、その効果を高めたアルテスネイト(Artesunate)とアルテメーター(Artemether)という2種類の誘導体が合成されています。これらは現在、マラリアの治療薬として世界中で使用されています。
青蒿からアルテミシニンを発見し、抗マラリア薬を開発した中国の女性科学者の屠呦呦(Tu Youyou)博士は、2015年のノーベル医学生理学賞を受賞しています。(459話参照)
マラリアは、熱帯・亜熱帯地域の70ヶ国以上に分布し、全世界で年間3~5億人、死者は100~150万人と言われる感染症ですので、その治療薬としてのアルテスネイトなどのアルテミシニン誘導体の開発は、ある本では「伝統薬から開発された医薬品としては、20世紀後半における最大の業績」という表現がなされているほど、医学において重要な成果だと言われています。

図:中国の女性科学者の屠呦呦(Tu Youyou)博士は、2011年のラスカー賞受賞に続いて、2015年度のノーベル医学生理学賞を受賞した。屠博士は、古くからマラリアの治療に利用されてきた青蒿(Artemisia annua)という薬草から活性成分としてアルテミシニン(Artemisinin)を発見した。アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)は、現在マラリアの治療薬として世界中で使用されている。さらに、抗がん作用があることから、がんの代替医療にも使用されている。
青蒿(セイコウ)という生薬は強力な解熱作用があり、中国医学でマラリアなど様々な感染症や炎症性性疾患の治療に古くから使用されていました。1972年に中国の湖南省長沙市の郊外で発掘された馬王堆漢墓は2100年以上前に作られた墓(古墳)ですが、その中から見つかった「五十二病方」という医書の中に、青蒿が記載されています。
青蒿はartemisia annuaという植物です。artemisiaとはヨモギのことで、青蒿はキク科ヨモギ属の植物です。 英語ではsweet Annieやwormwoodと呼ばれ、和名はクソニンジンとかカワラニンジンと呼ばれています。
ベトコンを援助するために中国軍がベトナム戦争に従軍しましたが、密林でマラリアに感染して病死する兵士が多く、そこで毛沢東の命令でマラリヤの治療薬の開発が国家プロジェクトとして1967年に開始されました。その指揮を取ったのが、当時37歳の屠博士でした。 屠博士は1970年代に、その薬効成分のアルテミシニン(Artemisinin)を分離し、アルテミシニンやその誘導体のアルテスネイト(Artesunate)やアルテメーター(Artemether)の抗マラリア薬としての有効性を確認しました。
近年、このアルテミシニン誘導体が抗がん物質として注目を集めています。
【アルテミシニンとその誘導体は正常細胞には毒性が少なく、がん細胞に抗がん作用を示す】
アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)はマラリア原虫を死滅させる作用があるので、マラリアの治療薬として使用されていますが、がん細胞を死滅させる作用も報告されており、がんの代替医療でも2000年ころから使用されています。私も開業した2002年から、マラリア治療として欧州で販売されていたアルテスネイトやアルテメーターの製剤を使用しています。
培養がん細胞を使った実験でアルテミシニンやアルテスネイトががん細胞を死滅させる作用や、がん細胞を移植した動物実験で、がんを縮小させる効果が報告されています。
さらに、抗腫瘍作用を示す投与量で、正常細胞に対する毒性が低く、副作用がほとんど無いという特徴を持っています。
アルテスネイトは昔からマラリアの治療に使われていた生薬の成分で、その安全性や副作用が軽度であることが確かめられています。
アルテスネイトなどのアルテミシニン誘導体は多彩な作用メカニズムで抗腫瘍効果を発揮することが報告されています。 がん細胞内でフリーラジカルを産生して酸化ストレスを高める作用、血管新生阻害作用、DNAトポイソメラーゼIIa阻害作用、細胞増殖や細胞死のシグナル伝達系に影響する作用などが報告されています。臨床試験での有効性も報告されています。
アルテスネイトは水溶性で、抗マラリア作用や抗がん作用はアルテミシン誘導体の中で最も高いと考えられています。毒性が極めて低いので、副作用がほとんど無いのが特徴です。しかし、体内での半減期が比較的短いという短所もあります。
アルテメーターは脂溶性で、アルテスネトより体内の半減期は長く、血液脳関門を容易に通過するので、脳マラリアや脳腫瘍にも効果があります。しかし、高用量を使用すると神経毒性が現れるという副作用があります。
アルテミシニンは、アルテスネイトとアルテメーターの2つの中間的な半減期をもち、血液脳関門も通過します。 米国では、これら3種類の成分を含有する製品がサプリメントとして販売されています。
【アルテスネイトはフェロトーシス(Ferroptosis)を誘導する】
アルテスネイトやアルテミシンやアルテメーターはセスキテルペン・ラクトンの一種で、分子の中にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持っています。
このエンドペルオキシド・ブリッジ(-C-O-O-C-)は鉄イオンと反応してフリーラジカルを発生します。がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています。つまり鉄介在性の細胞死です(下図)。
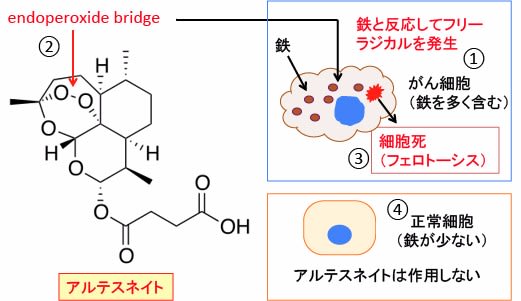
図:がん細胞は細胞内に鉄を多く含む(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持つ(②)。このエンドペルオキシド・ブリッジは細胞内の鉄と反応してフリーラジカルを産生し、フェロトーシスの機序で細胞死を誘導する(③)。一方、正常細胞は鉄の含有が少ないので、アルテスネイトによる細胞傷害を受けない(④)。
このアルテスネイトによる鉄介在性の細胞死は2000年頃から知られており、がん治療の目的でアルテスネイトを服用する数時間前に鉄剤を服用してがん細胞に鉄を多く取込ませておくと、抗腫瘍効果を増強できることが指摘されています。
以前は、「がん細胞に多く含まれる2価の鉄イオンとアルテスネイトが反応してフリーラジカルを産生してがん細胞を死滅させる」と簡単に理解されていましたが、2012年にフェロトーシスという鉄介在性の細胞死の存在が提唱され、そのメカニズムが明らかになってきて、アルテスネイトの抗がん作用に注目が集まってきています。つまり、フェロトーシス促進によるがん治療においてアルテスネイトの利用が検討されています。
【酸化的リン酸化を活性化するとアルテスネイトの抗がん作用が増強する】
アルテスネイトは、非常に低濃度で体内のマラリア原虫を死滅します。マラリア原虫は赤血球内に感染します。マラリア原虫が感染した赤血球中では、マラリア原虫によって赤血球中のヘモグロビンが分解してフリーの鉄が蓄積し、その鉄とアルテスネイトが反応してフリーラジカルが発生してマラリア原虫を死滅させると考えられています。つまり、赤血球中のマラリア原虫の周りにはフリーの鉄やヘムが多く存在するので、アルテスネイトの効果が出やすいのです。
がん細胞内の鉄やヘムの濃度は、マラリア原虫が感染した赤血球ほど高くはありません。したがって、マラリアの治療に比べて、がん細胞に対するアルテスネイトの効果はあまり強くありません。
しかし、アルテスネイトの抗腫瘍効果を高める方法が幾つか報告されていますので、それらを組み合せれば、強い抗がん作用が期待できます。以下のような報告があります。
The Role of Heme and the Mitochondrion in the Chemical and Molecular Mechanisms of Mammalian Cell Death Induced by the Artemisinin Antimalarials(アルテミシニン抗マラリア薬による哺乳類細胞死の化学的および分子的メカニズムにおけるヘムおよびミトコンドリアの役割)J Biol Chem. 2011 Jan 14; 286(2): 987–996.
この研究ではヒトがん細胞株のHeLa細胞と、HeLa細胞のミトコンドリアDNAを欠損させた細胞(HeLa ρ0)の2種類のがん細胞株を用いてアルテスネイトの抗腫瘍活性を比較しています。
ミトコンドリアは固有のDNA(ミトコンドリアDNA)を持ち、このミトコンドリアDNAには呼吸酵素複合体IからVを構成する85種類のサブユニットのうち13種類のたんぱく質を作成する遺伝子が存在します。
従って、ミトコンドリアDNAを欠失させるとミトコンドリアでの酸化的リン酸化によるATP産生が起こらなくなります。
ミトコンドリアDNAが欠損しても、酸化的リン酸化以外のミトコンドリアの機能は維持できます。がん細胞はミトコンドリアでの酸素を使ったATP産生を行わなくても、解糖系でATPを賄うことができるので、酸化的リン酸化が障害されても生存はできます。
アルテスネイト存在下で48時間培養した場合の50%細胞致死量はHeLa細胞が6 ± 3 μMで、ミトコンドリアDNAを欠損したHeLa ρ0細胞では34 ± 5 μMでした。
つまり、ミトコンドリアでの酸化的リン酸化が低下しているとアルテスネイトの殺細胞作用が減弱するという結果です。
また、アルテスネイトの殺細胞作用は、細胞のヘムの合成を亢進すると増強し、ヘムの合成を阻害すると減弱することを示しています。つまり、アルテスネイトの殺細胞作用の活性化にはヘムの存在が重要であることを示しています。
ヘムの合成を亢進するとアルテスネイトの抗腫瘍活性が亢進することに関しては以下のような報告があります。
Mechanistic Investigation of the Specific Anticancer Property of Artemisinin and Its Combination with Aminolevulinic Acid for Enhanced Anticolorectal Cancer Activity.(アルテミシニンの特異的抗がん特性とアミノレブリン酸との併用による抗結腸がん活性の増強に関するメカニズムの検討。)ACS Cent Sci. 2017 Jul 26;3(7):743-750.
アルテミシニンの殺細胞作用が正常細胞に比べてがん細胞に強く発現するのは、がん細胞ではヘムの合成が亢進していることを指摘しています。
そこで、ヘム合成の前駆物質のアミノレブリン酸(aminolevulinic acid)を添加してがん細胞のヘム合成を亢進するとアルテミシンの抗腫瘍活性が亢進することを示しています。
マウスの移植腫瘍を用いた実験でも、アルテミシン単独よりもアルテミシン+アミノレブリン酸の併用の方が高くなることを示しています。つまり、アルテミシンとアミノレブリン酸の併用によるがん治療の可能性を示唆しています。
5-アミノレブリン酸(5-aminolevulinic acid、5-ALA)は、ポルフィリン合成経路の最初の生成物です。動物においてはグリシンおよびスクシニルCoAからアミノレブリン酸合成酵素の作用で合成されます。5-アミノレブリン酸は最終的にプロトポルフィリンIXとなり、鉄イオンを配位することで、血液中のヘモグロビンや薬物代謝酵素であるP450を構成するヘムとなります。5-ALAはサプリメントとして一般に市販されています。
【高濃度ビタミンC点滴はアルテスネイトの抗腫瘍効果を増強する】
フェロトーシスは細胞内の鉄に依存して活性酸素種が発生し、酸化ストレスが亢進して細胞死を引き起こします。したがって、がん細胞に酸化ストレスを高める治療はアルテスネイトの抗がん作用を増強する可能性があります。
高濃度ビタミンC点滴はがん細胞内の活性酸素の産生を高め、グルタチオンの量を減らす効果によってアルテスネイトの抗腫瘍効果(フェロトーシス誘導)を高めます。
高濃度ビタミンC点滴は、1回に25〜100グラムという大量のビタミンCを1〜3時間かけて点滴する治療法です。がん細胞に取込まれたビタミンCが過酸化水素を発生することでDNAやミトコンドリアにダメージを与え、解糖系を阻害してATP産生を阻害することによって抗がん作用を発揮します。
ビタミンCはグルコースと構造が似ており、同じ糖輸送担体(グルコーストランスポーター)によって細胞内に取込まれます。がん細胞はグルコーストランスポーターの発現量が増え、グルコースの取込みが亢進しているので、大量のビタミンCががん細胞に取込まれ、がん細胞が選択的に死滅させることができます。
提唱されている作用機序として、ビタミンCによって発生した過酸化水素がDNAにダメージを与えると、ポリADPリボース合成酵素(PARP)が活性化されNADが枯渇し、解糖系もTCA回路も進まなくなります。活性酸素はミトコンドリアにもダメージを与えます。これらの作用で、エネルギーが枯渇して細胞が死滅することになります。この作用機序を下図にまとめています。

図:ビタミンCはグルコーストランスポーターから細胞内に取込まれる。がん細胞はグルコーストランスポーターの発現量が増えているので、がん細胞に高濃度のビタミンCが取込まれる。取込まれたビタミンCはがん細胞内で過酸化水素(H2O2)を発生させて、DNAとミトコンドリアにダメージを与える。DNAのダメージはポリADPリボース合成酵素(PARP)の活性を亢進してNAD+(ニコチンアミドアデニンジヌクレオチド)が減少すると解糖系が阻害される。ミトコンドリアのダメージは酸化的リン酸化でのATP産生を減少させる。この結果、がん細胞内のATPが枯渇してがん細胞は死滅する。
その他に、高濃度ビタミンCが解糖系酵素のグリセルアルデヒド3リン酸脱水素酵素(GAPDH)を酸化傷害で活性を阻害する作用機序がサイエンス(Science)に報告されています。
Vitamin C selectively kills KRAS and BRAF mutant colorectal cancer cells by targeting GAPDH(ビタミンCはグリセルアルデヒド3リン酸脱水素酵素を阻害する機序で、がん遺伝子のKRASとBRAFが変異した結腸直腸がん細胞を死滅させる)Science. 2015 Dec 11; 350(6266): 1391–1396.
【要旨】
ヒトの結腸直腸がんの半分以上において、がん遺伝子のKRASかBRAFの変異が見つかっており、このような変異を持つ結腸直腸がんは抗がん剤治療に抵抗性を示すことが多い。
この論文では、高濃度のビタミンCで処置すると、KRASあるいはBRAFの変異を持つ結腸直腸がんの培養細胞が選択的に死滅することを示す。
この作用は、GLUT1グルコーストランスポーターを介して、ビタミンCの酸化型のデヒドロアスコルビン酸(dehydroascorbate)の取込みが増えるためである。
細胞内のデヒドロアスコルビン酸はビタミンCに還元される過程でグルタチオンを消費して枯渇させるので、デヒドロアスコルビン酸の細胞内取り込み亢進は酸化ストレスを亢進させる。
このようにして活性酸素種が細胞内に蓄積し、グリセルアルデヒド3リン酸脱水素酵素(GAPDH)を不活性化する。
KRASあるいはBRAFの変異したがん細胞は解糖系への依存が高いので、解糖系酵素であるGAPDHの阻害はエネルギーの破綻をきたして死滅する。KRASとBRAFが正常ながん細胞では、GAPDHの阻害で細胞死は起こらない。
動物を使ったin vivoの実験では、高用量のビタミンCはApc/KrasG12Dが変異したマウスの小腸腫瘍の増殖を抑制した。
人間の腫瘍においても同様な結果になるかは不明であるが、KRASあるいはBRAFの変異がある結腸直腸がんの治療にビタミンCの効果を検討する根拠を今回の実験結果は提供している。
KRASとBRAFはがん遺伝子で、これらの遺伝子が変異してがん遺伝子として活性化しているがん細胞が、抗がん剤治療などに抵抗性で予後が不良であることが知られています。
このような変異がある結腸直腸がんは、グルコースの取込みが亢進し、グルコーストランスポーターのGLUT1の発現が多く、解糖系に依存度が高い特徴を持っています。
食事中のビタミンCはナトリウム依存性ビタミンCコトランスポーター(sodium vitamin C cotransporters;SVCTs)か促進性グルコース輸送体(acilitative glucose transporters;GLUTs)を介して細胞膜を通過します。
SVCTはビタミンCをそのまま通過させますが、GLUT(主にGLUT1とGLUT3)はビタミンCの酸化型のデヒドロアスコルビン酸を通過させます。
デヒドロアスコルビン酸は細胞内でグルタチオンやチオレドキシンやNADPHを使ってビタミンCに還元されます。したがって、デヒドロアスコルビン酸を多く取り込んだがん細胞は酸化ストレスが亢進することになります。

図:アスコルビン酸はナトリウム依存性ビタミンCコトランスポーター(sodium vitamin C cotransporters;SVCT)を通って細胞内に入り、酸化型のデヒドロアスコルビン酸はグルコース輸送体(glucose transporters;GLUT)を通って細胞膜を通過する。細胞内でデヒドロアスコルビン酸はグルタチオン依存性のデヒドロアスコルビン酸還元酵素で還元されてアスコルビン酸に変換される。この過程でグルタチオンを消耗するので、酸化ストレスが亢進する。
この論文では、高濃度ビタミンC点滴で細胞内に発生した活性酸素は、解糖系酵素のグリセルアルデヒド3リン酸脱水素酵素(GAPDH)の活性部位のシステイン(C152)を酸化して不活性化することを報告することを報告しています。

図:高濃度ビタミンC点滴で細胞内に発生した活性酸素は、解糖系酵素のグリセルアルデヒド3リン酸脱水素酵素(GAPDH)の活性部位の152番目のシステイン(C152)を酸化して不活性化する。
つまり、高濃度ビタミンC点滴は、がん細胞内の活性酸素の発生を高め、グルタチオンなどの抗酸化システムを低下させ、GAPDHを酸化して不活性化して解糖系を阻害するというメカニズムです。
さらに、DNAの酸化傷害が起こるとポリADPリボース合成酵素(PARP)が活性化されNADが枯渇し、解糖系もTCA回路も進まなくなります。
正常細胞はGLUTの発現が少ないのでビタミンCの取込みが少なく、過酸化水素を消去するカタラーゼの活性が高いので、高濃度ビタミンC点滴による細胞傷害は起こりにくいと考えられています。
人間に投与した場合でも、このメカニズムが働くのかは不明ですが、超一流のサイエンス(Science)に掲載されているので、信憑性があるメカニズムかもしれません。
いずれにしても、高濃度ビタミンC点滴はがん細胞内の酸化ストレスを高めるメカニズムでがん細胞を死滅させる治療法です。高濃度ビタミンC点滴で治療中に抗酸化性のサプリメントを摂取している人がいますが、これは高濃度ビタミンC点滴の抗腫瘍効果を弱めます。
がん細胞の酸化ストレスを高めるメトホルミン、ジスルフィラム、オーラノフィン、ジクロロ酢酸ナトリウム、半枝蓮、アルテスネイトなどを併用すれば高濃度ビタミンC点滴の抗腫瘍効果を高めることができます。
つまり、アルテスネイトや高濃度ビタミンC点滴やジクロロ酢酸ナトリウムなどは、それぞれ単独では抗腫瘍効果が弱いのですが、これらを組み合せれば、がん細胞内の酸化ストレスを高め、フェロトーシスの機序でがん細胞を死滅できます。
| « 614)好中球対... | 616)骨髄由来... » |



