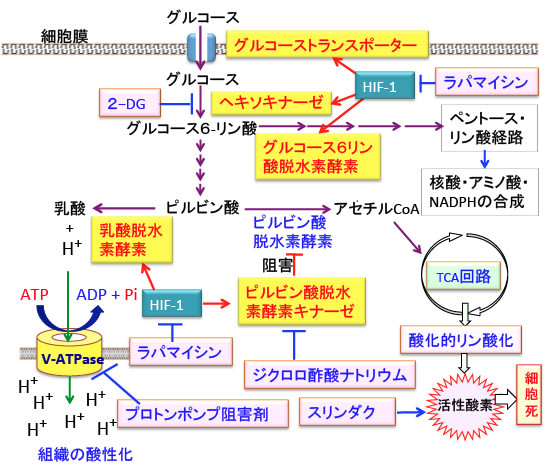
図:ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素を活性化し、ミトコンドリアでの代謝を亢進する。非ステロイド性抗炎症剤のスリンダクはがん細胞の酸化ストレスを高める作用があり、胃酸分泌阻害剤のプロトンポンプ阻害剤はV-ATPase(V型ATPアーゼ)を阻害してがん組織の酸性化を抑制する。低酸素誘導因子-1(HIF-1)は解糖系とペントースリン酸経路を亢進し、ミトコンドリアでの酸化的リン酸化を抑制する。HIF-1はmTORC1阻害剤のラパマイシンやラパマイシン誘導体で阻害できる。2-デオキシグルコース(2-DG)で解糖系とペントースリン酸経路を抑制するとがん細胞の抗酸化力は低下してジクロロ酢酸ナトリウムやスリンダクによる酸化ストレス亢進によって死にやすくなる。
366)ジクロロ酢酸ナトリウム+スリンダク+オメプラゾール+α
【がん細胞ではピルビン酸脱水素酵素キナーゼの活性が亢進している】
低酸素誘導因子-1(Hypoxia-inducible Factor-1:HIF-1)については364話の『低酸素誘導因子-1(HIF-1)をターゲットにしたがん治療』で解説しています。
正常細胞ではHIF-1は低酸素になったときしか活性化されませんが、がん細胞では増殖シグナルの異常などによってHIF-1は恒常的に活性化し、酸素がある状況でも酸素が無い状態と同じ代謝を行うため、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化が抑制されています。
がん細胞で活性化されている低酸素誘導因子-1(HIF-1)は、がん細胞における乳酸脱水素酵素の産生を高めます。また、HIF-1は、ピルビン酸脱水素酵素の活性を阻害するピルビン酸脱水素酵素キナーゼの遺伝子発現を促進します。
したがって、がん細胞では、HIF-1の発現亢進によって、TCA回路へいく経路が遮断され、嫌気性解糖系の亢進によって乳酸が大量に産生される代謝が亢進しています(下図)。
図:がん細胞では低酸素誘導因子-1(HIF-1)の活性亢進によって解糖系酵素や乳酸脱水素酵素が亢進している。HIF-1はピルビン酸脱水素酵素キナーゼの発現を誘導する。このキナーゼはピルビン酸脱水素酵素を阻害する。したがって、HIF-1の活性亢進によってミトコンドリアでの酸化的リン酸化が抑制される。つまり、がん細胞のおける解糖系亢進とミトコンドリアでの酸化的リン酸化の抑制はHIF-1の活性亢進によってもたらされている。
【ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する】
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があり、ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに医薬品として古くから使用されています。
がん細胞においてジクロロ酢酸ナトリウムでピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAへの変換を促進してTCA回路での代謝を亢進すれば、酸化的リン酸化の過程で活性酸素の産生が増え、酸化ストレスの増大によってがん細胞を死滅できる可能性があります(下図)。
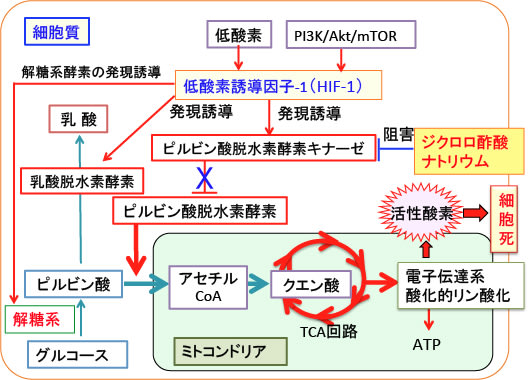
図:ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高め、ピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増えてがん細胞が死滅する。
ミトコンドリアでの活性酸素の産生量を増やしたくらいでがん細胞が本当に死滅するのかという疑問が出るかもしれませんが、ミトコンドリアは細胞の重量の10%を占めるくらい大量に存在するので、ミトコンドリアで一斉に酸化的リン酸化が亢進すれば細胞を死滅させることもできると考えられています。
培養がん細胞や動物移植腫瘍を用いた実験でジクロロ酢酸ナトリウムの抗腫瘍作用は証明されています。
このとき、がん細胞の抗酸化システムを阻害するとさらに抗腫瘍効果を高めることができます。(
346話、
352話、
360話参照)
ジクロロ酢酸ナトリウムでがん細胞におけるミトコンドリア内での酸化的リン酸化を活性化すると、がん細胞のアポトーシスが起こりやすくなり、がん細胞の抗がん剤感受性が高まります。実際に、動物実験にて、様々な抗がん剤治療との相乗効果が報告されています。
人間の場合、1日体重1kg当たり10~15mgを水に溶解して服用します。TCA回路が亢進するとビタミンB1を消耗するのでビタミンB1の補充が副作用予防に必要です。
臨床試験でも有効性が認められており、がんの代替医療では利用する患者さんが増えています。
【ジクロロ酢酸ナトリウムはHIF-1の活性を抑制する】
ジクロロ酢酸ナトリウムはHIF-1で誘導されるピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換)の活性を高め、ミトコンドリアでのエネルギー産生を亢進して酸化ストレスを高める作用でがん治療に使用されています。
ジクロロ酢酸ナトリウムでミトコンドリアを活性化するとがん細胞のHIF-1αシグナル系と血管新生が阻害されることを報告した論文については
364話で解説しています。
論文のタイトルは「Mitochondrial activation by inhibition of PDKII suppresses HIF1a signaling and angiogenesis in cancer.(ピルビン酸脱水素酵素キナーゼIIの阻害によるミトコンドリアの活性化はがんにおけるHIF1αシグナル系と血管新生を阻害する)」で、Oncogene 32(13): 1638-50, 2013年に掲載されています。
非常に重要な知見なので、再度、この論文の要旨を以下に記載しておきます。
【論文要旨】
多くの固形がんにおいて、グルコース代謝はミトコンドリアでの酸化的リン酸化が抑制され、解糖系が亢進しているという特徴がある。ミトコンドリアの活性の低下はアポトーシス抵抗性とも関連している。
ミトコンドリアの活性抑制は低酸素誘導因子-1αと血管新生の活性化にも関与している。
培養がん細胞や移植腫瘍を使った実験で、ピルビン酸脱水素酵素キナーゼの阻害剤のジクロロ酢酸ナトリウムが、がん細胞のミトコンドリアでの酸化的リン酸化を活性化し、がん細胞にアポトーシスを誘導することを報告している。
がん細胞では低酸素状態でなくてもHIF-1αが活性化して血管新生を促進しており、この「偽(にせ)の低酸素状態」のシグナルをジクロロ酢酸ナトリウムによって是正できるのではないかという仮説のもとに実験を行った。
HIF1αルシフェラーゼリポーターアッセイ法(HIF1α luciferase reporter assays)を含む幾つかの実験法を使って、がん細胞においてピルビン酸脱水素酵素キナーゼIIを阻害するとHIF1αが阻害されることを示した。
プロリル・ヒドロキシラーゼによるHIF1αの活性阻害(プロリル・ヒドロキシラーゼはHIF1αを水酸化して分解を促進する)を薬物や分子生物学的手法で抑制する実験系を用いて実験した結果、ジクロロ酢酸ナトリウムは、プロリル・ヒドロキシラーゼ依存性のメカニズム(ジクロロ酢酸ナトリウムによってTCA回路でのα-ケトグルタル酸の産生が関与)と、プロリル・ヒドロキシラーゼ非依存性のメカニズム(ミトコンドリア由来の過酸化水素H2O2を介したがん抑制遺伝子p53の活性化とGSK3βの活性化が関与)の両方によってジクロロ酢酸ナトリウムはHIF1αの活性を阻害することを明らかにした。
ジクロロ酢酸ナトリウムによるHIF1αの阻害は、HIF1αで誘導されるいくつかの遺伝子発現の抑制とマトリゲルアッセイ法によるin vitroでの血管新生阻害作用によって示された。
最も重要なことは、ラットに非小細胞性肺がんと乳がん細胞を移植した動物実験モデルにおいて、ジクロロ酢酸ナトリウムが腫瘍血管の新生と腫瘍内の血流を阻害することを、コントラスト増強超音波検査(contrast-enhanced ultrasonography)や画像診断や病理検査で示したことである。
この研究は、ピルビン酸脱水素酵素の活性を亢進してミトコンドリアの代謝を高める方法は、最近報告されているがん細胞のアポトーシス誘導と増殖抑制作用に加えて、固形がんにおける正常酸素濃度下でのHIF1αの活性化を誘導している「偽(にせ)の低酸素シグナル」を是正することによって血管新生を抑制できることを示している。
この論文の内容を簡単にまとめると以下のようになります。
1)低酸素誘導因子-1α(HIF-1α)はプロリル・ヒドロキシラーゼによって水酸化され、分解が促進される。プロリル・ヒドロキシラーゼによるHIF-1αの水酸化には酸素(O2)とTCA回路で産生されるα-ケトグルタル酸が必要。したがって、ジクロロ酢酸ナトリウムでピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへ変換)を活性化してミトコンドリアでのTCA回路を活性化することはプロリル・ヒドロキシラーゼの活性を高めてHIF-1αの分解を促進するので、その結果HIF-1の活性は低下する。
2)ジクロロ酢酸ナトリウムでミトコンドリアでの代謝が亢進すると活性酸素の産生が増え、がん抑制遺伝子のp53の活性化などによってHIF-1の活性が抑制される。
3)ジクロロ酢酸ナトリウムががん組織のHIF-1の活性を抑制し、血管新生や腫瘍の血流を低下させることががんを移植した動物実験で証明された。
4)ジクロロ酢酸ナトリウムでミトコンドリアにおけるグルコース代謝を活性化する治療法はHIF-1の活性抑制を介した抗腫瘍効果が期待できる。
つまり、ジクロロ酢酸ナトリウムの投与は、がん細胞のHIF-1の活性抑制にも効果が期待できるということです。
【ジクロロ酢酸ナトリウム+スリンダクはがん細胞の酸化ストレスを高めてがん細胞を死滅させる】
非ステロイド性抗炎症剤の
スリンダクががん細胞の酸化ストレスを高めて抗がん剤治療が放射線治療の効き目を高める作用があることは前回(
365話)解説しています。
そして、がん細胞の酸化ストレスを高めるジクロロ酢酸ナトリウムとスリンダクを併用すると、酸化傷害によってがん細胞を死滅させる効果が増強することが報告されています。
つまり、ジクロロ酢酸ナトリウムとスリンダクの併用は相乗的に作用してがん細胞を死滅させる効果があるということです。
【ジクロロ酢酸ナトリウムとプロトンポンプ阻害剤は相乗効果がある】
胃酸分泌阻害剤のプロトンポンプ阻害剤が抗がん剤や免疫療法の効き目を高めることは
359話で解説しています。
がん組織の酸性化は血管新生やがん細胞の浸潤・転移や免疫細胞の活性抑制などに関与しています。
胃酸分泌を抑制するプロトンポンプ阻害剤は、がん細胞における水素イオンの細胞外への排出に関与しているV型ATPアーゼ(vacuolar ATPase, V-ATPase)を阻害することによってがん組織の酸性化を抑制し、がん細胞の浸潤や転移を抑制し、抗がん剤や免疫療法が効きやすくする効果が報告されています。さらに、がん細胞内の酸性化が亢進すると、がん細胞を死滅できる可能性も報告されています(下図)。
図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸が蓄積する。乳酸がイオン化して水素イオン(プロトン、H+)の量が増えるので細胞内のpHは低下する(酸性になる)。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やMonocarboxylate transporter(MCT)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。その結果がん細胞の周囲はpHが低下してがん組織は酸性化している。組織が酸性化すると、細胞傷害性T細胞のようながん細胞を攻撃する免疫細胞の働きが阻害される。塩基性の抗がん剤は酸性の組織に到達しにくくなり抗がん剤が効かなくなる。さらに、周囲の正常細胞がダメージを受け、タンパク分解酵素が活性化してがん細胞の浸潤や転移が促進される。腫瘍を養う血管の新生も誘導される。胃酸分泌阻害剤として使われているプロトンポンプ阻害剤はV-ATPaseを阻害することによって、がん組織の酸性化を抑制し、がん細胞の浸潤や転移を抑制し、抗がん剤や免疫療法が効きやすくする効果が報告されている。さらに、がん細胞内の酸性化が亢進すると、がん細胞を死滅できる可能性も報告されている。
その後もがん治療におけるプロトンポンプ阻害剤併用の有用性を示す論文が報告されています。人間での有効性も報告されています。以下のような論文があります。
Proton pump inhibitor chemosensitization in human osteosarcoma: from the bench to the patients' bed.(ヒト線維肉腫におけるプロトンポンプ阻害剤による抗がん剤感受性の亢進;実験台の結果から臨床へ)
J Transl Med. 2013 Oct 24;11(1):268. [Epub ahead of print]
【要旨】
研究の背景:がんの基礎研究を臨床応用に反映させる上で最も大きな目標は、現行の抗がん剤治療の全身的な毒性を減らし、抗腫瘍効果を高めることである。
多くのがん組織において認められる微小環境の酸性化は、がん細胞が抗がん剤の効き目を減弱させるメカニズムとしては非常に有効な方法である。
それは、水素イオン(プロトン:H+)が多い環境に抗がん剤が到達すると、その抗がん剤はプロトン付加(protonation)と中性化によってがん細胞内に入り込みにくくなるからである。
この腫瘍組織の性状をプロトンポンプ阻害剤が変えることによってがん細胞の抗がん剤感受性が高まることを、我々は以前の研究で示している。この研究では、プロトンポンプ阻害剤が骨肉腫に対する抗がん剤感受性を高める効果があるかどうかを検討した。
方法: MG-63 と Saos-2 の2種類のヒト骨肉腫細胞の細胞株を用いて実験を行った。
マウスに肉腫細胞を移植する実験系でプロトンポンプ阻害剤で前処理したあとにシスプラチンを投与し、細胞増殖に対する作用を評価した。
臨床において、メソトレキセートとシスプラチンとアドリアマイシンによる補助化学療法においてプロトンポンプ阻害剤の前投与による効果を検討する多施設臨床試験を実施した。
結果:培養細胞を使った実験と移植腫瘍を用いた実験で2種類のヒト骨肉腫細胞株のどちらに対しても、プロトンポンプ阻害剤はシスプラチンに対する抗がん剤感受性を高めた。
プロトンポンプ阻害剤のエソメプラゾール(esomeprazole)を前投与する臨床試験では、
がん組織の壊死した組織の割合から評価した抗がん剤治療による抗腫瘍効果をエソメプラゾールは増強した。
この作用は、治療が困難な骨肉腫の組織型である軟骨芽細胞骨肉腫(chondroblastic osteosarcoma)において特に顕著に認められた。
プロトンポンプ阻害剤投与によって副作用が増強することはなかった。
結論:標準的な抗がん剤治療にプロトンポンプ阻害剤を併用することが有効であることの証拠を本研究は示している。
プロトンポンプ阻害剤ががん細胞の抗がん剤感受性を高めることは今までに多くの報告があります。
がん細胞では解糖系が亢進し、乳酸の産生が亢進し、組織が酸性化しているのが特徴です。この組織の酸性化は免疫細胞の働きを弱めたり、結合組織を分解する酵素の活性を高めてがん細胞の浸潤や転移を促進したり、血管新生を促進する作用などがあります。さらに抗がん剤ががん細胞内に入りにくくなったり活性が低下する作用もあります。
したがって、がん組織の酸性化を阻止すると抗がん剤が効きやすくなることが多くの実験で示されています。
そして、この論文では、人間での臨床試験の結果で、プロトンポンプ阻害剤が抗がん剤治療の効果を高めることを報告しています。
この臨床試験では手術可能な骨肉腫の患者を対象にして、プロトンポンプ阻害剤のエソメプラゾール(esomeprazole)を術前補助化学療法(メソトレキセート+シスプラチン+アドリアマイシン)の投与を受ける前の2日間の内服を受けています。
そして手術後の腫瘍組織の病理検査で、抗がん剤治療によってがん組織が壊死した程度を、過去のデータと比較しています。
その結果、抗がん剤治療が良く効いた症例(good responder:壊死した腫瘍部分が90%以上)の割合は抗がん剤治療単独では47%に対して、抗がん剤にプロトンポンプ阻害剤を併用した場合は57%に増加するという結果が得られています。治療に抵抗性の軟骨芽骨肉腫(chondroblastic osteosarcoma)の場合は、抗がん剤単独ではgood responderは25%に対してプロトンポンプ阻害剤を併用すると61%になるという結果が得られています。そして、副作用の程度は両群で差は認められていません。
プロトンポンプ阻害剤を服用してがん組織のpHをアルカリ側にすることはがん治療にプラスになると言えそうです。
次のような論文もあります。
Lansoprazole as a rescue agent in chemoresistant tumors: a phase I/II study in companion animals with spontaneously occurring tumors
(抗がん剤抵抗性腫瘍の救援成分としてのランソプラゾール:自然発症腫瘍をもつペット動物における第I/II相試験)J Transl Med. 2011; 9: 221.
ランソプラゾールはタケプロンという商品名の胃酸分泌阻害剤。
抗がん剤単独(犬10匹+猫7匹)と 抗がん剤+Lansoprazole((犬27匹+猫7匹)で検討し、抗がん剤単独群では17%に短期間の部分奏功を認めたが、その他は全て2ヶ月以内に死亡した。Lansoprazoleを併用した群では部分奏功+完全奏功が67.6%。奏功しなかった動物でもQOLの改善を認めた。
ジクロロ酢酸ナトリウムでピルビン酸からアセチルCoAへの変換を促進すると乳酸の産生が抑制されます。プロトンポンプ阻害剤とジクロロ酢酸ナトリウムの併用は、がん組織の酸性化を抑制する効果を高めることになります。
ジクロロ酢酸ナトリウムとプロトンポンプ阻害剤(オメプラゾール)の併用で相乗効果が期待できることが報告されています。以下のような論文があります。
Cotreatment with dichloroacetate and omeprazole exhibits a synergistic antiproliferative effect on malignant tumors. (ジクロロ酢酸とオメプラゾールの併用投与は悪性腫瘍に対して相乗的な増殖抑制効果を示す)Oncol Lett. 3(3): 726–728.2012年
線維肉腫細胞を移植したヌードマウスの実験で、ジクロロ酢酸ナトリウム50mg/kg+オメプラゾール2mg/kgの併用で著明な腫瘍の縮小が認められています。
それぞれ単独では腫瘍の縮小は認めなかったが併用すると著明な縮小効果が認められたという結果です。正常な線維芽細胞に対しては増殖抑制効果は認めなかったと報告されています。
ジクロロ酢酸ナトリウムの投与でがん組織の酸性化が緩和されると免疫細胞の働きが良くなって抗腫瘍免疫による抗がん作用が強化されることが報告されています。がん組織の酸性化が免疫細胞の働きを抑制するからです。
したがって、
ジクロロ酢酸ナトリウムとプロトンポンプ阻害剤の併用は抗腫瘍免疫の活性化にも効果が期待できます。(
359話参照)
ジクロロ酢酸ナトリウム単独での治療では抗腫瘍効果に限界があります。
そこで、いろんな組合せが試されています。
標準治療としては、種々の抗がん剤との併用で抗腫瘍効果を高める作用が報告されています。
代替医療としては、ジクロロ酢酸ナトリウムに非ステロイド性抗炎症剤のスリンダク、プロトンポンプ阻害剤(オメプラゾールなど)、がん細胞の抗酸化力を弱める2-デオキシグルコースなどの組合せは、理論的には抗腫瘍効果の増強が期待できるかもしれません。
いずれにしても、ジクロロ酢酸ナトリウムによるピルビン酸脱水素酵素キナーゼの阻害(=ピルビン酸脱水素酵素の活性化)と低酸素誘導因子-1(HIF-1)の活性抑制による「ミトコンドリアの酸化的リン酸化の亢進(=酸化ストレスの亢進)」と「がん組織の酸性化の抑制」は抗がん剤治療や免疫療法やその他の代替医療の抗腫瘍効果を高める方法として有用だと言えます。


画像をクリックするとサイトに移行します。
著書紹介:

詳しくはこちらへ: