がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
730)膠芽腫(グリオブラストーマ)の代替療法(その2):Wnt/βカテニン・シグナル伝達経路の阻害
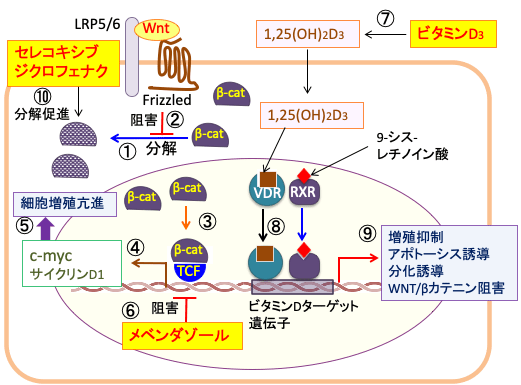
図:細胞質内でβ-カテニン(β-Cat)はリン酸化されてユビチキン化され、プロテアソームで絶えず分解されている(①)。Wntが受容体Frizzledとその共役受容体のLRP5/6に結合してWntシグナルが活性化されるとβ-カテニンの分解が阻止される(②)。その結果、細胞質と核内のβ-カテニンの量が増える(③)。β-カテニンは転写因子のTCF(T-cell factor)の活性を高めて、c-mycやサイクリンD1などのターゲット遺伝子の発現を促進し(④)、細胞の増殖を亢進する(⑤)。駆虫薬のメベンダゾールはTCFを活性化するキナーゼのTNIK (Traf2- and Nck-interacting kinase)を阻害してTCFの転写活性を阻害する(⑥)。食品やサプリメントから摂取したビタミンD3は肝臓や腎臓で代謝されて活性型ビタミンD3の1,25ジヒドロキシ・ビタミンD3(1,25(OH)2D3)になる(⑦)。1,25(OH)2D3がビタミンD受容体に結合すると、9-シスレチノイン酸が結合したレチノイドX受容体(RXR)とヘテロダイマーを形成してビタミンD応答配列に結合して、ビタミンDターゲット遺伝子の発現を亢進する(⑧)。発現が誘導される遺伝子は細胞増殖を抑制しアポトーシスを誘導し、分化を誘導する作用がある。さらに、Wnt/β-カテニン経路を阻害する因子の発現も促進する(⑨)。非ステロイド性抗炎症剤のセレコキシブとジクロフェナクはβ-カテニンのリン酸化を亢進してβ-カテニンの分解を亢進するメカニズムでWnt/β-カテニン経路を阻害する(⑩)。したがって、メベンダゾールとビタミンD3とセレコキシブ、ジクロフェナクはWnt/β-カテニン経路の阻害による抗腫瘍効果において相乗効果が期待できる。
730)膠芽腫(グリオブラストーマ)の代替療法(その2):Wnt/βカテニン・シグナル伝達経路の阻害
【副作用の少ない安価な薬の組合せによるがん治療】
単独での抗腫瘍効果は弱くても、他の薬と組み合わせることによって強い抗腫瘍効果を発揮できる薬もあります。しかし、単独で腫瘍縮小効果を証明できない薬は抗がん剤としては認可されることはないため、がんの標準治療で使用されることはありません。
しかし、このような効果の弱いが抗腫瘍効果が期待できる医薬品やサプリメントを組み合わせたがん治療が注目されています。
次のような論文があります。
A conceptually new treatment approach for relapsed glioblastoma: coordinated undermining of survival paths with nine repurposed drugs (CUSP9) by the International Initiative for Accelerated Improvement of Glioblastoma Care.(再発したグリオブラストーマに対する概念的に新規の治療アプローチ:グリオブラストーマの治療成績の改善を促進するための国際的取組みによる9種類の再利用医薬品による生存経路の協調的な弱体化)Oncotarget 4(4):502-30, 2013
【要旨】
再発したグリオブラストーマにおける治療成績を改善するために、従来の細胞毒性のある抗がん剤の組合せに基づく治療法でなく、他の病気の治療薬として使用されていて安全性が高く使用経験の長い既存の医薬品を組み合わせる治療法の確立を目指した。
この治療法で使用する医薬品は、a)薬理学的に十分に研究されている、b)正常細胞に対する毒性が少なく患者に投与して副作用が起こりにくい、c)グリオブラストーマの増殖を促進する良く知られている経路や因子に対して阻害作用を示す根拠がある、d)組み合わせることによってグリオブラストーマの増殖を阻害する効果が相乗的に高まる可能性がある、という4つ基準を満たすものを用いた。
これらの基準に合致する9種類の医薬品を見つけ、再発したグリオブラストーマに標準治療であるStuppプロトコール(Stupp Protocol:放射線治療と低用量のテモゾロマイドの連日服用の組合せの治療法)で治療を行ったあとに、さらにテモゾロマイドの低用量連日投与に加えて、これらの医薬品を併用する治療法を提案した。
この9種類の医薬品の組合せはCUSP9(Coordinated Undermining of Survival Paths;「生存経路の協調的弱体化」)と名付けられ、アプレピタント(aprepitant)、アルテスネイト(artesunate)、オーラノフィン(auranofin)、カプトリル(captopril)、 グルコン酸銅(copper gluconate)、ジスルフィラム(disulfiram)、ケトコナゾール(ketoconazole)、 ネルフィナビル(nelfinavir)、セルトラリン(sertraline)が、低用量のテモゾロマイドの連日投与の治療に追加された。
この論文では、個々の薬がどのようにグリオブラストーマの増殖を抑制し、テモゾロマイドによる治療に対してグリオブラストーマ細胞が抵抗するメカニズムをこれらの薬がどのように阻止するかを考察した。
これらの薬の相互作用のリスクと、これらの薬の組合せが生活の質(QOL)と全生存率の両方を高めることができるかを解説した。
がん治療以外の目的で開発された何千種類という既存の薬から、抗がん作用を有する物質を探索する研究が行われており、そのような研究を医薬品再利用(Drug Repositioning あるいはDrug Repurposing)と言います。
再発したグリオブラストーマの治療成績を高める目的で再利用医薬品の組合せの効果が検討されているという報告です。米国のバーモント大学の研究者を中心とした国際的な取組みが行われているようです。
「coordinated undermining of survival paths(生存経路の協調的な弱体化)」というのは、がん細胞の生存のための様々なシグナル伝達系や因子(生存経路)を、9種類の再利用医薬品を組み合せて用いることによって阻害することを意味しています。
この論文で報告された医薬品はがん治療以外で使用されていますが、がん細胞の増殖を抑制する作用が報告されています。そして多くは比較的安価です。
アプレピタント(aprepitant)はニューロキニン-1(NK-1)受容体拮抗薬で、制吐剤として、抗がん剤に伴う悪心・嘔吐の治療に用いられています。
アルテスネイト(Artesunate)は抗マラリア薬で、がん細胞の多く含まれる鉄と反応して活性酸素を産生してがん細胞の酸化ストレスを高めてがん細胞を死滅させます。
オーラノフィン(auranofin)は慢性関節リュウマチの治療に使われる金製剤です。チオレドキシン還元酵素(thioredoxin reductase)を阻害してがん細胞の酸化ストレスを高める作用によってジスルフィラムの抗腫瘍効果を増強します。
カプトリル(captopril)はアンジオテンシン変換酵素阻害薬(ACE阻害薬)と呼ばれる降圧剤です。
ジスルフィラム(disulfiram)はアルデヒドデヒドロゲナーゼを阻害する作用によって断酒薬として使用されています。がん幹細胞はアルデヒドデヒドロゲナーゼの発現と活性が亢進していることが知られており、その阻害剤の抗腫瘍効果が注目されています。
ケトコナゾール(ketoconazole)はイミダゾール系抗真菌剤で、真菌の細胞膜合成を阻害することにより、抗真菌作用を示します。
ネルフィナビル(nelfinavir)はプロテアーゼ阻害剤でHIV感染症(エイズ)の治療薬です。
セルトラリン(sertraline)は選択的セロトニン再取込阻害薬とよばれる薬で抗うつ作用や抗不安作用があります。
この論文の発表のあと、欧州ではケトコナゾールとネルフィナビルが製造中止になったので、新しいプロトコールではケトコナゾールの代わりにイトラコナゾール(itraconazole)、ナルフィナビルの代わりにリトナビル(ritonavir)が入っています。
ジスルフィラムと銅がキレート(結合)したものが抗腫瘍効果を発揮するという報告から、ジスルフィラムの抗腫瘍効果を高める目的でグルコン酸銅(copper gluconate)が加えられていますが、その後の研究で、胃内でジスルフィラムは銅とキレートすることが報告されたので、新しいプロトコールではグルコン酸銅は省かれています。その代わりにCOX-2阻害剤のセレコキシブ(celecoxib)が新しく加わっています。
私も、がんの代替療法で、アルテスネイト、オーラノフィン、ジスルフィラム、イトラコナゾール、セレコキシブを以前から使用していますが、いずれの薬も副作用がほとんどなく、組み合わせることによって明らかな抗腫瘍効果を認めています。
この論文に続いて次のような論文が同じ研究グループ(米国のバーモント大学とドイツのウルム大学)から報告されています。
CUSP9* treatment protocol for recurrent glioblastoma: aprepitant, artesunate, auranofin, captopril, celecoxib, disulfiram, itraconazole, ritonavir, sertraline augmenting continuous low dose temozolomide.(再発グリオブラストーマに対するCUSP9治療プロトコール:持続低用量テモゾロマイド治療の効果を高めるアプレピタント、アルテスネイト、オーラノフィン、カプトリル、 セレコキシブ、ジスルフィラム、イトラコナゾール、 リトナビル、セルトラリンの組合せ)Oncotarget. 5(18):8052-82.2014年
【要旨】
再発グリオブラストーマ(膠芽腫)に対するCUSP9治療プロトコールを1年前に報告した。今回、このプロトコールに少しの修正を加え、CUSP9*と命名した。
CUSP9*はアプレピタント(aprepitant)、アルテスネイト(artesunate)、オーラノフィン(auranofin)、カプトリル(captopril)、 セレコキシブ(celecoxib)、ジスルフィラム(disulfiram)、イトラコナゾール(itraconazole)、 セルトラリン(sertraline)、リトナビル(ritonavir)の9種類の薬の組合せで、これらは全て国で認可されており、がん以外の治療目的で広く使用されている。
個々の薬は、グリオブラストーマの生存や増殖を促進する経路の一つあるいは幾つかを阻害する作用がある。このような生存のために経路を阻害することによって、グリオブラストーマに対する標準的な抗がん剤治療の効果を高めることができる。
一度に9種類もの多くの薬を使うことに抵抗があるかもしれないが、CUSP9*のオリジナルの組合せ(CUSP9)での経験から、副作用が少なく十分に使用可能である。
これらの薬の組合せは、AKTリン酸化、アルデヒド脱水素酵素、アンジオテンシン変換酵素、 炭酸脱水酵素-2と9と12、 シクロオキシゲナーゼ-1と2、カテプシンB、ヘッジホッグ、インターロイキン-6、5-リポキシゲナーゼ、マトリックス・メタロプロテアーゼ2と9、哺乳類ラパマイシン標的タンパク質、ニューロキン-1、P糖タンパク質、チオレドキシン還元酵素、組織因子、20 kDa translationally controlled tumor protein、血管内皮細胞増殖因子のシグナル伝達経路や活性を阻害する。
グリオブラストーマは再発すると予後が極めて悪いので、CUSP9*の臨床試験を実施する価値がある。
それぞれ単独では抗腫瘍効果が弱くても複数の薬を組み合せることによって、グリオブラストーマの生存や増殖に働いている複数の経路や因子を阻害して、治療に役立てることが可能かもしれないという話です。
この論文で報告されている再利用医薬品はがんの補完・代替医療では既に利用されており、有効性や安全性に関する論文も増えています。
再利用医薬品の研究結果は「体にやさしいがん治療」の実践に役立ちます。
【膠芽腫を根治するためには、がん幹細胞をターゲットにしなければならない】
膠芽腫は、神経細胞(ニューロン)と神経膠細胞(グリア細胞)の両方の細胞を作り出している神経幹細胞に遺伝子変異が蓄積してがん化した腫瘍です。
神経幹細胞は側脳室の壁の部分の脳室下帯(subventricular zone)に存在し、成人になっても新たなニューロン(神経細胞)とグリア細胞(神経膠細胞)を供給しています(729話参照)。
成人の脳の脳室下帯に存在する神経幹細胞は長期間存在し、増殖活性を持っています。神経幹細胞に遺伝子変異が蓄積するとがん幹細胞になって、脳内を移動して離れた場所に膠芽腫を形成するのです(下図)。

図: 成人の脳の脳室下帯(①)では、上衣細胞に続いて神経幹細胞(②)が存在する。 神経幹細胞に幾つかの遺伝子変異(③)が起こり、腫瘍形成性の変異した神経幹細胞に変化する(④)。変異した神経幹細胞は他の脳領域に長距離移動でき、さらに遺伝子変異が蓄積することによってがん幹細胞(⑤)になり、成熟したがん細胞を生成しがん組織(膠芽腫)を形成する(⑥)。
膠芽腫が再発しやすいのは、膠芽腫のがん幹細胞が抗がん剤や放射線治療に抵抗し、生き残るためです。
がん幹細胞の自己複製や増殖を制御しているシグナル伝達系としてヘッジホッグ(Hedgehog)、mTOR、Notch、Wnt-β-Catenin、CXCR4/CXCL12、VEGF/VEGFR-2などがあります。
つまり、これらのシグナル伝達系を阻害すると、がん幹細胞を消滅できます。

図:膠芽腫細胞のHedgehog、Notch、Wnt/β-Catenin、mTORC1、CXCR4/CXCL12、VEGF/VEGFR-2の各シグナル伝達系を阻害すると、がん幹細胞特性を阻害して、がん細胞を死滅できる。
前回(729話)はCXCR4/CXCL12とVEGF/VEGFR-2をターゲットにする医薬品再利用による治療法(代替療法)について解説しました。
今回はWnt/βカテニンをターゲットにした医薬品再利用による膠芽腫の代替療法について考察します。
【膠芽腫ではWnt/βカテニン経路が亢進している】
膠芽腫ではWnt/βカテニン・シグナル伝達系が亢進しています。以下の様な報告があります。
β-Catenin overexpression in malignant glioma and its role in proliferation and apoptosis in glioblastma cells(悪性神経膠腫におけるβ-カテニンの過剰発現と、神経膠腫細胞の増殖とアポトーシスにおけるその役割)Med Oncol. 2011 Jun;28(2):608-14.
【要旨】
Wnt /β-カテニンシグナル伝達経路の主要成分であるβ-カテニンは、広範囲の腫瘍において重要な因子であることが示されているが、神経膠腫におけるその役割はよく理解されていない。
この研究では、異なるグレード(悪性度)の星状細胞神経膠腫組織およびヒトの正常な脳組織におけるβ-カテニンの発現を、逆転写ポリメラーゼ連鎖反応(RT-PCR)および免疫組織化学を使用して調べた。
我々は、対照の正常脳組織と比較して、高悪性度の星状細胞神経膠腫においてより高いβ-カテニンの発現レベルを発見した。
さらに、β-カテニンの発現を効果的に阻害することが確認されたsiRNAをリポソームによってヒトU251神経膠芽腫細胞にトランスフェクトしてβ-カテニンの遺伝子発現を阻害すると、細胞増殖が阻害され、細胞アポトーシスが誘導され、細胞周期をG1 / G1期で停止した。
さらに、β-カテニンの発現抑制は、サイクリンD1、c-Myc、およびc-junの発現レベルを低下させた。
これらの結果は、β-カテニンの過剰発現が神経膠腫の進行に重要な要因である可能性を示している。
以下の様な報告があります。
Nonsteroidal anti-inflammatory drugs diclofenac and celecoxib attenuates Wnt/β-catenin/Tcf signaling pathway in human glioblastoma cells(非ステロイド性抗炎症薬のジクロフェナクとセレコキシブは、ヒト神経膠芽腫細胞のWnt /β-カテニン/ Tcfシグナル伝達経路を弱める)Neurochem Res. 2013 Nov;38(11):2313-22.
【要旨】
最も一般的で悪性度の高い原発性脳腫瘍である膠芽腫は、予後が悪く、標準的な治療法の後でも再発することが多い。Wnt /β-カテニン/ Tcfシグナル伝達経路の調節異常が膠芽腫の進行に寄与することが最近の研究で明らかになっている。
非ステロイド性抗炎症薬は、さまざまなヒトの悪性腫瘍におけるWnt /β-カテニン/ Tcfシグナル伝達を抑制することにより、腫瘍細胞の増殖を抑制する。
この研究では、非ステロイド性抗炎症薬のジクロフェナクとセレコキシブによる神経膠芽腫細胞のWnt /β-カテニン/ Tcfシグナル伝達の阻害作用を検討した。
ジクロフェナクとセレコキシブの両方が、ヒト神経膠芽腫細胞の増殖、コロニー形成、および遊走を有意に減少させた。
ジクロフェナクとセレコキシブはβ-カテニン/ Tcfの転写活性を抑制し、β-カテニン標的遺伝子のAxin2、サイクリンD1およびc-Mycの発現を減少させた。
さらに、β-カテニンの細胞質蓄積および核移行は、ジクロフェナクおよびセレコキシブ投与によって有意に減少した。
さらに、ジクロフェナクとセレコキシブは、β-カテニンのリン酸化を有意に増加させ、GSK3βのリン酸化を減少させた。
これらの結果は、ジクロフェナクとセレコキシブが、Wnt /β-カテニン/ Tcfシグナル伝達経路の活性化を抑制することによって神経膠芽腫細胞に対する潜在的な治療薬になる可能性を示している。
非ステロイド性抗炎症剤のジクロフェナク(商品名:ボルタレン)とセレコキシブ(商品名:セレコックス)がWnt /β-カテニン/ Tcfシグナル伝達経路の活性化を抑制することによって膠芽腫の治療に役立つ可能性を示唆しています。
そのメカニズムとして「β-カテニンのリン酸化を有意に増加させ、β-カテニンの細胞質蓄積および核移行を抑制」ということは、βカテニンの分解を亢進することを示唆しています。
【がん細胞ではWnt/β-カテニン経路の異常が高頻度で認められる】
Wnt/β-カテニン経路は極めて複雑で、まだ不明な点も多くあります。簡単にまとめると、次のようになります。
①Wntは分子量約4万の細胞外分泌糖タンパク質で、種を超えて保存されており、初期発生における体軸の決定や器官形成を制御しています。これまでに哺乳類において19種類のWnt が同定されています。
②Wnt はFrizzledやlow-density lipoprotein receptorrelated protein(LRP)5/6の受容体を介して細胞内にシグルを伝達し、多様な細胞機能を制御しています。Frizzledは7回膜貫通型受容体でLRP5/6はFrizzledの共役受容体として機能します。
③Wnt の非存在下では細胞質内のβ-カテニンのタンパク質量は低く保たれています。これはGSK-3がβ-カテニンをリン酸化し、リン酸化された-カテニンはユビキチン化を受け、最終的にはプロテアソームで分解されるためです。
④Wnt が分泌されて細胞膜上のFrizzled と共役受容体であるLRP5/6に結合すると,そのシグナルは細胞内へと伝達され、GSK-3依存性のβ-カテニンのリン酸化を抑制し、低リン酸化状態となったβ-カテニンはプロテアソームによる分解から免れ、細胞質内に蓄積します。
⑤細胞内に蓄積したβ-カテニンは核内に移行し、転写因子Tcf/Lef と複合体を形成して標的遺伝子の発現を促進することによって、種々の細胞機能を制御しています。Tcf/LefはT-cell factor/lymphoid enhancer factorの略です。
⑥Tcf/Lefの標的遺伝子は100種類以上に及び、細胞の増殖、分化、運動、幹細胞多能性維持などの制御に関わっています。c-mycやcyclin D1などの発現を亢進して細胞増殖を促進します。(下図参照)

図:(左)Wntシグナルが無い状況では、β-カテニンは細胞質内で分解複合体によってリン酸化され(①)、ユビキチン(U)が結合し(②)プロテアソームで分解されている(③)。その結果、Tcf/Lef(T-cell factor/lymphoid enhancer factor)による遺伝子発現が阻止されている(④)。
(右)Wntが受容体のFrizzledとLRP5/6に結合してWntシグナルが活性化されると、分解複合体が不活性化され、β-カテニンのリン酸化が阻止されて(⑤)β-カテニンは分解されなくなり(⑥)、細胞質内で増加し核内に移行して転写因子のTCFに結合し(⑦)、β-カテニン/TCFのターゲット遺伝子の転写を活性化して(⑧)、細胞の増殖を亢進する(⑨)。βカテニン分解複合体は、AXIN、APC(adenomatous polyposis coli) 、セリン・スレオニンキナーゼのGSK3β(glycogen synthase kinase-3)、CK1α (casein kinase 1α)から構成され、GSK3βとCK1αがβカテニンをリン酸化する。βカテニンがリン酸化されるとβ‑TrCP E3 linker によってユビキチンが結合して、プロテアソームで分解される。
(参考:参考:npj Precision Oncologyvolume 2, Article number: 5 (2018) )
【Wnt/β-カテニン経路の活性化はc-Mycの発現を亢進する】
Wnt/β-カテニン・シグナル伝達系は多くのがん細胞で異常を起こしており、がん治療の重要なターゲットになっています。
βカテニンは781個のアミノ酸からなる92kDaのタンパク質で、細胞間接着と遺伝子発現調節の2つの働きを持っています。
βカテニンの大部分は細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリン(E-Cadherin)と会合体を作っています。このような細胞膜の接着部位のβカテニンはE-カドヘリンとアクチン細胞骨格との連結を助けています。
E-カドヘリンと会合していないβカテニンはすべて細胞質で複数のタンパク質からなる大型の分解複合体により分解されています。
しかし、Wnt(ウィント)という分子量約4万の分泌性糖タンパク質が受容体に結合すると、細胞質におけるβ-カテニンの分解が阻止されて細胞質に蓄積し、核内に移行した後, 転写因子のTcf/Lef(T cell factor/ Lymphoid enhancer factor)と複合体を形成し、Tcf/Lefの転写活性を亢進します。
つまり、β-カテニンはTcf/Lefの転写活性化補助因子として機能し、Tcf/Lefの標的遺伝子の転写を誘導します。このシグナル伝達系をWnt/β-カテニン経路と言い、この経路のターゲット遺伝子にc-Mycや cyclinD1など細胞の増殖を促進する因子が含まれます。(下図)

図:β-カテニンは細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリンに結合し、カドヘリンとアクチン細胞骨格との連結を助けている(①)。E-カドヘリンと会合していないβ-カテニンはリン酸化され、ユビキチン化をうけて最終的にプロテアソームで分解される(②)。Wntは細胞膜上のFrizzled(7回膜貫通型受容体)と共役受容体である1回膜貫通型LRP5/6(Low-density lipoprotein receptor-related protein5/6)に結合する(③)。Wntが受容体に結合するとβ-カテニンのリン酸化が抑制され、β-カテニンの分解が阻止される(④)。β-カテニンは細胞質に蓄積し核内に移行し(⑤)、転写因子のTCF(T cell factor)と複合体を形成する(⑥)。βカテニンにより活性化される遺伝子群にはc-Mycや cyclinD1など細胞の増殖を促進する因子が含まれ(⑦)、その結果、細胞の増殖が亢進する(⑧)。
β-カテニンは細胞膜近傍か細胞質・核のどちらかに局在し, 特に核にあるときは一連の遺伝子発現に影響を与えると考えられています。
Wnt/β-カテニン・シグナル伝達系により活性化される遺伝子群にはc-Myc、 c-Jun、 cyclinD1など細胞の増殖や転移を促進する因子が含まれます。
つまり、Wnt/β-カテニン・シグナル伝達系が活性化されると、がん細胞の増殖や転移が促進されることになります。
c-Mycは細胞増殖や嫌気的代謝を促進する因子としてがん細胞の特質に大いにかかわっている遺伝子です。その遺伝子産物であるc-Mycタンパク質はパートナー因子であるMax(MYC-associated protein X)と相互作用することで転写因子として機能します。
さらに、c-Mycタンパク質は遺伝子のプロモーターやエンハンサー領域に集まって、転写シグナルを増幅する働きもあります(下図)。

図:(上)MycはMaxと二量体を形成し、E-box(Enhancer box)と呼ばれるCACGTG配列に結合し、クロマチン構造を制御するタンパク質(GCN5, TIP60, TIP48, TRRAPなど)をリクルートし遺伝子転写を活性化する。GCN5 とTIP60はヒストンアセチル基転移酵素、TIP48はATP結合タンパク質、TRRAPは形質転換/転写ドメイン関連タンパク質。
(下)Mycタンパク質はE-boxのみでなく、遺伝子のプロモーターやエンハンサー領域に集まって、転写シグナルを増幅する働きがある。(出典:Signal Transduct Target Ther. 2018; 3: 5.)
c-Mycは細胞内の様々な機能を制御しています。タンパク質をコードしている遺伝子だけでなく、タンパク質をコードしていない遺伝子の制御にも関わっており、細胞周期、タンパク質合成、細胞接着、代謝、シグナル伝達、遺伝子転写、タンパク質翻訳、など多くの細胞機能を制御しています。(下図)
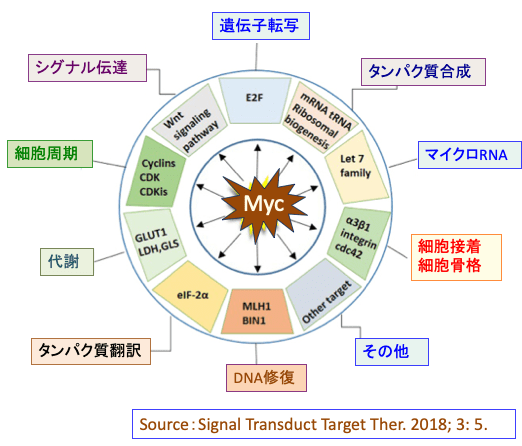
図:Mycは様々な遺伝子の転写を制御し、多彩な細胞機能の制御に関与している。
【駆虫薬のメベンダゾールはWnt/βカテニンによる遺伝子発現を阻害する】
駆虫薬のメベンダゾールがWnt/β-カテニン・シグナル伝達系の最下流の遺伝子発現レベルで阻害作用を示すことが報告されています。以下のような報告があります。
Comprehensive Modeling and Discovery of Mebendazole as a Novel TRAF2- and NCK-interacting Kinase Inhibitor.(包括的モデリングと新規TRAF2およびNCK相互作用キナーゼ阻害剤としてのメベンダゾールの発見)Sci Rep. 2016 Sep 21;6:33534. doi: 10.1038/srep33534.
【要旨】
TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)は、Wntシグナル系が活性化した結腸直腸がんの重要なターゲットの1つである。この研究では、2つのデータセットを選び、望ましい生物医薬品特性を有する新規なTNIK阻害剤を探索するための包括的なモデリング研究を行った。
データセットIを用いて、比較分子類似性指数分析(Comparative Molecular Similarity Indices Analysis :CoMSIA)および可変選択k-最近傍モデル(variable-selection k-nearest neighbor models)を導出し、そこからTNIK阻害剤活性にとって決定的な3D分子場(3D-molecular fields)および2D記述子(2D-descriptors)が明らかにされた。
データセットIIに基づいて、予測的なCoMSIA-SIMCA(Soft Independent Modelling by Class Analogy)モデルを取得し、1,448種類の FDA(米国食品医薬品局)承認の小分子薬物のスクリーニングに使用した。
実験的評価の結果、FDA承認の駆虫薬であるメベンダゾールは、解離定数Kd =〜1μMでTNIKキナーゼ活性を選択的に阻害することができることを発見した。その後のCoMSIAおよびkNN分析は、メベンダゾールがTNIKを結合および阻害するのに必要な好ましい分子特性を有することを示した。
コンピュータを使った構造解析や結合活性の解析でメベンダゾールが「TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)」の阻害剤として有用である可能性を報告しています。
がん治療薬の開発では、培養がん細胞(in vitro)や移植腫瘍などを使った動物実験(in vivo)で抗がん活性や安全性や薬物動態が検討されます。
さらに最近は、薬剤の候補物質がデータベース化され、細胞の受容体やシグナル伝達物質の構造のデータベースや、抗がん剤による遺伝子発現パターンのデータベースなど様々な情報をコンピューターを使って探索する方法(in silico)もあります。
「in silico」という用語は,「コンピュータ(シリコンチップ)の中で」の意味で、in vitro(試験管内で)やin vivo(生体内で)に対応して作られた用語で、コンピューターを駆使した研究です。
米国では、FDA(米国食品医薬品局)が承認した既存薬や、開発に失敗して製薬企業内で保存されている物質のデーターベースが公開されており、様々な手法で新たな薬効を見つける研究が進んでいます。
TNIK(TRAF-2 and NCK-interacting kinase)はセリン・スレオニンキナーゼで、このキナーゼ活性(タンパク質をリン酸化する活性)は結腸直腸がんの増殖活性の維持に必須であることが報告されています。
Wnt/βカテニン経路の最終段階であるβカテニンとTCFの相互作用において、TNIKはTCFのセリン154をリン酸化します。このリン酸化がβカテニン/TCFの遺伝子転写活性に必要だと言うことです。
したがって、TNIKの阻害剤は大腸がんのようにWnt/βカテニンシグナル伝達系が亢進したがんの治療に有効と考えられており、多くの製薬会社が開発しています。まだ臨床的に使用できるものはありませんが、何十年も前から多くの国で使用されている駆虫薬のメベンダゾールが、TNIKの阻害剤としてかなり有望だという報告です。
以下のような報告もあります。メベンダゾールの抗腫瘍効果にc-Mycが関与しているという報告です。
Mebendazole induces apoptosis via C-MYC inactivation in malignant ascites cell line (AGP01).(メベンダゾールは悪性腹水細胞株AGP01においてC-MYC不活性化を介してアポトーシスを誘導する)Toxicol In Vitro. 2019 Jun 14;60:305-312.
【要旨の抜粋】
メベンダゾールは、悪性腹水細胞のAGP01細胞のDNA損傷を有意に増加させたが、正常ヒトリンパ球に対してはDNA損傷を引き起こさなかった。
メベンダゾールは、0.5μMおよび1.0 μMの濃度で、それぞれG0/G1 および G2/M期において顕著な細胞周期停止を引き起こし、そしてより高濃度で有意にアポトーシスを誘導した。さらに、メベンダゾール(0.5μM と 1.0 μM)はカスパーゼ3および7の活性を増加させた。
メベンダゾールは、AGP01細胞におけるC-MYC mRNA とC-MYCタンパク質発現を減少させた。 メベンダゾールは、同じ濃度において、AGP01 shRNA MYCと比較して、AGP01細胞においてより細胞生存率を低下した。
我々の結果は、メベンダゾールが胃がん細胞において細胞死を誘導する経路の1つとしてC-MYC遺伝子の関与を示唆している。
shRNA(short hairpin RNA)は、RNA干渉による遺伝子サイレンシングのために用いられるヘアピン型のRNA配列です。AGP01 shRNA MYCはAGP01細胞にc-Myc遺伝子の発現を不活性化するshRNAを導入した細胞です。
c-Mycに依存性の高いがん細胞に対してメベンダゾールがc-Myc発現を阻害してアポトーシスを誘導する機序を示唆しています。
以下の報告もメベンダゾールの抗腫瘍効果にc-Mycの関与を報告しています。
Anthelmintic mebendazole enhances cisplatin's effect on suppressing cell proliferation and promotes differentiation of head and neck squamous cell carcinoma (HNSCC).(駆虫薬メベンダゾールはシスプラチンの細胞増殖抑制効果を高め、頭頸部扁平上皮癌(HNSCC)の分化を促進する。)Oncotarget. 2017 Feb 21;8(8):12968-12982.
【要旨の抜粋】
頭頸部扁平上皮がん患者の半数近くが治療後5年以内に再発を経験し、化学療法に対して耐性を示す。したがって、頭頸部扁平上皮がんのための安全で新規な抗癌療法を開発することが緊急の臨床的課題である。ここでは、駆虫薬メベンダゾールを頭頸部扁平上皮がんの治療薬として再利用する可能性を検討する。
2種類のヒト頭頸部扁平上皮がん細胞株のCAL27およびSCC15を使用して、メベンダゾールがヒト頭頸部扁平上皮がん細胞においてシスプラチンよりも強力な抗増殖活性を発揮することを示す。
メベンダゾールは頭頸部扁平上皮がん細胞の細胞増殖、細胞周期進行および細胞移動を効果的に阻害し、そしてアポトーシスを誘導する。
メカニズム的には、メベンダゾールはELK1/SRF、AP1、STAT1/2、MYC/MAXを含むがん関連経路を制御する。
メベンダゾールはまた、頭頸部扁平上皮がん細胞の細胞増殖の抑制およびアポトーシスの誘導においてシスプラチンと相乗的に作用する。
さらに、メベンダゾールは、CAL27細胞の最終分化およびCAL27細胞の異種移植腫瘍の角質化を促進する。
これらの結果は、メベンダゾールが特定の頭頸部扁平上皮がん細胞の分化を促進しながら増殖を阻害することによってその抗がん活性を発揮し得ることを実証した最初のものである。
駆虫薬のメベンダゾールは、頭頸部扁平上皮がん治療においてシスプラチンなどの他の化学療法薬と組み合わせて使用される安全かつ有効な薬剤として再利用され得ると考えられる。
メベンダゾールはがんの代替医療ではかなり有名です。
メベンダゾールの消化管からの吸収が低いのが欠点ですが、油の多い食事の後に服用すると吸収率を高めることができますので、ケトン食との併用は有効です。
また、メベンダゾールを分解する薬物代謝酵素を阻害するグレープフルーツや胃薬のシメチジンを併用すると、メベンダゾールの血中濃度を高めることができます。メベンダゾールの抗腫瘍効果については401話401話で紹介しています。
【ビタミンD3はWnt/β-カテニン経路を抑制する】
食事やサプリメントとして摂取したビタミンD3は、肝臓で25位が水酸化されて25(OH)ビタミンD3(カルシジオール:Calcidiol)に変換され、さらに腎臓などで1α位が水酸化されて活性型の1,25(OH)2-ビタミンD3(カルシトリオール:Calcitriol)になります。
ビタミンD3は複数のメカニズムでがん細胞の増殖を抑制し、細胞の分化や死(アポトーシス)を誘導します。
活性型ビタミンD3は幾つかのメカニズムでWnt/β-カテニン経路を抑制することが報告されています。以下のようなメカニズムが提唱されています。
(1)β-カテニンはビタミンD受容体とも相互作用します。ビタミンDとビタミンD受容体の複合体にβ-カテニンが結合すると、β-カテニンとTcf/Lefの結合を阻止するので、Tcf/Lefの転写活性が抑制され、増殖抑制作用を示すというメカニズムが提唱されています。
(2)β-カテニンは接着分子のE-カドヘリンに結合して細胞間接着に重要は働きを担っています。ビタミンD3はE-カドヘリンの発現を亢進するので、β-カテニンを細胞膜の接着班に取り込むことによって細胞内のβ-カテニンの量を減らすことになります。
(3)ビタミンD3はDickkopf(DKK)-1というタンパク質の発現を亢進します。DKK-1はWntシグナルの細胞外の阻害因子です。
以上のような複数のメカニズムで、活性型ビタミンD3はβ-カテニン/TCFのターゲット遺伝子(c-mycやサイクリンD1など)の発現を抑制し、その結果、がん細胞の増殖を抑制することになると考えられています。(下図参照)
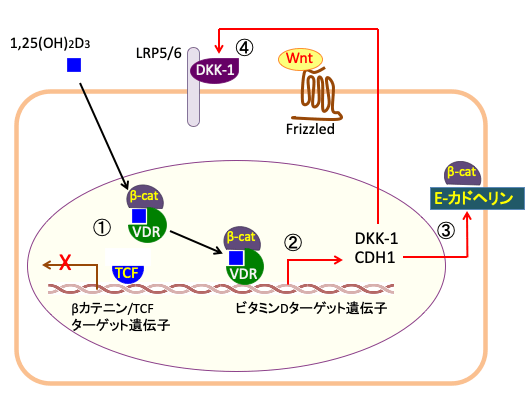
図:活性型ビタミンD3の1,25(OH)2ビタミンD3はビタミンD受容体(VDR)と結合してVDRとβ-カテニンの結合を促進する。その結果、転写因子のTCFとβ-カテニンの結合を阻害するので、β-カテニン/TCFのターゲット遺伝子の転写を抑制する(①)。ビタミンD3と結合したビタミンD受容体はさらにβ-カテニンと結合することによってビタミンDのターゲット遺伝子の転写を活性化する(②)。細胞膜のE-カドヘリンをコードするCDH1遺伝子の発現を促進し、β-カテニンを細胞膜の接着班に取込む(③)。細胞外のWnt阻害因子であるDKK-1の発現を促進することによってWntシグナルを阻害する(④)。このように、活性型ビタミンD3の1,25(OH)2ビタミンD3は様々なメカニズムでβ-カテニン/TCFの転写活性を阻害することによって、細胞増殖を抑制する。(参考:Cancers 2013, 5, 1242-1260)
ビタミンDの働きは、骨とカルシウムの調節だけではなく、種々の細胞の増殖や分化やアポトーシスの制御や免疫調節作用など、多くの生体内機能に関わっていることが明らかになっています。
骨形成やカルシウム代謝の調節以外のビタミンDの役割の存在は、カルシウムやリンの代謝とは関係のない組織や臓器の細胞にビタミンD受容体が見つかったことから明らかになりました。
すなわち、ビタミンD受容体は小腸、骨、腎臓、副甲状腺の他に、皮膚、脳、筋肉、肝臓、免疫系細胞などほぼ全ての組織での発現が観察されています。
そして、多くのがん細胞においてビタミンD受容体が発現しており、ビタミンDががん細胞の増殖を抑制し分化を誘導する作用を持つことが多くの研究で証明され、がんの治療におけるビタミンDの有用性に注目が集まっています。
【ビタミンDは肝臓と腎臓で代謝されて活性型になる】
ビタミンDは、ビタミンD2(エルゴカルシフェロール)とD3(コレカルシフェロール)の総称です。
ビタミンD2は植物に含まれるエルゴステロール(プロビタミンD2)から生成され、ビタミンD3は動物の体内でコレステロールから生成されます。
ビタミンD2はキノコなどの植物性食品に含まれ、特に白キクラゲや干し椎茸に多く含まれています。ビタミンD3は魚に多く含まれています。
日光に当たれば、体内で十分な量のビタミンD3が生成されます。すなわち、日光に含まれるUV-B帯域(波長280~315 nm)の紫外線が皮膚に当たると、表皮内で7-デヒドロコレステロール(プロビタミンD3)からプレビタミンD3を経てビタミンD3(コレカルシフェロール)が生成されます。
7-デヒドロコレステロールはコレステロールから体内で生成されるので、紫外線を含んだ日光に当たることでビタミンDは体内で作られるビタミンということになります。
体内で生成されたビタミンD3と食物から摂取したビタミンD2およびD3は、肝臓で25位が水酸化されて25(OH)ビタミンD(カルシジオール:Calcidiol)に変換され、さらに腎臓などで1α位が水酸化されて活性型の1,25(OH)2-ビタミンD(カルシトリオール:Calcitriol)になります。
25(OH)ビタミンDは体内でのビタミンDの貯蔵型であり、長期間安定に血液中を循環しています。したがって、血中25(OH)ビタミンDの濃度がビタミンDの体内貯蔵量の指標として用いられます。(下図)

図:自然界のビタミンDは植物で紫外線の働きで生成されるエルゴステロール(ergosterol; プロビタミンD2)と動物の皮膚で紫外線の働きで生成される7-デヒドロコレステロール(7-dehydrocholesterol; プロビタミンD3)から合成される。ビタミンD3は肝臓で25位が水酸化されて25-ヒドロキシ・ビタミンD3(Calcidiol)になり、さらに腎臓で1α位が水酸化されて1α,25-ジヒドロキシ・ビタミンD3(Calcitriol)となって活性化される。
【ビタミンD受容体の構造と機能】
ビタミンD受容体(VDR)は核内受容体スーパーファミリーの一員です。ヒトのVDRは427個のアミノ酸からなる分子量50kDaのタンパク質です。
VDRに活性型ビタミンDが結合すると、9-cisレチノイン酸が結合したレチノイドX受容体(RXR)とヘテロダイマー(ヘテロ二量体)を形成し、ビタミンD標的遺伝子のプロモーター上流に存在する特異的エンハンサー配列であるビタミンD応答配列(vitamin D response element: VDRE)に結合します。
リガンドが結合して核内受容体の構造が変化するとコアクチベーター(転写共役活性化因子)が結合できるようになり、転写を促進できるようになります。
VDRE のコ ンセンサス配列は、AGGTCAの基本配列が2つ直列に並び、モチーフ間が3bp 離れたものであると考えられており、この配列の 5′上流側にRXRが、3′下流側にVDRが結合します。(下図)

図:活性型ビタミンD3(1α,25(OH)2ビタミンD3:Calcitriol)と結合したビタミンD受容体(VDR)は9-シス-レチノイン酸に結合したレチノイドX受容体(RXR)とヘテロ二量体を形成してビタミンD標的遺伝子の上流にあるビタミンD応答配列に結合する。このヘテロ二量体に転写共役活性化因子(コアクチベーター)などの多くのタンパク質が結合して転写活性が亢進する。
ビタミンD受容体の活性化による増殖抑制には、細胞周期の G0/G1停止 とア ポトーシスが関与するとの報告が多く、細胞分化も増殖抑制に伴って誘導されると考えられています。
ビタミンDは細胞周期をストップさせるがん抑制遺伝子のp21とp27タンパク質の発現を誘導します。この2つのタンパク質は細胞周期のG0/G1停止を引き起こすサイクリン依存性キナーゼ阻害因子です。
細胞周期は,サイクリン(cyclin)/サイクリン依存性キナー ゼ(cyclin dependent kinase: Cdk)やp21Cip1, p27Kip1, p57Kip2などのサイクリン依存性キナーゼの阻害因子などにより厳密に制御されています。
p21Cip1 遺伝子のプロモーター上流にビタミンD応答配列が存在し、ビタミンD受容体による直接的な遺伝子制御でp21Cip1遺伝子が発現誘導されることが明らかになっています。
さらに、βカテニンの働きを直接阻害する作用もあります。

図:ビタミンDは核内のビタミンD受容体(VDR)に結合し(①)、9-シス-レチノイン酸が結合したレチノイドX受容体(RXR)とヘテロ二量体を形成して標的遺伝子のビタミンD応答配列に結合して遺伝子発現を亢進する(②)。ビタミンDの標的遺伝子には、細胞周期を停止させるタンパク質や分化やアポトーシスを誘導する遺伝子が含まれている(③)。一方、細胞膜に結合しているビタミンD受容体(VDR)にビタミンDが結合すると、フォスフォリパーゼCやプロテインカイネースC(PKC)、フォスファチジルイノシトール-3-キナーゼ(PI3K)などの増殖シグナル伝達系が活性化される(④)。この活性化はビタミンD依存性の遺伝子発現とクロストークすることによって、がん細胞の増殖抑制や分化誘導や細胞死誘導の作用を増強する。さらに、がん細胞で活性化している増殖シグナル伝達系であるWnt/βカテニン・シグナル伝達系に対して、ビタミンDとビタミンD受容体はβカテニンの転写活性を抑制する(⑤)。Wnt/βカテニン・シグナル伝達系はがん細胞の増殖や生存を促進するので、ビタミンD/VDRによるβカテニンの転写活性の抑制は増殖抑制になる。このような複数の機序で、ビタミンDは抗がん作用を発揮する。
【ビタミンDはがん組織の微小環境にも作用して抗腫瘍活性を示す】
ビタミンD3は体内で肝臓や腎臓で代謝され、1α,25-dihydroxyvitamin D3 (または calcitriol)という活性型に変換され、この活性ビタミンD3が細胞核の中のビタミンD受容体に結合して、ある種の遺伝子の発現を促進することによって作用を発揮します。
このビタミンD受容体によって発現が亢進される遺伝子には、細胞の分裂を抑制したり、細胞の分化を誘導する働きを持つものがあり、したがって、ビタミンD受容体の活性化は抗腫瘍作用を示します。
このように、ビタミンDの抗腫瘍作用は、がん細胞に対する直接作用が主体と考えられています。さらに、がん組織の線維芽細胞にビタミンD受容体の発現量が高いほどがん患者の予後が良いという報告が大腸がんなどで報告されています。
さらに、多くの免疫細胞にもビタミンD受容体が発現しており、ビタミンDは免疫システムの働きを高めるメカニズムでも抗腫瘍作用を発揮することが報告されています。
このように、がん細胞への直接作用だけでなく、免疫細胞やがん組織の間質細胞に対してもビタミンDは作用して抗腫瘍効果を発揮するのです。
進行がんの治療においてビタミンD3のサプリメントを1日4000 IU(100μg)以上摂取することは試してみる価値があることは多くの研究結果が示しています。
大腸がんや乳がんではビタミンDの血中濃度が高いほど生存率が高いという疫学や臨床試験の結果が多く出ています。
がん患者さんはビタミンDの血中濃度が低い人が多く、ビタミンDの血中濃度を高めることができれば生存率を高めることができます。
もともとビタミンD3の血中濃度が低いがん患者のビタミンD濃度を高めるには1日4000 IU(100μg)のビタミンD3の摂取が必要です。(647話参照)
進行がんの場合は、1日10,000 IU (250μg)くらいの摂取は試してみる価値はあります。さらに、メベンダゾールやCOX-2阻害剤のセレコキシブの併用は有効です。
新刊紹介:膠芽腫(グリオブラストーマ)の根治を目指す補完・代替医療
本書はプリント・オン・デマンド(Print on Demand)という出版形式で書店では販売していません。アマゾンからの購入になります。
アマゾンからの購入はこちらへ:
| « 729)膠芽腫(... | 731)膠芽腫(... » |




