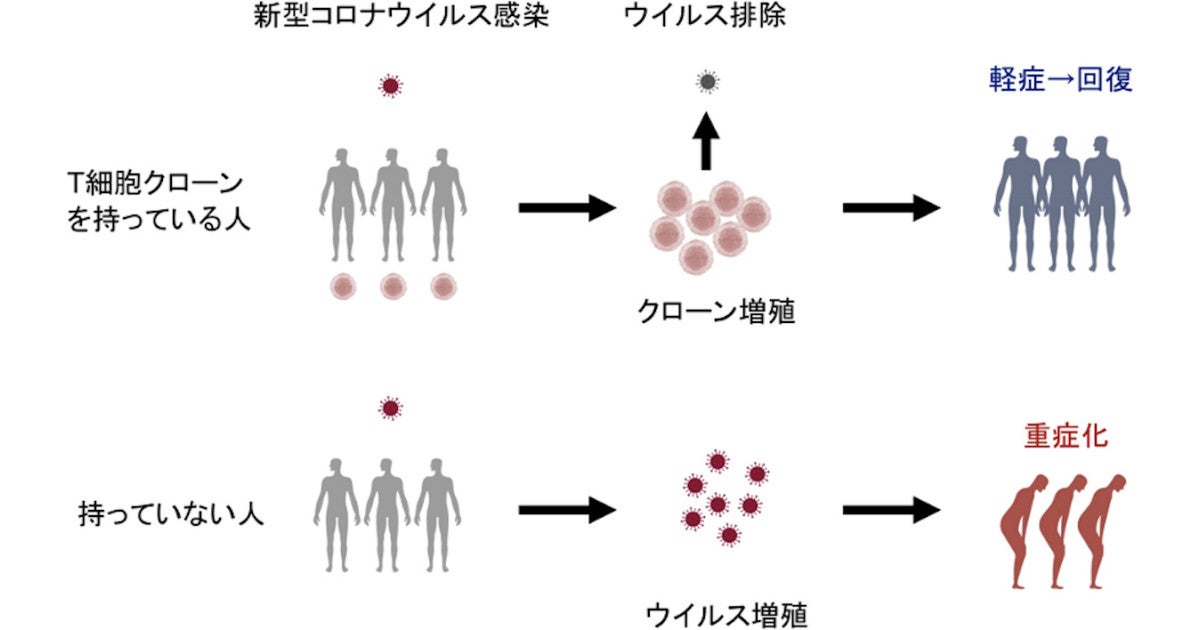
宮沢先生のこのツイートについて、考察してみました。

この研究は阪大の山崎教授の研究室の結果のようです。
新型コロナの重症化を防ぐT細胞、阪大が同定に成功
大阪大学(阪大)は10月14日、新型コロナウイルス(SARS-CoV-2)を認識するヘルパーT細胞受容体の構造を明らかにしたと発表した。
TECH+(テックプラス)
論文はこちらです。
共生細菌として、Selenomonas noxia、 Bacteroidales、Klebsiella pneumoniae が挙げられています。
Selenomonas noxia の共通エピトープは IAQYTSALL で、Bacteroidales とKlebsiella pneumoniae は LLQYGSF でした。
ところで少し前に、抗原認識に糖鎖が重要という千葉大他の論文を紹介しました。
「実際に得られた糖ペプチドの立体構造は、アミノ酸と糖鎖がT字型に繋がった立体的に大きな形でした。抗体中の抗原認識の性質を示す主要な部分がペプチド部分と糖部分の両方がうまくはまり込むようにくぼんだ構造をしており、直接結合していることが明らかになりました。」
糖鎖が結合するアミノ酸は、Asn(アスパラギン:N)と Ser/Thr (セリン:Sまたはトレオニン:T)です。
阪大の論文の共生細菌の Selenomonas noxia の IAQYTSALL には、TSが中央にあり、まさに、T字型の構造をしています。
新型コロナのスパイクタンパクが、タンパク質9個分この口腔内常在菌と共通しています(後で、核酸がどれくらい共通なのか調べてみます)。
阪大の論文には、このエピトープは、多数のHLAに認識されると書いてありますので、キラーT細胞と抗体の両方が標的とすると理解しました。
宮沢先生のツイートによると、共生細菌と交差反応を示すキラーT細胞がワクチンを接種すると消えてしまうということですが、これは、おそらく、糖鎖の種類が変わってしまうからではないでしょうか?
ワクチンでスパイクタンパクを作らせると、エピトープの IAQYTSALL に結合している糖鎖が、細菌仕様からヒト仕様になるので、IAQYTSALLが自己タンパクだと認識されて、寛容されてしまうのではと予想できます。
これって、自己寛容を促進させる創薬として利用できる?自己免疫疾患の治療に使用できるってこと?
新型コロナのIAQYTSALLのアミノ酸配列
att gct caa tac act tct gca ctg tta
atc gcc cag tat gcg tcc gcg ctg ctc
Selenomonas noxia ATCC 43541 contig00001, whole genome shotgun sequence
atc gcc cag tat gcg tcc gcg ctg ctc