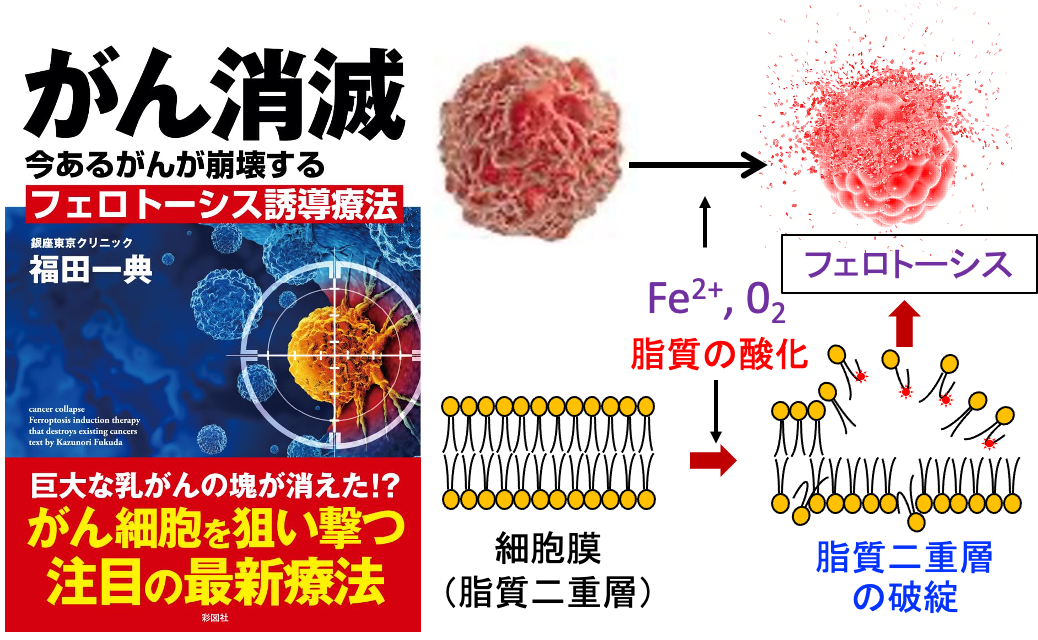
がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
861)アルテスネイトの抗がん作用(その1):ヒドロキシクロロキンとの相乗効果
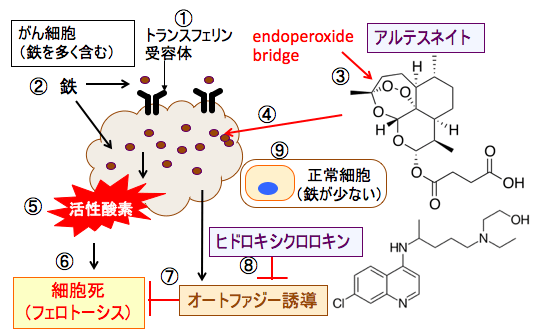
図:がん細胞はトランスフェリン受容体(①)の発現が多く、細胞内に鉄を多く取り込んでいる(②)。抗マラリア薬のアルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し(③)、これは鉄イオンやヘムと反応して(④)、活性酸素を発生する(⑤)。鉄イオンを介してがん細胞内で多量に発生した活性酸素は、細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、フェロトーシスやアポトーシスの機序で細胞死を誘導する(⑥)。がん細胞は細胞保護性オートファジーを誘導して細胞死に抵抗する(⑦)。ヒドロキシクロロキンはオートファジーを阻害することによって細胞死を促進する(⑧)。正常細胞は鉄の含有量が少ないのでアルテスネイトによる酸化傷害を受けない(⑨)。その結果、この2つの治療法は相乗効果で、がん細胞に比較的特異的に細胞障害作用を発揮する。
861)アルテスネイトの抗がん作用(その1):ヒドロキシクロロキンとの相乗効果
【細胞は様々なメカニズムで死滅する】
細胞死のメカニズムとして,ネクローシス(壊死),アポトーシス,オートファジー、フェロトーシスなどが知られています。
脳梗塞や心筋梗塞の様な虚血や、火傷や毒物による細胞傷害では、壊死(ネクローシス)という細胞死を起こして、細胞が崩壊して炎症反応が引き起こされます。炎症反応を引き起こすことによって、生体に異常事態を知らせ、防御や修復を促進することができます。
アポトーシス(Apoptosis)はミトコンドリアのチトクロームCやタンパク分解酵素のカスパーゼが関与する細胞死です。
カスパーゼは、基質であるタンパク質をアスパラギン酸残基の後で切断するシステインプロテアーゼの総称です。アポトーシスの実行や炎症性サイトカインの活性化に関与するタンパク分解酵素です。
カスパーゼは初め不活性型の前駆体のプロ・カスパーゼ(pro-Caspase)として発現しますが、Fas などの細胞死受容体や各種の傷害刺激などに反応して速やかに切断され、活性型となります。
アポトーシスの過程においては、誘導型カスパーゼ(Initiator caspase)と実行型カスパーゼ(Executioner caspase/Effector caspase)に大別されます。
誘導型カスパーゼ(Caspase-2、8、9、10)は実行型カスパーゼ(Caspase-3、6、7)を切断・活性化することによりアポトーシスのシグナルをスタートさせます。実行型カスパーゼは、多くの細胞内タンパク質を分解し、アポトーシスの実行へと導きます(下図)。これらのカスパーゼの阻害剤はアポトーシスによる細胞死を阻止します。

図:細胞死受容体(Fas と TNFR)のリガンド(FasLとTNF)による活性化(外因性経路)は、カスパーゼ8 および カスパーゼ10を活性化する(①)。ダメージを受けたミトコンドリアから放出されるシトクローム c はカスパーゼ-9 を活性化する(内因性経路②)。これらのカスパーゼはイニシエーターカスパーゼ(Initiator caspase)と呼ばれ、下流のエクセキューショナーカスパーゼ(Executioner caspase)のpro-caspase3とpro-caspase 7を切断して活性化する(③)。活性化したカスパーゼ3とカスパーゼ7は細胞内タンパク質を消化してアポトーシスを実行する。
一方、オートファジー(autophagy)は細胞内の構成成分を分解するための細胞機能で、このオートファジーが関与するプログラム細胞死をオートファジー細胞死と呼んでいます。
最近、フェロトーシス(Ferroptosis)という細胞死が提唱されています。フェロトーシスでは、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。
細胞内の鉄に依存する機構であり,ほかの金属類には依存しません。「フェロ(Ferro)」は「鉄」という意味です。
カスパーゼ阻害剤はアポトーシスの細胞死を阻止できますが、フェロトーシスは阻止できません。
鉄に結合して反応性を阻害するキレート剤や、フリーラジカルを消去する抗酸化剤(ビタミンEなど)はフェロトーシスを阻止しますが、アポトーシスは阻止できません。
つまり、フェロトーシスは鉄のキレート剤や抗酸化剤で阻止され、カスパーゼ阻害剤では阻止できない点でアポトーシスと区別される細胞死です。
がん治療においてフェロトーシスの誘導が注目されています。がん細胞は鉄を多く含みますが、正常細胞は鉄を多く含みません。
つまり、フェロトーシスはがん細胞で最も一般的に観察され、正常細胞ではあまり起こらないからです。正常細胞のダメージが少なく、がん細胞に特異的に細胞死を誘導する方法としてフェロトーシスを誘導する治療が注目されているのです。

図:鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる(①)。ほとんどの細胞の細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシス (Endocytosis)によって細胞内に取り込まれる(②)。エンドソーム(endosome)内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。2価の鉄イオンはエンドソームを出て細胞質に移行し、細胞内の様々な機能に使用される不安定鉄プール(the labile iron pool)に入り、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など、細胞内の様々な目的で使用される(④)。余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に3価の鉄イオン(Fe3+)として貯蔵される(⑤)。細胞質の2価鉄イオンはフェントン反応によって酸化作用の強いヒドロキシルラジカルや脂質ラジカルを発生させ、過酸化脂質の蓄積を引き起こし(⑥)、フェロトーシスによる細胞死を誘導する(⑦)。鉄のキレート剤や抗酸化剤はフェロトーシスを阻害する(⑧)。
【アルテミシニン誘導体は抗マラリア薬として開発された】
がん細胞にフェロトーシス(ferroptosis)を誘導する物質としてアルテミシン誘導体が近年注目されています。アルテミシニンは青蒿(セイコウ)というキク科の薬草から見つかっています。青蒿(Artemisia annua)は中国伝統医学でマラリアなど様々な感染症や炎症性性疾患の治療に古くから使用されていました。
抗マラリア作用の活性成分がアルテミシニン(Artemisinin)で、その効果を高めたアルテスネイト(Artesunate)とアルテメーター(Artemether)という2種類の誘導体が合成されています。これらは現在、マラリアの治療薬として世界中で使用されています。
青蒿からアルテミシニンを発見し、抗マラリア薬を開発した中国の女性科学者の屠呦呦(Tu Youyou)博士は、駆虫薬のイベルメクチンを開発した大村智氏およびW. C. キャンベル(William C. Campbell)氏と一緒に2015年のノーベル医学生理学賞を受賞しています。
マラリアは、熱帯・亜熱帯地域の70ヶ国以上に分布し、全世界で年間3~5億人、死者は100~150万人と言われる感染症ですので、その治療薬としてのアルテスネイトなどのアルテミシニン誘導体の開発は、ある本では「伝統薬から開発された医薬品としては、20世紀後半における最大の業績」という表現がなされているほど、医学において重要な成果だと言われています。

図:中国の女性科学者の屠呦呦(Tu Youyou)博士は、2011年のラスカー賞受賞に続いて、2015年度のノーベル医学生理学賞を受賞した。屠博士は、古くからマラリアの治療に利用されてきた青蒿(Artemisia annua)という薬草から活性成分としてアルテミシニン(Artemisinin)を発見した。アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)は、現在マラリアの治療薬として世界中で使用されている。さらに、抗がん作用があることから、がんの代替医療にも使用されている。
青蒿(セイコウ)という生薬は強力な解熱作用があり、中国医学でマラリアなど様々な感染症や炎症性性疾患の治療に古くから使用されていました。1972年に中国の湖南省長沙市の郊外で発掘された馬王堆漢墓は2100年以上前に作られた墓(古墳)ですが、その中から見つかった「五十二病方」という医書の中に、青蒿が記載されています。
青蒿はartemisia annuaという植物です。artemisiaとはヨモギのことで、青蒿はキク科ヨモギ属の植物です。 英語ではsweet Annieやwormwoodと呼ばれ、和名はクソニンジンとかカワラニンジンと呼ばれています。
ベトコンを援助するために中国軍がベトナム戦争に従軍しましたが、密林でマラリアに感染して病死する兵士が多く、そこで毛沢東の命令でマラリヤの治療薬の開発が国家プロジェクトとして1967年に開始されました。その指揮を取ったのが、当時37歳の屠博士でした。 屠博士は1970年代に、その薬効成分のアルテミシニン(Artemisinin)を分離し、アルテミシニンやその誘導体のアルテスネイト(Artesunate)やアルテメーター(Artemether)の抗マラリア薬としての有効性を確認しました。
近年、このアルテミシニン誘導体が抗がん物質として注目を集めています。
【アルテミシニンとその誘導体は正常細胞には毒性が少なく、がん細胞に抗がん作用を示す】
培養がん細胞を使った実験でアルテミシニンやアルテスネイトががん細胞を死滅させる作用や、がん細胞を移植した動物実験で、がんを縮小させる効果が報告されています。
さらに、抗腫瘍作用を示す投与量で、正常細胞に対する毒性が低く、副作用がほとんど無いという特徴を持っています。
アルテスネイトは昔からマラリアの治療に使われていた生薬の成分で、その安全性や副作用が軽度であることが確かめられています。
アルテスネイトなどのアルテミシニン誘導体は多彩な作用メカニズムで抗腫瘍効果を発揮することが報告されています。 がん細胞内でフリーラジカルを産生して酸化ストレスを高める作用、血管新生阻害作用、DNAトポイソメラーゼIIa阻害作用、細胞増殖や細胞死のシグナル伝達系に影響する作用などが報告されています。
臨床試験での有効性も報告されています。
アルテスネイトの抗がん作用は1993 年に最初に報告され、2001年以降少しづつ論文数が増え、最近の数年は年間50件以上の論文が報告されています。(下図)

図: PubMed(アメリカ国立医学図書館の国立生物工学情報センターが運営する医学・生物学分野の学術文献検索サービス)で「Artesunate cancer」を検索すると2022年までに400件以上の論文がヒットする。最初の論文が出た1993年から2009年頃までは、アルテスネイトの抗がん作用に関する論文は年間10報以下であった。2010年に年間10報を超え、最近では年間50編を超えている。アルテスネイトの抗がん作用はこの10年間に急速に注目されるようになったことを示している。
最初の1993年の論文は以下です。
Cytotoxicity of artemisinin-related endoperoxides to Ehrlich ascites tumor cells(エールリッヒ腹水腫瘍細胞に対するアルテミシニン関連エンドペルオキシドの細胞毒性)J Nat Prod. 1993 Jun;56(6):849-56.
抗マラリア薬のアルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し、これは鉄イオンやヘムと反応して、活性酸素を発生します。マラリア原虫が感染した赤血球ではヘモグロビンが分解したフリーの鉄イオンが存在し、この鉄イオンを介して赤血球内で多量に発生した活性酸素は、マラリア原虫を死滅します。がん細胞はフリーの鉄を多く持つので、がん細胞の細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、フェロトーシスやアポトーシスの機序で細胞死を誘導します。

図:マラリア原虫は赤血球に感染する(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し(②)、これは鉄イオンやヘムと反応して、活性酸素を発生する(③)。マラリア原虫が感染した赤血球ではヘモグロビンが分解したフリーの鉄イオンが存在し、この鉄イオンを介して赤血球内で多量に発生した活性酸素は、マラリア原虫を死滅する。がん細胞はフリーの鉄を多く持つので(④)、がん細胞の細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、フェロトーシスやアポトーシスの機序で細胞死を誘導する(⑤)。正常細胞は鉄が少ないので、アルテスネイトによるダメージを受けない(⑥)。
アルテスネイトは水溶性で、抗マラリア作用や抗がん作用はアルテミシン誘導体の中で最も高いと考えられています。毒性が極めて低いので、副作用がほとんど無いのが特徴です。しかし、体内での半減期が比較的短いという短所もあります。
アルテメーターは脂溶性で、アルテスネトより体内の半減期は長く、血液脳関門を容易に通過するので、脳マラリアや脳腫瘍にも効果があります。しかし、高用量を使用すると神経毒性が現れるという副作用があります。
アルテミシニンは、アルテスネイトとアルテメーターの2つの中間的な半減期をもち、血液脳関門も通過します。 米国では、これら3種類の成分を含有する製品がサプリメントとして販売されています。
【アルテスネイトはフェロトーシス(Ferroptosis)を誘導する】
アルテスネイトやアルテミシンやアルテメーターはセスキテルペン・ラクトンの一種で、分子の中にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持っています。エンドペルオキシド・ブリッジ(-C-O-O-C-)は鉄イオンと反応してフリーラジカルを発生します。がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています。
つまり鉄介在性の細胞死です(下図)。

図:がん細胞は細胞内に鉄を多く含む(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持つ(②)。このエンドペルオキシド・ブリッジは細胞内の鉄と反応してフリーラジカルを産生し、フェロトーシスの機序で細胞死を誘導する(③)。一方、正常細胞は鉄の含有が少ないので、アルテスネイトによる細胞傷害を受けない(④)。
マラリア原虫に感染した赤血球内にではヘモグロビンが分解してフリーの鉄イオンが増えるので、アルテスエイトの分子内のエンドペルオキシド・ブリッジは細胞内の鉄と反応してフリーラジカルを産生しマラリア原虫を死滅します。
同様な作用は鉄を多く取り込んでいるがん細胞を死滅する目的でも利用できます。がん治療の目的でアルテスネイトを服用する数時間前に鉄剤を服用してがん細胞に鉄を多く取込ませておくと、抗腫瘍効果を増強できることが指摘されています。
以前は、「がん細胞に多く含まれる2価の鉄イオンとアルテスネイトが反応してフリーラジカルを産生してがん細胞を死滅させる」と簡単に理解されていましたが、2012年にフェロトーシスという鉄介在性の細胞死の存在が提唱され、そのメカニズムが明らかになってきて、アルテスネイトの抗がん作用に注目が集まってきています。つまり、フェロトーシス促進によるがん治療においてアルテスネイトの利用が検討されています。
【オートファジーを阻害するとアルテスネイトの抗腫瘍効果が増強する】
以下のような報告があります。オートファジーを阻害するヒドロキシクロロキンを併用するとアルテスネイトの抗腫瘍効果が増強するという報告です。
Artesunate induces apoptosis and autophagy in HCT116 colon cancer cells, and autophagy inhibition enhances the artesunate‑induced apoptosis(アルテスネートは HCT116 結腸がん細胞のアポトーシスとオートファジーを誘導し、オートファジー阻害はアルテスネート誘導性のアポトーシスを増強する)Int J Mol Med. 2018 Sep;42(3):1295-1304.
【要旨の抜粋】
本研究では、in vitro および in vivo でのアルテスネイトの抗腫瘍効果、および HCT116 結腸がん細胞におけるその根底にある作用機序を評価した。アルテスネイトは、in vitro および in vivo の両方で HCT116 細胞のアポトーシスを誘導することにより増殖を阻害することが観察された。
フローサイトメトリー分析により、2 μg/ml および 4 μg/mlの濃度のアルテスネイト で 48 時間処理すると、それぞれ 22.7% および 33.8% の細胞で初期アポトーシスが誘導された。BALB/c ヌードマウスの異種移植腫瘍では、対照群(生理食塩水群)と比較して アルテスネイト投与群でアポトーシス陽性細胞が増加した。
さらに、細胞および動物の両方に実験系で、アルテスネイトはミトコンドリア切断型カスパーゼ 3、ポリ ADP リボース ポリメラーゼ (PARP)、カスパーゼ 9、および Bcl-2 関連 X タンパク質のレベルを増加し、B 細胞リンパ腫-2 (Bcl-2) は減少した。
アルテスネイト処理細胞は、軽鎖 3 (LC3) およびベクリン 1 のタンパク質発現レベルの増加、およびオートファゴソームの存在によって証明されるように、オートファジーの誘導も認められた。
特に、ヒドロキシクロロキンを使用したオートファジー活性化の薬理学的阻害は、切断型カスパーゼ3およびPARPのタンパク質レベルを増加させてアルテスネイト誘導性アポトーシスを顕著に増強し、LC3およびベクリン-1のレベルを低下させた。
これらの発見は、アルテスネイト誘導性オートファジーがアポトーシスを抑制することによって細胞保護効果を有する可能性を示唆した。
結論として、アルテスネイトはヒト結腸ガンに対して臨床的に有用な抗がん剤となる可能性がある。
アルテスネイトは大腸がん細胞においてアポトーシスとフェロトーシスを誘導し、オートファジーが誘導されました。このオートファジー誘導はがん細胞の細胞死を阻止する作用があります。細胞保護作用があります。従って、オートファジーを阻止するヒドロキシクロロキンを使うと、アルテスネイト誘導性の細胞死(アポトーシスとフェロトーシス)を増強できるという話です。アルテスネイトとヒドロキシクロロキンによる同時治療は、効果的な抗がん療法となる可能性があります。(トップの図参照)
【細胞が栄養飢餓になるとオートファジーが亢進する】
オートファジー (Autophagy) は、細胞内のタンパク質を分解するための仕組みの一つです。
「auto-」はギリシャ語の「自分自身」を表す接頭語で「phagy」は「食べること」の意で、「自食(じしょく)」と日本語訳されています。「自分を食べる」という意味です。
オートファジーは細胞内タンパクや小器官を二重の脂質膜で包み込み,これをリソソームに輸送して分解する仕組みです。
リソソーム(Lysosome)は,酸性で働く種々の加水分解酵素を内包しており,細胞内外から取り込まれた生体分子を加水分解する細胞内小器官の一つです。
オートファジーの仕組みを解明した大隅良典・東京工業大栄誉教授は2016年のノーベル生理学・医学賞を受賞しました。
細胞は栄養飢餓に陥るとオートファジーにより細胞質やオルガネラの一部を分解および再利用し、細胞の生存に必要なエネルギーやアミノ酸を得ています。
さらに、オートファジーを使い老廃物や損傷したミトコンドリア、病原体、異常タンパク質を除去しており、それにより神経変性疾患、がん、糖尿病、心不全、各種の炎症や感染症など、さまざまな疾患の発症を抑制していることが明らかになっています。
細胞が飢餓条件下におかれると、細胞質に隔離膜と呼ばれる扁平な小胞が現れます。その後、膜は細胞質内の異常タンパク質や細胞内小器官を取り込みながら伸長し、先端どうしが融合して、オートファゴソームが形成されます。 オートファゴソームがリソソームと融合して内包物は分解されます。自己消化で得られたアミノ酸は栄養源として再利用されます。

図:細胞質に隔離膜と呼ばれる扁平な小胞が現れ、異常なタンパク質や細胞内小器官を取り込む(①)。その後、膜は細胞質を取り込みながら伸長し(②)、先端どうしが融合して、オートファゴソームが形成される(③)。 オートファゴソーム内にはミトコンドリアなどの大きなオルガネラも含まれる。オートファゴソームがリソソームと融合すると(④)、内包物は分解される(⑤)。自己消化で得られたアミノ酸は栄養源として再利用される。
【オートファジーは抗がん剤や放射線によるダメージからがん細胞を保護する】
オートファジーの細胞保護機能は栄養欠乏の条件下で細胞の生存に必要なエネルギーと代謝中間体を提供するものとして一般的に理解されています。
抗がん剤治療に対する抵抗性のメカニズムの一つとしてオートファジーが注目されています。
抗がん剤治療で小胞体ストレスが亢進すると細胞に死滅しやすくなります。オートファジーは異常タンパク質を分解して小胞体ストレスを軽減すると同時に、タンパク質を分解してアミノ酸を再利用して増殖に使うことができます。
つまり、オートファジーはがん細胞を抗がん剤によるダメージから守る作用があります。
したがって、抗がん治療にオートファジー阻害剤を併用すると抗がん剤の効き目を高めることができます。
がん治療においてはオートファジー阻害剤の有用性が注目されています。一般に、オートファジーの阻害剤は抗がん剤の効き目を高めると考えられています。
PubMedで「Autophagy inhibition in cancer(がんにおけるオートファジー阻害)」で検索すると、最も古い論文が1984年で、1995年までは1年に2報以下、2005年に21報の論文が発表され、それ以降は急速に論文数が増えています。2019年が1470報で、2021年が1727報、2022年が1699報告と急速に増えています。(下図)

図:「がんにおけるオートファジー阻害(Autophagy inhibition in cancer)」に関する年間の論文数の推移。この10年間で論文数が急速に増えているのは、がん治療におけるオートファジー阻害の役割が注目されていることを示している。
がん細胞のオートファジーを阻害することは、化学療法または放射線に対する感受性を増強し、抗がん剤および放射線治療に対する耐性を克服することができると考えられています。
オートファジー阻害剤としてはヒドロキシクロロキンが有名です。
【ヒドロキシクロロキンは全身性エリテマトーデスの治療薬として使われている】
クロロキン(chloroquine)はマラリアの治療もしくは予防のために1940年代から用いられています。クロロキンの側鎖末端にヒドロキシル基(-OH)が付加したのがヒドロキシクロロキン(hydroxychloroquine)です。(下図)

ヒドロキシクロロキンの薬物動態はクロロキンと同様ですが、消化管からの吸収がより速やかで腎臓からの排泄も速く、クロロキンより毒性が低いので、ヒドロキシクロロキンの方が主に使用されています。
経口投与で70%前後が消化管から吸収されます。
シトクロムP450酵素(CYP 2D6、2C8、3A4、3A5)で代謝されます。
WHO必須医薬品モデル・リストに収載されている薬です。
ヒドロキシクロロキン硫酸塩(Hydroxychloroquine sulfate)は、マラリア、皮膚エリテマトーデス、全身性エリテマトーデスなどの治療薬として世界中で広く使用されています。
現在ではクロロキンに耐性を持つマラリア原虫が出現しているため、マラリア治療にはクロロキンやヒドロキシクロロキを単独で用いることはあまりなく、他の薬剤と併用されています。
ヒドロキシクロロキンは米国で1955年に承認されて以降、70 カ国以上で承認されており、適正量かつ短期間の使用では重篤な副作用は少ないとされています。
全身性エリテマトーデスの治療に欠かせない薬とされており、日本でもヒドロキシクロロキンの全身性エリテマトーデスへの治験が 2012 年に始まり、2015 年に承認されました。
ヒドロキシクロロキン硫酸塩(商品名:プラケニル)は免疫調節薬に分類されており、免疫系を抑制することによって自己免疫疾患の活動性を抑制します。
全身性エリテマトーデスでステロイドと免疫抑制薬を使用している場合、ヒドロキシクロロキン硫酸塩(プラケニル)を加えることによってステロイドをより減量しやすくなります。
【ヒドロキシクロロキンはがん治療への使用が注目されている】
日本では2015年に全身性エリテマトーデス(systemic lupus erythematosus:SLE)の治療薬として承認されていますが、米国では1955年に承認され、現在では欧州諸国を含む70カ国以上で、全身性エリテマトーデスの標準的治療薬として広く使用されています。
関節リュウマチや皮膚筋炎などの他の自己免疫疾患の治療にも使用されています。免疫調節作用によって自己免疫疾患に効果があるようです。
がん治療の領域でも10年くらい前からヒドロキシクロロキンは注目されており、特にこの数年間は論文の数が増えています。
例えば文献検索のPubMedで「Hydroxychloroquine and cancer」で検索すると、最初の論文が1961年に発表されています。2010年までは年間10報以下でしたが、2014年くらいから年間40報以上に増え、2017年が50報、2019年が65報で、2020年が194報です.
つまり、がんとヒドロキシクロキンに関する研究はこの数年間で大きく注目されているようです。

図:「ヒドロキシクロロキンとがん(Hydroxychloroquine and cancer)」に関する年間の論文数の推移。この10年間で論文数が増え、,がん治療におけるヒドロキシクロロキンの研究が注目されていることを示している。
ヒドロキシクロロキンががん治療で注目されている理由は、ヒドロキシクロロキンは細胞内のタンパク質を分解するオートファジーを阻害する作用があるためです。
オートファジー阻害薬はがん治療薬として開発が行われていますが、ヒドロキシクロロキンは現時点でFDA(米国食品医薬品局)が承認している医薬品の中でオートファジ阻害作用が証明されている唯一の医薬品です。
このオートファジー阻害作用は、がん細胞の細胞死を誘導し、抗がん剤感受性を高めます。
【ヒドロキシクロロキンはオートファジーを阻害する】
がん治療の抵抗性の一つのメカニズムとしてオートファジーが注目されています。
抗がん剤治療で小胞体ストレスが亢進すると細胞に死滅しやすくなります。オートファジーは異常タンパク質を分解して小胞体ストレスを軽減すると同時に、タンパク質を分解してアミノ酸を再利用して増殖に使うことができるためです。
オートファジーは細胞内の異常タンパク質を分解してリサイクル(再利用)するシステムです。
抗がん剤などでダメージを受けた細胞内小器官や異常タンパク質を分解して細胞のストレス負荷(小胞体ストレス)を軽減し、同時に栄養枯渇した状態において、細胞内のタンパク質やエネルギーを産生するための物質を得るために分解した栄養素をリサイクルすることによって生存を維持します。
したがって、抗がん治療にオートファジー阻害剤を併用すると、小胞体ストレスの亢進と、栄養飢餓が亢進して細胞が死滅しやすくなって、抗がん剤の効き目を高めることができます。
図:リボソームで合成されたタンパク質は小胞体で折り畳みや翻訳語修飾を受けて正常な機能を持ったタンパク質になる(①)。抗がん剤治療は小胞体にダメージを与え(②)、小胞体ストレスを引き起こし(③)、小胞体内で折畳み不全の異常タンパク質が増える(④)。小胞体内に異常タンパク質が凝集して蓄積し(⑤)、細胞機能が阻害されて細胞死が誘導される(⑥)。異常タンパク質はオートファゴソームに取り込まれ(⑦)、リソソームと癒合してオートファジーのメカニズムで分解される(⑧)。オートファジーは小胞体ストレス負荷を軽減し、栄養素をリサイクルすることによって(⑨)、細胞死を阻止する(⑩)。
以下のような論文があります。
Low concentration of chloroquine enhanced efficacy of cisplatin in the treatment of human ovarian cancer dependent on autophagy(低濃度のクロロキンは、オートファジーに依存するヒト卵巣がんの治療におけるシスプラチンの抗腫瘍効果を増強する)Am J Transl Res. 2017 Sep 15;9(9):4046-4058.
【要旨の抜粋】
背景:シスプラチンは卵巣がんの治療に使用され、強力な抗腫瘍効果を発揮する。オートファジーががん細胞の生存プロセスとして機能することが多くの研究で明らかにされており、オートファジー阻害薬のクロロキンと様々な化学療法薬の併用効果が検討されている。この研究では、クロロキンが卵巣がんの治療におけるシスプラチンの効果を高めることができるかどうかを検討した。
結果:低濃度のクロロキンだけでは細胞の生存率、移動、または浸潤に影響を及ぼさないが、ヒト卵巣がん細胞のSKOV3とhey細胞の両方で、低濃度のクロロキンの併用は、シスプラチンによる細胞の生存率、移動、浸潤を阻害する効果を高めた。
シスプラチンは、オートファゴソームの形成を誘導し、オートファジー関連タンパク質ATG 5、ATG 7、ベクリン1およびLC3B II / LC3B Iを増加させた。
クロロキン単独ではがん細胞のアポトーシスとアポトーシス関連タンパク質の発現に影響しなかったが、クロロキンとシスプラチンの併用投与はシスプラチン単独よりもアポトーシス誘導を増強した。
異種移植腫瘍を用いた動物実験でも、クロロキンとシスプラチンの併用は、シスプラチン単独よりも、移植腫瘍の増殖をより抑制し、細胞分裂の指標であるki-67発現を低下させ、アポトーシスの指標である切断型カスパーゼ3発現を増強した。
結論:シスプラチン投与は、卵巣がん細胞のおいて細胞保護的なオートファジーを誘導する。クロロキンはオートファジーを阻害することによって、シスプラチンの抗腫瘍効果を高める。
がん細胞に抗がん剤のシスプラチンを投与すると細胞死を逃れる一つのメカニズムとしてオートファジーを亢進します。オートファジーの亢進は抗がん剤によるダメージからがん細胞を保護する働きをします。
したがって、オートファジーを阻害する作用のあるクロロキンを併用すると、がん細胞が死滅しやすくなるということです。
ヒドロキシクロロキンの効果をメタ解析した報告があります。
The clinical value of using chloroquine or hydroxychloroquine as autophagy inhibitors in the treatment of cancers:A systematic review and meta-analysis(がんの治療におけるオートファジー阻害剤としてのクロロキンまたはヒドロキシクロロキンを使用することの臨床的価値:系統的レビューとメタ分析)Medicine (Baltimore). 2018 Nov; 97(46): e12912.
【要旨】
背景:オートファジーは、異常なタンパク質や細胞内小器官の除去とリサイクルを行うリソソームを使った細胞内のメカニズムである。オートファジーの異常ががんを含む様々な疾患の発症に関連していることが多くの研究で明らかになっている。
がん治療におけるオートファジー阻害剤の使用が検討されているが、オートファジー阻害剤の有効性については議論の余地がある。そこで、オートファジー阻害剤を使ったがん治療の臨床的価値を評価することを目的として、メタ分析を行った。
方法:オートファジー阻害剤を使ったがん治療を評価する臨床研究を検索した。これらの研究からデータを抽出して、全奏効率、6か月間の無増悪生存率、および1年全生存率率の相対リスク(RR)を評価した。
結果:7件の臨床試験が確認された(n = 293)。ヒドロキシクロロキン+ゲムシタビンの併用が2件、ヒドロキシクロロキン+ドキソルビシンの併用が1件、クロロキン+放射線の併用が1件、クロロキン+テモゾロミド+放射線の組み合わせが1件、およびヒドロキシクロロキンの単独療法が1件であった。
オートファジー阻害剤を併用しなかった場合に比べて、オートファジー阻害剤を併用したがん治療では、全奏功率(RR:1.33、95%信頼区間:0.95–1.86、P = .009)、6か月間の無増悪生存率(RR:1.72、95%信頼区間:1.05–2.82、P = .000 )、1年間の全生存率(RR:1.39、95%信頼区間:1.11–1.75、P = .000)はいずれも高かった。
結論:このメタ分析の結果は、化学療法や放射線療法においてオートファジー阻害剤の併用が治療効果を高めることを示しており、オートファジー阻害剤の併用はがん治療に新しい戦略を提供する可能性がある。
以下のような報告もあります。
Phase I trial of hydroxychloroquine with dose-intense temozolomide in patients with advanced solid tumors and melanoma.(進行性固形腫瘍および黒色腫の患者における高用量テモゾロミドを併用したヒドロキシクロロキンの第I相試験)Autophagy. 2014 Aug;10(8):1369-79.
【要旨の抜粋】
ヒドロキシクロロキンでオートファジーを阻害すると、アルキル化化合物による化学療法による細胞死を亢進できることが前臨床モデルの研究で示されている。
この第1相臨床試験では、進行性固形悪性腫瘍患者を対象に、高用量テモゾロミドとの組み合わせにおける、ヒドロキシクロロキンの最大耐量、安全性、有効性、薬物動態および薬力学を評価した。
40人の患者(転移性黒色腫が73%)が、ヒドロキシクロロキンを1日 200〜1200 mgと、高用量のテモゾモミド(150 mg / m2)を7日間あるいは14日間毎日投与された。この組み合わせは忍容性が良好であり、用量制限毒性は観察されなかった。
ヒドロキシクロロキンは最大耐用量に到達しなかったので、第2相臨床試験での推奨されるヒドロキシクロロキンの投与量は、高用量のテモゾロミドと組み合わせて、1日に1回600mgを2回服用と決定された。
一般的な毒性には、グレード2の疲労(55%)、食欲不振(28%)、吐き気(48%)、便秘(20%)、および下痢(20%)であった。
転移性黒色腫の患者において部分奏功が3/22(14%)および病状安定が6/22(27%)の患者で観察された。
最終用量のコホートでは、治療抵抗性のBRAF野生型黒色腫の患者の2/6がほぼ完全に奏効し、病状安定の延長を認めた。併用療法に反応して、末梢血単核細胞のオートファジー液胞(AV)に有意な蓄積が観察された。
この研究は、高用量のヒドロキシクロロキンと高用量のテモゾロミドの組み合わせが安全で忍容性があり、オートファジー阻害の程度と関連していることを示している。
長期にわたる病状安定と奏功率の向上は、黒色腫患者における抗腫瘍活性を示唆しており、悪性黒色腫におけるより強力なオートファジー阻害剤と化学療法の組み合わせのさらなる研究が必要である。
がん領域においては、抗がん剤治療の効果を高めることが多くの基礎研究で報告され、複数の臨床試験が実施されています。
オートファジーを阻害する作用によって、抗がん剤の効果を高めることが報告されています。ヒドロキシクロロキンはリソソームの酸性化を阻害してリソソームの働きを阻止します。以下のような報告もあります。
Hydroxychloroquine potentiates the anti-cancer effect of bevacizumab on glioblastoma via the inhibition of autophagy(ヒドロキシクロロキンはオートファジーの阻害を介して膠芽腫に対するベバシズマブの抗がん効果を増強する)Biomed Pharmacother. 2019 Oct;118:109339.
ベバシズマブは再発性神経膠芽腫患者の治療に広く使用されていますが、ベバシズマブが腫瘍細胞の生存を可能にする細胞保護的オートファジーを誘導することが実証されました。ヒドロキシクロロキン (HCQ) は、オートファゴソームの融合と分解に影響を与えることにより、リソソームの酸性化を阻害し、オートファジーをブロックします。ヒドロキシクロロキンは、化学放射線療法の有効性を高めるためによく使用されています。
この論文では、 膠芽腫細胞に対するベバシズマブの効果をヒドロキシクロロキンが増強することを報告しています。つまり、ベバシズマブの投与に対して、膠芽腫細胞はオートファジーを誘導して細胞死を起こさないように適応します。このベバシズマブ抵抗性をオートファジー阻害剤のヒドロキシクロロキンが阻止するという話です。
抗がん剤治療やアルテスネイト治療を行うとき、オートファジーを阻害するヒドロキシクロロキンの併用は抗がん作用を強化できます。(下図)

図:抗がん剤治療やアルテスネイト(①)はがん細胞にダメージを与えアポトーシスやフェロトーシスの機序でがん細胞を死滅する(②)。がん細胞はオートファジーのメカニズムを誘導し(③)、細胞死に抵抗する(④)。ヒドロキシクロロキンはオートファジーの過程を阻害する(⑤)。したがって、抗がん剤とアルテスネイトヒドロキシクロロキンを併用すると、抗腫瘍効果を増強できる。
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
| « 860)GPR109A(... | 862)アルテス... » |