講座
全身性炎症反応症候群における
活性酸素種の役割
京都大学大学院医学研究科 初期診療・救急医学分野
准教授 松田直之
記載:2010年1月10日
はじめに
活性酸素種(ROS: reactive oxygen species)の存在が分子レベルで報告されたのは1954年である1)。まさにパンドラの箱として発見されたROSも,現在までの54年の歳月を経て,老化,腫瘍,糖尿病,動脈硬化,慢性関節リウマチなどの細胞機能制御因子として詳細な検討が行われてきた。
急性期管理医学領域のターゲットとする全身性炎症や虚血性病態においても,ROSで酸化された蛋白,脂質,DNAが主要臓器機能に影響を与えることが注目されてきた。傷害組織では,浸潤する単球や好中球などの貪食細胞からROSが多量に放出されることに加えて,組織を構成する様々な細胞が独自にROSを産生する。正常生体内ではROSは微量の調節により細胞分化,細胞増殖,免疫反応,炎症反応,酸素センサーとして機能しているが,近年特に病態時における調節機構としてNADPHオキシダーゼ(NOX)のROS産生機構の研究が進んできた。ROSには,スーパーオキシド(O2・),過酸化水素(H2O2),ヒドロキシラジカル(・OH),次亜塩素酸(HOCl),一重酸素(1O2),ペルオキシルラジカル(RO2・),アルコキシルラジカル(RO・)などが含まれるが,この産生の根底として,NOXの発現が注目されている。
このようなROS産生に対して,生体内ではビタミンC,ビタミンE,β-カロチン,グルタチオン,尿酸,ビリルビンなどの生体内物質や,superoxide dismutase(SOD),カタラーゼ,ペルオキシダーゼ,ヘムオキシダーゼなどの抗酸化酵素が,抗酸化分子としてROSの作用に拮抗している。しかし,ROSが過剰に産生される病態においては,これらの抗酸化作用を凌駕して,ROSによる細胞機能障害が進行する。本稿では,生体内におけるROSの過剰産生機構を,重症患者管理における全身性炎症反応症候群の病態に照らして論じる。
全身性炎症反応症候群
全身性炎症反応症候群(SIRS:systemic inflammatory response syndrome)は,1992年に米国集中治療医学会と米国胸部疾患学会により提唱された症候群であり,体温,心拍数,呼吸数,白血球数の4つのクライテリアのうち,2つ以上を満たす病態と定義されている 2)。外傷,手術,広範囲熱傷,急性膵炎,敗血症(sepsis),長期絶食,虚血,ショックなどの基礎疾患において,炎症性サイトカンの産生の表現型としてSIRSが出現する。また,これらに加えて,がん,手術後,高齢者,糖尿病,免疫膠原病,免疫抑制剤使用中,腸疾患,喫煙習慣など基礎病態において,細菌やウイルスなどの感染症は2次性侵害刺激としてSIRSを重篤化しやすく,多臓器不全を合併した重症敗血症(severe sepsis)2)を導きやすい(図1)。このよう病態では,急性肺障害,ショック,急性腎不全,播種性血管内凝固症候群(DIC: disseminated intravascular coagulation)などを同時に合併し,死亡率が高まる。

主要臓器の様々な細胞には,Toll-like受容体(TLR),tumor necrosis factor(TNF)受容体,Interleukin(IL)受容体などの炎症性受容体が存在し,SIRSを進展させることが確認できる3~5)。このようなSIRS病態において,ROSが過剰産生され,炎症やアポトーシスが進行することが確認されている6~8)。集中治療管理を必要とする重症敗血症9),心原性ショック10),急性肺傷害11)などにおいても,様々な臓器で抗酸化分子が低下しているばかりか,ROS産生自体が亢進していることが検証されている。
SIRS病態では,炎症性血球細胞の浸潤に加えて,様々な組織の基幹細胞で独自に炎症とアポトーシスが進行する4)。この機序として,組織一群に炎症性受容体を持つ見張り番のようなAlert細胞(警笛細胞)4, 5)が関与する。末梢組織では,同種の細胞といえどもすべての細胞が炎症性反応を惹起するわけではなく,炎症の狼煙を上げるのは一群に存在する一部の細胞に過ぎない。SIRS病態における主要臓器のAlert細胞は,転写因子nuclear factor-kB(NF-kB),activator protein-1(AP-1),cyclic AMP response element binding protein(CREB)/activating transcription factor(ATF),signal transducer and activator of transcription(STAT),interferon regulatory factor(IRF),hypoxia inducible transcriptional factor(HIF)などの様々な転写因子を活性化させ,ケモカイン,接着分子,炎症性物質の転写を高める4, 5, 12)。さらに,Alert細胞では,炎症性シグナルとしてmitogen-activated protein kinase(MAPK)やプロテインキナーゼC(PKC)などのリン酸化酵素の活性化も認められる。SIRS病態では,このような細胞内情報伝達シグナルを介してAlert細胞でROSが過剰産生され,重症度が高められる。さらに,動員された貪食細胞は,同様の細胞内シグナルを介して極めて高量のROSを放出し,組織細胞障害を広範化させる。
活性酸素種とNADPHオキシダーゼ
ROSは,好中球,好酸球,単球,マクロファージなどの貪食細胞では細胞内でμM~mMレベルに増加し,殺菌作用をもたらすことが知られている13)。一方,主要臓器の基幹細胞や血管内皮細胞や血管平滑筋細胞でもROSは産生されるが,正常時はnM~μMレベルの低濃度に維持されている13)。ROSを産生する細胞内器官は,ミトコンドリア,小胞体,核膜,プロテアソーム,細胞膜などと様々であり,ROSはミトコンドリア電子伝達系に加えて,NOX,シクロオキシゲナーゼ,リポキシゲナーゼ,チトクロームp450,キサンチンオキシダーゼ,ペルオキシダーゼなどの酵素により産生される。このうち特に,NOXはROS産生の中心であり,スーパーオキシドの産生に重要な役割を担う。主要臓器の基幹細胞のROS産生においても,NOXが主要な役割を担うと考えられている13, 14)。
現在,NOXは,NOX1~NOX5,DUOX1~2の7つのアイソフォームが同定され,さらにNOX 作用を高める因子として,NOXと恒常的に会合しているp22phox ,2つのオーガナイザー因子(p47phox,NOXO1),2つの活性化因子(p67phox,NOXA1)およびp40phox,2つのDUOX特異的成熟因子(DUOXA1,DUOXA2)が同定されている。細胞膜上に固定化されるNOX1~NOX5は6回膜貫通型蛋白として,DUOX1/2の2つのアイソフォームは7回膜貫通型膜蛋白として,それぞれの活性化調節因子との連動によりNADPHよりスーパーオキシドを産生する。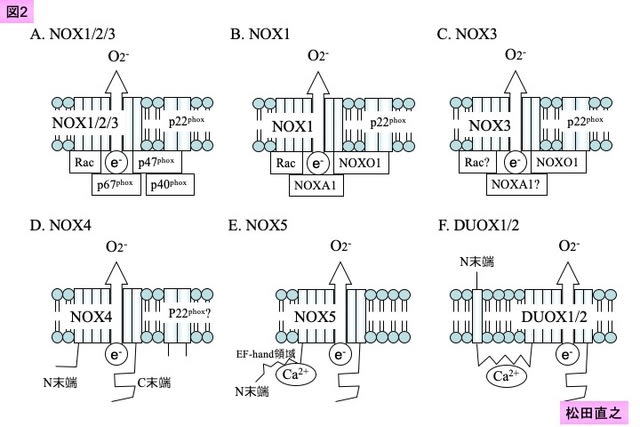
1. NOX2
NOX2は,gp91phoxやb-245として1986年にRoyer-Pokoraら15)や1987年にTeahanら16)によりはじめて同定されたNOXである。6回膜貫通型蛋白としてN末端とC末端が細胞質内に位置するように細胞膜上に固定されるが,その活性化にはp22phoxとの会合に加えて,p47phoxの細胞膜への移動が必要とされる17)(図2A)。p47phoxの細胞膜移動により,次にp47phoxをターゲットとしてp67phoxやp40phoxの細胞膜移動が生じ,最終的にはRacがp67phox と連動してNOX2を活性化させる18)(図3)。Racは現在3種類が同定されているsmall GTPaseであり,主に末梢組織に存在するのはRac1であり,Rac2は主に骨髄系細胞,Rac3は主に中枢神経系に分布している。
NOX2は発見当初,好中球やマクロファージなどの貪食細胞に局在するものと考えられていた。確かにNOX2は貪食細胞に高発現しているものの,神経細胞や腸管,さらには心筋細胞,血管内皮細胞などの心血管系にも比較的高密度に発現している19~21)。このような組織では,p47phoxの細胞膜移動をトリガーとして,スーパーオキシドが産生される。
このNOX2をコードするNOX2遺伝子は,X染色体q21.1に存在する。NOX2遺伝子のプロモーター領域には,NF-kB,AP-1,IRF1,IRF2,PU.1(myeloid-specific transcriptional factor),Elf-1,YY1が結合し,NOX2の転写を高めることができる。虚血,外傷,感染症などにおいては,傷害部位でNF-kBやAP-1や IRFの活性が高まるため12),NOX2発現が高まりやすい。このように炎症局所では,ROSの産生が高まりやすい。これに加えて,心血管系領域ではアンジオテンシンIIにより翻訳レベルでNOX2発現が高まることも報告されている22)。
2. NOX1
NOX1は,NOX2の次に1999年に同定されたNOX2の相同体であり,当初はMox1,NOH1と呼ばれていた23, 24)。NOX1も他のNOXと同様に単独ではROSを産生する能力は極めて低い。NOX1は,NOX2と同様にp22phox との連動が必要であり,さらにNOXO1/NOXOA1(図2B)あるいはp47phox/p67phox(図1A)との会合により活性化され,最終的にはRacにより活性化される25, 26)。NOX1は腸管上皮,肺,腎臓に多く存在するが,血管平滑筋細胞や血管内皮細胞にも発現しており21, 23),特に血管平滑筋におけるNOXの主体はNOX1である。
ヒトNOX1遺伝子はNOX2と同様に,X染色体上(Xq22)に存在する。プロモーター領域には, NF-B,AP-1,IRF,CREB,STAT,CBP/p300,GATAとの結合領域があり,これらによりNOX1は転写が高められる。虚血や炎症で活性が高まるNF-kBや,IL-6シグナルにより活性化されるSTAT3により,NOX1の発現は転写段階で高められる。血管系では,PMA(phorbol 12-myristate 13-acetate)刺激によるPKC活性やPKC-δにより,NOX1発現が高まることも報告されている27)。このようにSIRS病態では,炎症局所でNOX2に加えてNOX1の発現が高まり,ROSの産生が増加すると考えられる。
3. NOX3
NOX3は,2000年に菊池らによりヒト腸管上皮細胞で同定された28)。内耳に高密度に発現し,脳や胎児の腎臓などにも発現を認めるが,心血管系における発現は乏しく,当研究室においてもヒト血管における発現を検出できていない。NOX1やNOX2と同様の活性化分子を介してROSを産生するが,その中でもp22phox およびNOXO1の関与が大きい。しかし,RacがNOX3を活性化させるかどうかに関しては,2008年までの段階で結論が出ていない。現在,NOX3の活性化において,NOXO1存在下ではRacの会合は不必要であり,p47phox存在下ではRacを必要とするとの考えが一般的である(図1A)。NOX3は,NOXO1存在下でヒト腸管上皮細胞で恒常的にスーパーオキシドを産生していると考えられている(図2C)。
4. NOX4
NOX4は,2000年に腎臓と甲状腺で同定された29, 30)。腎臓だけではなく,心血管系の小胞体や核膜に強く発現することが知られている。NOX4が他のNOXと異なる点は,免疫沈降ではNOX4とp22phoxとの結合を確認できるが,必ずしも細胞膜でのp22phox との会合を必要としないことにある(図2D)。NOX4の活性化にはp22phoxが関与するとの報告があるが,NOX4の活性化はp22 phox欠損においても保たれる。また,NOX4の活性化には,他のp47phox やNOXO1/NOXOA1の細胞膜移動やRacの活性化などを必要としないことも報告されている31)。このように,NOX4は他のNOXと異なり,その膜発現量でROS産生を制御していると考えられている。
一方,ヒトNOX4遺伝子は11q14.2-q21に存在し,NOX4発現はTNF-α,アンジオテンシンIIシグナル,PKC活性,高血糖により高められることが確認されている。NOX4はSIRS病態の心血管系で発現が高められる可能性がある。このような状況において,Toll-like受容体4(TLR4)とNOX4は結合することが確認されており,グラム陰性桿菌感染症ではTLR4シグナルが直接にNOX4を活性化させ,ROSを産生させる可能性が示唆されている32, 33)。
5. NOX5
NOX5は,2001年に脾臓や精巣で同定された34, 35)。NOX5は,脾臓やリンパ組織に高密度で存在するが,心血管系にも確認でき,成熟段階のリンパ球には存在するが,血中のリンパ球には存在しないことが知られている。NOX5はNOX1~3と異なり,その活性化にはp47phox やNOXO1/NOXOA1の細胞膜移動やRacの活性化などを必要としない。NOX5は,N末端の細胞内領域が長く保存されているのが特徴であり,EF-hand領域と呼ばれている(図2E)。このEF-hand領域にはCa2+が結合することが知られており36),細胞内Ca2+濃度の上昇によりNOX5は構造変化を起こし,NADPHよりスーパーオキシドを産生すると考えられている36)。NOX5の発現調節については,今後の詳細な検討が待たれる。
6. DUOX1/2
DUOX1/2は,1999年に甲状腺より同定された30, 37)。甲状腺以外には,気管支上皮細胞やLangerhans島に存在するが,心血管系には同定できない。他のNOXと異なり,7回膜貫通型蛋白であり,N末端領域が細胞外に位置する。DUOX1/2もNOX5と同様に,細胞内にCa2+結合部位を持つ。甲状腺上皮細胞では,細胞内Ca2+濃度の上昇によりDUOX1/2を活性化させ,スーパーオキシドを産生する。
7. p22phox
p22phoxは,NOXに機能を補助する分子として,極めて重要なら区割りを担う。このp22phoxの主な機能は,①NOXの細胞膜上での安定化,②p47phox とNOXO1との結合の2つにある。一般にNOXの細胞膜分画のウエスタンブロッド解析を行う際に,そのバンド検出蛋白重量にばらつきやスメアが生じやすい理由のひとつとして,NOXとp22phoxの恒常的会合や糖鎖修飾があげられる。NOXとp22phoxは,細胞膜上で1:1の比率で会合しており38),NOXやp22phoxが会合せずに単体で存在する場合には,これらは細胞質内に陥入し,プロテアソームにより分解されやすい39)。そして第2の役割として, C末端のプロリンリッチ流域(PRR)を介して,p22phoxはp47phox やNOXO1のSH3ドメイン(Src homology 3 domain)と結合できる。このように,p22phoxは,NOXとオーガナイザー因子(p47phox,NOXO1)を橋渡しする足場蛋白としての役割を担っている。
8. NOXオーガナイザー因子(p47phox,NOXO1)
p47phox (NOXO2)とNOXO1の役割は,p22phoxとの結合の後にNOX活性化因子(p67phox,NOXA1)を細胞膜に動員させることにある。p67phoxとNOXA1は共に,N末端領域にphoxドメイン(PXD)を保持しており,このPXDにより細胞膜リン脂質と結合できる。さらにC末端のPRRを介して,p47phoxはp67phoxと,NOXO1はNOXA1と結合できる。p47phoxとNOXO1には,PXDとPRRの間にSH3ドメインがあり,p22phoxと結合する40)。この2つのオーガナイザー因子のうち,心血管系に豊富なのはp47phoxであり,NOXO1は腸管,肝臓,腎臓,膵臓などに高密度で発現している。
p47phoxとNOXO1の違いは,p47phoxは活性化抑制領域(AIR: autoinhibitory region)を持つ点にある。また,NOXO1は主に細胞膜上のホスホチジルイノシトール1リン酸に結合するのに対して,p47phoxはPI3キナーゼにより細胞膜で変化を受けた3’-ホスホチジルイノシトールとPXDで結合するが特徴がある41)。炎症病態の貪食細胞や血小板ではPI3キナーゼの細胞膜移動が亢進し,p47phoxの細胞膜接着が高まりやすい。さらに,虚血や炎症の過程でNF-kB活性などによりp47phoxとNOXO1の産生が高まることが知られている。このような量的活性化調節に加えて,p47phoxは即時型活性化調節を受ける。
p47phox のAIRは,その3次構造の特徴より立体的にp22phoxとの結合領域であるSH3ドメインを遮蔽している(図3)。現在,p47phox のAIRにおいて特に,Pro299,Pro300,Arg301,Arg302,Ser303,Ser304,Ser328,Ser345,Ser359,Ser370,Ser379などが機能的アミノ酸として重要と考えられている。p47phox が構造変化を起こし,p22phoxと結合できるようになるためには,Ser303からSer379までのいずれかのリン酸化が必要であり,特にSer379とSer345の単独リン酸化や,Ser303+Ser304あるいはSer359+Ser370の重複リン酸化が必須となる42, 43)。このように,p47phox はNOXO1と異なり,AIRのリン酸化により細胞膜上のp22phoxとの結合を高める特徴がある。p47phoxのAIRのリン酸化は,TNF-αやIL-1βなどの炎症性サイトカイン,リポポリサッカライドなどのTLR刺激,G-CSF,GM-CSF,PAFなどにより,MAPキナーゼ(p38MAPK, ERK1/2)やPKCの活性化を介して生じることが確認されている44)。
以上のように,炎症病態において厳密に機能調節されているオーガナイザー因子はp47phoxであり,SIRS病態ではp47phoxで選択的に活性化されるNOX2の調節機構がスーパーオキシドの産生に極めて重要な役割を担うと考えられる。

9. NOX活性化因子(p67phox,NOXA1)とp40phox
p67phox(NOXA2)やNOXA1は,それぞれC末端領域のSH3ドメインでp47PhoxやNOXO1と結合する。p67phoxは,さらにC末端領域にp40phoxと結合するPhox/Bem1(PB1)ドメインをもつ。p40phoxは,p67phoxのNOX活性化作用を強化するが,siRNAを用いた培養細胞における検討などよりNOXの活性化に必要不可欠な分子ではないと考えられている。p67phoxやNOXA1は,N末端ではRacと結合し,最終的にRacのGTPase活性を介して,NOXを活性化させる。
このような特徴を持つp67phoxは,貪食細胞に加えて,血管内皮45)や血管平滑筋46),腎臓にも発現している。NOXA1は,腸管や肺に加えて,血管平滑筋に恒常的に発現しており,血管平滑筋におけるNOX活性化因子の主体はNOXA1と考えられている。p67phoxは,NOX2と同様にIFR1やPU.1などの転写活性で増加すると共に,AP-1により発現が高まることが確認されている47)。このように,p67phoxも他のNOX活性化因子と同様に,SIRS病態で転写が高まると評価される。
活性酸素種の病態修飾
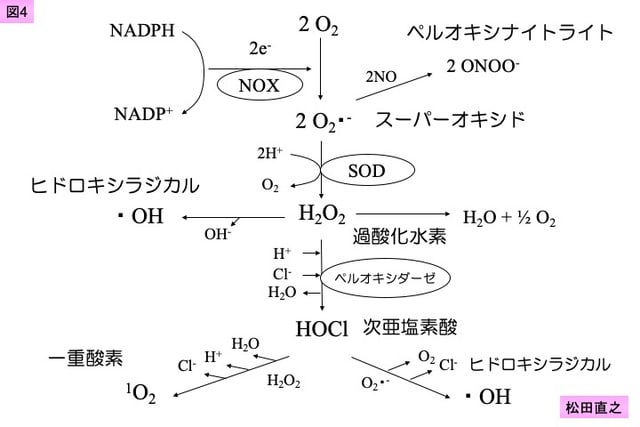
ROSがDNAや細胞内情報伝達蛋白に障害を与えることは,これまで多くの研究で明らかとされてきた。NADPHはNOXの活性化された細胞において,図3のように,まず,スーパーオキシドに変換される。スーパーオキシドは,次に一酸化窒素(NO)との反応によりペルオキシナイトライトに変換されるとともに,SODにより過酸化水素に変換される。過酸化水素からは,ヒドロキシラジカルや次亜塩素酸が産生される。
これらのROSによるDNA障害は,適切に修復されない限り,アポトーシスを介した細胞死の誘因となる。また,ペルオキシナイトライトは,細胞内情報伝達蛋白のチロシン残基のニトロ化を介して,チロシン残基のリン酸化を障害し,正常な細胞内情報伝達を障害する48)。次亜塩素酸も極めて強い組織障害を与えることが知られており,これらのROSはインシュリン受容体の機能障害にも関与し,インスリン抵抗性高血糖の誘引として知られている49)。その他,以下のROSを介した転写因子活性化作用が明らかとされており,SIRS病態を増悪させると評価される。