米シカゴのノースウェスタン・メモリアル病院は10日,人体に有害な多くの細菌がコンピューターのキーボードの上で24時間以上生存するとの研究結果をまとめた。病院でのハイテク投資が加速するなかで,感染症増悪の脅威となる可能性が増すとしている。研究報告は,素手であればキーボード上の細菌に汚染された医師や看護士の手を通じて,患者が細菌に感染する可能性があると説明する。この病院で疫学を担当するゲリー・ノースキン医師は,「病院で電子カルテを導入する傾向がみられるようになっており,全病室にコンピューターを設置する病院も出てきている」と述べた。ノースキン医師は、感染を予防する最良の方法は,まめに手洗いを行うこととしている。
(ロイター) - 4月11日15時10分
(コメント)病院には実に汚いkeyboardがたくさんころがっている。あまりに汚いので僕は良く酒精綿で拭いてあげている。まず,僕の当直はtebleをアルコール綿で拭くところから始まる。しかし,以前行ったkeyboard面の環境培養検査ではMRSAや緑膿菌が検出されたことはない。
心肺停止の判定と治療
Evaluation and care of cardiac arrest
松田直之
【はじめに】AHAガイドライン2000
American heart association(AHA)による心肺蘇生のガイドライン2000(AHAガイドライン2000)が2000年に発表され1),1992年のガイドラインと比較し,より科学的論証に基づいた心肺蘇生法が提唱されるようになった。現在,このAHAガイドライン2000を用いた心肺蘇生が世界共通に行われ,シュミレーショントレーニングも多くの医療施設で医療従事者や医学生を対象に実施されるようになり,質の高い心肺蘇生法を学び,さらにより良いものへ改良していく基盤ができつつある。
【1】BLSからACLSへのスムーズな移行
1. Chain of survival concept(救命の連鎖)
救命のためには1)early access(早い通報),2)early CPR(早い1次救命処置),3)early defibrillation(早い除細動),4)early advanced care(早い2次救命処置)の4つの医療の連鎖が重要であり,これらを的確に連結させて初めて心肺停止患者の救命が可能となり,これをAHAはchain of survival concept(救命の連鎖)と呼んでいる。院内で意識レベルの低下した患者を発見した場合であれば,すぐに人を集め,第1発見者が適切にBLSを行い,人や救急カート,背板,除細動器,心電図計が到着した際には,まず,優先して除細動の適応を評価し,必要であればACLSに移行することになる。
2. Primary ABCD surveyとsecondly ABCD survey
心停止の評価は,BLSの手順に準じて行われる。まず,意識確認を行い,意識低下を認めた場合,「見て・聞いて・感じる」呼吸の確認(10秒間以内)を行い,気道確保(頭部後屈あご先挙上法,あるいは,下顎挙上法)の後,rescue breathingを2回行い,「息・咳・動き・脈の触知」による循環徴候の確認(10秒間以内)を行う。このようなairway(A),breathing(B),circulation(C)の評価がBLSの基本となる。次に人が集まり,救急カートや心電図計,除細動器がそろった際には,すぐに心電図を装着し,まず心電図波形を評価する。この波形が心室細動(ventricular fibrillation: VF)か無脈性心室性頻拍(ventricular tachycardia: VT)の場合のみ,除細動(defibrillation: D)の適応になる。ここまでの評価と対応をprimary ABCD surveyと呼び,VFと無脈性VTに対する早期除細動の必要性をBLSに持ち込んだ概念である。
3. Secondly ABCD survey
BLSのprimary ABCD surveyに対し,ACLSではsecondary ABCD surveyへ移行する。Secondary ABCD survey はprimary ABCD surveyと対比して理解するとよい(表1参照)。
4. ACLSチームリーダーを決定することが大切
皆がばらばらに動く心肺蘇生法は混乱を招き,蘇生効率が低下するため,ACLSではチームリーダーを決定し,リーダーの指示に従い行動する。ACLSはACLSのアルゴリズムを十分に理解した者により行なわれることが望ましく,チームリーダーはACLSのアルゴリズムを十分に理解した医師とする。リーダーには患者状態評価と蘇生における問題解決能力が要求される。
5. 感染防御の重要性
ACLSの施行にあたり,標準予防策に準じた感染防御を行うことが必要である。ACLSに参加してくる医療従事者には,手袋,マスク,ガウンの着用を推奨する。
【2】心停止の判定と心電図評価
1. Flat line protocol
心電図を装着してまっすぐな直線(flat line)だったからといって,心停止と早急に評価してはならない。心停止の最終確認はcheck pulseであり,頸動脈触知によるcheck pulseを必ず行う。心電図波形がflat lineである場合,flat line protocol(表2)に準じた確認を行う習慣も大切である。電極装着の確認,心電図感度を上げる,心電図誘導を変えることにより,隠れたVFの発見につながる。ACLSリーダーは,心電図を装着してflat lineを見たときに,心電図誘導を変え,心電図感度を最大とするように周囲に依頼することが大切である。
2. 心停止の心電図診断と4つの波形
心停止と評価する心電図波形は1)VF,2)pulseless VT,3)asystole(エイシストリー)(心静止),4)PEA(pulseless electrical activity)(無脈性電気活動)の4つである。このうち,除細動の適応はVFとpulseless VTであり,asystoleやPEAには除細動を行ってはならない(図1)。PEAは従来の電導収縮解離と同義であり,心電図波形が認められるものの,脈の触知ができない状態をさす。
3. Check pulseの重要性
心電図で心停止波形を認めたときは,必ず,頸動脈を触知し,心停止の最終確認を行う。Check pulseには頚動脈触知が第1選択であり,通常,頚部は露出されているため,触知法を覚えることで素早い頸動脈触知が可能となる。頚動脈触知は,まず甲状軟骨を触知することが大切であり,次に,手前に指を滑らせ胸鎖乳突筋との間域で触知するのが原則である。
<特論:Check Pulse:MATSUDA法>
NORMAL MATSUDA法2000
a. 頸動脈を第1選択とする。
b. 甲状軟骨を第2指と第3指の2本指で触知する。
c. 指は手前にすべらせる。
d 甲状軟骨と胸鎖乳突筋の間隙で2本の指を立てる。
e. 指圧は,動脈触知に適した圧に感知調節とする。
以上を,天井を見ていても,他の皆の処置を見ていても,患者さんを見なくてもできるまでにトレーニングする。
頭部保持MATSUDA法2000
頭の側に位置して,気道確保している状態では,左の頚静脈は自分の左手で,右の頚静脈は自分の右手で触知する。私は,研修の時期に,右手でも左手でも動脈圧ライン(観血的動脈路)や静脈路を確保できるように自己トレーニングしたが,この応用である。患者さんの頭に立った場合,他の者の邪魔をしない空間管理が,多発外傷にしても,心肺蘇生においても最も重要である。50 cm2で動くなと,後輩には教えている。つまり,頭側に立った場合には,患者さんへの左側処置は全て自分の左手を使い,患者さんへの右側処置はすべて自分の右手を付けうようにトレーニングされて初めて救急科医であるのだ。
a. 患者さんへの左側頸動脈触知は,自分の左手を使う。
b. 患者さんへの右側頸動脈触知は,自分の右手を使う。
【3】心電図波形に準じた心停止治療のアルゴリズム
心電図装着後は,ACLSチームリーダーが心電図波形を評価し,「VFのアルゴリズムで治療を開始します」などのように,治療のアルゴリズムを大きな声で宣言し,チームが同一の治療方針にあるように方向付けることが大切である。心電図波形により心停止治療のアルゴリズムが異なることに留意して治療に当たる。
また,これらの治療では,絶え間ない心臓マッサージを原則とし,不必要に心臓マッサージが中断しないように工夫する。循環の再評価は1分毎に頚動脈触知と心電図確認で行い,タイムキーパーを1人用意し,1分毎に連絡してもらうとよい。さらに,記録係を一人設けることで,処置内容や使用薬物,心電図波形の記載を残すことが可能となり,あわただしい中にあっても,記録を残すように工夫する。
1.VFとpulseless VTのアルゴリズム
VFとpulseless VTの治療のアルゴリズムを図2に示した。心電図装着後,VFとpulseless VTである場合,電気的除細動の絶対的適応となる。VFかpulseless VTが継続する限り,3回の除細動が終了するまではパドルを胸壁より離さずに200 J,300 J,360 Jの順に除細動を継続させる。この最初の3連続除細動に反応しない難治性VFやpulseless VTの場合,secondly ABCD surveyに移行する。
まず,ACLSチームリーダーは気道確保者に気管挿管の指示を出し,次に,別な医師に静脈路確保の指示を出す。気管挿管後は気管内からエピネフリンを投与し,静脈路確保後は静脈内投与に変える。成人の場合,気管挿管完了までは心臓マッサージと人工呼吸は15:2の比率で同期させるが,気管挿管後は心臓マッサージは1分間に100回の速度とし,人工呼吸と非同期でよい。除細動を行う以外では,チームリーダーは絶え間ない心臓マッサージを指示し,1分毎に循環の再評価を行う。エピネフリンは3~5分毎の投与とし,その間1分毎の循環評価に際しては,VFやpulseless VTが継続している場合,リーダー自らが360 Jで除細動を1回のみ行う。除細動無効時には,図2のように抗不整脈薬投与を考慮し,循環の再評価にあわせてリドカイン,硫酸マグネシウム,プロカインアミドの順に選択する。この他に抗不整脈薬として推奨されているものにアミオダロンがあるが,日本では静注薬が発売されていないため,同じVaugham Williamsらの分類のIII群抗不整脈薬に分類されるニフェカラント(シンビット®)を用いてもよい。このような治療に効果を示さない難治性不整脈に対しては,心原性の心肺停止の可能性が高く,経皮的心肺補助(percutaneous cardiopulmonary assist systems:PCPS)の導入を考慮するが,AHAガイドライン2000では,明らかな余後改善の有効性は示されていない。
2.Asystoleの治療のアルゴリズム
心電図装着後,flat lineを確認した場合,flat line protocolに基づき,隠れたVFを除外することが大切である。その上で,check pulseを行い,asystoleと確定した場合,チームリーダーは「asystoleのアルゴリズムで治療を開始する」と宣言する。直ちに,secondary ABCD surveyに移行し,気管挿管,静脈路の確保を指示し,1分毎の循環評価の際にasystoleが継続していればエピネフリン,アトロピンを順に用いる。動脈血ガス分析により代謝性アシドーシスや高K血症が高度な場合には重炭酸ナトリウムの投与も考慮するが,これはルーチンに行われるものではない。チームリーダーは絶え間ない心臓マッサージを指示することが大切である。
3.PEAの治療のアルゴリズム
心電図装着後,心電図波形が認められるものの,脈を触知できない場合,PEAとしてsecondary ABCD surveyに移行する(図4参照)。PEAの治療はasystoleに準じるが,表3の原因検索を行うことが重要である。このために,動脈血ガス分析,エコー図が有用であり,潜在的な血流を評価するためには超音波ドプラーが鋭敏である。Asystoleと同様にPEAに対する最も重要なことは,治療可能な原因を検索し,原因を特定し,取り除くことにある。動脈血ガス分析の結果,極度なアシドーシスや高カリウム血症が存在する場合,重炭酸ナトリウムの投与を考慮し,出血や脱水による循環血液量低下に対しては急速輸液の反応をみる。
4.呼気ガス二酸化炭素モニタによる心臓マッサージの効果判定
心停止のアルゴリズムにのっとり,治療を行う過程での有効な心臓マッサージの評価は,呼気ガス二酸化炭素モニタを用いるとよい。Secondly ABCD surveyへ移行し,気管挿管され,心臓マッサージが有効な場合には肺血流が生じるため,呼気ガス二酸化炭素モニタに呼気ガス波型が生じる。心停止のアルゴリズムにおいて,循環評価の時期以外には絶え間ない心臓マッサージを継続させることがチームリーダーの役割でもあるが,呼気ガス二酸化炭素モニタを用いて心臓マッサージの有効性を評価するとよい。
【4】心肺蘇生に用いる薬物の留意点
1.気管内投与と静脈内投与の原則
すべての心停止波形のsecondary ABCD surveyのアルゴリズムにおいて,気管挿管は静脈路確保に優先する。蘇生に用いる薬物のうちエピネフリン,アトロピン,リドカインは気管内投与することが可能であり,静注量の2~2.5倍を10 mLの生理的食塩水か蒸留水で希釈して気管内投与できる。
静脈路確保は正中皮静脈を第1選択とし18 Gカテーテルを留置するのがよい。正中皮静脈からの薬物投与後は,輸液剤20 mLを急速に後押しし,上肢を10~20秒間挙上させることで, 全身循環に薬物が早く到達するようにする。
2.エピネフリン(エピクイック®)
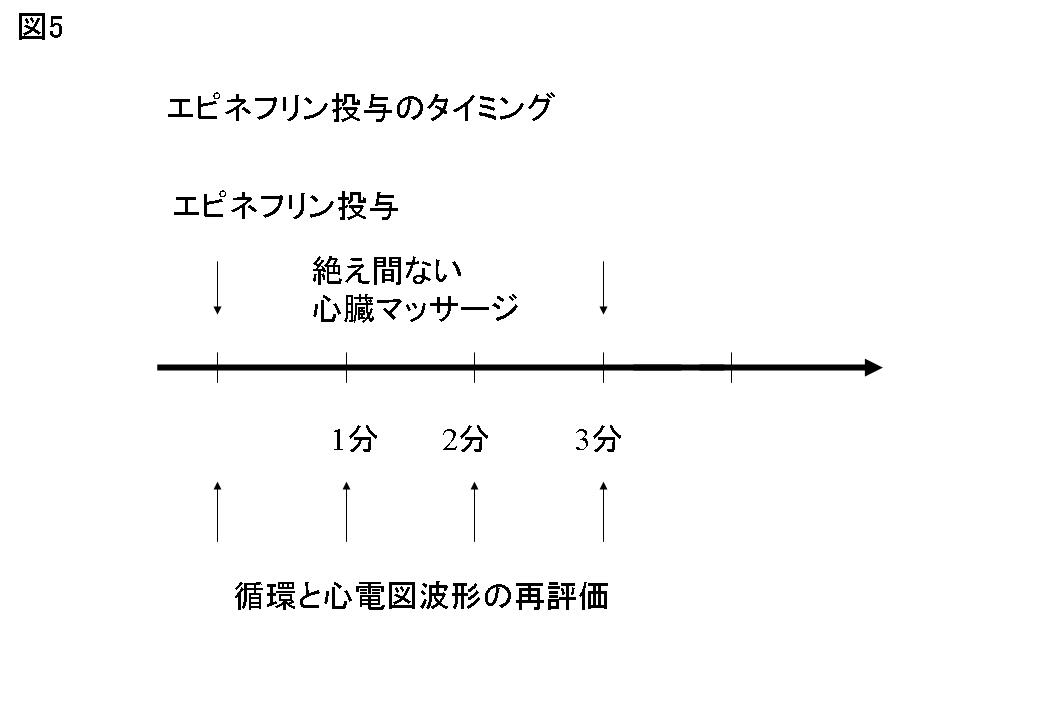
エピネフリンは他のアドレナリン受容体作動薬よりも脳血流と心臓血流を増加させ,心停止における脳血流維持のためのカテコラミンとしてAHAガイドライン2000でも推奨されている。エピネフリンの静脈内投与量は1回1 mgが推奨されており,これ以上の多量のエピネフリン投与はむしろ心毒性として働き,有害である可能性が示唆されている。エピネフリンの血中消失半減期は3~5分であるため,1分毎の循環の再評価の際に,3~5分毎にエピネフリンを追加投与する(図5参照)。実際に,エピネフリンは社会復帰のための心肺蘇生に必要なのかどうか,この検証は重要である。社記復帰のための心肺蘇生には,アトロピンのみを用いて,心臓のムスカリン受容体シグナルM2-Giを抑制することのみが重要と考える。
3.バゾプレッシン(ピトレシン®)
本稿の心停止波形のアルゴリズムではエピネフリン投与を第1選択として記載したが,AHAガイドライン2000ではエピネフリンの代わりに,バゾプレッシン40 Uの静脈内投与も推奨されている。バゾプレッシンは強い血管収縮作用により脳血流と心臓血流を増加させることができ,消失除去半減期が10~20分であるため,1度投与すると10~20分間は再投与を必要としない。10~20分後に治療効果が得られない場合は,エピネフリンに戻ることが容認されている。
5.アトロピン(アトクイック®)
アトロピンはasystoleとPEAのアルゴリズムで用いられ,エピネフリンまたはバゾプレッシンの次に用いられる第2選択薬である。副交感神経遮断により交感神経緊張を高めるが,心筋酸素消費量を高める可能性や低体温での使用に注意が必要である。通常は,asystoleとPEAのアルゴリズムにおいて,エピネフリン投与1分後の循環評価の際にasystoleとPEAが継続した場合に,アトロピンを1 mgを静脈内投与する。アトロピンの血中消失半減期は10時間以上であり,極量を0.04 mg/kgとし,この量により十分な副交感神経遮断ができる。しかし,pH<7の状態では,アトロピンによる副交感神経遮断は,心筋細胞のCa過負荷を助長させるのみであり,蘇生には無効であろう。
6.リドカイン(リドクイック®)
リドカインはVFとpulseless VTの抗不整脈治療に用いる第1選択であり,これらの治療アルゴリズムではエピネフリンの次に投与される。リドカインは心室筋の自動能を抑制しVFやVTの発生を抑制する。リドカインの推奨される1回静脈内投与量は1~1.5 mg/kgである。難治性VFに対しては5~10分ごとに0.5~0.75 mg/kgの追加静脈内投与を行うが,3 mg/kgを蘇生における投与極量とする。高齢者や肝機能障害を伴う患者ではリドカイン投与量を減じる必要があり,投与量下限値1 mg/kgの1回投与でよい。
7.硫酸マグネシウム(マグネゾール®,コンクライト-Mg®)
VFとpulseless VTに対して,マグネシウムの有効性を示した大規模無作為試験はなく,有効性が確立されていないが,アルコール中毒や低栄養,低マグネシウム血症が疑われる患者には硫酸マグネシウム1~2 gを1~2分で静脈内投与することが推奨されている。低マグネシウム血症がなくともtorsades de pointesパターンのVFにはマグネシウム投与が有効である。心臓の刺激伝導系や心筋細胞のL型カルシウムチャネルを抑制するように働いており,低マグネシウム血症は心筋細胞の自動能を亢進させ,不整脈や突然死を惹起する誘因となる。一方,マグネシウムの急速投与はasystoleを惹起する可能性があり,投与に際しては,マグネゾール(10%)® (1アンプル:2 g/20 mL)か,コンクライト-Mg ® (1アンプル:2.47 g/20 mL)を1~2分かけてゆっくりと投与する。
8.プロカインアミド(アミサリン®)
プロカインアミドは心筋の自動能のみならず,心室内電導を抑制するために,リドカインに抵抗性のあるVFやpulseless VT,また,非VF状態になるものの再びVFに戻る難治性VFの治療に用いる第3選択の抗不整脈治療薬である。アミサリン® 200 mg(1アンプル 100 mg/mL)を生理食塩水18 mLで希釈して総量 20 mLとし,1分毎に20~30 mg(2~3 mL)の投与とし,最大17 mg/kgまで投与する。プロカインアミド投与により不整脈が消失し心拍が再開した場合は,シリンジポンプを用いて維持量を1~4 mg/分とするが,プロカインアミドは腎排泄であるために,長期投与に際しては腎機能を十分に評価する。
9.ニフェカラント(シンビット®)
Vaugham Williams分類ですべての群の作用を有するアミオダロンの有効性がVF治療において知られているが,Vaugham Williams分類でIII群抗不整脈薬に分類される塩酸ニフェカラント(シンビット®)を用いた有効例が報告されている。シンビット®1瓶50 mgを生理食塩水20 mLに希釈し,1回0.3 mg/kgを5分間かけて緩徐に静脈内投与することができる。私は,難治性VFであればニフェカラントを使用する。しかし,アミオダロンの静注使用が最も期待される。
10.炭酸水素ナトリウム(メイロン®)
炭酸ナトリウムは蘇生においてルーチンに使用すべきものではなく,血液pHをアルカリ化することでヘモグロビンの組織局所での酸素放出を妨げ,組織の嫌気性代謝を促進させる可能性があることに注意する。また,換気が不十分な状態での炭酸ナトリウム投与は,組織への二酸化炭素の蓄積を促し,透過した二酸化炭素により組織のアシドーシスが助長する。よって,心肺停止で炭酸ナトリウムの投与が推奨される場合は,1)高カリウム血症,2)気管挿管が既に行われ換気が十分に行える場合,3)pH 7.2以下の代謝性アシドーシス,4)薬物中毒による心停止で尿をアルカリ化したい場合に限られる。メイロン®の初期投与量は1 mEq/kgとし,10分後に半量を投与する。一般に,pH7.2を目標として,適正換気とともに,メイロンの使用を施す。pH<7.0では,心筋細胞のCa過負荷,心拡張不全に注意する。
【5】心肺蘇生の中止
心肺蘇生を中止する場合は,1)患者の生命反応が戻った場合,2)上級者に判断を委ねる場合,3)非可逆的な死の確認,4)医学的専門家が中止を指示する場合,5)蘇生処置を行う者が疲れたり周囲に危険が迫った場合,6)患者が蘇生を拒否していたことが判明した場合(DNAR:do not attempt resuscitate)が挙げられるが,特に,ACLSにおいては,十分な蘇生処置が行われて30分を目安に自発的な循環が再開することがない場合,CPRを中止してもよいとされている。患者の非可逆的な死の兆候として,死斑の出現は20~30分,死斑融合は1~2時間,顎硬直は2~3時間であり,蘇生処置を開始したものの,十分に効果が得られない場合は,非可逆的な死を確認することが必要である。
【おわりに】ICLSコースとACLSコース
本稿ではAHAガイドライン2000に沿って,心停止の判定と治療の概略を述べた。心停止波形に準じた各アルゴリズムをACLSチームとして行うトレーニングは,救急領域を超えて,医療従事者の常識として重要である。現在,日本救急医学会が主催するICLS(immediate cardiac life support)コース2),日本循環器病学会の主催するACLSコース3)が,心肺蘇生のシュミレーションを提供しており,このようなコースに参加し,心肺蘇生を体得することも重要である。その一方で,頭を使って,次代を予測して,ガイドレインレベルを超えた究極の心肺蘇生理論を展開することが救急医学を教育する講座には期待される。ブログであるために,未来像を展開している記載もあるが,本稿が,新しい心肺蘇生法の手引きとなれば幸いである。心肺蘇生は,技術,つまりテクニックとして,完成される基礎がある。そのテクニックの普遍化をはかる一方で,次代を変えるための発展と創造が,この領域にも重要である。
参考文献
1. American Heart Association: Guidelines 2000 for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 102: I-1~I-252, 2000
2. 平出敦,山畑佳篤:ICLSコースガイドブック. 羊土社 p12-75,2004
3. 岡田和夫,青木重憲,金弘 監修:ACLS プロバイダーマニュアル. 中山書店 p1-130,2004
<表と図>
表1 Primary ABCD surveyとsecondary ABCD survey

表2 Flat line protocol

表3 PEAの原因鑑別

図1 心停止の4つの心電図波形
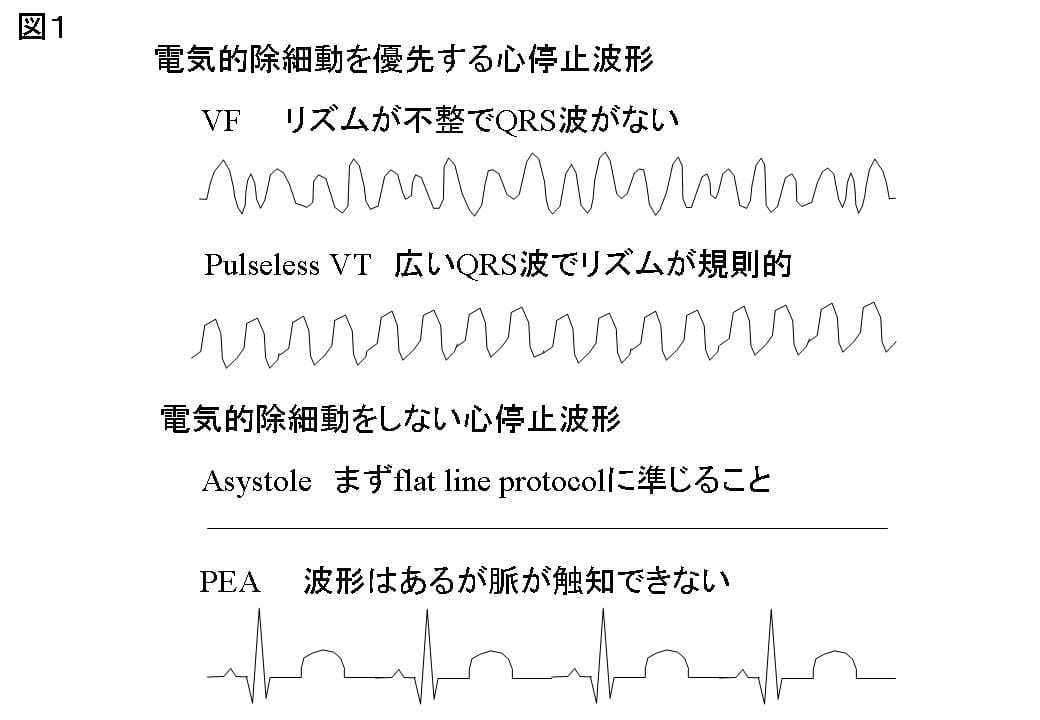
図2 VFとpulseless VTの治療のアルゴリズム

図3 Asystoleの治療のアルゴリズム

図4 PEAの治療のアルゴリズム
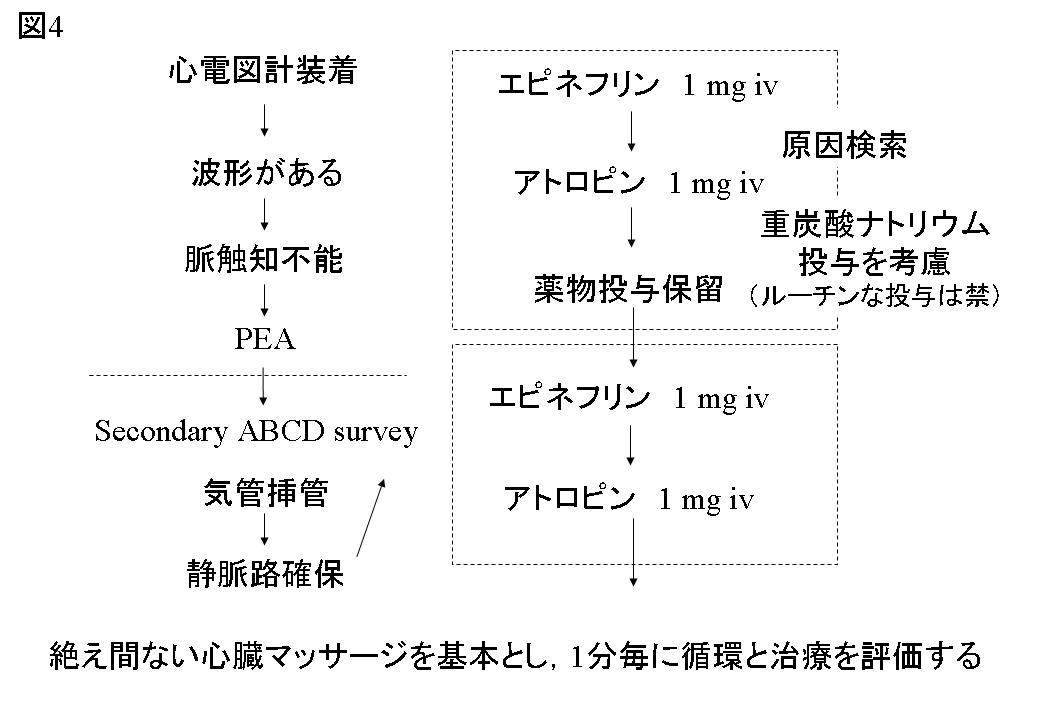
図5 エピネフリン投与のタイミング
Karl S Lang, Mike Recher, Tobias Junt, Alexander A Navarini, Nicola L Harris, Stefan Freigang, Bernhard Odermatt, Curdin Conrad, Lars M Ittner, Stefan Bauer, Sanjiv A Luther, Satoshi Uematsu, Shizuo Akira, Hans Hengartner & Rolf M Zinkernagel
Autoimmune diabetes mellitus in humans is characterized by immunological destruction of pancreatic beta islet cells. We investigated the circumstances under which CD8+ T cells specific for pancreatic beta-islet antigens induce disease in mice expressing lymphocytic choriomeningitis virus (LCMV) glycoprotein (GP) as a transgene under the control of the rat insulin promoter. In contrast to infection with LCMV, immunization with LCMV-GP derived peptide did not induce autoimmune diabetes despite large numbers of autoreactive cytotoxic T cells. Only subsequent treatment with Toll-like receptor ligands elicited overt autoimmune disease. This difference was critically regulated by the peripheral target organ itself, which upregulated class I major histocompatibility complex (MHC) in response to systemic Toll-like receptor−triggered interferon- production. These data identify the 'inflammatory status' of the target organ as a separate and limiting factor determining the development of autoimmune disease.

















