講座 急性呼吸促迫症候群 ARDSの病態と管理 2017
Acute Respiratory Distress Syndrome
名古屋大学大学院医学系研究科
救急・集中治療医学分野
教授 松田直之(まつだなおゆき)
はじめに
急性呼吸促迫症候群(acute respiratory distress syndrome:ARDS)は,炎症性分子の産生を伴う血管透過性亢進を主体とした非心原性肺水腫であり,病理学的にはびまん性肺胞傷害(diffuse alveolar damage:DAD)を特徴とする。1967年にAshbaughら1)によってショックや外傷に急性呼吸不全が合併することが報告され,1971年にはPettyとAshbaugh2)により成人に発症する呼吸不全症候群としてARDS(adult respiratory distress syndrome)が提唱された。その後,1988年にはMurrayら3)は,肺傷害スコア(lung injury score:LIS)を用いて,急性肺傷害(acute lung injury:ALI)の用語が紹介した。以上を主軸とする経緯の中で,1992年には米国胸部疾患学会(ATS)と欧州集中治療医学会(ESICM)の合同検討会(American-European consensus conference:AECC)が開催され,1994年にBernardら4)によってARDSの定義と診断基準が公表され,ARDSの臨床研究ベースが構築された。2012年には, ARDSの臨床研究を踏まえて,新たにBerlin定義5)が公表されている。この治療のエッセンスは,炎症性サイトカインおよび増殖性サイトカインの制御である。敗血症に合併しやすいが,外傷,急性薬物中毒,熱傷などにも合併する。第45回日本救急医学会総会・学術集会(大阪)では,以下の内容に基づいて,当教室のsevere ARDSの管理ストラテジーついてディスカッションした。随伴する線維化についても,未然の注意した管理が期待される。本稿では,ARDSの定義を振り返り,病態,および現在の治療について基本的内容を整理する。
ARDSの定義
1.AECCによるARDS定義
1994年に公表されたAECCによるARDS定義4)は,①急性発症,②胸部X線像における両側びまん性浸潤影,③肺動脈楔入圧<18 mmHgもしくは左房圧の上昇がない,④PaO2/FIO2比 ≦ 300 mmHgをALI,PaO2/FIO2比 ≦ 200 mmHgをARDSとするという4項目からなる(表1)。このAECC定義に基づき,前向き臨床研究が施行され,人工呼吸管理などの幾つかの指針が構築され,非侵襲的陽圧管理(non-invasive positive pressure ventilation: NPPV)や人工呼吸における終末呼気陽圧(positive endexpiratory pressure:PEEP)の使用がルーティンになった。この状況において現在は,PaO2/FIO2比の評価をより末梢気道に陽圧を残した状態として,厳密に行う必要が生じた。また,急性発症の定義の具体化,画像評価の検討,心不全評価の見直しなどが提案され,これまでの研究に準じた実証性と実現性を求める定義として,2012年に新たにBerlin定義5)が公表された。
2.ARDSのBerlin定義
2011年9月30日から10月2日までの3日間, ARDSの新定義に対するテーブル会議がBerlinで行われた。Berlin定義の特徴は,①急性発症を1週間以内としたこと,②両側性胸部陰影において胸水,無気肺および結節では説明がつかないもの,③心原性肺水腫の臨床上の否定,④PEEPやCPAP(continuous positive airway pressure)の設定に基づくPaO2/FIO2比の評価,⑤ARDSとしてPaO2/FIO2比による3段階評価とした,以上の5内容にある(表2)。管理においてリスクがない場合には,心エコーによる心原性要因の評価,体血管抵抗などの理学所見,bronchoalveolar lavage(BAL)などの施行を検討することも検討された。さらに,本定義にCT像や炎症分子マーカーを含めるかどうかも検討されたが,多くの施設における実現性の問題などの理由より,定義に含めることが見送られた。また,肺コンプライアンス,死腔,画像所見による重症度などの評価基準を定義に含めることも見送られた。Mild ARDSをPaO2/FIO2比 ≦ 300 mmHg,Morerate ARDSをPaO2/FIO2比 ≦ 200,severe ARDSをPaO2/FIO2比 ≦ 100 mmHgとして,肺酸素化低下の各レベルに適した診療にたいする臨床研究が期待されている。
ARDSの病態
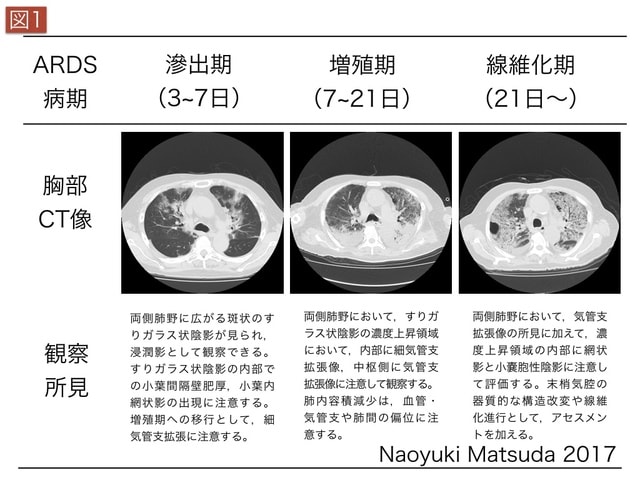
ARDSは,酸素投与だけでは改善しない高度な低酸素状態を特徴とする。肺胞腔への水分貯留による酸素拡散低下,肺コンプライアンス低下,換気血流比低下,肺サーファクタントの機能不全,肺血管内皮細胞傷害を伴う肺血管抵抗上昇などの複数の病態が関与する。このようなARDSの病理学的所見は,DADを特徴とする。DAD病理像は,ARDS発生時より大きく,滲出期,増殖期,線維化期の3つの病期に分類されている(図1)6)。
まず,ARDS初期の血管透過性亢進を特徴とする時期は,滲出期と呼ばれ,肺胞上皮細胞や血管内皮細胞の細胞死,および硝子膜形成が認められる。硝子膜は,フィブリノーゲンやフィブロネクチンなどの血液成分が肺胞壁に沿って沈着したものである。その後,ARDS発症の約1週間以降は,増殖期と呼ばれ,線維芽細胞が間質内から末梢気道にまで増殖し,さらに肺胞内ではII 型肺胞上皮の過形成が認められる。その後,線維化期が訪れるが,ARDSが長期化した例では線維化期が長引き,膠原線維の沈着により肺構造を変性する可能性がある。
このようなARDSの病理像の分子機構としては,pathogen-associated molecular patterns(PAMPs)およびdamage associated molecular patterns(DAMPs)(表3),さらに炎症性サイトカインや炎症性分子の産生が関与する。血管透過性亢進による滲出期に加えて,増殖期はtumor growth factor−βなどの増殖因子やトロンビンによる線維芽細胞増殖と筋線維芽細胞化,さらに膠原線維増生のトリガーとなる。炎症性病態に増殖因子の産生が混入することで,時系列だけではなく,肺内の血流に依存した部位による空間的差異が認められ,単純に時系列で滲出期,増殖期,線維化期の3つの病期に分けることができない場合も存在する。このようにARDSでは, PAMPsやDAMPsを作動物質として,表4のような炎症性分子が新たに転写段階から産生されることが関与する。ARDSの治療のためには,鑑別が必要な病態として表5に注意するとよい。
ARDSの画像評価
ARDSの診断では,胸部単純X線像,胸部CT像,肺エコーの評価を加え,それらの画像に照らして,診療指針を討議する。
1.胸部単純X線像
ARDSの胸部単純X線像では,両側性すりガラス陰影と浸潤影を特徴とする。線維化の進行する時期には,すりガラス状陰影の内部の網状影に加えて,肺野の容積減少と気管支拡張像の所見に注意する。心原性肺水腫との鑑別としては,気管支血管周囲間質,小葉間間質,胸膜下間質のうっ滞所見として,cuffing sign(正面像における左右B3bの腫大と不鮮明化),KerleyA線,KerleyB線,KerleyC線,胸水などに注意する。このようなARDSの陰影分布は,必ずしもびまん性とならずに肺内での部位差が生じる場合もあり,器質性病変,胸水,無気肺,腫瘍などの評価を胸部CT像で追加する。また,動脈血ガス分析による酸素化の変化に対して,胸部単純X線像の変化は鋭敏ではなく,12時間程度の時間差が生じることが知られている。ルーチンな日々の胸部単純X線像では,気胸,肺炎,胸水,カテーテル位置などを時系列で評価する。
2. 胸部CT像
胸部CT像により,ARDSに肺炎や誤嚥などの直接的な肺障害因子が関与するかどうかを評価する。炎症性サイトカインなどの炎症性分子が関与する間接的な肺障害因子は,血流依存的に荷重領域障害を主とする。また, ARDSの進展に伴うDADの滲出期,増殖期,線維化期の3つの病期に合わせて,high-resolution CT(HRCT)で病態を評価する(図2)。胸部CT像では,気胸,縦隔気腫,胸水や皮下気腫などの合併の詳細評価にも留意する。また,すりガラス陰影(multifocal ground-glass opacities)などの進展に注意する。ウイルスやレジオネラなどの病態では,それらに寄生された2型肺胞上皮細胞やクララ細胞などの細胞機能障害や,線維芽細胞の急激な増殖に留意する。
3.肺エコー
肺病変として,肺水腫や肺線維化の間質肥厚として,B-lineやlung slidingの観察は有用である。Lung slidingはリニアプローブを用いるのが理想的であり,呼吸による臓側胸膜と壁側胸膜とのずれが横方向のhigh echoのA-lineとして観察できる。ARDSにおける含気不良領域では,A-lineやlung slidingが消失傾向を示す。ARDSに気胸を合併した際には,障害肺有意にA-lineやlung slidingが消失する。一方,B-lineは,胸膜から縦方向に尾を引く線状陰影であり,横方向のlung slidingとともに左右に動く特徴がある。コンベックスプローブを用いた観察において,B-lineの異常は視野内に3本以上のB-lineの観察や,B-line間の幅が7mm以内に狭小化する所見となる。ARDSでは,びまん性肺病変として,肺エコーにおけるB-lineが不均一な分布として観察できる。また,肺エコーでは,無気肺,胸水,横隔膜運動などを合わせて評価する。
ARDSの病理所見
ARDSの病理学的所見は,DADを特徴とする。DAD病理像は,ARDS発生時より大きく,滲出期,増殖期,線維化期の3つの病期に分類されている(図2)。まず,ARDS初期の血管透過性亢進を特徴とする時期は,滲出期と呼ばれ,肺胞上皮細胞や血管内皮細胞の細胞死,および硝子膜形成が認められる。硝子膜は,フィブリノーゲンやフィブロネクチンなどの血液成分が肺胞壁に沿って沈着したものである。その後,ARDS発症の約1週間以降は,増殖期と呼ばれ,線維芽細胞が間質内から末梢気道にまで増殖し,さらに肺胞内ではII 型肺胞上皮の過形成が認められる。その後,線維化期が訪れるが,ARDSが長期化した例では線維化期が長引き,膠原線維の沈着により肺構造を変性する可能性がある。
ARDSの治療
ARDSの治療においては,原因の同定と,原因の治療が必要となる。このような原疾患の治療に加えて,呼吸管理,循環管理などの幾つかの補助治療が行われる。図3は,今後のARDSに治療指針や臨床研究のテーマを,Fergusonら7)が示したものである。
1.疾患の治療
ARDSの先行病態として,肺炎や敗血症には注意が必要であり,肺炎や敗血症を疑う場合には,喀痰や血液などの細菌培養検体を採取し,抗菌薬の適正に使用する。ARDSを引き起こす病態として,敗血症などの全身性炎症病態の治療を適正化する。
2.非侵襲的人工呼吸
非侵襲的人工呼吸(noninvasive positive pressure ventilation:NPPV)は, EPAP(expiratory positive airway pressure)を5 cmH2Oを初期設定としてARDSの初期評価に用いることができる。ARDSのBerlin定義はARDSの診断に,PEEP 5 cmH2O以上を必要とする。ARDSにおけるNPPVは,図1のように軽症ARDSに対する位置づけであり,中等症ARDSおよび重症ARDSにおける適応を含めて,今後の検討が必要とされている。
3.人工呼吸管理
ARDSにおける低酸素血症は,末梢気道の開放が病態生理学的には重要であり,人工呼吸管理ではまず,PEEP(positive endexpiratory pressure)を適正化する。FIO2については臨床研究では明確な指針が得られていないが,PEEPに優先してFIO2を高めることで,死亡率が上昇する危険性が確認されている8)。FIO2は0.6以下を目標として,動脈血ガス分析により虚血が進行しない安全なレベルに,可能な限り低下させる。ARDSにおける呼吸管理において,肺保護を目的とした人工呼吸管理とする。換気条件については,①1回換気量を6~8 mL/kg体重とするlow tidal ventilation,②driving pressure(最大級気圧-PEEP)を可能な限り低下させること,③最大気道内圧≦30 cmH2Oにを維持することの少なくとも3つの内容に注意する。
4.鎮痛と鎮静
ARDSの人工呼吸管理においては,Richmond Agitation Sedation Scale(RASS)9)などの鎮静スケールを用いて,適切な鎮痛と鎮静を必要とする。集中治療領域では,フェンタニル(成人:25μg〜125 μg/時),デクスメデトミジン(成人:0.1〜0.7 μg/kg/時),プロポフォール(成人:30〜100 mg/時)などが,静脈内持続投与として利用される。これらの一部は,1日に1回持続投与を中止し,浅い鎮静状態で意識状態,せん妄合併の有無,薬物代謝を評価し,早期離床につなげる工夫が行われている。
5.重症ARDSに対する補助療法
重症ARDSにおいては,図3のように人工呼吸下での筋弛緩薬の併用,腹臥位療法,高頻度換気,extracorporeal membrane oxygenation(ECMO)などの有効性が,より一層に臨床研究として検討されようとしている。各施設における検討課題である。重症ARDSでは,間質性肺炎,肺線維症の増悪や器質化に注意が必要であり,救命と社会復帰のためには適切な時期にECMOを導入することを検討している。
6. グルココルチコイド療法
グルココルチコイドは,DAMPsやPAMPsの細胞内情報伝達系において炎症性分子の産生を転写レベルで制御するために,ARDSの治療において有効であるかもしれない。しかし,急性期ARDSにおけるメチルプレドニゾロン大量療法の臨床研究10)では,生存率を改善させず,感染症を悪化させる結果だった。一方,メチルプレドニゾロン1 mg/kgレベルのメチルプレドニゾロン少量療法11)では,lung injury score,人工呼吸期間,ICU滞在日数の減少が認められている。少量ステロイド療法における臨床研究では,研究によって投与方法がさまざまであり,少量メチルプレドニゾロン持続投与法(表6)12)などの投与法を統一した治療効果の集積が期待される。少量ステロイド持続投与法は,ステロイドの観血的投与に比較してグルココルチコイド濃度のトラフ値を一定に保つため,コルチゾルの日内変動を維持し,極端な免疫抑制を阻止し,また急性期の血糖コントロールを行いやすい特徴がある。2006年のデータではあるが,発症後1週間以上経過したARDSにおいて,メチルプレドニゾロン2 mg/kg/日を2週間使用して漸減する少量メチルプレドニゾロン療法は,人工呼吸管理期間を短縮させている13)。今後は,Berlin定義に準じてARDSと明確に区分できる群において,グルココルチコイド療法の検討が進められようとしている。メチルプレドニゾロン1~2 mg/kg/日レベルの少量グルココルチコイド持続投与療法は,炎症性サイトカイン産生に伴う炎症,および随伴して増加するTGF-β,PDGF,FGFなどを介した線維化に対する先取り治療として,中等度以上のARDSにおける効果が期待できるかもしれない。
7.その他の薬物療法
ARDSの薬物療法においては,無作為臨床試験を用いたシステマチック・レビューとして,生命予後を改善することを示すことができない。その内容としては,一酸化窒素吸入療法,サーファクタント補充療法,抗酸化剤(ビタミンC,N-アセチルシステイン,プロシステイン),グルタミン,スタチン(ロバスタチン,シンバスタチン),GM-CSF,β刺激薬アルブテロールなどが含まれる。一方,スタチンを内服している場合には,継続するように指導している。スタチンは,細菌感染率を低下させる効果があることや,血管内皮などにおけるオートファジーやマイトファジーを維持できる可能性を持つ。
おわりに
1994年におけるALI/ARDSのAECC定義4)以降,ARDSによる集中治療室内の死亡は30%以上,病院死亡は40%以上で推移したが,60日死亡は25%レベルに低下してきている14-16)。基礎基盤研究ではARDSの病態および病理像の解析も進み,臨床研究としてもBerlin定義5)により,薬物療法を含めたさまざまな治療の見直しが行われるであろう。ARDSの臨床研究は,Berlin定義5)により,多くのエビデンスとして公表されることが期待される。
文 献
1. Ashbaugh DG, Bigelow DB, Petty TL, et al. Acute respiratory distress in adults. Lancet. 1967;2:319-23.
2. Petty TL, Ashbaugh DG. The adult respiratory distress syndrome. Clinical features, factors influencing prognosis and principles of management. Chest. 1971;60:233-9.
3.Murray JF, Matthay MA, Luce JM, et al. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis. 1988;138:720-3.
4. Bernard GR, Artigas A, Brigham KL, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994;149:818-24.
5. ARDS Definition Task Force Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307:2526-33.
6. Tomashefski JF Jr. Pulmonary pathology of the acute respiratory distress syndrome: diffuse alveo- lar damage. In: Matthay MA, ed. Acute Respiratory Distress Syndrome. New York: Marcel Dekker. 2003; 75-108.
7. Ferguson ND, Fan E, Camporota L, et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Med. 2012;38:1573-82.
8. Britos M, Smoot E, Liu KD, et al. The value of positive end-expiratory pressure and Fio₂ criteria in the definition of the acute respiratory distress syndrome. Crit Care Med. 2011;39:2025-30.
9. Sessler CN, Gosnell MS, Grap MJ, et al. The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients. Am J Respir Crit Care Med. 2002;166:1338-44.
10. Peter JV, John P, Graham PL, et al. Corticosteroids in the prevention and treatment of acute respiratory distress syndrome (ARDS) in adults: meta-analysis. BMJ. 2008;336:1006-9.
11. Meduri GU, Golden E, Freire AX, et al. Methylprednisolone infusion in early severe ARDS: results of a randomized controlled trial. Chest. 2007;131:954-63.
12. Meduri GU, Annane D, Chrousos GP, et al. Activation and regulation of systemic inflammation in ARDS: rationale for prolonged glucocorticoid therapy. Chest. 2009;136:1631-43.
13. Steinberg KP, Hudson LD, Goodman RB, et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. N Engl J Med. 2006;354:1671-84.
14. Rubenfeld GD, Caldwell E, Peabody E, et al. Incidence and outcomes of acute lung injury. N Engl J Med. 2005;353:1685-93.
15. Villar J, Blanco J, Añón JM, The ALIEN study: incidence and outcome of acute respiratory distress syndrome in the era of lung protective ventilation. Intensive Care Med. 2011;37:1932-41.
16. Erickson SE, Martin GS, Davis JL, et al. Recent trends in acute lung injury mortality: 1996-2005. Crit Care Med. 2009;37:1574-9.