文 献
1. Commoner B, Townsend J, and Pake GE. Free radicals in biological materials. Nature 1954;174: 689-91.
2. Members of the American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference Committee: Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med 1992; 20: 864–74.
3. Matsuda N, Hattori Y. Systemic inflammatory response syndrome (SIRS): Molecular pathophysiology and gene therapy. J Pharmacol Sci 2006;101: 189-98.
4. 松田直之. 敗血症における遺伝子発現変化 -主要臓器の警笛細胞を標的とした遺伝子治療-.麻酔 2008;57:327-40.
5. 松田直之. 全身性炎症反応症候群とToll-like受容体シグナル -Alert Cell Strategy-. 循環制御2004;25:276-84.
6. Azevedo LC, Janiszewski M, Soriano FG, et al. Redox mechanisms of vascular cell dysfunction in sepsis. Endocr Metab Immune Disord Drug Targets 2006;6:159-64.
7. Peng T, Lu X, Feng Q. Pivotal role of gp91phox-containing NADH oxidase in lipopolysaccharide-induced tumor necrosis factor-alpha expression and myocardial depression. Circulation 2005;111:1637-44.
8. Gujral JS, Hinson JA, Farhood A, et al. NADPH oxidase-derived oxidant stress is critical for neutrophil cytotoxicity during endotoxemia. Am J Physiol Gastrointest Liver Physiol 2004;287:G243-52.
9. Motoyama T, Okamoto K, Kukita I, et al. Possible role of increased oxidant stress in multiple organ failure after systemic inflammatory response syndrome. Crit Care Med 2003;31:1048-52.
10. Biasi F, Chiarpotto E, Lanfranco G, et al. Oxidative stress in the development of human ischemic hepatitis during circulatory shock. Free Radic Biol Med 1994;17:225-33.
11. Baldwin SR, Simon RH, Grum CM, et al. Oxidant activity in expired breath of patients with adult respiratory distress syndrome. Lancet 1986;1:11-4.
12. 松田直之. 生体侵襲のメディエーターと転写因子. 救急・集中治療 2008;20:1192-1206.
13. Ray R, Shah AM. NADPH oxidase and endothelial cell function. Clin Sci (Lond) 2005;109:217-26.
14. Cave AC, Brewer AC, Narayanapanicker A, et al. NADPH oxidases in cardiovascular health and disease. Antioxid Redox Signal 2006;8:691-728.
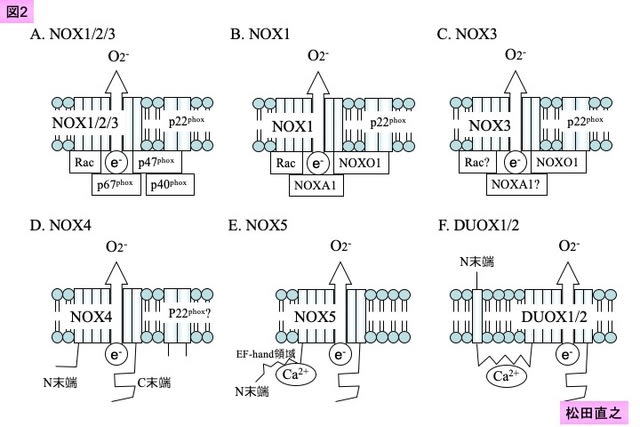
15. Royer-Pokora B, Kunkel LM, Monaco AP, et al. Cloning the gene for an inherited human disorder--chronic granulomatous disease--on the basis of its chromosomal location. Nature 1986;322:32-8.
16. Teahan C, Rowe P, Parker P, et al. The X-linked chronic granulomatous disease gene codes for the beta-chain of cytochrome b-245. Nature 1987;327:720-1.
17. Groemping Y, Lapouge K, Smerdon SJ, et al. Molecular basis of phosphorylation-induced activation of the NADPH oxidase. Cell 2003;113:343-55.
18. Lapouge K, Smith SJ, Walker PA, et al. Structure of the TPR domain of p67phox in complex with Rac.GTP. Mol Cell 2000;6:899-907.
19. Heymes C, Bendall JK, Ratajczak P, et al. Increased myocardial NADPH oxidase activity in human heart failure. J Am Coll Cardiol 2003;41:2164-71.
20. Görlach A, Brandes RP, Nguyen K, et al. A gp91phox containing NADPH oxidase selectively expressed in endothelial cells is a major source of oxygen radical generation in the arterial wall. Circ Res 2000;87:26-32.
21. Kinoshita H, Matsuda N, Kaba H, et al. Roles of phosphatidylinositol 3-kinase-Akt and NADPH oxidase in adenosine 5'-triphosphate-sensitive K+ channel function impaired by high glucose in the human artery. Hypertension 2008;52:507-13.
22. Touyz RM, Chen X, Tabet F, et al. Expression of a functionally active gp91phox-containing neutrophil-type NAD(P)H oxidase in smooth muscle cells from human resistance arteries: regulation by angiotensin II. Circ Res 2002;90:1205-13.
23. Suh YA, Arnold RS, Lassegue B, et al. Cell transformation by the superoxide-generating oxidase Mox1. Nature 1999;401:79-82.
24. Bánfi B, Maturana A, Jaconi S, et al. A mammalian H+ channel generated through alternative splicing of the NADPH oxidase homolog NOH-1. Science 2000;287:138-42.
25. Cheng G, Diebold BA, Hughes Y, et al. Nox1-dependent reactive oxygen generation is regulated by Rac1. J Biol Chem 2006;281:17718-26.
26. Ueyama T, Geiszt M, Leto TL. Involvement of Rac1 in activation of multicomponent Nox1- and Nox3-based NADPH oxidases. Mol Cell Biol 2006;26:2160-74.
27. Fan CY, Katsuyama M, Yabe-Nishimura C. PKCdelta mediates up-regulation of NOX1, a catalytic subunit of NADPH oxidase, via transactivation of the EGF receptor: possible involvement of PKCdelta in vascular hypertrophy. Biochem J 2005;390:761-7.
28. Kikuchi H, Hikage M, Miyashita H, et al. NADPH oxidase subunit, gp91(phox) homologue, preferentially expressed in human colon epithelial cells. Gene 2000;254:237-43.
29. Geiszt M, Kopp JB, Várnai P, et al. Identification of renox, an NAD(P)H oxidase in kidney. Proc Natl Acad Sci U S A 2000;97:8010-4.
30. De Deken X, Wang D, Many MC, et al. Cloning of two human thyroid cDNAs encoding new members of the NADPH oxidase family. J Biol Chem 2000;275:23227-33.
31. Martínez-Salgado C, Eleno N, Tavares P, et al. Involvement of reactive oxygen species on gentamicin-induced mesangial cell activation. Kidney Int 2002;62:1682-92.
32. Park HS, Jung HY, Park EY, Kim J, et al. Cutting edge: direct interaction of TLR4 with NAD(P)H oxidase 4 isozyme is essential for lipopolysaccharide-induced production of reactive oxygen species and activation of NF-B. J Immunol 2004;173:3589-93.
33. Park HS, Chun JN, Jung HY, et al. Role of NADPH oxidase 4 in lipopolysaccharide-induced proinflammatory responses by human aortic endothelial cells. Cardiovasc Res 2006;72:447-55.
34. Cheng G, Cao Z, Xu X, et al. Homologs of gp91phox: cloning and tissue expression of Nox3, Nox4, and Nox5. Gene 2001;269:131-40.
35. Bánfi B, Molnár G, Maturana A, et al. A Ca2+-activated NADPH oxidase in testis, spleen, and lymph nodes. J Biol Chem 2001;276:37594-601.
36. Bánfi B, Tirone F, Durussel I, et al. Mechanism of Ca2+ activation of the NADPH oxidase 5 (NOX5). J Biol Chem 2004;279:18583-91.
37. Dupuy C, Ohayon R, Valent A, et al. Purification of a novel flavoprotein involved in the thyroid NADPH oxidase. Cloning of the porcine and human cdnas. J Biol Chem 1999;274:37265-9.
38. Huang J, Hitt ND, Kleinberg ME. Stoichiometry of p22-phox and gp91-phox in phagocyte cytochrome b558. Biochemistry 1995;34:16753-7.
39. DeLeo FR, Burritt JB, Yu L, et al. Processing and maturation of flavocytochrome b558 include incorporation of heme as a prerequisite for heterodimer assembly. J Biol Chem 2000;275:13986-93.
40. Takeya R, Ueno N, Kami K, et al. Novel human homologues of p47phox and p67phox participate in activation of superoxide-producing NADPH oxidases. J Biol Chem 2003;278:25234-46.
41. Hawkins PT, Davidson K, Stephens LR. The role of PI3Ks in the regulation of the neutrophil NADPH oxidase. Biochem Soc Symp 2007;74:59-67.
42. Faust LR, el Benna J, Babior BM, et al. The phosphorylation targets of p47phox, a subunit of the respiratory burst oxidase. Functions of the individual target serines as evaluated by site-directed mutagenesis. J Clin Invest 1995;96:1499-505.
43. Brown GE, Stewart MQ, Bissonnette SA, et al. Distinct ligand-dependent roles for p38 MAPK in priming and activation of the neutrophil NADPH oxidase. J Biol Chem 2004;279:27059-68.
44. DeLeo FR, Renee J, McCormick S, et al. Neutrophils exposed to bacterial lipopolysaccharide upregulate NADPH oxidase assembly. J Clin Invest 1998;101:455-63.
45. Jones SA, O'Donnell VB, Wood JD, et al. Expression of phagocyte NADPH oxidase components in human endothelial cells. Am J Physiol 1996;271:H1626-34.
46. Manea A, Manea SA, Gafencu AV, et al. AP-1-dependent transcriptional regulation of NADPH oxidase in human aortic smooth muscle cells: role of p22phox subunit. Arterioscler Thromb Vasc Biol 2008;28:878-85.
47. Gauss KA, Bunger PL, Quinn MT. AP-1 is essential for p67(phox) promoter activity. J Leukoc Biol 2002;71:163-72.
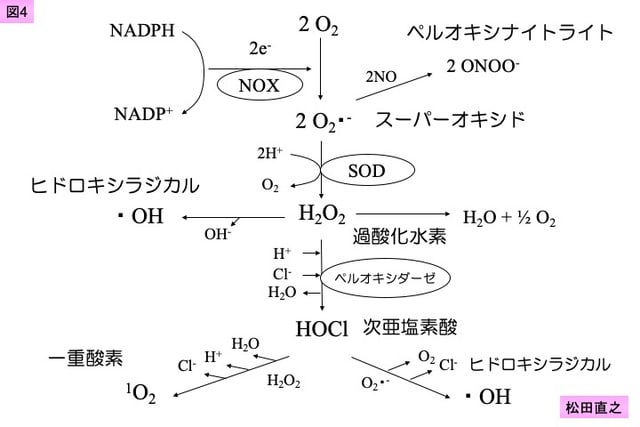
48. Maeda H, Akaike T. Nitric oxide and oxygen radicals in infection, inflammation, and cancer. Biochemistry (Mosc) 1998;63:854-65.
49. Hotz-Wagenblatt A, Dröge W. Redox-mediated functional and structural changes in insulin receptor kinase. Methods Enzymol 2002;348:288-96.
50. Meier B, Radeke HH, Selle S, et al. Human fibroblasts release reactive oxygen species in response to interleukin-1 or tumor necrosis factor-α. Biochem J 1989;263: 539-545.
51. Li N, Karin M. Is NF- B the sensor of oxidative stress? FASEB J 1999;13: 1137-43.
52. Bowie A, O'Neill LA. Oxidative stress and NF-κB activation. Biochem Pharmacol 2000;59: 13-23.
53. Kretz-Remy C, Bates EE, Arrigo AP. Amino acid analogs activate NF-κB through redox-dependent I B- phosphorylation. Consequence on HIV-1 long terminal repeat activation. J Biol Chem 1998;273: 3180-91.
54. Hehner SP, Breitkreutz R, Shubinsky G, et al. Enhancement of T cell receptor signaling by a mild oxidative shift in the intracellular thiol pool. J Immunol 2000;165: 4319-28.
55. Matsuda N, Yamamoto S, Shun-ichiro Kageyama1, et al. RNA interference targeting Fas-associated death domain (FADD) protects mice from septic lung inflammation and apoptosis. Am J Res Crit Care 2009, in press
56. Janssen YM, Matalon S, and Mossman BT. Differential induction of c-fos, c-jun, and apoptosis in lung epithelial cells exposed to ROS or RNS. Am J Physiol Lung Cell Mol Physiol 1997;273: L789-96.
57. Beiqing L, Chen M, Whisler RL. Sublethal levels of oxidative stress stimulate transcriptional activation of c-jun and suppress IL-2 promoter activation in Jurkat T cells. J Immunol 1996;157: 160-9.
58. Karin M. The regulation of AP-1 activity by mitogen-activated protein kinases. J Biol Chem 1995;270: 16483-6.
59. Hehner SP, Breitkreutz R, Shubinsky G, et al. Enhancement of T cell receptor signaling by a mild oxidative shift in the intracellular thiol pool. J Immunol 2000;165: 4319-28.
60. Griffith CE, Zhang W, Wange RL. ZAP-70-dependent and -independent activation of Erk in Jurkat T cells. J Biol Chem 1998:273: 107
リターン
全身性炎症反応症候群における活性酸素種の役割PART1
全身性炎症反応症候群における活性酸素種の役割PART2