レビュー COVID-19の集中治療:多臓器障害の特徴について 2020.05
名古屋大学大学院医学系研究科
救急・集中治療医学分野
教授 松田直之
はじめに
新型コロナウイルス感染症COVID-19(corona virus disease 2019)のパンデミックにおいて,集中治療室(Intensive Care Unit:ICU)は,重症化した際の救命および社会復帰のための砦として重要な役割を担っています。ICUは,急性期全身管理として脳,呼吸,循環(心血管),肝臓,腎臓,消化器,血液凝固線溶,内分泌,筋骨格などのすべての臓器や生体機能管理を担当し,生命に関わる緊急状態から早く適切に回復させることを目標として,病院内での中央診療部門として運用されています。
COVID-19においても,集中治療によるさまざまな臓器機能の管理が,重症状態や中等症状態の改善に寄与しています。本稿は,COVID-19において国内外で観察される臓器機能障害について,2020年5月までの主要な報告から集中治療を必要とする多臓器障害の特徴をまとめました。
1.COVID-19における初期症状と重症化の理解の必要性
2020年1月1日から2月23日までに発表されたCOVID-19の診療に関する文献レビュー1)として,Medline/PubMed, Scopus,およびWeb of Scienceの3つのデータベースを使用して19臨床研究論文と39件の症例報告が解析され,COVID-19の初期症状が報告されています。COVID-19患者656名において,発熱88.7%,咳57.6%,呼吸困難45.6%が一般的な症状であり,患者の20.3%がICUを必要とし,32.8%が急性呼吸窮迫症候群(ARDS:acute respiratory distress syndrome),6.2%が急性循環不全,ショックでした。入院患者の死亡率は約13.9%(95%信頼区間:6.2–21.5%)です。
日本では,ファビピラビル(アビガンⓇ)観察研究の中間報告2)において,COVID-19の重症化率を確認できます。本中間解析は,2020年5 月15 日 18 時までの日本におけるCOVID-19診療の解析として,407の医療施設から2,158 名が登録されています。臨床経過において,ファビピラビル投与開始7 日目においてCOVID-19が増悪と判定されたのは軽症例で13.1%,中等症例で21.3%,重症例で28.3%(表1),14 日目において増悪と判定されたのは軽症例で5.9%,中等症例で8.8%,重症例で25.2%でした(表2)。中等症および重症は,ICUなどで呼吸管理が必要となります。その上で,7日や14日レベルでの増悪においても,ICUでの適切な管理が生存のためには必要になると思います。このような重症化とされる病態の理解が重要であり,単に呼吸状態だけではなく,凝固亢進,血管内皮障害を含めて多角的に捉える必要があります。
日本でSARS-CoV-2が拡大しはじめた2020年3月は,このような重症化に関与する臓器障害の特徴を確認すること,その上で臓器障害の進展を阻止するための集中治療の方策が必要とされていました。


2.概説 COVID-19における臓器障害の特徴
新型コロナウイルスSARS-CoV-2は,アンジオテンシン変換酵素(ACE-2:angiotensin-converting enzyme-2)との結合性が高く結合し,ヒト細胞膜上のACE-2と接着し,細胞寄生します3)。このため経気道的には,SARS-CoV-2は, ACE-2の発現の高い場所である肺の末梢部位である肺胞領域や毛細血管領域に接着し,播種しやすい特徴があります。肺末梢領域における肺胞嚢や毛細血管領域へのウイルス播種と増殖により,呼吸苦が出現し,呼吸状態が急激に悪くなる特徴があります。また,SARS-CoV-2の侵入経路は,舌,唾液,そして消化管を介した経路もあります。消化管より,肝臓や血管内に播種する可能性もあります(図1)。

実際に,どのような臓器にSARS-CoV-2が播種するのかについては,病理解剖所見が重要と思われます。日本では,84歳のCOVID-19における病理解剖が報告されています4)。死後5時間で病理解剖が行われています。肉眼的には気管と気管支は発赤もびらんはなく,肺(左:590 g,右:690 g)は部分的に赤色固化し,含気がなく,切断面は粘液状であり,胸膜が両側で肥厚しており,胸水は1 mL未満です。肺の組織学的分析は,肺が浸出性および組織化びまん性肺胞損傷の両方の特徴を示しており,CT像で報告された所見5)などと同等のようです。心臓(420 g)は,右心室が拡張しており,10 mLの心嚢液がありました。さらにこの報告では,肺,脾臓,リンパ節に血球貪食があり,また腎臓の糸球体は微小血栓症として特徴づけられ,播種性血管内凝固の初期徴候に矛盾しないと考えられます。このように,肺の末梢領域,心臓,腎臓,脾臓,さらに血管内皮などを障害する特徴が病理所見として確認できます。
また,スイスからの病理解剖の報告6)では,3例の病理解剖が行われています。1例目の71歳男性は,腎移植のレシピエントであり,COVID-19診断後に全身状態が悪化し,人工呼吸下で進行する多臓器不全に対する管理が行われたが,管理8日目に死亡されています。電子顕微鏡では,腎臓の内皮細胞にウイルス封入体があり,腎に移行する可能性が確認され,組織学的分析では肺,心臓,小腸への浸潤があり,肺において微小血管内凝固が確認されています。2例目の58歳女性は,糖尿病と高血圧症の既往があり,COVID-19により呼吸不全などの多臓器不全となり,16日目に腸間膜動脈領域の虚血による小腸壊死となっており,さらに心筋梗塞を併発して死亡しています。死後の病理解剖では,肺,心臓,腎臓,および肝臓においてリンパ球性内皮炎症と組織壊死が明らかとされています。最後の3例目の69歳男性は,COVID-19による呼吸不全により人工呼吸管理をされていましたが,2例目と同様に小腸領域の壊死を生じて死亡しています。これらの病理所見においては,肺だけではなく,心臓,肝臓,腎臓,消化管など複数の臓器へSARS-CoV-2が浸潤する特徴があることや,T細胞やマクロファージなどの白血球の浸潤,そして血管を含む内皮系細胞死や血液凝固が確認されています(図2,図3)。


以上のように,これまでに日本や海外で報告された臨床経過や病理解剖の報告から,肺胞領域などの肺の末梢領域はCOVID-19の初期のターゲットとなる一方で,心臓,腎臓,肝臓,脾臓,消化管などの重要臓器のすべてが臓器障害のターゲットとなることが確認されています。
3.急性呼吸不全/ARDS
COVID−19における急性呼吸不全は,肺胞領域などの末梢気道病変として,急激に進行する特徴があります。中国の武漢や瀋陽のCOVID-19の重症化に関する報告では,ARDS7)の発生率は15.6–31%,急性心筋障害(7.2–17%),急性腎障害(2.9–15%)の発症率であす8-13)。COVID-19においては,呼吸器感染症として呼吸不全の進展としてARDSの発生が認められます。中国武漢の金銀潭病院と武漢肺病院の191例の後ろ向き観察研究データ13)では,呼吸不全103例(54%),ARDS 59例(31%),敗血症性ショック38例(20%),血液凝固障害37例(19%),急性心筋障害33例(17%),急性腎障害28例(15%)であり,SARS-CoV-2により臓器不全をきたした症例は112例(59%)です(表3)。
中国以外で2020年初頭にCOVID-19感染症による死亡の急増を認めたイタリアでは,20020年6月1日の段階で罹患者233,019名,人口10万人あたり罹患者数3,868名,死者数33,415名と,米国についで国際的に死者数が多い特徴がありました。2020年2月20日から3月18日までCOVID-19に罹患してイタリアのICUに入院した1,287例の解析14)では,合計1,150名が気管挿管下の人工呼吸管理を必要とし,137例が非侵襲的人工呼吸管理で治療されています。気管挿管下人工呼吸管理は,63歳以下で645例中565例,64歳以上では655例中585例(約89%)と年齢に関わらず若年層でも呼吸不全が進行し,ICUで呼吸管理されることが確認できます(表4)。
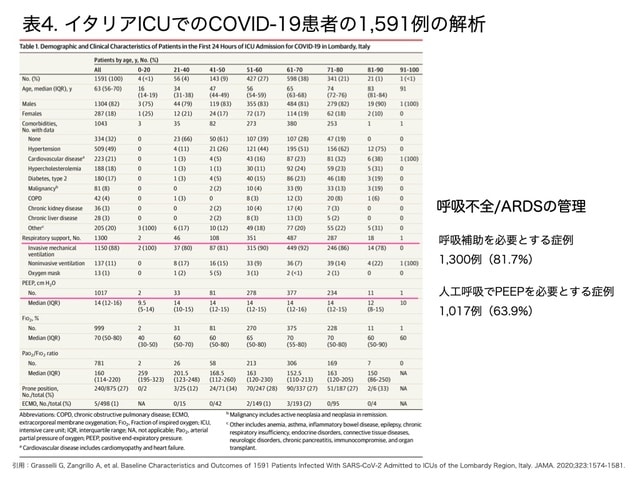
ARDS7)は,非心原性透過性亢進型肺水腫であり,2012年に公表されたベルリン定義に基づき,現在は日本でもARDS診療ガイドライン15)が作成され,これらを基準としてARDSの診療がICUで行われています。
4.心血管系異常
COVID−19において,SARS-CoV-2は心血管系にも播種することが確認されています13, 16, 17)。SARS-CoV-2に関連する心筋障害は,武漢でCOVID-19と診断された最初の41名の患者では5名で確認され,高感度の心臓トロポニンの上昇として同定されています。5名の心筋障害患者のうち4名がICU管理を必要としたと報告されています。一方で,心筋障害のバイオマーカーのレベルは,正常域内にとどまるもののICU治療を必要した群で高い可能性が示唆されています17)。中国武漢の金銀潭病院と武漢肺病院の191例の後ろ向き観察研究データでは,急性心筋障害は17%であり,心筋障害としての心筋逸脱酵素の上昇,心筋炎や不整脈などを合併しています13)。
急性心筋炎などの心不全としてextracorporeal membrane oxygenation(ECMO)を必要とした症例などについては,日本COVID-19対策ECMOnet18)のからの報告やデータ解析が行われることになるでしょう。
5.肝機能異常/急性肝不全
武漢初期の2020年1月2日までに収容された41例のコホート調査9)では,感染した患者の73%が男性であり,糖尿病8例(20%),高血圧6例(15%),心血管疾患6例(15%)などの基礎疾患を持つ13例(32%)において,管理中の総ビリルビン(t-Bil)の中央値はICU管理群で0.82(0.7-1.92) mg/dL,一般病棟管理で0.62(0.55-0.72)mg/dLとICU管理を必要とした群で軽度の上昇する傾向があります。また,中国武漢の金銀潭病院と武漢肺病院の191例の後ろ向き観察研究データでは,死亡群41例の肝逸脱酵素ALTは40(24–51)IU/Lですが,t-Bilなどの上昇を認める肝不全としての死亡を認めていません13)。
肝細胞と胆管上皮細胞にもACE-2が存在することが確認されているので19),COVID-19における肝不全の進行が懸念されますが,観察された肝障害はSARS-CoV-2感染の治療に抗ウイルス剤として使用されたロピナビル/リトナビルなどの薬剤が原因である可能性が高いのかもしれません20)。ICUではICU一般の軽度の肝障害にとどまり,肝不全が進行しやすいという報告は確認できませんが, COVID-19の診療においても軽度の肝障害を増悪させない一般の管理は必要とされます20, 21)。COVID-19に関する肝障害は主にALT/ASTの上昇であり,t-bilは軽度な上昇に留まり,アルブミンレベルも2.6〜3.1 g/L,通常の一般のICU管理と相違がない特徴です10, 11, 20-28)。
6.急性腎障害
中国武漢の金銀潭病院と武漢肺病院の2020年2月1日までの191例の観察研究データ13)では,急性腎障害(AKI:acute kidney injury)は28例(15%)です(表5)。急性腎障害はKDIGOガイドライン29)に準じて診断されており,28例中27例が死亡しており,ICUなどにおける急性腎障害に対する血液浄化法などの併用の必要性があるかもしれません。
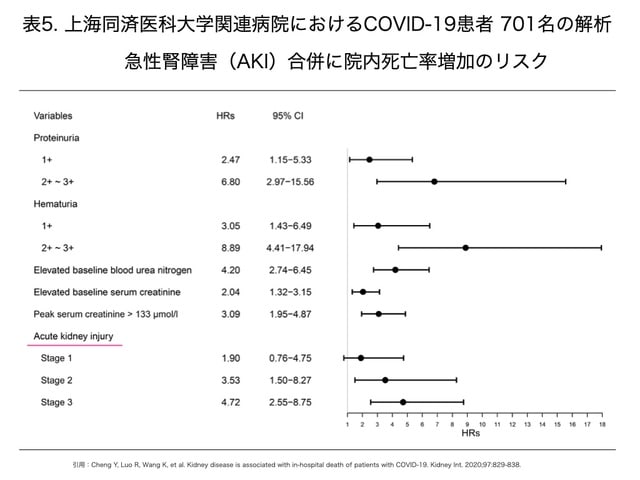
中国からはさらに,2020年1月28日から2月11日まで武漢の同済医科大学関連病院における連続したすべてのCOVID-19患者 701名(男性367名,女性334名)の前向きコホート研究が実施されており,COVID-19において血清クレアチニン上昇は14.4%,血中尿素窒素上昇は13.1%,糸球体濾過有病率は13.1%です。KDIGOガイドライン29)に準じたAKI合併患者の重症度は,ステージ1が13例(1.9%),ステージ2が9例(1.3%),ステージ3が14例(2%),AKI全体で36例(5.1%)と,武漢からのAKI報告13)より少ない合併率となっています。しかし,表5のように院内死亡リスク比はAKI合併によりステージ1で1.90(95%信頼区間:0.76-4.76),ステージ2で3.51(95%信頼区間:1.49-8.26),ステージ3で4.38(95%信頼区間:2.31-8.31)とステージ上昇により高まり,AKIステージ2および3の合併により死亡リスクが高まることに注意する報告となっています。
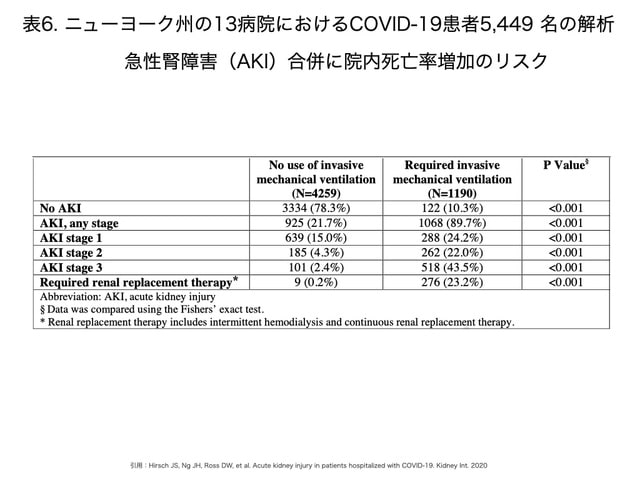
米国ニューヨーク州の13病院における2020年3月1日から4月5日までの報告32)では,Covid-19で入院した患者5,449名のうち,AKIが1,993名(36.6%)に発生し,AKIのピークステージはステージ1が46.5%,ステージ2が22.4%,ステージ3が31.1%と報告されています(表6)。中国のデータ13, 29)より高いAKI合併率です。人工呼吸中患者では89.7%,工呼吸中患者では21.7%に,KDIGOガイドライン29)に準じたAKIが発症したとしています。血液浄化法は人工呼吸器を装着した患者の276例(23.2%),工呼吸患者の9例(0.2%)と,人工呼吸患者における血液浄化法の併用が多い結果となっています。この報告では,AKI発症の危険因子として,高齢,糖尿病,心血管疾患,黒人,高血圧,人工呼吸管理,昇圧薬などが挙げられています。 AKI患者における694人(35%)が死亡,519名(26%)が退院,780名(39%)が治療中という結果です。
日本でもAKI(急性腎障害)診療ガイドライン201631)が作成され,AKIステージ分類とAKI診療がICUで行われています。
7.凝固線溶系異常
COVID-19において,血液凝固線溶系の異常がCOVID-19の重症化に深く関わり,治療成績に大きな影響を与えることが報告されてます。国際血栓止血学会(International Society on Thrombosis and Haemostasis:ISTH)は,COVID-19の凝固線溶異常に対するISTHガイダンス31)を公表し,COVID-19における凝固線溶管理の重要性を提唱しています。
武漢におけるCOVID-19管理初期において2020年1月2日までに収容された41例のコホート調査9)として,ICUに入室が必要となった患者群で入院時のプロトロンビン時間(PT)とDダイマーが高く,血液凝固線溶系の異常が報告されています。COVID-19では,凝固が亢進することが一般的に観察できます。中国武漢の金銀潭病院と武漢肺病院の191例の後ろ向き観察研究データ13)では,血液凝固障害が37例(19%)に認められています。
その上で,2020年1月1日から2月3日まで武漢の華中科技大学同済病院でCOVID-19における血液凝固に関する臨床研究34)が施行され,PT,活性化部分トロンボプラスチン時間(APTT),アンチトロンビン活性(AT),フィブリノーゲン,フィブリン分解産物(FDP)およびDダイマーが評価されています。COVID-19患者183名(男性98名,女性85名)が研究に登録され,21名(11.5%)が死亡し,死亡群でPT,FDPおよびD−ダイマーが高値となることが確認されています。また,ISTHの診断基準31)に準じて診断される播種性血管内凝固症候群(DIC:disseminated intravascular coagulation)として,死亡者の15名(71.4%)がovert-DIC(≥5ポイント)と診断されています。SARS-CoV-2は,血液凝固を促進させる特徴があります。
2020年1月20日から2月20日までSoochow大学附属感染症病院に入院したCOVID-19と診断75例(男性:45例,女性:30例)においても,PTとAPTTは正常にもかかわらず,フィブリノーゲン(60%)とD-ダイマー(12%)の上昇が明らかとされています35)。
日本では,急性期DIC診断基準36)が2005年に定められ,DICおよび血液凝固線溶系の管理が,日本版敗血症診療ガイドライン201637)に準じて行われています。日本版敗血症診療ガイドラインは,世界に先駆けて,敗血症におけるDIC治療の診療エビデンスを提案しています。ICUなどのCOVID-19における重症化の管理では,血液凝固線溶系異常の合併を念頭におきます。血管内凝固DICが死亡率を高める危険性があることに留意して,COVID-19に抗凝固療法を併用することは不可欠と考えられます。
おわりに
本報告は,COVID-19において国内外で観察される臓器機能障害について,2020年5月までの主要な文献から,集中治療を必要とする多臓器障害の特徴をまとめたものです。論文多くは,初期にCOVID-19が蔓延し,都市閉鎖が行われた武漢を中心とする中国からのものです。2020年7月移行には,米国やイタリアなどの海外各国からの臓器機能障害が報告されてくるようです。適時,再レビューとしていく必要があります。
臓器不全の特徴として,ICUは肺,心血管系,肝臓,腎臓,血液凝固系に加えて,意識,消化器,内分泌,筋骨格など,すべての臓器や生体機能管理を担当しています。このような細部にわたって,集中治療管理過程で観察を続け,臓器不全の特徴としてまとめていくことが期待されます。ICUにおけるCOVID-19の多臓器管理の特徴についての参考としてまとめさせて頂きました。
文 献
1. Rodriguez-Morales AJ, Cardona-Ospina JA, Gutiérrez-Ocampo E, et al. Clinical, laboratory and imaging features of COVID-19: A systematic review and meta-analysis. Travel Med Infect Dis. 2020;34:101623.
2.藤田医科大学ファビピラビル観察研究事務局. ファビピラビル観察研究中間報告 (2020 年 5 月 15 日現在). 2020年5月26日
3. Letko M, Marzi A, Munster V. Functional assessment of cell entry and receptor usage for SARS-CoV-2 and other lineage B betacoronaviruses. Nat Microbiol. 2020;5:562-569.
4.Adachi T, Chong JM, Nakajima N, et al. Clinicopathologic and Immunohistochemical Findings from Autopsy of Patient with COVID-19, Japan. Emerg Infect Dis. 2020;26:10.3201/eid2609.
5.Inui S, Fujikawa A, Jitsu M, et al. Chest CT Findings in Cases from the Cruise Ship “Diamond Princess” with Coronavirus Disease 2019 (COVID-19)https://pubs.rsna.org/doi/10.1148/ryct.2020200110
6. Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395:1417‐1418.
7. ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307:2526‐2533.
8. Li X, Ma X. Acute respiratory failure in COVID-19: is it "typical" ARDS?. Crit Care. 2020;24:198. Published 2020 May 6.
9. Huang C, Wang Y, Li X, et al. Clinical features of patients with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506.
10. Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel corona virus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395:507–513.
11. Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020. 11.1001/jama.2020.1585.
12. Guan WJ, Ni ZY, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020. 10.1056/NEJMoa2002032.
13. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020. 10.1016/S0140-673630566-3.
14. Grasselli G, Zangrillo A, Zanella A, et al. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy. JAMA. 2020;323:1574‐1581.
15. ARDS 診療ガイドライン2016. https://www.jsicm.org/pdf/ARDSGL2016.pdf
16. Guzik TJ, Mohiddin SA, Dimarco A, et al. COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options.Cardiovasc Res. 2020;cvaa106. doi:10.1093/cvr/cvaa106
17. Zheng YY, Ma YT, Zhang JY, Xie X. COVID-19 and the cardiovascular system. Nat Rev Cardiol. 2020;17:259‐260.
18. 日本COVID-19対策ECMOnet情報. https://crisis.ecmonet.jp
19. Chai X, Hu L, Zhang Y, et al. Specific ACE2 expression in cholangiocytes may cause liver damage after 2019‐nCoV infection. bioRxiv;2020.
20. Fan Z, Chen L, Jun LI, et al. Clinical features of COVID‐19‐related liver damage. medRxiv. 2020; in press.
21. Xie H, Zhao J, Lian N, et al. Clinical characteristics of Non-ICU hospitalized patients with coronavirus disease 2019 and liver injury A Retrospective study. Liver Int 2020.
22. Cai Q, Huang D, Ou P, et al. COVID-19 in a Designated Infectious Diseases HospitalOutside Hubei Province, China. medRxiv. 2020; in press. https://doi.org/10.1101/2020.02.17.20024018
23. Cao W. Clinical features and laboratory inspection of novel corona-virus pneumonia (COVID-19) in Xiangyang, Hubei. medRxiv. 2020; in press. https://doi.org/10.1101/2020.02.23.20026963
24. Shi H, Han X, Jiang N, et al. Radiological findings from 81 pa-tients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis, 2020. https://doi.org/10.1016/S1473 -3099(20)30086-4
25. Xu X-W, Wu X-X, Jiang X-G, et al. Clinical findings in a group of pa- tients infected with the 2019 novel coronavirus (SARS-Cov-2) out- side of Wuhan, China: retrospective case series. BMJ. 2020;m606.
26. Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020. https://doi.org/10.1016/S2213-2600(20)30079-5
27. Zhang B, Zhou X, Qiu Y, et al. Clinical characteristics of 82 death cases with COVID-19. medRxiv. 2020; in press.
28. Huang Y, Zhou H, Yang R, et al. Clinical characteristics of 36 non-survivors with COVID-19 in Wuhan, China. medRxiv;2020; in press. https://doi.org/10.1101/2020.02.27.20029009
29. Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012;120:c179‐c184.
30. Cheng Y, Luo R, Wang K, et al. Kidney disease is associated with in-hospital death of patients with COVID-19. Kidney Int. 2020;97:829‐838.
31. AKI(急性腎障害)診療ガイドライン2016. https://www.jsicm.org/pdf/aki2016.pdf
32. Hirsch JS, Ng JH, Ross DW, et al. Acute kidney injury in patients hospitalized with COVID-19. Kidney Int. 2020;S0085-2538(20)30532-9.
33. Whyte CS, Morrow GB, Mitchell JL, et al. Fibrinolytic abnormalities in acute respiratory distress syndrome (ARDS) and versatility of thrombolytic drugs to treat COVID-19. J Thromb Haemost. 2020;10.1111/jth.14872.
34. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18:844-847.
35. Fu J, Kong J, Wang W, et al. The clinical implication of dynamic neutrophil to lymphocyte ratio and D-dimer in COVID-19: A retrospective study in Suzhou China. Thromb Res. 2020;192:3-8.
36. Gando S, Saitoh D, Ogura H, et al. A multicenter, prospective validation study of the Japanese Association for Acute Medicine disseminated intravascular coagulation scoring system in patients with severe sepsis. Crit Care 2013; 20:R111.
37. 日本版敗血症診療ガイドライン2016. https://www.jsicm.org/pdf/jjsicm24Suppl2-2.pdf

















