Clinical Practice Guideline for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer: 2010 Update by the Infectious Diseases Society of America
Clin Infect Dis. 2011 Feb 15;52(4):e56-93.
I.発熱性好中球減少症患者における高リスクあるいは低リスク患者の区別、
またはリスクアセスメントの役割とは何か?
1.発熱を呈する患者では重症感染を合併しているリスクのアセスメントが
おこなれなければならない(A-II)。リスクアセスメントにより、経験的抗菌薬治療が
どういった形でおこなわれるか(経口か静注か)、治療の場(外来か入院か)、
抗菌薬の治療期間が決まるかもしれない(A-II)。
2.ほとんどの専門家は、高リスク患者は7日以上続くまたは深刻な好中球減少症
(抗癌剤治療後、絶対値で 医学的合併症、低血圧、肺炎、腹痛、神経学的変化がある患者としている。
こういった患者は、経験的治療のために入院すべきである。(A-II)
3.低リスク患者、7日未満と短い好中球減少期間が予想され、合併症が全くないか
ほとんどない患者は、経口の経験的治療が適応となる。(A-II)
4. 公式なリスク分類としては、Multinational Association for
Supportive Care in Cancer(MASCC)スコアシステムを用いる。(B-I)
i. 高リスク患者はMASCCスコアが21未満である(B-I)。高リスクの全患者は
入院して経験的治療を受ける必要がある(B-I)。
ii. 低リスク患者はMASCCスコアが21より高いものである(B-I)。
この患者は経口および/または外来の経験的治療が適応されるかもしれない(B-I)。
II. 初期アセスメントとして、どのような敗血症の検査、培養がおこなわれるべきか
5.ラボ検査は血球分画を含むCBC、血小板、血清クレアチニン、尿素窒素、
電解質、肝機能酵素、総ビリルビンが行われるべきである(A-III)。
6.最低でも2セットの血液培養が推奨される。
中心静脈カテーテルが留置されている場合は、そのルーメンと末梢静脈
から採血してもよい。中心静脈カテーテルがない場合は、末梢静脈から
2セット採取すべきである(A-III)。40kg未満の患者の場合、
血液培養量はトータルの血液量の1%未満におさえるべきである
(トータル血液量は通常70 mL/kg)(C-III)。
7. 感染が疑われる部位からの培養検体は、臨床的に適応がある場合
採取されるべきでる(A-III)。
8. 胸部レントゲンは呼吸器症状がある場合に適応となる(A-III)。
III. 発熱性好中球減少症では、どのような経験的抗菌薬治療が妥当か
9. 高リスク患者は静注の経験的治療のために入院を要する。
抗緑膿菌作用のあるβラクタム剤(cefepime, carbapenem、
piperacillintazobactam)単剤治療が推奨される(A-I)。
他の抗菌薬(aminoglycosides, fluoroquinolones, and/or vancomycin)
を合併症(低血圧、肺炎)管理のため、耐性菌が疑わしい・確定している場合
に初期治療レジメンに加えてもよい(B-III)。
10. vancomycin(もしくは好気性グラム陽性菌に活性のあるほかの抗菌薬)
は発熱性好中球減少症の初期治療レジメンとしてはすすめられない(A-I)。
これらの抗菌薬は、特殊な臨床状況下においてのみ適応されるものであり、
カテーテル関連感染症、皮膚軟部組織感染症、肺炎、血行動態不安定な
ときに考慮する。
11. 下記のような耐性菌感染のリスクが考えられる患者においては、
特に状態が不安定であったり血液培養で耐性菌が陽性になった場合には
経験的初期治療の変更を考えてもよい(B-III)。すなわち、
MRSA,VRE,ESBL,KPCを含むカルバペネム耐性菌。
i. MRSA:vancomycin, linezolid,daptomycin (B-III)
ii. VRE:linezolid、daptomycin(B-III)
iii. ESBLs: carbapenem (B-III)
iv. KPCs: polymyxin-colistin、tigecycline (C-III)
12. ほとんどのペニシリンアレルギー患者はセファロスポリンに忍容性があるが、
即時型アレルギー反応の既往が有る場合はβラクタム・カルバペネム使用は
避けるべきであり、ciprofloxacin+clindamycinや
aztreonam+vancomycinといった組み合わせを用いる(A-II)。
13. 新しい感染症状を呈した無熱性の好中球減少患者は、高リスクとして
扱う(B-III)。
14.低リスク患者は初期経口あるいは静注の経験的治療を行うが
特殊な臨床基準をみたせば外来における治療に移行してもよい(A-I)。
i. ciprofloxacin + amoxicillin-clavulanateの組み合わせは経口初期治療
として推奨される(A-I)。他の経口レジメンとして
levofloxacin またはciprofloxacinの単剤治療または
ciprofloxacin+clindamycinがスタディは少ないもののよく使用される(B-III)。
ii. fluoroquinolone予防を受けている患者は経口初期治療として
fluoroquinoloneを使用すべきでない(A-III)。
iii. 再入院あるいは入院継続は、遷延性発熱や症状持続があれば必要である(A-III)。
IV. 発熱性好中球減少の経過でいつあるいはどのようにして抗菌薬を変更するか
15. 臨床的あるいは微生物学的データに基づいて初期抗菌薬レジメンを
変更する(A-II)。
16. 説明できない遷延性発熱がある患者で状態が安定しておれば
初期抗菌薬レジメンの変更はあまり必要ないかもしれない。
もし感染が同定されれば、抗菌薬はそれにしたがって調節すべきである(A-I)。
17.臨床的および/または微生物学的感染は、部位や微生物感受性にあわせて
適切な抗菌薬で治療されるべきである(A-I)。
18. vancomycinや他のグラム陽性菌をカバーする薬が初期に開始された場合、
もしグラム陽性菌感染の根拠がない場合には2日後にやめてもよい(A-II)。
19.初期抗菌薬治療によっても血行動態が安定しない患者は耐性菌、嫌気性菌、
真菌にまでそのカバーを広げて治療を行うべきである(A-III)。
20.入院で静注あるいは経口抗菌薬により治療が開始された低リスク患者は
臨床経過が安定しておれば治療アプローチを単純化してもよい(A-I)。
i. IV-to-oralスイッチは臨床的に安定していて消化器吸収不良が問題なければ
おこなってもよい(A-I)。
ii. 低リスク基準を満たす入院患者は毎日のフォローアップが可能であれば
外来に移行可能である(B-III)。もし発熱が48時間以内に再度起これば
再入院が推奨され、高リスクとして扱う(A-III)。
21. 経験的真菌治療カバーは高リスク患者でブロードスペクトラム
抗菌薬治療後4~7日後に発熱が遷延する場合、発熱源が同定できない場合
に考えるべきである(A-II)。
V. 経験的抗菌薬治療期間はどのくらいか
22.臨床的あるいは微生物学的に感染が疑われる患者において、
治療期間は微生物、感染巣に基づいて決定されるべきである。
適切な抗菌薬治療は、少なくとも好中球減少の期間(500cells/mm3より
多くなるまで)あるいは臨床的に必要であれば続けるべきである(B-III)。
23. 説明できない発熱がある患者では初期レジメンは骨髄機能が戻るまでは
続けるべきである。歴史的にエンドポイントは好中球が500cells/mm3を
超えるまでである(B-II)。
24. 代替案として、もし適切な抗菌薬治療が終了して
すべての症状が軽快した場合、好中球減少が残る患者であっても
経口fluoroquinolone予防は骨髄機能が戻るまで続けてよい(C-III)。
VI. いつ抗菌薬による予防をおこなうべきか、どのような薬を用いるべきか
25. fluoroquinolone予防は、遷延性あるいは深刻な好中球減少
(100cells/mm3未満が7日より多く続く)がある高リスク患者に
考えるべきである(B-I)。
levofloxacinとciprofloxacinは最も総合的に評価され、大雑把には同等であるが
levofloxacinは口腔粘膜炎関連の侵襲性連鎖球菌感染症のリスクを上昇させる
場合には好ましい。fluoroquinolone耐性の発育をモニターするために
全身的な戦略は推奨される(A-II)。
26. グラム陽性球菌をカバーする抗菌薬をfluoroquinoloneの予防に追加することは
一般的にすすめられない(A-I)。
27. 7日未満の好中球減少の遷延が危惧される低リスク患者に
抗菌薬予防はルーチンに推奨されない(A-III)。
VII. 経験的あるいは先制的抗真菌治療はどのような役割があるか、
どの薬剤を使用すべきか
・高リスク
28. 経験的抗真菌治療と侵襲性真菌感染症の検証は、4~7日の抗菌薬治療ののち
遷延性あるいは再発性の発熱があった場合、または7日以上の好中球減少が
推定される場合に考慮されるべきである(A-I)。糸状菌予防をすでに受けている患者に
特異的に使用すべき経験的抗真菌薬のデータは不足しているが、他のクラスの
糸状菌対応の抗真菌薬にスイッチすることは考えてもいい(B-III)。
29. 先制的な抗真菌薬マネジメントは高リスク好中球減少患者においては
容認できるものである。ブロードスペクトラム抗菌薬の治療後4~7日後
に発熱が続いているものの、臨床的に安定しておりレントゲンやCT(胸・副鼻腔)上
明らかな異常がない場合、血液検査で侵襲性真菌感染症が否定的である場合、
あらゆる部位からの真菌のリカバリーが無い場合には、抗真菌薬の投与は
差し控えてもよいかもしれない(B-II)。抗真菌治療は上記のごとく真菌の存在が
示唆される場合にはおこなわれるべきである。
・低リスク
30. 低リスク患者において、侵襲性真菌感染症のリスクは低く、そのため
ルーチンに経験的抗真菌治療を投与することはすすめられない(A-III)。
VIII. いつ抗真菌薬による予防を投与すべきか、どの薬剤を用いるべきか
・高リスク
31. Candida感染の予防は、侵襲性真菌感染のリスクがある患者には推奨される。
たとえば、造血幹細胞移植(HSCT)レシピエント、寛解導入療法中、
急性白血病のサルベージ治療中など(A-I)。fluconazole, itraconazole,
voriconazole, posaconazole,micafungin, caspofunginは
すべて容認できる代替薬である。
32. 侵襲性アスペルギルス症の予防としてposaconazoleは、13歳以上で
急性骨髄性白血病(AML)や骨髄異形成症候群(MDS)の化学療法下であれば
予防なしに感染リスクがあるような場合は考慮すべきである(B-I)。
33. Aspergillus感染予防は、移植生着前の同種あるいは自家移植レシピエント
においては効果的と考えられていない。しかしながら、糸状菌に対する薬剤は
過去に侵襲性アスペルギルス症にかかったことがある患者にはすすめられ(A-III)、
少なくとも2週間好中球減少が遷延することが危惧される場合(C-III)、
HSCT直前に好中球減少期が遷延している場合(C-III)にもすすめられる。
・低リスク
34. 7日未満の好中球減少が予想される患者において、
抗真菌予防はすすめられない(A-III)。
IX. 抗ウイルス予防にどのような役割あがるか、どのウイルス感染に治療が必要か
35. 単純ヘルペスウイルス(HSV)の血清学的陽性患者で
同種HSCTを受けたり白血病の導入療法中の場合には
acyclovirによる抗ウイルス予防を考慮すべきである(A-I)。
36. HSVあるいは帯状疱疹ウイルス(VZV)の治療は活動性のウイルス疾患があるという
臨床的あるいは検査的な確証がある時に用いる(C-III)。
37. 呼吸器系のウイルス検査(インフルエンザ、パラインフルエンザ、アデノウイルス、
RSウイルス、ヒトメタニューモウイルスの検査)や胸部レントゲンは
鼻風邪などの上気道症状がある、および/または咳がある場合には適応となる(B-III)。
38. 不活化ワクチンによる季節性インフルエンザワクチン接種は、
癌治療をおこなう患者すべてにすすめられる(A-II)。
適切な接種時期は確立されていないが、血清学的な反応は
化学療法が開始になる2週間より前ないしは化学療法サイクル中(治療後7日を
超えたあと)には成立していることが望ましいかもしれない (B-III)。
39.インフルエンザウイルス感染は感受性のある株であれば
ノイラミニダーゼ阻害薬により治療すべきである(A-II)。
インフルエンザの曝露やアウトブレイクの状況下では、好中球減少患者は
インフルエンザ様症状があれば治療を経験的に受けるべきである(C-III)。
40.上気道症状のあるRSウイルス感染の治療は、好中球減少患者においても
行うべきではない(B-III)。
X.発熱性好中球減少症をマネジメントする上でのG-CSFやGM-CSFの役割は何か
41.予防的にコロニー刺激因子(CSFs)を用いることは発熱性好中球減少症の
リスクが20%を超える場合に考慮すべきである(A-II)。
42. CSFsは発熱性好中球減少患者には一般的にすすめられる(B-II)。
XI. 発熱性好中球減少症患者においてカテーテル関連血流感染症の診断とマネジメントはどうすべきか
43. 120分を超えるdifferential time to positivity (DTP) がCVCと末梢静脈の
血液培養で認められれば、中心静脈カテーテル関連血流感染症(CLABSI)を
示唆する(A-II)。
44. S.aureus、P. aeruginosa、真菌、抗酸菌による
CLABSIでは、カテーテル抜去は推奨され、なおかつ少なくとも14日の全身的
抗菌薬治療が必要である(A-II)。カテーテル抜去は、いわゆるトンネル感染、
ポートポケット部感染、敗血症性血栓、心内膜炎、血行動態不良の敗血症、
72時間を超える適切な抗菌薬治療にもかかわらず続く血流感染症にも
推奨される(A-II)。
45. コアグラーゼ陰性ブドウ球菌によるCLABSIの場合、カテーテルは
全身的抗菌薬治療をしているときは抗菌薬ロック療法の有無を問わず
抜去を保留してもよいかもしれない(B-III)。
46. 4~6週間の長期治療は複雑性CLABSIには推奨される。
すなわち、深部組織感染症の存在、心内膜炎、敗血症性血栓(A-II)
あるいは持続的菌血症や真菌血症が適切な治療下でのカテーテル抜去後
72時間を超えても存在する場合、と定義される
(A-II for S. aureus, C-III for other pathogens)。
47. 手指消毒、マキシマムバリアプリコーション、CVC挿入中のクロルヘキシジン
皮膚消毒は、全CVC挿入手技においてすすめられる(A-I)。
XII. 発熱性好中球減少患者をマジメントする上でのどういった環境的予防策が必要か
48.手指消毒はもっとも効果のある院内感染予防策である(A-II)。
49.標準予防策は全ての患者におこなわれるべきであり、感染特異的隔離は
確実な徴候・症状がある患者においておこなわれるべきである(A-III)。
50. HSCTレシピエントはプライベートルームに配置すべきである(B-III)。
同種HSCTレシピエントは1時間に12換気を超え
high-efficiency particulate air (HEPA)フィルターを有する部屋に配置すべきである(A-III)。
51. 植物、花(ドライであろうとなかろうと)は入院中の発熱性好中球減少患者の
部屋に持ち込むことを許可すべきではない(B-III)。
52. hospital work exclusion policiesは医療従事者(HCWs)が
疾患や曝露の報告を奨励するようデザインされるべきである(A-II)。


肺炎を合併したARDS(P/F ratio 60 mmHg)の胸部単純X線像と胸部単純CT像である。
これに加えて,びまん性肺胞出血に対しては,以下を念頭に置く。
Diffuse alveolar damage
Systemic vasculittis syndromes
・Wegener'sgranulomatosis
・Microscopic polyangiitls
・Henoch-Schelein purpura
・Behcet's syndrome
・Mixed cryoglobulinemia
・Churg-Strauss syndrome
Connective-tissue diseases
・Systemic lupus erythematosus
・Rheumatoid arthritis
・Scleroderma
・Mixed connective-tissue disease
・Polymyositis or dermatomyositis
Anti-basement-membrane disease
Glomerdonephritis-associated alveolar hemorrhage
・Immuno-complexex-mediated
・Pauci-immune IgA nephropathy
Infections
・Pneumonia
・Angioinvasive aspergillosis
・Candidiasis
・Cytomegalovirus infection
・Legionellosis
・Herpes simplex pneumonia
・Acquired immunodeficiency syndrome
Drugs or toxic agents
・Penicillamine
・Triimellitic anhydride
・Isocyanates
・Cocaine
・Propylthiouracil
・Tirofiban
・Abciximab
・Phenytoin
Pulmonary metastasis
・Metastasis of angiosarcoma
・Metastasis of Kaposi's sarcoma
Transplantadon
・Bone marrow transplantation
・Solid-organ transplantation
Cardiac disorders
・Mitral stenosis
・Congestive heart faiure
・Cor triatriatum
Bleeding disorders
・Adverse effect of anticoagulation therapy
・Disseminated intravascular coagulation
・Thrombotic thrombocytopenic purpura
Pulmonary vascdar disease
・Primary pulmonary hypertension
・Thromboembolic disease
・Pulmonary-capillary hemangiomatosis
Other disorders
・Lymphangioleiomyomatosis or tuberous sclerosis
・Sarcoidosis
・Idiopathic pulmonary fibrosis
・Antiphospholipid-antibody syndrome
・Heiner's syndrome(alveolar hemorrhage associated with allergy to milk)
・Isolated pauci-immune pulmonary capillaritis
・Idiopathic pulmonary hemosiderosis
肺動脈カテーテルの適正使用
PART 1
名古屋大学大学院医学系研究科
救急・集中治療医学分野
松田直之
はじめに
Harold James SwanとWilliam Ganzにより,スワン・ガンツカテーテルが肺動脈カテーテルとしてN Engl J Med1)に公表されたのは1970年です。Ganzら2)は,1971年には20名の健常成人を用いた臨床研究で,熱希釈法による心拍出量の測定が色素希釈法による測定と近似することを示し,熱希釈法を用いての肺動脈カテーテルによる心拍出量測定法を提案しました。こうして1972年には,肺動脈カテーテルが臨床使用され,さらに共同研究者だったForresterと共に肺動脈楔入圧を横軸,心係数を縦軸として心機能評価を行うForrester subset分類3-5)が提唱され,後に虚血性心疾患による心不全の治療概念としてForrester subset分類が定着しました。現在まで,肺動脈カテーテルは急性心筋梗塞の急性期管理をはじめ,心機能の低下した患者の循環管理に有益な情報を与えてくれています。本稿では,肺動脈カテーテルの挿入,原理,測定パラメータについての解説を加え,肺動脈カテーテルの有効利用と安全管理を解説します。肺動脈カテーテルは,留置した以上,最大に活用するように工夫しましょう。
1. 肺動脈カテーテルによるモニタリングの概要
肺動脈カテーテル(図1)は,大静脈,右心房,右心室を介して,肺動脈に留置されるものです。挿入された肺動脈カテーテルは,先端孔ルーメン・ハブを肺動脈圧測定用トランスデューサと接続し,側孔ルーメン・ハブを中心静脈圧測定用トランスデューサと接続し,大気圧でゼロ校正をした後に,三尖弁孔の位置に相当する右第4肋間・胸郭中心線に圧トランスデューサ孔の高さを合わせることで,肺動脈圧や中心静脈圧を持続測定できます。一方,肺動脈カテーテルのオプティカル・モジュール・コネクター,サーマル・フィラメント・コネクター,サーミスター・コネクターをビジランスヘモダイナミックモニターⓡ(Edwards Lifesciences)(図2)に接続することで,心係数(CI: cardiac index),混合静脈酸素飽和度(Sv(ー)O2)などの循環パラメータをモニターできます。この肺動脈カテーテルにより測定できる項目は,主に表1の内容です。
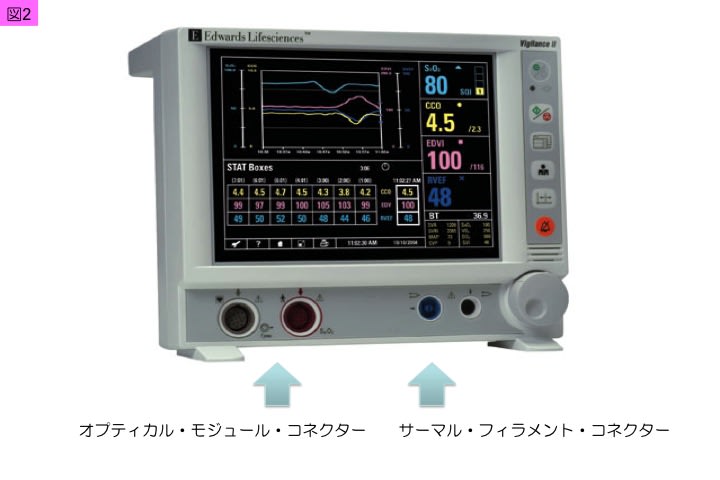
2. 肺動脈カテーテルの留置
肺動脈カテーテルの留置には,内頚静脈,鎖骨下静脈,外頚静脈,上腕静脈,大腿静脈などが選択できますが,手術中やICUなどでの管理における操作と固定性を考えると,一般的に内頚静脈が選択されます。肺動脈カテーテルの留置では,穿刺後にまず挿入するものはイントロデューサシースⓡ(イントロフレックス・イントロデューサ:Edwards Lifesciences)(図3)です。肺動脈カテーテルは,イントロデューサシースⓡの中に挿入していきます。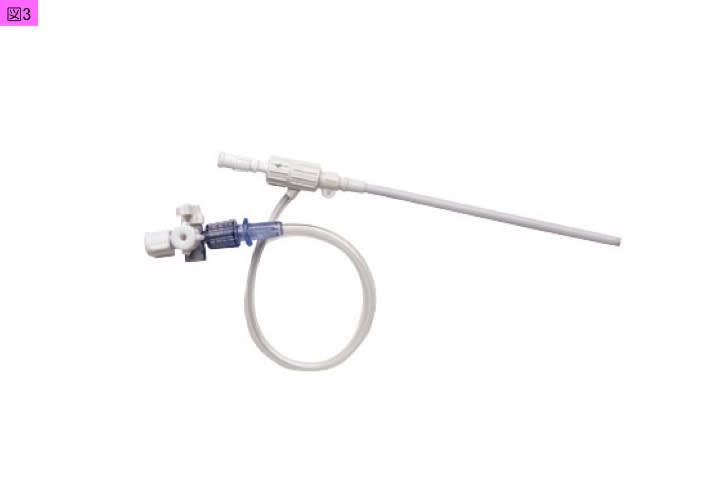
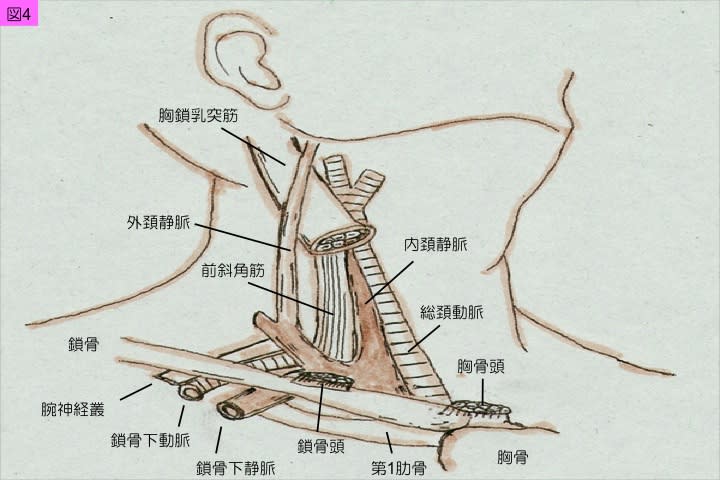
1)内頚静脈穿刺
内頚静脈穿刺に際しては,胸鎖乳突筋の走行と鎖骨頭・胸骨頭への分岐部の視診が大切です(図4)。この分岐部の内頚静脈拍動と呼吸性変動を視診で観察し,内頚静脈拍動が認められない場合はさらに頭低位とします。内頚静脈は,第5~第6頚椎付近では総頚動脈と併走しています。胸鎖乳突筋鎖骨頭付近で前斜角筋の前方を走行します(図4)。頚部の解剖学的特徴としては,内頚静脈,総頚動脈,迷走神経は結合組織性の頚動脈鞘に収納されています。以上の解剖学的特徴を理解した上で,内頚静脈穿刺では胸鎖乳突筋の分岐部付近で呼吸性拍動の強く認められる点を刺入点とし,その刺入点より同側乳房の乳頭方向を刺入方向とすることで総頚動脈穿刺を避けることができます。また,気胸合併に注意するためには,穿刺針が肺尖部に到達しないように皮膚に対して穿刺針を60度以上にできるだけ立てて,ゆっくりと陰圧をかけながら穿刺することがコツとなります。以上は,メルクマール法とかブラインド法と呼ばれています。
作画:Naoyuki Matsuda MD, PhD
内頚静脈穿刺の手順とポイント
□ 体位の準備:円座で頭部固定し,頭を穿刺側と反対側へ向かせ,頭低位(10~20度のトレンデンブルグ位)とする。
□ 頚静脈拍動の観察:穿刺点の決定に役立てる。
□ エコー図の利用:カラーエコーにより,頚静脈と刺入点を確認するとよい。
□ maximum barrier precaution:手洗い・手指消毒,ガウン,マスク,清潔手袋,刺入部を含めた広範な消毒,広範な清潔覆布を必要とする。
□ イントロデューサシースと肺動脈カテーテルのプライミング:イントロデューサシースとダイレーターをセッティングし,ヘパリン加生理的食塩水などでカテーテル管腔の空気抜きを行い,肺動脈カテーテルに対して附属ビニールシートを装着する。
□ 試験穿刺:試験穿刺針23G針あるいは25G針をシリンジ装着し,胸鎖乳突筋分岐部より乳頭方向へ,穿刺針を十分に立てて,シリンジに陰圧をかけながらゆっくりと試験刺入し,血液逆流の生じた深さ・角度・方向を確認する。
□ 本穿刺:シリンジに陰圧をかけながらゆっくりと刺入し,血液逆流の生じた地点で針先の変位がないように,片方の手でしっかりと留置針を保持する。
□ カイドワイアー挿入:挿入に抵抗があるときは静脈内に穿刺針が留置されていない可能性が高い。ガイドワイヤーを進める際には力は不要である。
□ ダイレーターとイントロデューサ挿入:ガイドワイアー刺入部をカッティングし,ダイレーターとイントロデューサを同時に刺入し,挿入後にダイレーターとガイドワイアーを同時に抜去し,残っているのはイントロデューサのみとなる。
□ イントロデューサ内の血液逆流確認と空気抜き
□ 肺動脈カテーテル挿入:肺動脈カテーテルを心腔内へ進める際には,バルーン膨張用バルブよりバルーンを膨らませる。肺動脈カテーテルを引き戻す際には,脱気し,バルーンを収縮させる。
注意点
□ 血液逆流の確認:内頚静脈穿刺では,血液逆流は穿刺針を引き戻してくる際に確認できることも多い。本穿刺にプラスティック留置針を用いる際には,穿刺後に金属針を抜去し,プラスティック針のみを注射筒に接続し,ゆっくりと引きながら血液逆流を確認するとよい。
□ 総頚動脈の誤穿刺:止血の得られるまで,適切な圧で用手的に十分に圧迫止血する。
2)鎖骨下静脈穿刺
鎖骨下静脈は,鎖骨と第一肋骨に挟まれた状態で走行しており,第一肋骨上の鎖骨下静脈溝に固定されています(図4)。この外側後方を鎖骨下動脈が走行し,同じく鎖骨下動脈溝に固定されています。鎖骨下静脈穿刺では気胸合併の可能性があることや鎖骨下動脈誤穿刺後の止血が難しいことにより,鎖骨下静脈は肺動脈カテーテル留置における第2選択以下となります。左鎖骨下静脈穿刺により乳糜胸や乳糜縦隔を合併する可能性もあります。また,穿刺部位については,鎖骨に近い近位側と,腋窩に近い遠位側が選択できますが,近位側での留置では鎖骨と第1肋骨などによりカテーテルが切断される可能性があり,これをPinch-off症候群と呼びます。一方,鎖骨遠位側での留置では鎖骨下筋を貫かないように,エコーなどで鎖骨下筋の同定が重要できると良いです。鎖骨下筋を貫いた場合,鎖骨を動かすことでカテーテルが牽引されたり,切断される危険に注意します。
鎖骨下静脈穿刺の手順とポイント
主なポイントは内頚静脈穿刺に準じる。鎖骨下静脈穿刺では,以下に注意する。
□ 体位の準備:背枕挿入,円座での頭部固定の後,頭を穿刺側へ向かせ,頭低位(10~20度のTrendelenburg体位)とする。患者の頭位は,内頚静脈穿刺と異なり,穿刺側へ向かせることで,鎖骨下静脈より内頚静脈へのガイドワーヤー迷入を減少できる可能性がある。
□ 穿刺点:鎖骨内側1/2~1/3あたりで尾側約1~2 cmとする。
□ 試験穿刺:23Gレベル以下のカテラン針で必ず試験穿刺を行う。穿刺針は,内頚静脈穿刺と異なり,針先は一度鎖骨に当て,可能な限り皮膚に沿って寝かせ,角度を付けないことで気胸合併を回避する。次に穿刺針を持たぬ手で,穿刺部の皮膚と胸壁を押し下げることで鎖骨下に穿刺針が進入しやすくなる。
3. 肺動脈カテーテルにおける圧波形観察
肺動脈カテーテルを肺動脈に進める際には,カテーテル先端のバルーンを空気で膨らませて,血流に乗って進めます。バルーン膨張用バルブに接続した附属シリンジより最大1.5 mLの空気を注入します。肺動脈カテーテルを進める際には圧波形観察が大切であり,先端孔ルーメン・ハブ(図1)を肺動脈圧測定用血圧トランスデューサと接続することで,挿入過程で,順々に右心房圧波形,右心室圧波形,肺動脈圧波形,肺動脈楔入圧波形の4つの圧波系を観察します(図5)。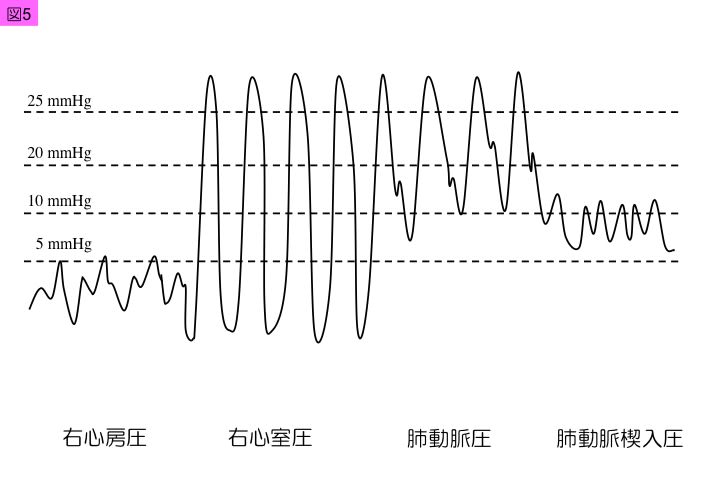
1)中心静脈圧および右心房圧と波形
中心静脈圧(CVP: central venous pressure)や右心房圧の波形は3つの陽性波(A波,C波,V波)と,2つの陰性波(X谷,Y谷)で構成される。この中心静脈圧波形の特徴を,表1,図6と図7に示した。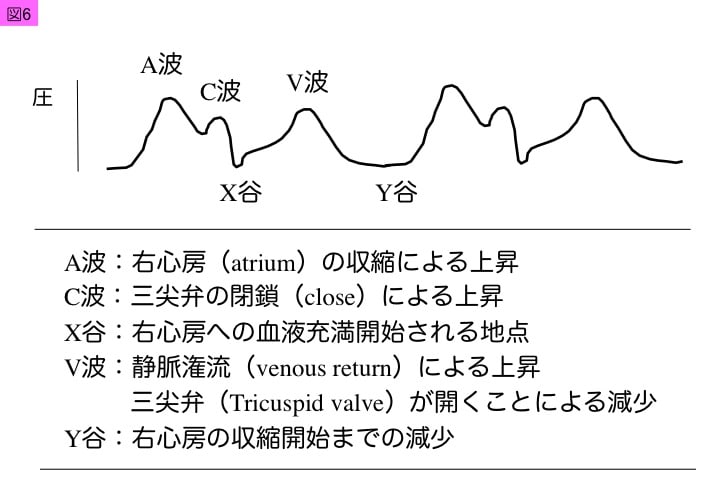

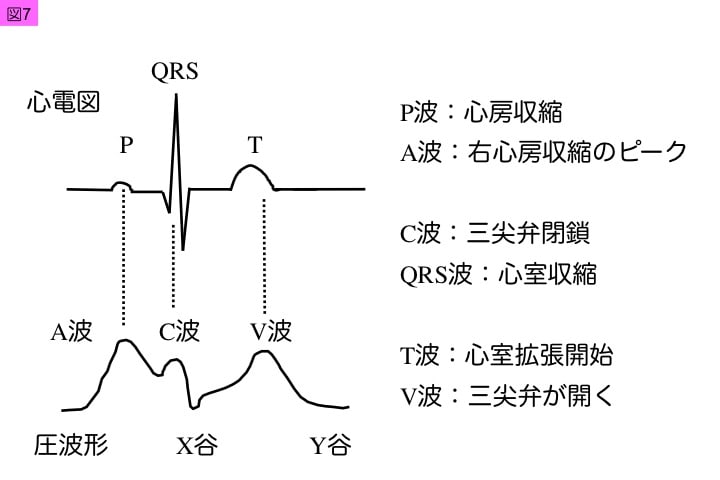
A波は右心房筋の収縮により生じ,心電図のP波に一致する。C波は三尖弁閉鎖により生じ,心電図のR波に一致する。V波は三尖弁閉鎖期に右心房への静脈潅流上昇によって高まり,三尖弁開放により低下し,T波に一致する。このような上昇波間に,図7のようなX谷とY谷が形成される。心房キックが低下した場合には,A波が消失傾向を示す。また,全身性炎症病態で輸液過剰などにより三尖弁閉鎖不全が進行するとX谷が軽微となり,C波とV波が突出し,Y谷が急峻化する傾向がある。このような静脈圧波形異常の特徴は,肺動脈カテーテル留置後にも心機能評価に利用できる(表2)。
2)右心室圧と波形
右心室圧は,正常では収縮期圧30 mmHg,拡張期圧 5 mmHg以下のレベルに維持されています。等容収縮期,最大駆出期,減速駆出期,等容拡張期,急速流入期,緩徐充満期,前収縮期の7期で波形が構成されています。
3)肺動脈圧と波形
肺動脈圧は,正常では収縮期圧30 mmHg以下,拡張期圧 15 mmHg以下のレベルに維持されています。肺動脈は弾性血管であり,肺動脈中膜には弾性線維があり,加齢により減少する傾向があります。この弾力により肺動脈圧波形は,右心拍出量に対する立ち上がりのpercussion waveとプラトーを形成するtidal waveの後に,心拡張期にdicrotic wave(重複波)が付く特徴があります(図8)。Percussion waveの立ち上がり角(dp/dt)は右室収縮性を示し,dicrotic waveは1回右室駆出量に対する肺血管抵抗を示します。肺動脈弁閉鎖後の肺動脈収縮により,dicrotic waveは形成されます。これは,PART2における肺動脈カテーテルの留置固定位置における安全管理として使用されるシグナルクオリティーインジケータ(SQI)の数値変化(適正:1あるいは2)においても,数値変動のある場合に注意して観察しています。肺動脈圧波形の変化をSQIとともに観察することは,肺動脈カテーテルの適正管理と考えています。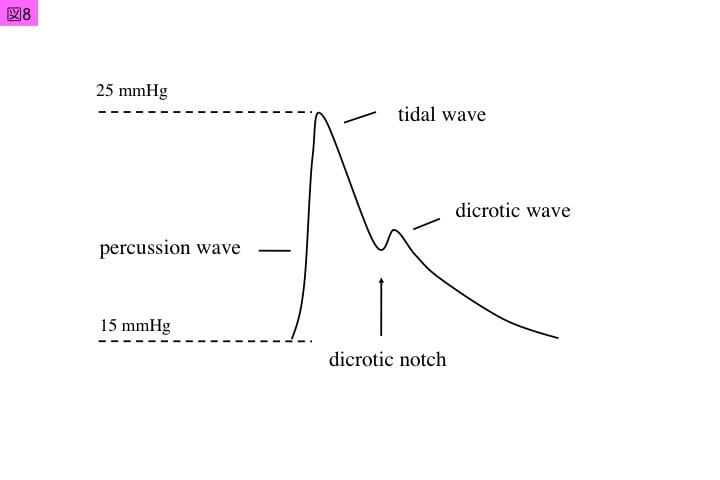
4)肺動脈楔入圧(◯せつにゅうあつ,◯けつにゅうあつ,Xきつにゅうあつ)と波形
肺動脈末端で拡張バルーンが肺動脈を閉鎖させると,ふにゃふにゃした肺動脈楔入圧波形と肺動脈楔入圧(PAWP:pulmonary artery wedge pressure)が現れます。肺動脈楔入圧は,肺毛細血管抵抗がないと仮定すると,左心房圧に近似する値となります。正常の肺動脈楔入圧は,5~12 mmHg以下です。
このような肺動脈カテーテル挿入後は,胸部単純X線像で肺動脈カテーテル先端の位置やカテーテルがループを作っていないことを確認する必要があります。肺動脈カテーテルはバルーン拡張により血流にのせて進めるため,通常は肺血流の多い下葉背側のゾーン3へ留置されます。ゾーン3へ留置の場合,胸部単純X線像での肺動脈カテーテル先端は左第2弓の左心房より下方に位置する。一方,肺上葉のゾーン1や肺中心部のゾーン2に肺動脈カテーテルが留置された場合,肺胞内圧の影響が強く出現しやすいため,PAWPの持続測定には不向きとなります。陽圧換気中のPAWPの絶対値評価では,このような肺胞内圧の影響を除くために,呼吸器を外した状態で評価しています。
4. 熱希釈法による心拍出量測定の原理
心拍出量を間接的に測定する方法には,Fick法,色素希釈法,熱希釈法の3つの方法があります。
Fick法の原理となるFickの原理は,1890年代にAdolph Fick6)により考案され,心拍出量は酸素消費量(吸気ガス酸素含量―呼気ガス酸素含量)を肺動静脈の酸素含有量の差で割ったものとして測定されます(図9)。1946年,KetyとSchmidt7)は,示標物質に一酸化窒素を用い,Fickの原理を用いてヒトの脳血流量の測定に初めて成功しました。その後,Ketyが1951年に,示標物質の肺および脳組織中の交換系を考案し,Fickの原理をKetyの式(dCt (t) /dt=BF×[Ca (t) -Cv(t)],Ct (t):単位時間組織中物質濃度,BF:臓器血流量,Ca (t):単位時間動脈血中物質濃度,Cv(t):単位時間静脈側物質濃度)として,微分方程式の形で表現しました。このようにFickの原理は,示標物質が代謝による増減がなく測定系に保存されるならば,目的臓器への示標物質の摂取量と,目的臓器の入口濃度と出口濃度の差から,血流量を知ることができるという原理です(図9)。心拍出量を肺循環系で測定する場合,正常の酸素消費量は200~250 mL/分,酸素消費量係数は120~160 mL/分/mm2ですが,周術期や敗血症などの全身性炎症病態では酸素消費量が変動するため,肺機能を用いたFickの原理の応用では正確に心拍出量が求められない可能性に注意となります。
一方,色素希釈法の原理は1897年にStewartによって報告され8),さらにHamiltonによって1940年代に完成されました9)。この色素希釈法は,色素を体内循環させることにより得られる血漿色素濃度を分光光度計で測定することにより,Stewart-Hamiltonの式(心拍出量(L/分)=色素注入量(mg)×60/ [色素平均濃度(mg/L)×色素希釈時間(秒)×色素校正係数])を用いて,心拍出量を測定するものです。
SwanとGanzは,この色素希釈法を応用してスワン・ガンツカテーテルに熱希釈法を導入し,現在の肺動脈カテーテルによる心拍出量測定の基盤を確立しました。私が心臓麻酔や集中治療を担当しはじめた1993年〜1994年の当時は,心拍出量測定は熱希釈法で測定しており(図10),血漿色素濃度の代わりにカテーテルから投与される注入液の温度変化を用いていました。現在は,臨床応用されている持続心拍出量測定肺動脈カテーテルは,サーマルフィラメントとサーミスター・コネクターにより,図10のような計算が,自動的に行われ,冷水などの投与が不要です。

5. 心前負荷・心後負荷および心拍出量のモニタリング
オキシメトリCCO/CEDVサーモダイリューションカテーテルⓡ(Edwards Lifesciences)の開発により,サーマルフィラメントとサーミスター・コネクターによる熱希釈法で,連続心拍出量測定(CCO:continuous cardiac output mesurement)と右心室駆出率(RVEF:right ventricle ejection fraction)の連続測定が提供されるようになりました(表3)。また,ビジランスヘモダイナミックモニターⓡ(Edwards Lifesciences)に観血的動脈圧とCVPと心拍数を連動させることにより,1回拍出量(SV:stroke volume),右室拡張終期容量(RVEDV: right ventricular end-diastolic volume),肺血管抵抗(PVR: pulmonary artery resistance),体血管抵抗(SVR:systemic vascular resistance),右室一回仕事量(RVSW:right ventricle stroke work),左室一回仕事量(LVSW:right ventricle stroke work)をモニターできるようになりました。
このようなモニタリングにおいて,右室前負荷はCVP,右室後負荷はPVR,左室前負荷はPAWP,左室後負荷はSVRであり,右心系と左心系を個別に輸液バランス,心拡張性,心収縮性,および血管抵抗を評価することができます。その結果として,右心機能と左心機能をRVSWとLVSWでモニターします。Forrester subset分類3-5)(図11)は左心機能を評価するものとして用いますが,右心機能に関してもCVP,PVR,RVSWを用いて評価します。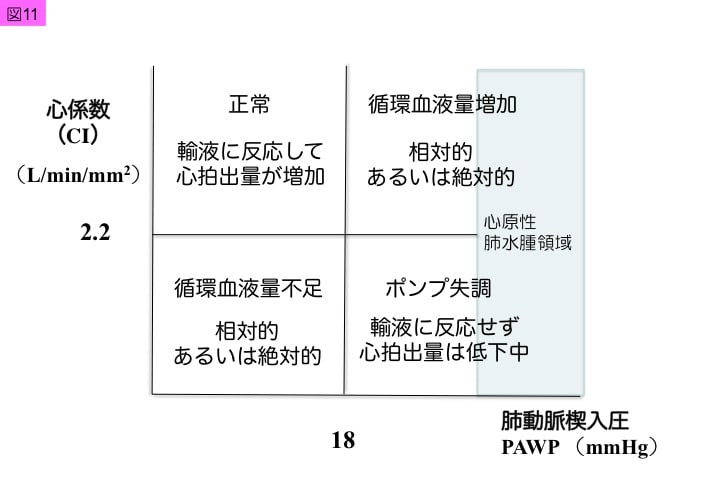


救急・集中治療 肺動脈カテーテルの適正使用
PART 2
名古屋大学大学院医学系研究科
救急・集中治療医学分野
松田直之
<続 編>
6. 混合静脈血酸素飽和度の意義
肺動脈カテーテルが普及する過程で,1990年代より混合静脈血酸素飽和度(Sv(ー)O2:mixed venous oxygen saturation,正常値60~80%)を連続測定できるようになりました。Sv(ー)O2は,上大静脈,下大静脈,冠静脈洞から流入する最終静脈血の酸素飽和度であり,酸素運搬量と酸素消費量の全身の酸素化バランスを反映する指標です。現在,Sv(ー)O2は,肺動脈カテーテルの先端位に設置された光ファイバーを用いた2波長反射式分光光度法で,持続計測できます。
従来Sv(ー)O2の算出には,表5のように,動脈血酸素飽和度(SaO2)と酸素摂取率(酸素運搬量(V(・)O2)/ 酸素消費量(D(・)O2))を必要としました。しかし,現在の肺動脈カテーテルにおけるSv(ー)O2の持続測定では,体内(in vivo)キャリブレーションとして,血液ガス分析器を用いた肺動脈血のヘモグロビン濃度あるいはヘマトクリット値と,実際に測定したSv(ー)O2値を入力することで,持続計測値ができます。
このようにSv(ー)O2は持続計測できるようになりました。この急激な変化や異常には,注意が必要です(表5)。Sv(ー)O2が60%以下に低下している場合には,酸素運搬量が低いか,酸素消費量が高い可能性があります。一方,Sv(ー)O2が80%以上に高い場合には,①代謝抑制,②組織酸素利用障害(敗血症,多臓器不全,播種性血管内凝固症候群など11)),③高心拍出量,④動静脈シャントの可能性を念頭におきます。Sv(ー)O2は,酸素運搬量を規定する①心拍出量,②ヘモグロビン濃度,③SaO2,および酸素消費量により決定されるため,酸素消費量,ヘモグロビン濃度,SaO2が安定している状態では,心拍出量の急激な変化を鋭敏に反映してくれます。逆に言うと,特にヘモグロビン濃度の変化について,前提条件として確認することが大切です。このように,Sv(ー)O2は,その絶対値のみならず時系列での変動に注意します。

7. 肺動脈カテーテルの安全かつ適切な使用
肺動脈カテーテルの留置には,いくつかの安全性に配慮してください。
1)肺動脈カテーテル先端位置の問題:SQIをモニタリングする重要性
胸部単純X線像で,毎日必ず,肺動脈カテーテルの先端位置を確認します。この確認ポイントは,肺中心部のゾーン2なのか,下方向のゾーン3なのか,上方向のゾーン1なのか,そして深さです。坐位などで血流変化の起きやすいゾーン1への留意などでは,同じ位置に固定されていても,測定用の光ファイバーのシグナルクオリティインジケータ(SQI)が3あるいは4と高くなることに注意します。また,体位変換でも肺動脈血流が変化する可能性があり,SQIの変化に注意して下さい。SQIが2以下となるように注意し,肺動脈カテーテルをバルーンを膨らませない状態で引き戻して,再固定して下さい。肺動脈カテーテル先端が,末梢の肺血管床に移動することで,肺梗塞や肺動脈損傷の原因となることに注意してください。
【追記1:SQIについて】肺動脈カテーテル,あれほど長いカテーテルの先端でパルスオキシメータと同じようにヘモグロビン酸素飽和度を,肺動脈のSVO2として連続して測定できる仕組みを開発したのは,大変な開発と思います。シグナルクオリティーインジケータ(SQI)は,結局のところ,末梢循環不全の指先でパルスオキシメータのSpO2の値が出ないのと同様に,肺動脈カテーテル先端付近でSVO2を検出しにくくなっていることを,示してくれるものと理解しています。肺動脈におけるヘモグロビン酸素飽和度を測定しにくくなっていることを,1(最良)から4(要注意)の4段階で表示してくれます。SQIでは3と4は要注意です。特にSQI 4は,1)壁あたり(血流が流れにくくなくなっていること),2)カテーテル先端への血栓の付着,3)カテーテル先端が壊れたなどを考えます。このため,SQIが3か4のときは,1か2になるように少し引き戻した位置で管理することになります。もちろん肺動脈楔入圧を測定するときはバルーンを膨らました状態で少し深くするかもしれません。
【追記2:SQIの数値変動について】肺動脈楔入圧の測定できる位置で固定し,同じ位置にしているのに,SQIが2から3や4に変化するのは,1)肺動脈攣縮,2)微小血栓ができたり溶けたりしている可能性,3)ドライサイドの管理で肺動脈圧が低下してきた状態(フロセミドで水引をし始めた時),4)肺動脈カテーテル先端位置の適正,5)体位変換の影響を考えます。肺動脈カテーテル先端の留置位置の内径が細くなると壁あたりする可能性に注意します。また,血栓の原因となる可能性についても抗凝固をしていないときには考慮しますし,肺動脈カテーテルで血小板が減少する原因の一つとなります。黄色ブドウ球菌やMRCNSなどの血流感染があると,ここがまた病巣となり,血栓が巨大化することにも注意します。
2)バルーン拡張に対する注意
肺動脈は弾性線維を中膜に持つものの,加齢や動脈硬化などの影響により弾性線維が減少し,膠原線維が増加することが知られています。このため,特に高齢者や肺高血圧のある場合には,肺動脈末梢で不注意にバルーンを膨らませると肺動脈損傷の可能性があります。通常,1.25 mL未満のバルーン拡張で肺動脈楔入が得られる場合,1.5 mLで肺動脈楔入が得られる位置まで,肺動脈カテーテルを引き戻しています。拡張バルーンは,最大1.5 mLまでに対応しています。また,バルーン拡張に際しては,液体注入は禁忌です。バルーン拡張は空気を用います。液体は回収できなくなる可能性があることに注意してください。また,バルーンを拡張させたままにしておくことで,肺梗塞の可能性が高まるので,PAWPの測定を行うときのみ,バルーンを拡張させます。
3)カテーテル感染症と血小板減少のリスク
長期留置により,カンジダ属などの真菌感染症,ブドウ球菌属などを含めた血流感染症,そして血小板減少の発症が増加します。このため,肺動脈カテーテルは,PCPS離脱やIABP離脱までなどの急性期の心機能評価の一時的な使用に限定することが望ましいです。
おわりに
SwanとGanzが考案した肺動脈カテーテルは,既に40年の歳月が経過しました。本稿は,主に研修医と後期研修医を対象として,この肺動脈カテーテルによる心機能モニタリングを解説したものです。集中治療室(ICU)などで勤務する看護師さんも,是非,お役立て下さい。このような肺動脈カテーテルは,適切な理解のもとで使用することにより,心機能に関する多くの情報を提供してくれます。ICUやCCU,また心臓血管麻酔などでの利用に役立てて下さい。
文 献
1. Swan HJ, Ganz W, Forrester J, et al. Catheterization of the heart in man with use of a flow-directed balloon-tipped catheter. N Engl J Med 1970;283:447-51.
2. Ganz W, Donoso R, Marcus HS, et al. A new technique for measurement of cardiac output by thermodilution in man. Am J Cardiol 1971;27:392-6.
3. Forrester JS, Diamond G, Chatterjee K, et al. Medical therapy of acute myocardial infarction by application of hemodynamic subsets (first of two parts). N Engl J Med 1976;295:1356-62.
4. Forrester JS, Diamond G, Chatterjee K, et al. Medical therapy of acute myocardial infarction by application of hemodynamic subsets (second of two parts). N Engl J Med 1976;295:1404-13.
5. Forrester JS, Diamond GA, Swan HJ. Correlative classification of clinical and hemodynamic function after acute myocardial infarction. Am J Cardiol 1977;39:137-45.
6. Adolph Fick (1829-1901), mathematician, physicist, physiologist. JAMA 1967;202:1100-1.
7. Kety SS, Schmidt CF. The effects of active and passive hyperventilation on cerebral oxygen consumption, cardiac output, and blood pressure of normal young men. J Clin Invest. 1946;25:107-19.
8. Stewart GN. Researches on the Circulation Time and on the Influences which affect it. J Physiol. 1897;22:159-83.
9. Hamilton WF, Riley RL Comparison of the Fick and dye injection methods of measuring the cardiac output in man. Am J Physiol 1948;153:309-21
10. Krafft P, Steltzer H, Hiesmayr M, et al. Mixed venous oxygen saturation in critically ill septic shock patients. The role of defined events. Chest 1993;103:900-6.
救急・集中治療医学分野
教授 松田直之
はじめに
IIT(intensive insulin therapy:強化インスリン療法)は,救急・集中治療領域の急性期管理や糖尿病患者の血糖管理などにおける,即効型インスリンの持続投与による厳格血糖管理の方法である。血糖値上昇は,血漿浸透圧上昇,糖化蛋白を介した血管内皮細胞傷害,白血球機能低下,組織再生遅延などを介して,心血管系イベント,急性腎不全を高めるため,できるだけ正常な血糖値を維持することが望ましい。しかし, IITを用いた厳格血糖管理では,医原的低血糖合併の危険性,また,糖尿病罹患歴がある場合にはどのレベルでの維持が適切なのかにも留意しなければならない。現在,集中治療領域では,IITとして即効型インスリン50単位を50mLの生理的食塩水に希釈し,中心静脈路より持続投与し,4時間毎に観血的動脈路からの採血により血液ガス分析器を用いて,厳格血糖管理を行っている。このようなIITによる厳格血糖管理の動向を,近年の臨床研究に照らしてまとめる。名大病院をはじめ,救急・集中治療部で勤務される皆さんに,参考として頂きたい。
急性期臨床研究によるIITの目標血糖値の探求
救急・集中治療領域の対象とする急性期患者では,基礎疾患の内容によらず炎症性サイトカイン濃度の高まり,耐糖能異常が生じやすい病態となる。このような急性期全身性炎症病態では,糖負荷に対する即効型インスリンの持続投与により,厳格血糖管理を行っている。この管理血糖値目標を定めるいくつかの大規模臨床研究が,1990年代より報告されている。
1995年に報告されたDIGAMI study(diabetes mellitus insulin-glucose infusion in acute myocardial infarction)1)は,急性心筋梗塞を発症したHbA1cが8~8.2%レベルの糖尿病患者620名を対象に,1990~1993年にスエーデン19施設で行われた多施設合同前向き臨床研究である。本研究は,グルコース・インスリン療法(GI)として80 IUの速効型インスリンを5%糖液500 mLに溶解し,30 mL/hの速度で静脈内投与する効果を検討したものである。GIにより,血糖値170 mg/dLレベルに維持した306名と血糖値270 mg/dLレベルに維持した314名の生存率を比較した結果,血糖値170 mg/dLに調節した群で1年死亡率が26.1%から18.6%に低下したと報告されている。
この追試に当たるDIGAMI 2 study2)は,急性心筋梗塞を発症したHbA1c 7.2~7.3レベルの2型糖尿病患者1,253名を対象として,1998年1月より2003年5月までヨーロッパ44施設で施行された前向き臨床研究である。インスリン投与法を3群に分けて解析し,血糖値をすべて170 mg/dLレベルに維持している。DIGAMI study1) で施行された24時間のGIのみの群,初病日のGIに加えて第2病日以降もインスリン皮下投与を継続した群,さらに,施設独自の管理でインスリンの有無にこだわらずに血糖値を170 mg/dLレベルに調節した群の3群を比較した結果,3群間の院内死亡率に差が認められなかった。すなわち,糖尿病を合併した急性心筋梗塞患者の生命予後において,長期的なインスリン投与やインスリン投与量が重要なのではなく,管理初期の170 mg/dLレベルのIITによる血糖管理が長期生存に重要と結論されている。
一方,DIGAMI study1)を受けて2001年N Engl J Medに報告されたベルギーのルーバン大学のVan den Bergheらによるルーバンスタディは3),2000年2月から2001年1月までの期間における単一の集中治療室(intensive care unit: ICU)で施行された前向き臨床研究であり,Acute Physiology and Chronic Health Evaluation II score(APACHE-IIスコア)9レベルの重症度の比較的低い外科系患者1,548名を対象としたものだった。手術後の血糖値をIITによる厳格血糖管理80~110 mg/dLレベル,従来推奨型血糖管理180~200 mg/dLレベルの2群に分類し,死亡率を解析している。この研究は,管理初病日より盲目的に1日量200~300 gの糖負荷を行い,1日あたり約71単位の速効型インスリンの持続投与を行い,血糖値を80~110 mg/dLレベルに厳格管理している。結果として,ICU死亡率を8.0%から4.6%,5日以上ICUに滞在した患者群のICU死亡率を20.1%から10.6%,院内死亡率を10.9%から7.2%に減じることができたと報告し,厳格血糖管理の重要性を提起する結果となった。
後にVan den Bergheらは,2003年のCrit Care Med4)において,血糖値20 mg/dLの増加により急性腎不全や感染症の合併率が高まること,さらに,インスリン10 IU/日の増加は3日以上持続するCRP 15 mg/dL以上の発生を有意に減少させることを公表し,血糖値20 mg/dLの上昇で死亡率が30%上昇し,血糖値200 mg/dLでは血糖値100 mg/dLの2.5倍に死亡率が高まると報告した。
このような結果は,内科ICU患者においてもVan den Bergheら5)により検討が加えられ,血糖値180-200 mg/dLより80-110 mg/dLに管理することで,急性腎不全合併率,人工呼吸管理期間,ICU管理期間を有意に減少することが確認されたが,対象とした全患者の院内死亡率を低下させてはいなかった。さらに,後に国際学会等を含めて大きな議論となったことは,ルーバンプロトコール4)によるインスリン投与により,低血糖発症率が6.2%から18%の約3倍に上昇していることだった。
急性期患者の厳格血糖管理を追試した臨床研究
2003年4月から2005年6月までにドイツの18施設の大学病院ICUで検討されたVISEPトライアル(the Efficacy of Volume Substitution and Insulin Therapy in Severe Sepsis trial)6)は,APACHE IIスコア20レベルの重症敗血症患者群を対象に,血糖値を110 mg/dLレベルに管理する厳格血糖管理(n=247)と,180 mg/dLレベルで管理する従来型血糖管理(n=290)が比較された。これらの患者群には,両群ともに糖尿病罹患患者を約30%含んでいたことが特徴である。ICU管理初日の投与カロリーは600 kcalレベル,第2病日で900 kcalレベルであり,ルーバンスタディより投与カロリーが少ない特徴がある。さらに,初病日より経腸栄養が約40%の患者に併用されている特徴がある。このような群間比較において,厳格血糖管理群の28日死亡率は24.7%,従来型血糖管理群の28日死亡率は26.0%と,厳格血糖管理群群に若干の死亡率減少を認めるものの,死亡率に有意差は認められなかった。このVISEPトライアル6)では,厳格血糖管理群で17%の低血糖合併を認め,従来型血糖管理群の4.1%と比較して,厳格血糖管理のIITで有意に高い低血糖合併が示される結果となった。
最終的にVan den BergheらのIITによる厳格血糖管理に対しての強い反論を訴える結果を提示したものが,Normoglycemia in Intensive Care Evaluation–Survival Using Glucose Algorithm Regulation study(NICE-SUGARスタディ)7)である。このIITによる厳格血糖管理の研究は,2004年12月から2008年11月までオーストラリア,ニュージーランド,カナダを中心とする38の大学病院を含む42のICUで,合計6,104名を対象として施行されたたものである。患者重症度はAPACHEスコア 21.1レベルであり,APACHEスコア 25以上の患者を約30%含んでいた。この研究では約20%の糖尿病歴のある患者を含み,ICU入室前にインスリン投与を受けていた患者を約29.8%程度に含んでいることが特徴である。また,NICE-SUGARスタディ7)の特徴は,ICU入室後の非蛋白カロリーが600 kcal/日レベルに保たれている点であり,経静脈栄養は 170 kcal/日レベルである点にある。
このような患者管理背景において,NICE-SUGARスタディ7)の1次エンドポイントは90日死亡率とされ,厳格血糖管理81~108 mg/dL(n=3,010)と,従来型血糖管理180 mg/dL(n=3,012)が比較された結果,少なくとも14日までの厳格血糖管理により,28日死亡率は従来型血糖管理で20.8%,厳格血糖管理で22.3%であり,さらに90日死亡率は厳格血糖管理で有意に高くなるという結果が得られた。低血糖合併率は,17%レベルのVISEPトライアル6)ほどには高くなく,厳格血糖管理で約6.8%,従来型血糖管理で約0.5%の結果であった。
ルーバンスタディとNICE-SUGARスタディの比較
IITによる血糖管理目標を定める上で,Van den Berghe らの外科系ルーバンスタディ3)とNICE-SUGARスタディ7)を比較する際に,注意するべきいくつかの点がある。主な注意点は,①患者重症度,②グルコース負荷量,③研究手法,つまり単施設研究か多施設共同研究か,の3点である。
まず第1に,Van den Berghe らの対象とした患者群は,NICE-SUGARスタディ7)より患者重症度が低い特徴がある。また,糖尿病既往歴のある患者を,NICE-SUGARスタディ7) では多く含んでいる。患者重症度の低い患者群では全身性炎症が必ずしも強いものではないため,急性期に生じた高血糖自体が炎症負荷として強く出現する可能性がある。全身性炎症が低い病態では,高血糖自体が白血球機能を低下させ,感染症合併率を高める結果を導く可能性は否めない。
第2に,外科系ルーバンスタディ3)の高血糖は医原的と考えられるものであり,ICU入室の初病日からの糖負荷が800~1,200 kcalと高い点に問題がある。ルーバンスタディ3-5)とNICE-SUGARスタディ7)を比較する上で,1日あたりの糖負荷量の差が結果に反映した可能性がある。これらの研究結果の差は,全身性炎症期の過量の糖負荷は有害であるということを意図しているのかもしれない。
最後に,単施設研究では,研究施行者達の主観が入り込む可能性は否定できない。また,NICE-SUGARスタディの28日死亡率は20%を超える比較的高いものであり,多施設研究による管理の質の乱雑さにより,IITによる厳格血糖管理の有意性が消失した可能性は否めない。
糖尿病合併患者に対する留意点
IITの目標とする血糖値は,糖尿病患者ではやや高い方が望ましいとする可能性が指摘されていることには,今後の注意が必要である。表には,本稿で解説を加えた臨床研究結果をまとめたが,VISEPトライアルにおいても,NICE-SUGARスタディにおいても,糖尿病罹患歴のある患者を多く含んでいることに注意が必要である。
Van den Bergheら8)は2006年に,既に報告した外科ICU患者1,548名3,4)と内科ICU患者1,200名5)を合わせたサブグループ解析として,非糖尿病患者2,341名と糖尿病罹患患者407名の解析を加えている。この報告8)では,ICU入室前に糖尿病を罹患していた患者群の院内死亡率は,血糖値150 mg/dLを超える管理で21.2%,血糖値110~150 mg/dLで21.6%,血糖値110 mg/dL未満で26.2%と,血糖値110 mg/dL未満の厳格血糖管理で院内死亡率がむしろ増加する傾向が確認されている。
このような糖尿病患者を対象とした厳格血糖管理の近年の臨床研究としては,2型糖尿病患者 10.251名を対象としたACCORD (Action to Control Cardiovascular Risk in Diabetes) スタディ9),11,140 名を対象としたADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation) スタディ10),1,791名を対象としたVADT (Veteran Administration Diabetes Trial) 11, 12)などがある。これらの研究結果を評価しても,2型糖尿病患者の急性期に厳格血糖管理を施行しても,心血管系イベントや死亡率が低下すると結論できないのが現状である。

おわりに
即効型インスリンの持続投与を用いたIITにより,少なくとも180 mg/dLを超える血糖管理は望ましくないと評価できる。IITによる厳格血糖管理の血糖目標は,糖尿病既往歴のない患者では150 mg/dL以下,糖尿病既往歴のある患者では170-180 mg/dL以下と近年の臨床研究より評価される。このような厳格血糖管理において,留意すべきことは,①糖負荷量,②低血糖合併であることを本稿では記した。患者急性期の全身性炎症病態においては,まず,盲目的な過剰糖負荷を行っていないかを各施設で再評価する必要がある。蛋白や脂質の投与量に比べ,糖負荷量が多い傾向を目にする機会が多い。その上で,厳格血糖管理の技術的手法に,スライディングスケールやダイナミックスケールを用いるにせよ,時系列で血糖変動を評価することが今後の課題である。現在,さまざまな企業で簡易型人工膵臓や持続血糖モニタの臨床応用が検討されている。今後は,これらのルーティンな臨床使用の中で,血糖値を時系列で評価し,IITによる急性期患者管理が安全に施行されることが期待される。多くの臨床結果が,日本集中治療医学会学術集会でも発表されることを期待している。
■ 参考文献
1. Malmberg K, Ryden L, Efendic S, et al; Randomized trial of insulin-glucose infusion followed by subcutaneous insulin treatment in diabetic patients with acute myocardial infarction (DIGAMI study): effects on mortality at 1 year. J Am Coll Cardiol 26:57–65, 1995
2. Malmberg K, Ryden L, Wedel H, et al; Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on morbidity and mortality. Eur Heart J 26:650–661, 2005
3. Van den Berghe G, Wouters P, Weekers F, et al; Intensive insulin therapy in the critically ill patients. N Engl J Med 345:1359-1367, 2001
4. Van den Berghe G, Wouters PJ, Bouillon R, et al; Outcome benefit of intensive insulin therapy in the critically ill: insulin dose versus glycemic control. Crit Care Med 31:359–366, 2003
5. Van den Berghe G, Wilmer A, Hermans G, et al; Intensive insulin therapy in the medical ICU. N Engl J Med 354:449-461, 2006
6. Brunkhorst FM, et al; Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med 358:125-139, 2008
7. NICE-SUGAR Study Investigators; Intensive versus conventional glucose control in critically ill patients. N Engl J Med 360:1283-97, 2009
8. Van den Berghe G, Wilmer A, Milants I, et al; Intensive insulin therapy in mixed medical/surgical intensive care units: benefit versus harm. Diabetes 55:3151-3159, 2006
9. Gerstein HC, Miller ME, Byington RP, et al; Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med, 358: 2545–2559, 2008
10. Patel A, MacMahon S, Chalmers J, et al; ADVANCE Collaborative Group. Intensive BG control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 358: 2560–2572, 2008
11. Duckworth W, Abraira C, Moritz T, et al; Intensive glucose control and complications in American veterans with type 2 diabetes. N Engl J Med 360: 129–139, 2009
12. VADT Group; Glycaemic separation and risk factor control in the Veterans Affairs Diabetes Trial: an interim report. Diabetes Obes Metab 11: 150–156, 2009
名古屋大学大学院医学系研究科 救急・集中治療医学分野
教授 松田直之
外科手術後の早期経腸栄養の有用性に関する最新のmeta-analysisでは,外科手術後24時間以内に経腸栄養(経口栄養)を開始した群と古典的な絶食群とを比較した13のRCTの1,173例を検討した結果,早期経腸栄養群で死亡率が有意に低く,有意差にはないものの,肺炎,SSI,腹腔内膿瘍,縫合不全,在院日数が早期経腸栄養群で少ないという結果となっている。早期経腸栄養は,肌のつやを改善し,ムチン性汗からは炎症性サイトカインを対外放出し,さらに副交感神経活性化よりニコチン受容体を介して免疫維持に働き,さらに外科吻合部等の組織回復に骨髄由来多能性幹細胞を招聘する可能性をもち,良いことばかりでやみつきになる治療のはずである。しかし,成功するすべを知らないものも多い。1日,2日と経腸栄養を遅らせることで,外科領域の多くの患者を救命できないでいる可能性がある。
外科領域では,開腹術後には腸管麻痺が生じ,経腸栄養を行うのは好ましくないとか,消化管吻合があれば吻合部の安静を保つのが重要で吻合部を食物が通ると縫合不全の危険性が増すなどという古くからの外科的慣習により,開腹手術後の早期経腸栄養は未だに浸透していない。Rothnieのデータ(Lancet 1963, 2:64-67)では,開腹手術後の腸管蠕動回復に要す時間は小腸で6~12時間,胃で12~24時間,大腸で48~120時間である。炎症の程度が高まる前に経腸栄養を開始することで,こ腸管蠕動回復時間が短縮されるのは,腸蠕動が消化管における炎症性サイトカインの産生を抑制するからである。腸管麻痺の観点からは,小腸内であればほぼ手術当日から,胃内であっても術後24時間以降に流動食が入っても問題がない。
また,消化管吻合がある場合に,早期経腸栄養を行って吻合部を栄養剤が通ったからといって縫合不全が増えるというエビデンスは見つけられない。一方,Tadanoら(J Surg Res 2010.)の動物実験では,消化管吻合部の創傷治癒プロセスを促進するためには,絶飲食は消化管治癒に望ましくなく,吻合部治癒を妨げる。血流の多いところに多能性幹細胞が応援に来るにくることからも自明である。さらに,この研究では,早期経腸栄養で機械的な荷重が加わることで,消化管吻合部の創傷治癒が促進すると結論している。古くは,Khaliliら(Am J Surg 2001;182:621-624)の動物実験も,早期の栄養が吻合部の耐圧強度を大きくすると報告している。
一方,Lewis SJらの臨床研究のメタ解析(J Gastrointest Surg 2009;13:569-575.)では,外科手術後24時間以内に経腸栄養を開始した群を古典的な絶食群とを比較すると,早期経腸栄養群で有意差はないものの縫合不全発生率は低くなっていることが確認されている。これらの栄養は,吻合部の上流から投与されており,吻合部の上流から,早期経腸栄養を行っても通常は問題になることはないと評価される。
以上の状況において,何か問題かというと,患者に低タンパク状態と組織脆弱性を進行させないことである。そして,細胞膜を維持するための必要不可欠なリン脂質をどのように維持するかである。このような中で,創傷治癒に関与する亜鉛(ココア)などの微量元素と,ビタミンの補充が不可欠に注意する。早期経腸栄養は,患者さん自身のホメヲスタシスに合わせた原始的な栄養法であり,経腸栄養の成功なきところに「生」はない。ならば,はじめから経腸栄養をという観点が,私自身が推奨する「早期経腸栄養」の展開である。集中治療と対峙している専門医は,おそらくは私のような経腸栄養推進派であろう。2009年に発表されたASPEN/SCCMの急性期栄養ガイドラインを紹介する。
紹介文献
■ McClave SA, Martindale RG, Vanek VW, et al : Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). J Parenter Enteral Nutr 33:277-316, 2009.
■ Martindale RG, McClave SA, Vanek VW, et al : Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine and American Society for Parenteral and Enteral Nutrition: Executive Summary. Crit Care Med 37:1757-61, 2009.
はじめに
2009年に発表されたASPEN/SCCMの急性期栄養ガイドラインは,重症症例の栄養管理に関するエビデンスに基づくガイドラインである。集中治療室(ICU)滞在日数が2-3日以上と予測される内因性および外因性成人重症患者を対象としており,一時的な管理を目的とした術後回復室としてのICU入室などの軽症患者は対象としていない。また,重症患者の栄養療法にかかわる全ての医療者を対象としており,医師をはじめコ・メディカルに向けた内容となっている。A-Lの計12項目,および49の推奨項目が記載され,項目ごとに推奨グレードが付記されている。エビデンス レベルIを保証する大規模研究は,100症例以上,あるいはpower analysisで事前に決定されたエンドポイントを満たすものと定義され,非ランダム化比較試験のエビデンス レベルは,同時対照試験(レベル),過去症例比較試験(レベル),専門家意見と同等の非コントロール試験(レベル)を含むかどうかにより決定されている。このようにして,それぞれの文献の質が評価され,エビデンス レベルがガイドラインに付記されている。推奨グレードは,個々の研究のエビデンス レベルに基づいて決定されている。推奨グレードAは少なくとも2つ以上の大規模陽性ランダム化試験(レベルI),Bは1つの大規模陽性ランダム化試験,グレードCは少なくとも1つ以上の小規模ランダム化試験(レベル)に基づいて決定されている。本ガイドラインでは,経静脈栄養の開始について,経腸栄養がうまくいかない場合として経腸栄養開始7日以降を推奨していることが特徴である。以下を,参考とされたい。
A. 経腸栄養の開始
A1. 集中治療においては,従来の栄養評価法(アルブミン,プレアルブミン,身体計測)は正確ではない。これは,急性相反応により影響を受けるためである。栄養を開始する直前評価には,体重減少の評価,入院前の栄養摂取,疾患の重症度,合併症,消化管の機能等を含むべきである。(Grade E)
A2. 随意摂取の維持できない重症患者においても,経腸栄養が開始されるべきである。(Grade C)
A3. 経腸栄養法は経静脈栄養法よりも好ましい投与経路である。(Grade B)
A4. 経腸栄養法は,入院後24~48時間以内の早期に開始されるべきである。(Grade C) そして次の48~72時間にかけ,目標に向かって進められるべきである。(Grade E)
A5. 血行動態が不安定な状態(高容量のカテコラミン投与および高容量の輸液など)では,血行動態の安定化まで,経腸栄養は差し控えるべきである。(Grade E)
A6. ICU患者における経腸栄養の開始に際し,腸蠕動音や腸内ガス・便の通過の有無の確認は,不必要である。(Grade B)
A7. ICUでは,経胃栄養あるいは経小腸栄養が好ましい。重症患者では,誤嚥の危険性が高い場合や,経胃栄養が困難であった場合には,小腸に留置された経腸チューブを用いて栄養されるべきである。(Grade C) 胃内残量が多いことを繰り返すために経腸栄養法を中断せざるを得ないだけでも,経小腸栄養に切り替える十分な論拠となる。(Grade E)
B. 経静脈栄養の開始
B1. ICU入室後7日間に渡り,早期経腸栄養法が適さないあるいは開始できない場合は,低栄養を放置すべきではない。(Grade C) ICU入室7日までに経腸栄養が不十分である場合に,7日以降の低栄養に備えて経静脈栄養が開始されるべきである。 (Grade E)
B2. 入院時に蛋白とエネルギーの欠乏を認めた場合には,経腸栄養法が実現不可能であれば,経静脈栄養法をできる限り早期に開始することが適切である。(Grade C)
B3. 上部消化管手術施行予定患者で経腸栄養法が行いにくい場合には,以下の特殊な状況下で,経静脈栄養法が行われるべきである。
栄養失調状態にある場合,経静脈栄養法を術前5~7日前より開始し,術後にかけ継続すべきである。(Grade B)
経静脈栄養法は術直後に開始すべきではなく,経腸栄養法が行えない状態が続く場合に,術後5~7日以降より開始されるべきである。 (Grade B)
術後5~7日間以内の経静脈栄養法は予後の改善が期待できず,感染症などのリスクが増加するかもしれない。経静脈栄養法は,7日間以上の治療期間が見込まれる際にのみ,開始されるべきである。(Grade B)
C. 経腸栄養の投与法
C1. 栄養必要量に従う目標経腸栄養量は,開始時点で明確に決定されるべきである。(Grade C) 栄養必要量は予測式によって算出するか,間接熱量測定により測定する。予測式は間接熱量測定よりも栄養必要量の評価が不正確であるため,予測式は注意して用いられるべきである。肥満患者における予測式は,間接熱量測定を用いなければ,より不正確となる。(Grade E)
C2. 入院第一週目に経腸栄養法の臨床効果を高めるためには,目標カロリーの50~65%以上を投与しようと努めるべきである。(Grade C)
C3. 経腸ルートのみで7~10日後に栄養必要量(目標摂取カロリー100%)を満たすことができない場合には,経静脈栄養による栄養補足を考慮する。(Grade E) 7~10日間経腸栄養法を行う前に経静脈栄養法による補足を開始することは,予後を改善しないどころか,有害となるかもしれない。(Grade C)
C4. 適切な蛋白投与量の時系列評価が重要である。標準的な経腸栄養製剤は糖質や脂肪などで供給される非蛋白熱量 (NPC: non-protein calorie)と蛋白質に含まれる窒素 (N: nitrogen)との比率NPC/Nを高くする傾向にあり,通常,蛋白を追加補足する。BMI (body mass index)が30未満の患者では,蛋白必要量は実体重に応じて1.2~2.0 g/kg/日を必要とし,熱傷や多発外傷患者ではさらに高くなるであろう。(Grade E)
C5. 肥満の重症患者では,経腸栄養法を用いた低栄養療法が推奨される。BMIが30をこえる肥満患者では,経腸栄養の目標は目標栄養必要量の60~70%,あるいは実体重に対して11~14 kcal/kg/日,あるいは理想体重に応じ22~25 kcal/kg/日を超えるべきではない。蛋白は,BMI 30~40のクラス�・�患者に対しては理想体重で2.0 g/kg/日以上,BMI 40以上のclass�患者に対しては理想体重で2.5g/kg/日以上に,投与されるべきである。(Grade D)
D. 経腸栄養適正化のモニタリング
D1. ICUにおける経腸栄養の開始にあたり,消化管運動(臨床上の腸閉塞の回復)の確認は,必ずしも必要ではない。(Grade E)
D2. 経腸栄養耐性(患者の腹痛や腹満の訴え,身体所見,腸内ガスや便の滞留,腹部X線像所見)は,監視されるべきである。(Grade E) 不適切な経腸栄養の中断は避けるべきである。(Grade E) 胃内残量が500 mL未満で,耐性兆候がなければ,経腸栄養を中断するべきではない。(Grade B) 診断目的の検査や処置のために患者を絶食にすることは,栄養素の不適切な供給や腸閉塞の長期化を防ぐために,最小限にとどめるべきである。腸閉塞は絶食により増悪するかもしれない。(Grade C)
D3. 経腸栄養プロトコールは,目標栄養量を達成させるために,施行されるべきである。(Grade C)
D4. 経腸栄養を施行されている患者では,誤嚥の危険を評価するべきである。(Grade E) また,誤嚥の危険性を減らすための手段を考慮すべきである。(Grade E) 誤嚥の危険性を減らすために以下の手段がある。
経腸栄養中のすべてのICU挿管患者において,ベッドの頭側を30~45°挙上するべきである。(Grade C)
誤嚥の高危険患者あるいは経胃栄養に耐えられない患者に対して,経腸栄養は持続輸液に切り替えられるべきである。(Grade D)
腸管運動促進薬(メトクロプラミドやエリスロマイシン)や麻薬拮抗薬(ナロキソン等)のような,消化管運動を促進させる薬剤を併用すべきである。(Grade C)
幽門より肛門側へチューブを留置することにより,経腸栄養注入量を再評価すべきである。(Grade C)
人工呼吸器関連肺炎の危険性を減少させるために,クロルヘキシジンによる口腔内洗浄を2回/日行うことを考慮すべきである。(Grade C)
D5. 誤嚥のマーカーとして,経腸栄養剤の青色着色やグルコースオキシダーゼ法は,重症患者管理において使用するべきではない。(Grade E)
D6. 経腸栄養に関連した下痢の増悪は,その原因の精査を必要とする。(Grade E)
E. 適切な経腸栄養剤の選択
E1. 免疫調節経腸栄養剤(アルギニン,グルタミン,核酸,ω-3脂肪酸,抗酸化物質)は,適切な患者群(定時の大手術,外傷,熱傷,頭頸部癌,人工呼吸を要する重症患者)において,重症敗血症に注意しながら使用されなければならない。(重症敗血症ではアルギニンによりNO産生が高まる可能性がある) (外科系ICU患者に対してGrade A),(内科系ICU患者に対してGrade B) 免疫調節製剤の適応を満たさないICU患者群では,標準的な経腸栄養製剤を投与すべきである。(Grade B)
E2. ARDS (acute respiratory distress syndrome)や重症急性肺傷害の患者では,抗炎症脂質(ω-3魚油,サラダオイル等)や抗酸化物を含有する経腸栄養剤を投与すべきである。(Grade A)
E3. 免疫調節製剤から最適な治療効果を得るには,少なくとも必要栄養量の50~65%が投与されるべきである。(Grade C)
E4. 下痢を認める場合には,可溶性繊維や小ペプチド含有製剤を使用してもよい。(Grade E)
F. 補助療法
F1. プロバイオティクス製剤の投与は,移植,腹部大手術,重症外傷のような重症患者群において,感染を減少させることにより,予後を改善することが示されている。(Grade C) しかし,現在,一般的ICU患者群では,予後改善効果が一貫しないため,プロバイオティクスを使用することは推奨されない。プロバイオティクス製剤の種類により効果が異なり,広く断言的にプロバイオティクス製剤の推奨を行うことは困難である。現在,同様に重症急性壊死性膵炎患者に対するプロバイオティクスの使用は,文献エビデンスの相違と細菌株の不均質性に基づき,推奨されない。
F2. 抗酸化ビタミンと微量ミネラルの組み合わせ(特にセレン)は,特殊栄養療法を受けている重症患者全てに投与されるべきである。(Grade B)
F3. 熱傷,外傷や混合ICU患者において,グルタミンが含まれていない経腸栄養製剤には,グルタミンを加えることを考慮すべきである。(Grade B)
F4. 経腸栄養を受け下痢が増悪している血行動態が安定した重症患者に対しては,可溶性繊維が有益かもしれない。不溶性繊維は,全ての重症患者において,避けるべきである。腸管虚血や腸蠕動異常の危険性が高い患者に対しては,可溶性繊維や不溶性繊維は避けるべきである。(Grade C)
G. 経静脈栄養の適応
G1. 経腸栄養がうまくできない場合,経静脈栄養の必要性を評価すべきである。(Grade C) 経静脈栄養が必要と評価される場合,量,内容,モニター,補助的添加物の選択を考慮し,効果を最大に高めるように進めるべきである。(Grade C)
G2. 経静脈栄養を受けている全てのICU患者において,少なくとも初期には,許容範囲内の低栄養療法が考慮されるべきである。いったん栄養必要量が決定されると,栄養必要量の80%が最終目標あるいは経静脈栄養の投与量として投与されるべきである。(Grade C) 患者状態の安定により,栄養必要量を満たすために経静脈栄養を増量してもよい。(Grade E) 肥満患者(BMI≧30)に対しては,経静脈栄養は,本ガイドラインC5における経腸栄養での推奨量に従うべきである。(Grade D)
G3. ICU入室の最初の1週間において,経腸栄養が適さず経静脈栄養が必要な際は,大豆油を含まない経静脈栄養とするべきである。(Grade D)
G4. 栄養支持療法では,血清グルコース濃度を適切にコントロールするべきである。(Grade B) 血清グルコース濃度は110~150 mg/dLが最適かもしれない。(Grade E)
G5. 経静脈栄養を重症患者に用いる際,グルタミンを経静脈的に補足することを考慮すべきである。(Grade C)
G6. 経静脈栄養により安定化した患者において,繰り返し経腸栄養を開始する努力をすべきである。経腸栄養の耐性が改善し,経腸投与されるカロリー量が増加するにつれ,経静脈投与の栄養量を減量すべきである。目標栄養必要量の60%以上が経腸投与されるまでは,経静脈栄養を終了すべきでない。(Grade E)
H. Pulmonary Failure (呼吸不全)
H1. 急性呼吸不全のICU患者において,高脂質低炭水化物製剤をCO2産生減少のために,ルーチンに使用することは推奨されない。(Grade E)
H2. 急性呼吸不全の患者では,水分が制限された高濃度栄養製剤を考慮すべきである。(Grade E)
H3. 血清リン酸塩濃度を厳重にモニターし,必要に応じて適切に補正すべきである。(Grade E)
I. Renal Failure (腎不全)
I1. 急性腎障害を合併したICU患者にも,標準的な経腸栄養製剤を投与すべきであり,標準的なICUの蛋白と栄養量投与に従うべきである。電解質異常を伴う場合には,電解質制限のある腎不全のための特殊製剤を考慮するとよい。(Grade E)
I2. 血液浄化法を受けている患者では,最大2.5 g/kg/日まで蛋白を投与すべきである。腎不全患者において,透析療法の開始を避けるあるいは遅らせる目的で,蛋白投与量を制限すべきではない。(Grade C)
J. Hepatic Failure (肝不全)
J1. 肝硬変および肝不全患者においては,腹水,循環血液量減少,浮腫,門脈圧亢進,低アルブミン血症などの合併症のため,従来の栄養評価法は正確性や信頼性に欠けるので,注意して使用すべきである。(Grade E)
J2. 急性・慢性肝疾患のICU患者において,経腸栄養は栄養療法の好ましい投与経路である。肝不全患者の栄養において,蛋白制限は避けるべきである。(Grade E)
J3. 急性・慢性肝疾患ICU患者では,標準的な経腸栄養製剤を使用すべきである。標準治療に抵抗性である脳症患者に対しては,腸管作用性抗生剤とラクツロースに抵抗性のある場合,分枝鎖アミノ酸製剤(BCAA: balanced chain amino acid formulation)を用いるべきである。(Grade C)
K. Acute Pancreatitis (急性膵炎)
K1. 急性膵炎患者は,入院時に重症度を評価すべきである。(Grade E) 重症急性膵炎では,経鼻腸管チューブを留置し,輸液蘇生が完了するやいなや経腸栄養を開始すべきである。(Grade C)
K2. 軽症~中等症急性膵炎患者は,予期しない合併症が増悪するか,7日以内に経口摂取に進むことができない場合以外には,栄養補助療法を必要としない。 (Grade C)
K3. 重症急性膵炎では,経胃あるいは経空腸による経腸栄養を行う。(Grade C)
K4. 重症急性膵炎では,以下の方法により経腸栄養の併用効果を高めることができる。
経腸栄養の早期開始により,入院後の腸閉塞の期間を最小限とする。(Grade D)
消化管における経腸栄養注入位置を,より肛門側に変更する。(Grade C)
投与される経腸栄養の内容を,蛋白質から小ペプチドに,また長鎖脂肪酸から中鎖脂肪酸あるいはほぼ脂肪分のない製剤に変更する。(Grade E)
ボーラス注入から持続注入に切り替える。(Grade C)
K5. 重症急性膵炎患者に対して,経腸栄養が不可能であれば,経静脈栄養が考慮されるべきである。(Grade C) 入院後最初の5日間が経過するまで,経静脈栄養を開始すべきではない。(Grade E)
L. 終末期栄養療法
L1. 終末期症例では,特殊な栄養療法は必ずしも必要ではない。栄養療法を行うかどうかの判断は,患者およびその家族との十分なコミュニケーションや現実的な目標に基づいて,また患者自身の意思を尊重して決断されるべきである。(Grade E)
おわりに
集中治療の専門医によるしっかりとした急性期管理体制が必要でもあるにかかわらず,本邦における集中治療医学の学術的基盤は,一部の施設や一部の医師を除いて乏しい。これは,まだまだ救急・集中治療を担う専門医としてのマンパワーが本邦に足りないためと考えている。世界はすこぶる治療成績の良い我々の集中治療管理のエビデンスを待っているようにも思われる。急性期集中治療の発展に夢を持つ若い皆さんの参入を期待してやまない。急性期栄養管理においても,本稿で紹介したASPEN/SCCMの急性期栄養ガイドラインを踏まえて,これからの5年で本邦のエビデンスをまとめていくことが必要と考えている。少なくとも,既に汎発性腹膜炎や重症敗血症では,死亡することない治療成績を得ている。これが達成できないときは,栄養管理と免疫管理と感染症管理ができていないときである。
日本麻酔科学会 山村記念賞受賞記念講演
敗血症病態における転写因子nuclear factor-κBの機能解析
京都大学大学院医学研究科 初期診療・救急医学分野
松田直之
はじめに
現在,敗血症(sepsis)は,1991年の米国胸部疾患学会(American College of Chest Physicians)と米国集中治療医学会(Society of Critical Care Medicine)の合同会議による定義に従い,感染症を基盤とした全身性炎症反応症候群(systemic inflammatory response syndrome: SIRS)と理解されている1)。このような敗血症病態は,炎症性サイトカイン血症を基盤とし2),多臓器不全,ショック,播種性血管内凝固症候群(disseminated intravascular coagulation: DIC)を合併しやすい病態であり,麻酔科医や集中治療医の管理する重要な病態の1つである。
この敗血症病態は,現在も死亡率が高く,麻酔科医は縫合不全などの術後感染病態として,麻酔管理や集中治療管理に難じる場合も多い。Angusら3)の2001年の報告では米国における敗血症罹患患者数は年間75万人を超えると評価され,米国の救急救命センターで治療される重症敗血症患者数は年間50万人を超え,未だ敗血症性ショック後の死亡率は約45%レベルで推移している4)。米国では,敗血症罹患者数は2020年までに年間100万人,そして2050年までには年間200万人を越えると推定され,重症敗血症と敗血症性ショックの治療の標準化を目的としてSurviving Sepsis Campaign guidelines5, 6)が公表された。本邦においても,2010年以降には肺炎などによる敗血症が死因の第2位となると予測されており7),現在も集中治療領域の死因の第1位は重症敗血症や敗血症性ショックである。
一方,私は1993年に麻酔科医となり,その後,多くの敗血症病態の麻酔や集中治療を経験した。しかし,多くの麻酔科医や集中治療医が経験してきたように麻酔中の敗血症病態にはどうにか対応できるものの,麻酔管理後の集中治療室を含めた治療成績は極めて不良な時期が続いた。万能薬として知られていたグルココルチコイドが効果を示さないケースは極めて多いものだった。このような背景を基に,私は敗血症を代表とするSIRS病態の解明を研究することを目的として,1995年に北海道大学大学院に進学し,薬理学講座や生化学講座などで研究技術の指導を受け,主に糖尿病病態を中心とした循環薬理学的研究を行う一方で,さまざまな重症度の敗血症モデル動物を独自に考案し,敗血症病態の解析を開始した。この過程において,敗血症病態の炎症性サイトカインをひとまとめに抑制する方法として,2001年に転写因子nuclear factor-κB(NF-κB)の遺伝子治療を敗血症動物モデルに応用した。そして,その後,敗血症動物モデルに対するactivator protein-1やCREBなどの転写因子阻害やnon-cording RNAの導入に移行した。本学会賞受賞記念講演では,このような背景に基づき,私の敗血症研究初期にターゲツトとしたNF-κBの役割について論じる。
1. Alert細胞理論
1996年にCell誌に報告されたToll受容体と自然免疫との関連を発端とし8),ヒトのToll-like受容体(TLR)(9-11)の解析が進み,現在,敗血症やSIRSにおけるトリガーシグナルの理解が進んだ(2, 12, 13)。TLRやnucleotide oligomerisation domain(NOD)(14)およびNOD containing leucine-rich repeats(NLR)(15)は,細菌の含有する病原体関連分子パターン(pathogen-associated molecular patterns)を認識する受容体であり,敗血症病態において炎症性分子の初期産生に関与する。さらに,TLRやNLRに加え,TNF受容体(TNF-R)16)やinterleukin受容体(IL-R1(17), IL-R6(18)),C-type lectin receptor(CLR)(19),receptor for advanced glycation end product(RAGE)(20),protease activated receptor(PAR)(21, 22)などの機能解析が進み,現在はさまざまな炎症性受容体を介した敗血症病態の炎症増幅の機構が明らかとされてきている。
敗血症病態はさまざまな炎症性サイトカイン,抗炎症性サイトカイン,および炎症性分子により制御されるが,これらの根底をなす機能制御として転写因子の解析が重要である。敗血症病態で出現する炎症性分子は,炎症性受容体を介した転写因子活性に伴う産生物質としてまとめることができ,初期にこの中心的役割を担う転写因子がNF-κBである(2, 23-26) 。上述の炎症性受容体を発現する細胞は,inflammatory alert cell(Alert細胞)(12)として,NF-κBを活性化させる細胞内情報伝達を持ち,結果として炎症性分子の転写を高める特徴を持つ。
敗血症において,多臓器不全が誘導される最も重要な要因は,単球,好中球,樹状細胞,リンパ球などの免疫担当細胞のみではなく,血管内皮細胞や主要臓器を構成する一部の細胞にあり,これらは同じ細胞種といえども炎症惹起力に個性を持つ。これらのAlert細胞には,TLR,TNF-R,IL-1Rなどの炎症性受容体が発現していることが特徴である。これらは,Alert細胞として,炎症性分子の産生を高め,細胞内でのnon cording RNAによる自己制御の中で,特にケモカインや接着分子の産生を高め,炎症局所への白血球系細胞の浸潤を誘導する作用がある。 これにより,Alert細胞近傍の炎症は,他の非炎症部位と異なり,炎症活性を相乗的に高めることになる。肺では気管支上皮細胞や2型上皮細胞,さらには右心房では,他の臓器に比較して,正常状態にあってAlert細胞の比率が高い。これにより,全身性炎症の初期のターゲットは,急性肺傷害や心房筋炎症となる。
2. 敗血症病態と転写因子NF-κB
NF-κBは1986年にSenとBaltimoreにより免疫グロブリン軽鎖遺伝子のエンハンサーに結合する転写因子として同定され27),N末端に約300のアミノ酸からなるRelドメイン(DNA結合ドメイン)を持つ蛋白として,哺乳類ではRelA(p65),p50, p52,c-Rel,RelBの5つからなるRel/ NF-κBファミリーとして総称されている28)。このRelドメインは2つの免疫グロブリン様のドメインで形成され,2量体形成にはC末端側ドメインが,DNAとの結合にはN末端側ドメインが関与する。これらのNF-kBファミリーはホモあるいはヘテロ2量体を形成し,その組み合わせにより核内のκBモチーフ(GGGACTTTCC)との結合親和性や転写活性を変化させている。しかし,これら2量体NF-κBは,非炎症状態では細胞質内や核内でinhibitory kB(I-kB)ファミリー(I-kBα,I-kBβ,I-kBε,I-kBγ,I-kBζ,Bcl-3,p105,p100)と結合し,DNA領域との結合が抑制されている。
これに対して,敗血症などのSIRS病態では,TLR,TNF-R,IL-1Rなどの炎症性受容体シグナルを介して,I-kBキナーゼ(IKK)複合体がリン酸化されることにより,I-κBがリン酸化され,I-kBのプロテアソームでの分解が促進する。これにより,敗血症病態のさまざまな臓器のAlert細胞の細胞質内で2量体NF-kBがI-kBより遊離し,2量体NF-κBが核膜を通過し,DNAのNF-kBモチーフに結合し,炎症性サイトカインや炎症性分子の転写活性を高める(図)。これが,NF-kB活性化の古典的経路として,主要臓器のAlert細胞で確認できる。
一方,2量体NF-kBは核内でもI-kBζなどにより哺綴されることが報告され,さらには,IKKが細胞質内と核内を移動していることも知られている29, 30)。免疫担当細胞では,炎症性受容体シグナルを介して活性化されたIKKαなどが,核内に移行し,核内のI-kBζなどがリン酸化やユビキチン化を受け,核内でもNF-kB活性を高める機序が存在する。
このようなDNA上のNF-κB領域の活性化により過剰産生される,私自身が確認した代表的分子を表に示した。TNF-α,IL-1,IL-6などの炎症性サイトカイン,誘導型NO合成酵素(inducible nitric oxide synthase: iNOS),誘導型シクロオキシゲナーゼ(inducible cyclooxygenase-2:COX2),ケモカイン,接着分子, granulucyte-macrophage colony-stimulating factor(GM-CSF),granulucyte colony-stimulating factor(G-CSF),macrophage colony-stimulating factor(M-CSF)などがNF-κB活性に依存して転写段階で過剰産生される。過剰産生されたiNOSにより産生される一酸化窒素(nitric oxide: NO)は,殺菌作用を持つものの,血管透過性亢進やリンパ流抑制の原因となり,間質の浮腫形成に強く関与する。また,IL-8などのケモカインの過剰産生により炎症性細胞の遊走が高まり,血管内皮細胞などに過剰産生された接着分子により好中球や血小板などの細胞接着が高まる。血管側では,血液凝固に関与する組織因子(tissue factor: TF)や線溶抑制に働くplasminogen activator inhibitor-1(PAI-1)などもNF-kB活性により過剰発現されるため,血管内凝固が亢進し,線溶が抑制され,線溶抑制型DICの進展が高まる。
3. 転写因子NF-κBの遺伝子治療
DNA上のNF-κB結合領域(GGGACTTTCC)の構造をなぞらえた2本鎖オリゴヌクレオチド(5’-CCTTGAAGGGATTTCCCTCC-3’, 3’-GGAACTTCCCTAAAGGGAGG-5’)などをデコイ核酸(おとり核酸)として作成し,2量体NF-κBを細胞質内や核内で補綴し,DNAのNF-κB結合領域活性を抑制することが期待できる。NF-kBデコイ核酸をリポゾームで包埋し,静脈内投与した場合,正常の肺でも効率よく導入される傾向があるが,敗血症病態では血管内皮細胞や2型肺胞上皮細胞などのAlert細胞に特異的に導入効率が高まり,Alert細胞のNF-kB活性を強く抑制できることを見出した23-26)。このようにして,敗血症に合併する急性肺傷害をNF-kB活性抑制の観点から評価した結果,表に示したiNOSやCOX2などの炎症性物質のほか,ヒスタミンH1受容体,ブラジキニン受容体,TLR2,ヒスタミン合成酵素L-ヒスチジンジカルボキシラーゼ,platelet activated factor(PAF),macrophage migration inhibitory factor(MIF)などの転写がNF-κB活性により高まることが確認された23-26)。
また,敗血症病態ではインスリン抵抗性が生じることが知られているが,NF-kB活性はインスリン抵抗性にも関与する。盲腸結紮穿孔によるマウス敗血症モデルでは,敗血症10時間以降に大腿筋でもNF-kB活性が高まるが,これをリポゾーム包埋したNF-kBデコイ核酸の筋注で抑制でき,この結果として大腿筋におけるインスリン受容体を介したグルコーストランスポータ4(GLUT4)の細胞膜移動が改善できる26)。
以上のように,NF-kBデコイ核酸はNF-kB活性の高まるAlert細胞に取り込まれ,NF-kB活性を抑制することにより,炎症活性を低下させる可能性を持つ。従来,抗炎症効果はグルココルチコイドなどの合成ステロイドに期待されていたが,敗血症病態ではグルココルチコイド受容体は減少する傾向があり,メチルプレドニゾロンなどの効力が期待できない31)。NF-κBデコイ核酸は,合成ステロイドと異なり,リポゾーム包埋などの方法によりAlert細胞に取り込みを高める特徴がある。これは,その後の当研究グループにおけるsiRNAの導入においても確認された32, 33)。敗血症などのSIRS病態では,Alert細胞が脂質や蛋白の貪食能を高める機能を逆利用した結果である。Alert細胞を対象としたSIRS病態の遺伝子治療の1つとして,ステロイドに変わるNF-κBデコイ核酸の臨床応用が期待される。近年,NF-κB活性の抑制は,敗血症病態の炎症強度を弱めるものの,細菌排除に影響を与えないことが,別の研究グループから報告されている34)。
おわりに
敗血症は,感染を基盤とした全身性炎症反応症候群である。この病態進行過程において,主要臓器のAlert細胞のNF-κB活性が高まり,ケモカインや接着分子の転写段階からの産生を介して,Alert細胞近傍の炎症活性が高まる。この機能を抑制するためにリポゾーム法などで導入したNF-κBデコイ核酸は,Alert細胞に強い取り込みが期待でき,臓器炎症を強く抑制できる可能性を持つ。Alert細胞がリポゾームや異物の取り込みを高めることは,本一連の研究の副次的作用として確認された。
一方,ステロイドの作用するグルココルチコイド受容体は,Alert細胞に必ずしも発現しているわけではなく,敗血症病態では減少する傾向を持つ。このようなステロイドに代わり,NF-κBデコイ核酸の臨床応用が敗血症病態においても期待される。
本一連の研究は,私が麻酔や集中治療を担当していた際の臨床の場の病態生理学的疑問を基礎医学に持ち込み,臨床医の研究として発展させたものである。麻酔科学および救急・集中治療医学の領域には,未解決の多くの臨床上の問題点が残存する。基礎研究が臨床の15年先を見据えていることは否めない。臨床診療技術に加え,基礎医学と臨床研究の融和が,これから先の15年後に求められていることも否めない。麻酔科学の一つの魅力は,中枢から末梢まで,すなわちまさに全身の急性反応を網羅する点にある。麻酔科医が,臨床技術の熟成とともに,その後には自らの臨床上の疑問を解決すべく,さまざまな病態において学術的発展に助力されることを祈念している。
後記および謝辞
講演当日は,多くの皆さまに,御聴講頂き,どうもありがとうございました。そして,これまで多くのアドバイスを頂きました先輩諸先生,私の研究を手伝ってくれた若き先生たち,そして教え子たちにも列席を頂き,深く感謝しております。また,こうして研究を継続できているのも,学会や研究会で多くの皆さまより御指導や助言を頂いているからだと考えております。今度とも,変わらぬ御指導のほど,どうぞよろしくお願い申し上げます。
1)Members of the American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med 1992;20: 864–74.
2)Matsuda N, Hattori Y. Systemic inflammatory response syndrome (SIRS): molecular pathophysiology and gene therapy. J Pharmacol Sci 2006;101: 189-98.
3)Angus DC, Linde-Zwirble WT, Lidicker J, Clermont G, Carcillo J, Pinsky MR. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med 2001;29:1303-10.
4)Vincent JL, Taccone F, Schmit X. Classification, incidence, and outcomes of sepsis and multiple organ failure. Contrib Nephrol 2007;156:64-74.
5)Dellinger RP, Carlet JM, Masur H, Gerlach H, Calandra T, Cohen J, et al. Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock. Crit Care Med 2004;32:858–73.
6)Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med 2008;36:296-327.
7)柴田恵三, 舟田 久. 我が国におけるSIRS・sepsisの疫学. 日本臨牀 2004;62:2184-8.
8)Lemaitre B, Nicolas E, Michaut L, Reichhart JM, Hoffmann JA. The dorsoventral regulatory gene cassette spatzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell 1996; 86:973-83.
9)Kawai T, Akira S. Toll-like receptor and RIG-I-like receptor signaling. Ann N Y Acad Sci 2008;1143:1-20.
10)O'Neill LA. The interleukin-1 receptor/Toll-like receptor superfamily: 10 years of progress. Immunol Rev 2008;226:10-8.
11)Frantz S, Ertl G, Bauersachs J. Mechanisms of disease: Toll-like receptors in cardiovascular disease. Nat Clin Pract Cardiovasc Med. 2007;4:444-54.
12)松田直之. 全身性炎症反応症候群とToll-like受容体シグナル -Alert Cell Strategy-. 循環制御2004; 25:276-84.
13)Matsuda N, Hattori Y. Vascular biology in sepsis: pathophysiological and therapeutic significance of vascular dysfunction. J Smooth Muscle Res 2007;43:117-37.
14)Cartwright N, Murch O, McMaster SK, Paul-Clark MJ, van Heel DA, Ryffel B, et al. Selective NOD1 agonists cause shock and organ injury/dysfunction in vivo. Am J Respir Crit Care Med 2007; 175:595-603.
15)Becker CE, O'neill LA. Inflammasomes in inflammatory disorders: the role of TLRs and their interactions with NLRs. Semin Immunopathol 2007; 29:239-48.
16)Shen HM, Pervaiz S. TNF receptor superfamily-induced cell death: redox-dependent execution. FASEB J 2006; 20:1589-98.
17)Boraschi D, Tagliabue A. The interleukin-1 receptor family. Vitam Horm 2006; 74:229-54.
18)Kishimoto T. IL-6: from laboratory to bedside. Clin Rev Allergy Immunol 2005;28:177-86.
19)Kanazawa N. Dendritic cell immunoreceptors: C-type lectin receptors for pattern-recognition and signaling on antigen-presenting cells. J Dermatol Sci 2007; 45:77-86.
20)Lutterloh EC, Opal SM. Antibodies against RAGE in sepsis and inflammation: implications for therapy. Expert Opin Pharmacother 2007; 8:1193-6.
21)Leger AJ, Covic L, Kuliopulos A. Protease-activated receptors in cardiovascular diseases. Circulation 2006; 114:1070-7.
22)Jesmin S, Gando S, Matsuda N, Sakuma I, Kobayashi S, Sakuraya F, et al. Temporal changes in pulmonary expression of key procoagulant molecules in rabbits with endotoxin-induced acute lung injury: elevated expression levels of protease-activated receptors. Thromb Haemost 2004;92:966-79.
23)Matsuda N, Hattori Y, Takahashi Y, Nishihira J, Jesmin S, Kobayashi M, et al. Therapeutic effect of in vivo transfection of transcription factor decoy to NF-κB on septic lung in mice. Am J Physiol Lung Cell Mol Physiol 2004;287: L1248-55.
24)Matsuda N, Hattori Y, Takahashi Y, Jesmin S, Gando S. Nuclear Factor-κB decoy oligonucleotides prevent acute lung injury in mice with cecal ligation and puncture-induced sepsis. Mol Pharmacol 2005;67:1018-25.
25)Matsuda N, Yamazaki H, Takano KI, Matsui K, Takano Y, Kemmotsu O, et al. Priming by lipopolysaccharide exaggerates acute lung injury and mortality in responses to peptidoglycan through up-regulation of Toll-like receptor-2 expression in mice. Biochem Pharmacol 2008;75:1065-75.
26)Matsuda N, Yamamoto S, Yokoo H, Tobe K, Hattori Y. Nuclear factor-κB decoy oligodeoxynucleotides ameliorate impaired glucose tolerance and insulin resistance in mice with cecal ligation and puncture-induced sepsis. Crit Care Med 2009 in press.
27)Sen R, Baltimore D. Inducibility of kappa immunoglobulin enhancer-binding protein NF-κB by a posttranslational mechanism. Cell 1986;47:921-8.
28)Chen LF, Greene WC. Shaping the nuclear action of NF-κB. Nat Rev Mol Cell Biol 2004;5:392-401.
29)Gross S, Piwnica-Worms D. Real-time imaging of ligand-induced IKK activation in intact cells and in living mice. Nat Methods 2005;2:607-14.
30)Bates PW, Miyamoto S. Expanded nuclear roles for IκBzeta. Sci STKE 2004;254:48.
31)Kamiyama K, Matsuda N, Yamamoto S, Takano K, Takano Y, Yamazaki H, et al. Modulation of glucocorticoid receptor expression, inflammation, and cell apoptosis in septic guinea-pig lungs using methylprednisolone. Am J Physiol Lung Cell Mol Physiol 2008;295:L998-1006.
32)Matsuda N,Takano Y,Kageyama S,Hatakeyama N,Shakunaga K,Kitajima I,et al. Silencing of caspase-8 and caspase-3 by RNA interference prevents vascular endothelial cell injury in mice with endotoxic shock. Cardiovasc Res 2007;76:132-40.
33)Matsuda N, Yamamoto S, Takano KI, Kageyama SI, Kurobe Y, Yoshiwara Y, et al. Silencing of Fas-associated Death Domain Protects Mice from Septic Lung Inflammation and Apoptosis. Am J Respir Crit Care Med 2009;79:806-15.
34)Ye X, Ding J, Zhou X, Chen G, Liu SF. Divergent roles of endothelial NF-κB in multiple organ injury and bacterial clearance in mouse models of sepsis. J Exp Med 2008;205:1303-15.

図 NF-κB活性化の古典的経路
Nuclear factor-κB(NF-κB)は,5種類のサブタイプからなるRel/ NF-κBファミリーの総称であり,非炎症病態ではI-κB(inhibitory κB)と結合し,核内移行が阻止され,細胞質内に存在する。敗血症などの全身性炎症病態では,Toll-like受容体,IL-1受容体,TNF受容体などの炎症性受容体の各リガンドとの反応により,IRAK(Interleukin-1 receptor-associated kinase),TRAF(tumor necrosis factor receptor –associated factor),TAK1(TGF-βactivated kinase 1)などのリン酸化酵素が活性化し,さらに細胞質内でIKK(inhibitory κB kinase)が活性化される。これにより,IKKのターゲット分子であるI-κBがリン酸化されると,I-κBは細胞質内でマルチユビキチン化を受け,細胞質内消化を受け,ペッドキャップ構造のとれた2量体NF-κBが核内へ移行し,DNA上のκB領域と結合することで炎症性分子の転写が高まる。NF-κBデコイ核酸を用いた遺伝子治療は,2量体NF-κBを補綴する2本鎖オリゴヌクレオチドとして作用し,細胞質内でDNA上のκB領域と競合し,NF-κB活性化を抑制する。

京都大学大学院医学研究科
初期診療・救急医学分野
准教授 松田直之
はじめに
セプシス(sepsis)が感染症に起因する全身性炎症反応症候群(systemic inflammatory response syndrome: SIRS)とAmerican College of Chest Physicians(ACCP)とSociety of Critical Care Medicine(SCCM)の合同カンファレンスで定義されたのは1991年である1)。このセプシスの定義は,現在では集中治療医をはじめとする急性期管理者に十分に認知されるものとなったが,2000年までの段階では欧米ですらセプシスの診断が不確実だった。Poezal2)の米国,イギリス,フランス,ドイツ,イタリア,スペインの1,058名の医師を対象とした2000年11月から12月までの調査では,調査対象の半数に集中治療医が含まれているにもかかわらず,ACCP/SCCMのセプシスの定義に基づいてセプシスが診断されたのは,集中治療専門医で22%,他の専門医で5%に過ぎないものだった。このような背景は未だ本邦では続いており,病棟診療などを散見する限り,セプシスの診断や治療は未だ医師全般に十分に認知されているとは言えないようである。
Surviving Sepsis Campaign guidelines(SSCG)3)は欧米などの11学会の合同指針として重症セプシスと敗血症性ショックの治療成績の向上に向けて2004年に発表され,2008年には日本集中治療医学会や日本救急医学会も加わり,15の国際学会の合同指針として改訂された4)。この2008年改訂版SSCG(SSCG2008)4)では,エビデンスの質によるA(高)-D(低)の4段階評価に加え,ガイドライン作成委員の推奨度として1(強い),2(弱い)の2つに分類され,重症セプシスと敗血症性ショックの管理の推奨がまとめられている。このうち,推奨度1Aの記載は,①ハイドロコルチゾンを併用する場合には1日量を300 mg以下とすべきである,②重症セプシスでも致死率が低いと考えられる症例では活性化プロテインCを投与すべきではない,③深部静脈血栓症予防として禁忌でなければ未分画ヘパリンか低分子ヘパリンを投与する,④深部静脈血栓症予防としてペパリン禁忌であれば圧迫ストッキングか間歇的空気圧迫装置を併用する,⑤ストレス潰瘍予防にH2ブロッカーを併用する,という5項目のみである。これらに関しても,例えば重症セプシス病態でアンチトロンビンIIIの効果を保つためにヘパリンを用いてよいのか5, 6),28日死亡率に差を認めないグルココルチコイド併用に意義があるのか7)などの議論が未だに残存している。推奨度1Dの記載は,輸液療法や感染コントロールなどに散見されるが,本邦でもこれらの検証を十分に行う必要がある。
SSCG2008は,あくまでも集中治療室や救命救急センターでは,そのままのガイドラインとして採用しやすい。しかし,現在,一般病棟の重症個室ですぐに適応できるほどに,本邦のさまざまな施設の病棟管理が向上しているとは評価できない。本稿では,SSCG2008 4)の要点に即して,SSCG2008を振り返り,本邦における現在のセプシス治療の実状と問題点を探る。
セプシスの診断の迅速性と抗菌薬の適正使用
セプシスを初期より評価するためには,セプシスの定義を十分に理解し,その観察を一般病棟でも徹底する必要がある。現在,セプシスが本邦の一般病棟で診断される場合,その多くは既にセプシスがショックや急性呼吸不全や急性腎不全などの臓器不全を合併した重症セプシスに移行している傾向がある。このため,感染症合併の初期より,セプシスの早期診断に留意し,セプシス重症化を念頭に置いた観察や治療が必要とされる。SSCG2008は,セプシスの診断基準を集中治療専門医以外の一般医やコ・メディカルの共通認識とし,セプシス早期からの適切な治療を開始する意義を喚起する側面を持つ。
セプシスは,感染症状態を基盤とし,表1のように,①体温,②心拍数,③呼吸数,④白血球数の4項目のうち2つ以上を満たす場合と定義される1)。1989年にRoger Boneらは,セプシスを的確に診断する目的でsepsis syndrome8)という概念(表2)を提唱し,この概念が1991年のACCP/SCCM合同カンファレンスに持ち込まれ,セプシスの定義が定められた。このRoger Boneらの191症例を対象とした報告8)では,sepsis syndromeの後にショックを合併すると死亡率が13%から43.2%に上昇することが示されている。如何に早い時期にセプシスを診断し,抗菌薬の適正使用とともに,適切な輸液などの補助療法を開始するかがセプシス重症化阻止のために必須と考えられる。しかし,現在も一般病棟では,呼吸数や脈拍数が十分に観察されていないなどの問題が散見され,まず,各診療科のセプシス診断に対する理解を高める必要が残存している。
一方,近年,本邦の各病院で院内感染制御チームの貢献により,院内感染予防策や抗菌薬のpharmacokinetics(PK)/pharmacodynamics(PD)に基づいた使用が指導されるようになり,本邦でもセプシスの治療成績が向上すると予想される。セプシス治療における最重要点は,起炎菌の除去にあることは言うまでもない。SSCG20084)では,抗菌薬投与を開始する直前に細菌培養検査を提出すること(1C)や,まず2セットの血液培養検体を提出すること(1C)を推奨している。感染巣に対しては積極的に画像評価をし,抗菌薬に加え,ドレナージやデブリドマンを考慮する必要もある(1C)。また,感染が疑われる血管内カテーテルは直ちに抜去する必要がある(1C)。カテーテル感染症では,Candida属などの深在性真菌症も念頭に置く必要がある。その上でPK/PDを考慮し,抗菌薬投与法を決定する必要がある。
一般に,ペニシリン系抗菌薬,カルバペネム系抗菌薬,セファロスポリン系抗菌薬は菌体細胞壁に作用し効力を発揮するため,time above MIC(minimum inhibitory concentration)を維持することが必要であり,1日3~4回投与を原則とする。キノロン系抗菌薬とアミノグリコシド系抗菌薬は菌体内で効果を示すため,血中濃度のピーク値(Cmax)とAUC(aria under the curve)を十分に高めることが必要であり,分割投与ではなく1日1回投与が望ましい。アミノグリコシド系抗菌薬は適切に使用すれば有用な抗菌薬であるにもかかわらず,残念ながら添付文書通りに少量分割投与した場合には,Cmaxが高まらず,有効な殺菌効果が期待できない。アミカシンは7-7.5mg/kgの短時間投与でピーク濃度56-64 μg/mLを目標とし,トラフ濃度は10 μg/mL以下に持ち込み,ゲンタマイシンやトブラマイシンでは3 mg/kgの短時間静脈内投与でピーク濃度を16-24 μg/mLを目標とし,トラフ濃度を2 μg/mL以下に持ち込むことにより,緑膿菌感染症などの治療成績を向上させることができる。また,MRSA治療では,バンコマイシン(トラフ濃度10-15µg/mL),テイコプラニン(トラフ濃度 17 µg/mL以上),アルベカシン(ピーク濃度12 µg/mL)が必要であり,添付文書や従来の投与法では殺菌効果が期待できないのが実状である。本邦においては,このように培養感受性試験レベルでは効力があると評価されても,実際の不適切な抗菌薬投与法により殺菌効果が期待できず,セプシス治療成績が向上しない実状が存在した。
現在,薬剤感受性検査に基づき,抗菌スペクトルを広域のものから狭いものに代えてゆく抗菌薬使用法をde-escalationと呼び,セプシスにおいても有効な抗菌薬投与法と考えられている。敗血症性ショックの治療開始の抗菌薬は広域スペクトラム抗菌薬を用いたempiric therapyとし,起炎菌同定後にdefinitive therapyとして狭域なものに変更する。このように,まずはグラム染色による早期評価も加え,グラム陽性菌,グラム陰性菌,緑膿菌,MRSAを念頭に入れ,広域スペクトラム抗菌薬を用いて,敗血症性ショック(1B)や重症セプシス(1D)では,診断後1時間以内に抗菌薬の投与を開始することが必須と考えられている。
今後,抗菌薬を適切に用いた治療の中で,本邦のセプシス患者の治療成績を解析することが重要とされている。これまでのセプシス治療では,上述のようにセプシス診断の遅れと,セプシスと診断した際の抗菌薬の適正使用の2点が問題と考えられ,治療法の詳細な個別評価が十分にできなかったと評価される。
Early goal -directed therapyの実状
Early goal-directed therapy(EGDT)9)は,敗血症性ショック初期における十分な輸液を推奨したショック蘇生のプロトコールである。SSCG20084)でも初版と同様に,敗血症性ショックの初期の輸液療法がEGDTという名称で強く推奨されている(1D)。この原典となるRiversらが2001年に報告したEGDT 9)は,救急初療の段階で敗血症性ショックと評価された対照群133症例,EGDT群130症例を前向き検討したものであり,カテコラミン投与に優先して十分な輸液を行うことで,虚血に伴う代謝性アシドーシスと血清乳酸値上昇を有意に軽減させ,院内死亡率を46.5%から30.5%に減じている。Riversら9)は,敗血症性ショックにおいて,①初期輸液により院内死亡率を低下させる可能性と,②輸液の治療目標を具体的に定める必要性を提示した。
EGDT4, 9)は,敗血症性ショックにおいて,まず,晶質液であれば30分で1 L,コロイド液であれば30分で1 Lの速度で輸液負荷を開始し(1D),中心静脈圧8~12 mmHgを目標として輸液により心前負荷を高めること(1B)を原則としている。結果として,平均血圧≧65 mmHg,尿量≧0.5 mL/kg/h,中心静脈酸素飽和度≧70 %を,ショック出現の6時間以内に達成させることを目標としている(1B)。上記の輸液前負荷でも十分な結果が得られない場合には,Hb <7 g/dLであれば赤血球輸血を行ない(1B),敗血症性ショックの初期の体血管抵抗減弱を特徴とするwarm shockの補助療法としてノルエピネフリンを推奨している(1C)。しかし,このようなEGDTは集中治療室ではたやすく施行できるものの,一般病棟に応用するためには,いくつかの問題点が挙げられる。
このような現状において,一般病棟における敗血症性ショック患者の管理初期には,循環血液量が相対的に不足しているにもかかわらず,ドパミンとドブタミンが早期より併用される傾向がある。セプシスではアドレナリンβ1受容体を介した陽性変力作用が障害されることが知られている12-14)が,ドパミンやドブタミンは刺激伝導系や血管平滑筋に存在するアドレナリンβ2受容体を介して頻脈や血管拡張を誘導しやすく,むしろ昇圧を妨げる傾向がある。結果として,敗血症性ショック初期においては,可能な限りドパミンやドブタミンを併用することなく,輸液により適切な心前負荷を施すことにより,速やかに昇圧される場合が多い。
さらに,一般病棟での敗血症性ショックの管理では,集中治療管理と異なり,適切な鎮静がなされていないことが特徴である。このような状態の血漿カテコラミン3分画を測定すると,ドパミン,ノルエピネフリン,エピネフリンの何れもが,正常状態より有意に高いことが観察される。セプシスの進行過程では交感神経緊張が高まるが,この破綻期に敗血症性ショックと診断される場合も散見される。このように交感神経緊張によりアドレナリン受容体が刺激されている敗血症warm shockの状態では,バゾプレシン0.03単位/minの持続投与が有効となる場合も多い。
Russellら15)の米国,カナダ,オーストラリアの27施設の集中治療室における779症例を対象とした前向き臨床試験は,重症度の低い敗血症warm shockでは,バゾプレシンはノルエピネフリンと比較して28日死亡率を35.7%から26.5%に低下させると報告している。ノルエピネフリンやバゾプレシンは腸管虚血や尿量減少を導く可能性があるため,これまで多くの診療医がセプシス治療に避けてきたと推測される。しかし,敗血症性ショックにおけるRussellら16)の報告では,急性腸間膜動脈虚血の発生頻度はノルエピネフリン投与で3.4%,バゾプレシン投与で2.7%であり,水中毒や腎機能増悪も認められていない。現在,本邦においてバゾプレシンは下垂体尿崩症と食道静脈瘤の保険適応に限られるが,ノルエピネフリン0.1μg/kg/minあるいはバゾプレシン0.03単位/minは,中心静脈圧8 mmHgを目標とした輸液療法との併用において,初期の敗血症性ショックの離脱に有効と評価される。
以上のように,病棟レベルでショック管理を行う際には,必ずしもEGDTをそのまま採用することはできない実状がある。当院救急科では,他科より診療応援を求められた敗血症患者の診療において,まずパルスオキシメータ波形やエコー図を有効に用い,EGDTに準じて適切な輸液量とカテコラミンの適正使用を指示するとともに,その後に必要であれば観血的動脈圧測定や持続的中心静脈圧測定に移行している。これにより,2008年から現在までにコンサルトを受けた10症例のすべてが,敗血症性ショックより離脱し,28日生存を達成できている。
Resuscitation BundleとManagement Bundle
SCCMは,重症セプシスと敗血症性ショックに対して,治療の中隔としてのbundle(束)を制定している。SCCMのウエブサイトであるhttp://ssc.sccm.org/では,左バーの目次のsevere sepsis bundleを選択することで,このbundleの詳細が確認できる。SCCMは,このbundleによりセプシスの包括的治療指針を与え,治療成績を向上させようとしている。
このbundle の構成は,resuscitation bundle とmanagement bundle の2つである。Resuscitation bundleの中には,①血清乳酸値測定,②抗菌薬投与前の血液培養検体2セットの採取,③抗菌薬の1時間以内の投与,④低血圧あるいは血清乳酸値>4 mmol/Lの場合のEGDTが含まれており,これらを6時間以内に達成することが目標とされている。一方,management bundleでは,①ショック持続における少量ステロイド療法,②活性化プロテインCの投与基準,③血糖値<150 mg/dL,④人工呼吸管理における最大吸気圧<30 cmH2Oの4つが基盤である。活性化プロテインCを除いた項目は,既に本邦の集中治療室の多くで,概ね施行されていると評価される。
一方,既にスペインの59の集中治療施設より,重症敗血症と敗血症性ショックに対するSSCG2008のbundleに対する検証が多施設共同研究として報告されている17)。SSCG2008のbundleを遵守して治療するように介入した介入前854症例と介入後1,465症例の比較では,院内死亡率は介入前後で44.0%と39.7%であり,院内死亡率とICU死亡率に有意な改善が認められたが,介入後であってもresuscitation bundleの遵守率は10%,management bundleの遵守率は15.7%に過ぎない結果となっている。
今後,本邦においても,このようなSSCG2008のbundleの理解を一般に広めるとともに,特に集中治療における実際の遵守率と治療成績の関係を評価する必要がある。2007年4月に発足された日本集中治療医学会Sepsis Registry委員会は,本邦に即した敗血症管理ガイドラインを作成することを目的とし,2009年10月から6ヶ月間,本邦の重症セプシスおよび敗血症性ショックの治療方法と治療成績の再調査を予定している。この際に,SSCG2008のbundleの実際の遵守率と治療成績の関係が再評価されるであろう。
セプシス治療の根底は,抗菌薬の適正使用と感染創管理にある。この前提において,セプシスを遷延させないためのmanagement bundleの詳細は,本邦においても近い将来に再評価されるであろう。播種性血管内凝固症候群に対する予防策18)や早期経腸栄養19)は,現在もさまざまな施設で検証されており,そのエビデンスにより今後management bundleに含まれる可能性がある。私自身の治療では,既に経腸栄養は胆嚢炎を除いたショック症例のすべてでショック離脱直後より開始しており,血小板減少が進行してくる場合には血管内皮細胞保護として迷わずメシル酸ガベキサート39 mg/kg/dayの経中心静脈持続投与を開始している。一方,敗血症管理が遷延した際には血管内皮細胞障害が必ず合併してくる20)ため,血管内皮細胞の再生療法が新規に考案されなければならない。SSCGは,集中治療医や救急科専門医のみならず,一般病棟を管理する幅広い専門医に理解される必要がある。セプシスを重症化させない早期の工夫として,本稿を記載させていただいた。
文 献
1. Bone RC, Balk RA, Cerra FB, et al: Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Chest 1992; 101:1644-1655.
2. Poeze M, Ramsay G, Gerlach H, et al: An international sepsis survey: a study of doctors' knowledge and perception about sepsis. Crit Care 2004; 8:R409-413.
3. Dellinger RP, Carlet JM, Masur H, et al: Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock. Crit Care Med 2004; 32:858-873.
4. Dellinger RP, Levy MM, Carlet JM, et al: Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med 2008; 36:296-327.
5. Warren BL, Eid A, Singer P, et al: Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA 2001; 286:1869-1878.
6. Wiedermann CJ, Hoffmann JN, Juers M, et al: High-dose antithrombin III in the treatment of severe sepsis in patients with a high risk of death: efficacy and safety. Crit Care Med 2006; 34:285-292.
7. Sprung CL, Annane D, Keh D, et al: Hydrocortisone therapy for patients with septic shock. N Engl J Med 2008; 358:111-124.
8. Bone RC, Fisher CJ Jr, Clemmer TP, et al: Sepsis syndrome: a valid clinical entity. Methylprednisolone Severe Sepsis Study Group. Crit Care Med 1989; 17:389-393.
9. Rivers E, Nguyen B, Havstad S, et al: Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345:1368-1377.
10. Arnold RC, Shapiro NI, Jones AE, et al: Multi-Center Study of Early Lactate Clearance as a Determinant of Survival in Patients with Presumed Sepsis. Shock 2008 Dec 22. online
11. Nguyen HB, Rivers EP, Knoblich BP, et al: Early lactate clearance is associated with improved outcome in severe sepsis and septic shock. Crit Care Med 2004; 32:1637-1642.
12. Rudiger A, Singer M: Mechanisms of sepsis-induced cardiac dysfunction. Crit Care Med 2007; 35:1599-1608.
13. Cariou A, Pinsky MR, Monchi M, et al: Is myocardial adrenergic responsiveness depressed in human septic shock? Intensive Care Med 2008; 34:917-922.
14. Matsuda N, Hattori Y, Akaishi Y, et al: Impairment of cardiac -adrenoceptor cellular signaling by decreased expression of Gs in septic rabbits. Anesthesiology 2000; 93:1465–1473
15. Russell JA, Walley KR, Singer J, et al: Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med 2008; 358:877-887.
16. Russell JA, Walley KR, Gordon AC, et al: Interaction of vasopressin infusion, corticosteroid treatment, and mortality of septic shock. Crit Care Med 2009; 37:811-818.
17. Ferrer R, Artigas A, Levy MM, et al: Improvement in process of care and outcome after a multicenter severe sepsis educational program in Spain. JAMA 2008; 299:2294-2303.
18. Gando S, Saitoh D, Ogura H, et al: Disseminated intravascular coagulation (DIC) diagnosed based on the Japanese Association for Acute Medicine criteria is a dependent continuum to overt DIC in patients with sepsis. Thromb Res 2009; 123:715-718.
19. McClave SA, Martindale RG, Vanek VW, et al: Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr 2009; 33:277-316.
20. Matsuda N, Hattori Y: Vascular biology in sepsis: pathophysiological and therapeutic significance of vascular dysfunction. J Smooth Muscle Res 2007; 43:117-137.
図表の解説

図1 パルスオキシメータや動脈圧の波形から観察できること
パルスオキシメータや観血的動脈圧の測定では,酸素飽和度や血圧の絶対値のみではなく,波形を観察することが大切である。循環血液量が相対的に低下した敗血症warm shockでは,波形のピーク値の呼吸性変動が強まる。心拡張期に形成されるdicrotic wave(重複波)は,体血管抵抗(心後負荷)の強い際に高まり,体血管抵抗の低い敗血症warm shockでは消失する。また,波形の立ち上がり角(dp/dt)は心収縮性を示し,波形下面積(AUC: area under curve )は心拍出量に比例する。輸液療法においては,この呼吸性変動が軽減され,dp/dtが高まることを確認するとよい。輸液による心前負荷やノルエピネフリンやバゾプレシンンの使用に際しては,以上の基礎知識をもとにdicrotic waveやdp/dtの変化を時系列で評価する習慣が大切である。

図2 下大静脈径のエコー図による観察
中心静脈圧を連続モニタリングしていない場合には,下大静脈径を評価するとよい。敗血症warm shock では,early goal-directed therapyに準じた治療として,下大静脈径は15 mm以上を目標とし,22 mmを超えないように輸液負荷をし,その結果をパルスオキシメータや観血的動脈圧の波形で評価するとよい。
表1 全身性炎症反応症候群の定義

表の4つのクライテリアのうち,2つ以上を持たす場合に,全身性炎症反応症候群と診断される。全身性炎症反応症候群の原因が感染症である場合,セプシスと診断される。
表2 Sepsis Syndromeの特徴

救急医療 水銀で注意すること
救急科指導医・専門医/集中治療専門医
松田直之
1歳の子供さんが,水銀式体温計で体温を測っている際に体温計を壊してしまい,水銀を飲んだのではないかと,お母さんに心配されて,救急搬入されました。体温計の水銀は,飲んでも体内に吸収されることはないとされており,基本的に心配は要らないです。
しかし,口腔内に残っていたり,環境に水銀を放置すると,気化した水銀が経気道的に体内に吸収されることに注意します。このため,こぼれた水銀は,放置せずに掃除機で吸い取ったり,水に沈めて保存する必要があります。
体温計1本中に含まれる金属水銀は0.8~1.2gレベルと報告されています。飲んでも消化管からの吸収はないとされています。通常,割れて口腔内にはいる体温計の水銀は先端部のものだけなら,0.1 gレベルです。このため注意すべきこととしては,気化した水銀を吸わないことです。
気化した水銀を吸入してしまうと,発熱,悪寒,呼吸困難感,頭痛が数時間で出現し,下痢,腹痛,視力低下などに加え,痙攣,肺気腫や急性腎不全を合併する可能性があります。つまり,壊れた水銀温度計を机などの上に放置すべきではありませんし,気道に誤嚥した場合には水銀中毒としての注意が必要となります。
体温計に限らず,蛍光灯にも水銀が含まれています。40 Wの蛍光灯は,約8 mgの水銀を含んでいます。また,魚介類では,日本は0.3 mg/kgまでの水銀含有を正常上限として認めていますし,米国FDAは1.0 mg/kgまでの水銀含有を正常上限として認めています。
手術管理において気をつける感染対策について
京都大学大学院医学研究科
初期診療・救急医学分野
松田直之
留意事項のポイント
集中治療室,術前および術後に免疫機能を維持するためのモニタリングは,未だ不十分な状況にあります。このため,院内診療の際と同様に,手術管理においても院内感染を考慮し,細菌感染症を阻止するための接触感染予防が大切となります。術後の起炎症菌として問題となるのは,黄色ブドウ球菌,MRSA,大腸菌,緑膿菌などの一般細菌であり,必ずしもA群β溶連菌のような病原性の強いものではありません。これらは,医療従事者の手を介して伝播することに注意が必要です。
呼吸器感染,カテーテル感染,創感染などは,丁寧な接触感染予防策によって発症率を低下させることができます。注意すべきこととして,①処置前処置後のアルコール性手指消毒(手掌,指間,手背,爪床,たこ,親指,手首),②静脈留置針や動脈留置針のライン接合部などを素手で触らないこと,③気管チューブやスタイレットを手指消毒していない素手で触らないこと,④吸引チューブ挿入部を素手で触らないことなどが挙げられます。麻酔導入において研修医の動作を観察すると,実に多くの研修医がアルコール性手指消毒剤による手指消毒をすることなく,また手袋をすることなく,静脈路や動脈路を確保したり,喉頭鏡に触れています。手袋は,自らの手指の汚染を防ぐためのものです。さらに,静脈路や動脈路の確保の際には,環境や挿入者の手を汚染させない技術が要求されるとともに,接続部に血液汚染培地を作らない技術も必要です。気管内吸引においても,同様の接触感染予防に対する配慮が必要です。これらが徹底して注意されている手術室は,極めて感染症管理ができていると評価できます。接触感染を抑制する習慣が,一般細菌や多剤耐性菌の術後感染症の予防となります。気管挿管においては,喉頭鏡ブレードやスタイレットを素手で触ることは禁忌です。ブレードを滅菌袋に入れずに管理することも禁忌と考えています。
一方,手袋を装着していれば,接触感染を抑制できるかといえば,必ずしもそうとは言えません。静脈路確保や気管内吸引など一般手技では,滅菌手袋を着用しているわけではありません。昨今,院内感染対策により院内での手袋の使用が増加しているため,多くの病院は安価な手袋を購入し,日本製ではないものを購入しています。これらの製造過程は必ずしも明らかではなく,製造過程で微量な泥などの不純物が混入するケースも確認されています。通常の手袋は必ずしも無菌ではないことに注意します。さらに大切なことは,手袋は処置直前に着用し,処置後にはすぐに廃棄することです。手袋を長期に着用することにより発汗が高まり,手指の細菌数が増加します。塩化ビニル製の手袋は安いものであれば1枚2.7円程度,アルコール性手指消毒剤は1プッシュ1.6円程度です。
そして,最後の注意点としては,活動期の細菌は20分レベルで分裂することです。これは非常に重要な事項であり,1時間で8倍,2時間で64倍,4時間で4,096倍,5時間で32,768倍,6時間で262,144倍になるということです。手袋を4時間以上に渡り,つけっぱなしでいることは危険と考えています。手指に細菌増殖をさせる可能性が高いことになります。
Standard PrecautionsとMaximum Barrier Precautions
標準感染予防策(standard precautions)は,汚染が予想される際に必要な感染予防策です。①手洗い,②手袋,③マスク,④ガウン,⑤ゴーグルあるいは眼鏡により,患者への汚染と患者からの汚染を予防します。また,中心静脈カテーテルや肺動脈カテーテルの挿入では,血流感染症が生じ易いことが知られています。通常の手洗いに加えて,maximum barrier precautionsとして滅菌手袋および長袖ガウンを着用し,非滅菌マスクおよび非滅菌帽子を着用し,十分なサイズの滅菌覆布を行う必要があります(Raad II, Hohn DC, Gilbreath BJ, et al: Prevention of central venous catheter-related infections by using maximal sterile barrier precautions during insertion. Infect Control Hosp Epidemiol 15:231–238, 1994)。カテーテル感染の起炎菌としては,①ブドウ球菌属,②カンジダ属,③大腸菌,④腸球菌属などが高頻度に検出されています。
抗菌薬の適正使用について
感染症が同定されている場合には,抗菌薬を適切に用いる必要がありますが,抗菌薬は漫然と使用することを避ける必要があります。すなわち,抗菌薬にはカテコラミンのように徐々に強度を高めるとか,徐々に離脱するという概念はなく,用いる際には最大効力を期待し,最大量を投与するようにし,不必要であれば潔く投与を中止します。これにより,十分な治療効果が得られるばかりか,薬剤耐性菌の出現を防ぎます。抗菌薬が周術期に用いられる場合には,①予防的投与,②治療的投与の2つの側面で考える必要があります。
一般に,「予防的抗菌薬投与」は,手術部位感染を予防することにあり,組織の無菌化を目的とするものではありません。術野での汚染菌量を患者が防御できる範疇に減量することを目的としています。ヘルニア,乳腺,甲状腺,心臓・血管などの清潔創では,黄色ブドウ球菌や連鎖球菌などの皮膚常在菌をターゲットとし,まずは術野消毒を適切に行い,抗菌薬としては第1世代セファロスポリン系薬(セファゾリンなど)やペニシリン系薬(クロキサシリン/アンピシリン)を用います。しかし,これらの抗菌薬はMRSAに対して抗菌活性を持たないので,胸骨縦切開を行う心臓・大血管手術では,MRSA縦隔炎の発症に留意する必要があります。このように,すべての手術において,予防的抗菌薬はMRSAに対する対応が未然であることを念頭に置き,皮膚消毒や術野洗浄を重視する必要があります。
一方,食道,肝臓などの開腹を伴う準清潔手術では,予防的抗菌薬として大腸菌や肺炎桿菌に抗菌活性を持つ第1世代セファロスポリン系薬(セファゾリンなど)や第2世代セファロスポリン系薬(セフォチアムなど)を用います。結腸や直腸などの下部消化管や虫垂(非穿孔)の手術では,バクテロイデス・フラジリス(Bacteroides fragilis)などの嫌気性菌への抗菌活性も必要となるため,第2世代オキサセフェム系薬(フロモキセフ)や第2世代セファマイシン系薬(セフメタゾールなど)を用います。下部消化管には,バクテロイデス・フラジリスが常在していることに注意が必要です。さらに注意点として,フロモキセフはEnterobacter cloacae,Enterobacter aerogenes,Enterococcus facecalisに抗菌活性を持ちませんので,特にプロトンポンプインヒビターなどで術後の胃酸分泌を抑制した状態では,フロモキセフの3日を越える長期投与によりこれらが胃内や口腔内に逆行性感染し,人工呼吸器関連肺炎の原因となります。しかし,一般的には,人工呼吸器関連肺炎の最大の問題点は,不潔な気管挿管(気管チューブの不潔取扱,喉頭鏡の不潔管理,スタイレットの不潔管理)および気管挿管前を含む患者さんの口腔内および鼻腔内の不潔環境によると考えています。
このような予防的抗菌薬の投与タイミングは,いつがよいのでしょうか。Classen等の1708名の手術患者解析によると,術前2時間前から執刀直前までの間に投与することで創感染率が0.6%レベルに低下でき,皮膚切開より3時間以上遅れると極めて高い創感染率となると報告されています(N Engl J Med 326:281-286, 1992)。一般に,抗菌薬の皮下脂肪組織濃度を考慮しますと,半減期の2倍の時期に抗菌薬を再投与すると皮膚常在菌などのMIC(minimum inhibitory concentration)を超える抗菌薬濃度が十分に維持できると考えられています。臨床研究のデザインも,抗菌薬の半減期の2倍の時間での再投与をプロトコールとされました。現在用いられている主な予防的抗菌薬の半減期は,セファゾリン(約1.6時間),フロモキセフ(約50分),セフォチアム(約50分),セフメタゾール(約1時間)であり,セファゾリンは3時間で再投与,その他は2時間で再投与が望ましいと考えられます。もちろん,ここに患者の腎機能を考慮する必要があります。しかし,一般に予防的抗菌薬は腎機能が正常域にあれば3時間毎の再投与とし,現在,創感染の発症率を評価しているのが現状です。また,こうした予防的抗菌薬の再投与には,出血量や輸液量が影響を与えます。たとえば1.5Lを超えるような短時間の出血では,予防的抗菌薬の血中濃度が輸液や輸血により低下します。出血では再投与間隔を短くする必要があると思いますが,このような臨床評価も必要とされています。そして,セファゾリンなどの腎排泄で代謝される薬剤では,予防的抗菌薬投与においても腎機能を評価して,クレアチニンクリアランスに合わせて,投与間隔を延長します。
以上の予防的抗菌薬投与に対して,感染症が明確である場合は,「治療的抗菌薬投与」が必要となります。治療的抗菌薬の選択に当たっては,①グラム陽性菌が原因なのか,②グラム陰性菌が原因なのか,③嫌気性菌が原因なのか,④グラム陽性菌であればMRSAの可能性があるのか,⑤グラム陰性菌であれば緑膿菌の可能性があるのかの5点を考慮することにより,選択する抗菌薬の大筋が決定できます。このためにグラム染色は不可欠ですし,抗菌薬を再開する前に,細菌培養検査の提出も不可欠となります。
さらに,実際の抗菌薬の使用に当たっては,抗菌薬の薬理学的特性を尊重することが重要です。ペニシリン系抗菌薬,カルバペネム系抗菌薬,セファロスポリン系抗菌薬は,細菌細胞壁に作用するため,起炎菌のMICを血中濃度が超える時間が重要であり,time above MICを十分に長く取るために,1日3~4回の投与が原則となります。キノロン系抗菌薬とアミノグリコシド系抗菌薬は,菌体細胞内に入ることにより殺菌効果を示すため,最大血中濃度が重要となります。キノロン系抗菌薬とアミノグリコシド系抗菌薬の最大血中濃度を高め,AUC(aria under the curve)を大きくするためには,分割投与ではなく1日1回の投与が原則となります。アミドグリコシド系抗菌薬であれば,アミカシンは7-7.5mg/kgの短時間投与でピーク濃度56-64 μg/mLを目標とし,トラフ濃度は10 μg/mL以下に持ち込み,ゲンタマイシンやトブラマイシンでは3 mg/kgの短時間静脈内投与でピーク濃度を16-24 μg/mLを目標とし,トラフ濃度を2 μg/mL以下に持ち込みます。これにより,腎機能障害や第8脳神経障害を軽減させます。また,MRSA治療では,バンコマイシン(トラフ濃度10-15µg/mL),テイコプラニン(トラフ濃度 17 µg/mL以上),アルベカシン(ピーク濃度12 µg/mL)が必要であり,添付文書や従来の投与法では菌体数減少が期待できないのが現状です。真菌感染では,血漿(1→3)-β-D-glucan値の上昇が認められる場合は,抗真菌薬の投与を開始します。血液培養検査で真菌が検出された場合は,眼内炎の合併にも留意しなければなりません。
現在,起炎菌が明確ではない敗血症性ショックなどでは,血液培養2セットに加え,喀痰,尿,胃液,便の細菌培養検査を提出し,広域スペクトラムの抗菌薬を選択し,細菌培養検査の結果に基づき,抗菌薬のスペクトルを狭いものに変更しています。この抗菌薬使用戦略をde-escalating strategyと呼び,敗血症性ショックや重症敗血症に有効な抗菌薬投与法となります。
以上のように,手術中や術後には,特に細菌感染症や真菌感染症が生じ易いことに留意し,適切な抗菌薬の使用により患者の免疫機能低下を補助しています。あわせて,周術期の免疫管理が重要です。私自身は,術後24時間以内の経腸栄養開始や血糖コントロールに加えて,免疫機能のモニタリングの考案も必要と考えています。
Jean-Charles Preiser, MD, PhD
From the Department of General Intensive Care, University Hospital Centre of Liege, Belgium.
In this issue of JPEN, Pontes-Arruda and collaborators report the results of an interesting meta-analysis on the effects of an inflammation modulating diet enriched with -3 fatty acids (ie, eicosapentaenoic acid [EPA], -linolenic acid [GLA]), and antioxidant vitamins in critically ill with acute respiratory distress syndrome (ARDS) or acute lung injury (ALI).1 As expected, the beneficial effects of the only available solution matching the criteria used for the literature search are confirmed. Investigators from the 3 individual studies cooperated in this meta-analysis. These results strikingly contrast with the confounding and sometimes contradictory results of the meta-analyses performed on "immune-enhancing diets" or "immunonutrition,"2-7 thereby suggesting at first glance that an inflammation (or presumably immune) modulating diet is currently the best solution for patients with ARDS or ALI.
Do the findings of Pontes-Arruda and co-workers reveal that the Holy Grail of nutrition therapy was eventually found for patients that fulfilled the inclusion criteria of the individual studies used for the meta-analysis? Probably not. Rather, these findings are indicative of the complexity of research and of the interpretation of data in the field of "nutrition therapy" in ICU patients.8 Indeed, performing research in the field of specialized solutions for critically ill patients is not easy, and much more complicated than the assessment of a single pharmacological intervention for several reasons.
First, the key issue of intention-to-treat (ITT), an indispensable component for the analysis of any randomized trial, is actually very difficult to handle and to report from studies on enteral formulas. An ITT analysis includes all randomized patients in the groups to which they were randomly assigned, regardless of their adherence with the entry criteria, regardless of the treatment they actually received, and regardless of subsequent withdrawal from treatment or deviation from the protocol.9 In particular, critically ill patients are usually unable to tolerate the full amount of enteral solution.10 All of us working in an intensive care unit know this problem well. Therefore, the volume of enteral formulas actually infused will is usually unknown, even in the context of prospective and carefully designed studies, suggesting that a fully reliable ITT analysis and a dose-effect relationship are illusory. Other daily aspects of the management of enteral feeding-related complications and the policy regarding the re-infusion of residual volumes are highly variable and could also largely influence the amount of solution infused.11
Second, the calculation of the sample size required to demonstrate an effect on the primary outcome variable was not reported in the individual trials used for the meta-analysis. The sum of effects is nonetheless quite interesting to build a working hypothesis to be tested on a large-scale. The most spectacular effects were observed on the respiratory function, suggesting indices of ventilatory function as a meaningful outcome variable for a large study, rather than the usual, standard 28-day mortality.
Third, the timing of initiation of enteral feeding following the onset of ARDS/ALI may be critical when the modulation of inflammation is considered. This is unfortunately not reported in these trials, and is difficult to determine. Importantly, management of patients with ARDS/ALI has changed over the past few years (prone positioning, low tidal volumes, use of steroids, inhalation of nitric oxide). In particular, use of steroids could actually confound the effect of an inflammatory modulating diet. In any case, the positive effects of the formula tested should be confirmed by controlling the other therapeutic interventions.
Fourth, both the control and the experimental solution are richer in lipids than most of the currently used solutions. Therefore, the claim of a benefit from the use of one lipid-rich solution over another cannot be translated without additional data when the experimental solution will be compared against a lipid-poor formula.
In summary, most of the difficulties reported here are clearly inherent to the nature of research in the field of enteral nutrition in critically ill patients. Nevertheless, the evidence provided by Pontes-Arruda and colleagues1 represents a spectacular and strong incentive to support further investigations if the field, with an adequately powered and carefully designed prospective randomized controlled and multicenter trial.
文 献
1. Pontes-Arruda A, DeMichele S, Seth A, Singer P. The use of an inflammation modulating diet in patients with acute lung injury or acute respiratory distress syndrome: a meta-analysis evaluation of outcome data. JPEN J Parenter Enteral Nutr.2008; 32:696 -605.
2. Heyland DK, Novak F, Drover JW, Jain M, Su X, Suchner U. Should immunonutrition become routine in critically ill patients? A systematic review of the evidence. JAMA.2001; 286:944-953.
3. Heys SD, Schofield AC, Wahle KW. Immunonutrition in clinical practice: what is the current evidence? Nutr Hosp.2004; 19:325 -332.
4. Montejo JC, Zarazaga A, Lopez-Martinez J et al. Immunonutrition in the intensive care unit. A systematic review and consensus statement. Clin Nutr.2003; 22:221 -233.
5. Beale RJ, Bryg DJ, Bihari DJ. Immunonutrition in the critically ill: a systematic review of clinical outcome. Crit Care Med. 1999;27:2799 -2805.
6. Heyland DK, Dhaliwal R, Drover JW, Gramlich L, Dodek P. Canadian clinical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients. JPEN J Parenter Enteral Nutr. 2003;27:355 -373.
7. Marik PE, Zaloga GP. Immunonutrition in critically ill patients: a systematic review and analysis of the litterature. Intensive Care Med. 2008 July 15. [Epub ahead of print].
8. Preiser JC, Chioléro JC, Wernerman J, ESICM (European Society of Intensive Care Medicine) Working Group on Nutrition and Metabolism. Nutritional papers in ICU patients: what lies between the lines? Intensive Care Med.2003; 29:156 -166.
9. Fisher LD, Dixon DO, Herson J, Frankowski RK, Hearson MS, Peace KE. Intention to treat in clinical trials. In: KE Peace, eds. Statistical Issues in Drug Research and Development. New York, NY: Marcel Dekker; 1990:331-350.
10. De Jonghe B, Appere-De-Vechi C, Fournier M, et al. A prospective survey of nutritional support practices in intensive care unit patients: what is prescribed? What is delivered? Crit Care Med.2001; 29:8 -12.
11. Preiser JC, Berre J, Carpentier Y, et al. Management of nutrition in European intensive care units: results of a questionnaire. Working Group on Metabolism and Nutrition of the European Society of Intensive Care Medicine. Intensive Care Med.1999; 25:95 -101.[
CDCガイドライン 2008
CDC:Guideline for Disinfection and Sterilization in Healthcare Facilities, 2008.
http://www.cdc.gov/ncidod/dhqp/pdf/guidelines/Disinfection_Nov_2008.pdf#search='CDC sterilization 2008 guideline'
医療現場における消毒・滅菌のためのCDCガイドライン2008は手洗い・病院環境管理のためのガイドライン(1985)の改訂版であり,「患者ケアに使用する医療器具の洗浄・消毒・滅菌」と「環境の洗浄と消毒」を,エビデンスに基づいて改訂し,勧告したものです。このうち,医療器具と医療環境の消毒に関連した勧告が勧告2~12として掲載されています。以下を,チェックされて下さい。
2. 患者ケア用器具の洗浄
病院での患者ケア用器具の洗浄,消毒,滅菌は中央材料室で行う。患者ケア用器具を高水準消毒または滅菌する前には,汚れが乾燥しないよう,ただちに洗剤または酵素洗剤を使用して洗浄し,洗浄後は十分にリンスする。使用する洗剤または酵素洗剤は医療器具の材質との適合性を確認する。この際の洗浄は用手洗浄もしくは機械洗浄のどちらかで行う。器具の表面を点検し,洗浄または消毒・滅菌を損なう可能性のある場合には器具を廃棄または修理する。
3. 滅菌・高水準消毒および低水準消毒の適応
各患者への使用前に,無菌組織または血管内に挿入する器具あるいは無菌の体液が流れる器具,手術器具などのクリティカル医療器具を滅菌する。粘膜または健常でない皮膚に触れるセミクリティカル患者ケア用器具(ex. 消化器内視鏡,気管チューブ,麻酔呼吸回路,呼吸療法器具など)は高水準消毒とする。ベッド柵、オーバーベッドテーブルなどのノンクリティカル患者ケア表面や,血圧測定用カフなどの健常な皮膚に触れる器具は低水準消毒とする。
4. ノンクリティカル患者ケア用器具の低水準消毒薬の選択
ノンクリティカル患者ケア用器具に消毒薬を使用する時には,説明書などに従って消毒する。実際には説明書などに表記されている消毒時間は実際の科学的研究で示されている時間より長いが,法律上,説明書に従う必要がある。説明書に記載された条件と異なる条件で消毒を行った場合,生じた有害事象については負担責務があり,さらに法的措置を負わなければならない可能性に注意する。
ノンクリティカル患者ケア用器具が定期的に消毒されていること,および目に見える汚染がある場合には消毒されていることを確認する。ノンクリティカル患者ケア用器具を患者専用や使い捨てにできなければ,接触予防策下におかれている患者に使用した後の器具は他の患者に使用する前に消毒する。
5. 医療現場における環境表面の洗浄および消毒
床やテーブルの上などのハウスキーピング表面を定期的に洗浄し,目に見える汚れなども洗浄する。また,環境表面を定期的に消毒・洗浄し,目に見えて汚れている場合にも消毒・洗浄をする。また,病室の壁,ブラインド,窓カーテンなどは目に見える汚染がある際に洗浄する。
洗浄剤を使用する場合には,希釈,材質適合性,保管,有効期限に注意し,安全使用と廃棄適正使用を留意し,製造元の説明書に従う。消毒薬は必要時に調製し,頻繁に新しい液と交換する。また,汚染を防ぐために定期的にモップヘッドやふきんを洗浄する。
患者ケア領域では,汚れの種類・存在が不明確な場合や多剤耐性菌の存在が不明確な場合には消毒と洗浄を兼ねた製品による処理法や,ハウスキーピングのために設計されたEPA登録病院用消毒薬を使用する。患者以外の表面消毒には,洗剤と水による洗浄が適している。ノンクリティカル表面を消毒する場合には高水準消毒薬や液体化学的滅菌剤を使用してはいけない。水平面にたまった湿性の塵はEPA登録病院用消毒薬や洗剤を浸した布で定期的に洗浄する。
幼児用ベッドや保育器を洗浄するときは,消毒薬を使用してはいけない。幼児用ベッドや保育器の最終的な洗浄に消毒薬を使用した場合には,ベッドや保育器を使用する前に水で表面を十分にすすぎ,乾燥させる必要がある。新生児室の洗浄にフェノール類含有洗浄剤を使用したことで,新生児に高ビリルビン血症を生じたとの報告がある。
血液や嘔吐物などの感染性物質を環境に暴露させたときには,直ちに洗浄する。この際には,スタンダードプレコーションを施行し,手袋やガウンなどを着用する。消毒薬はEPA登録結核菌殺菌剤,HIVまたはHBV用であることが明確にラベル表記されたEPAのリストDおよびEに登録された消毒薬,あるいは新たに希釈した次亜塩素酸溶液を用いて血液汚染領域を消毒する。次亜塩素酸ナトリウム液を選択した場合,少量の血液や感染性物質であれば通常の1:100の希釈液を使用する。大量の血液や嘔吐物などには処理中に生じる感染リスクを低減させるために洗浄前に次亜塩素酸液1:10希釈液を最初に使用する。次に,次亜塩素酸ナトリウム1:100希釈液を用いて完全な消毒処理をする。大量の血液や体液をこぼした場合には,スタンダードプレコーションを遵守し,手袋やガウンなどを着用し,使い捨ての吸収性素材で目に見える汚染物を拭き取り,汚染物質を適切に表示された容器に廃棄する。
クロストリジウム・ディフィシル感染が流行している場合には,日常的な環境消毒に5.25~6.15%次亜塩素酸ナトリウムの希釈液(家庭用ブリーチであれば1:10希釈液)を使用する。
塩素溶液が毎日調製できない場合には,栓付き遮光プラスチック容器中に室温保存で30日まで保管できる。30日間の保存で塩素濃度は,50%以下に低下する可能性がある。
6. 消毒薬噴霧
患者ケアにおいて,消毒薬噴霧を習慣的に行うべきではない。
7. 内視鏡の高水準消毒
内視鏡の使用に際しては,液漏れテストをし,テストに逸脱した器具は臨床使用するべきではなく,修理をする必要がある。
内視鏡を使用した後には,直ちに酵素洗剤を用いて内視鏡を洗浄する。さらに吸引弁などの内視鏡の部品を分解・取り外し,酵素洗剤に部品を完全浸漬させる。使用する酵素洗剤や洗浄剤は細菌汚染防止のために使用ごとに廃棄する。内視鏡が熱に耐えられる場合は,これらの部品を高圧蒸気滅菌する。内視鏡は血液,体液などの有機物を取り除くためにチャンネル内をフラッシュおよびブラッシングする必要がある。外表面と装置はやわらかい布,スポンジ,ブラシを用いて洗浄する。ブラッシングはブラシに汚れが見えなくなるまで続ける。使用するブラシは,内視鏡チャンネルまたはポートのサイズに適したものを使用する。これらのブラシや布などは,使い捨てとする。使い捨てにできない場合は洗浄し,さらに高水準消毒や滅菌処理とする。
内視鏡および付属品は粘膜に接触するため,セミクリティカル器具として取り扱い,患者使用ごとに高水準消毒する。洗浄後に高水準消毒を達成するためには,グルタルアルデヒド,オルトフタルアルデヒドなどを使用し,その後にすすぎを行い,乾燥させる。消毒する時には,消毒薬による内視鏡損傷を考慮して必要最小限の時間で浸漬するのがよい。高水準消毒薬に内視鏡を完全に浸漬し,すべてのチャンネルの環流を確実に行う。高水準消毒後,残留した消毒薬を滅菌水,ろ過水または水道水ですすぎ,チャンネルのフラッシュを行う。続いて70~90%エチルアルコールまたはイソプロピルアルコールでリンスする。アルコールリンス後にすべてのチャンネルをフラッシングした後,強制換気を行う。再処理過程の終了後,内視鏡は乾燥を促進させるために垂直に吊り下げ,損傷および汚染させないように内視鏡を保管する。
関節鏡,膀胱鏡,腹腔鏡などの通常無菌組織に用いる内視鏡は,使用ごとに滅菌処理とする。これができない際には,少なくとも高水準消毒とし,高水準消毒後に滅菌水ですすぎをする。内視鏡に装着する生検鉗子や切開器具などの再使用機械は,超音波洗浄などで機械的洗浄し,滅菌処理にかける。
医療従事者と患者のためには,安全な環境で内視鏡が使用され,消毒される環境を設置する必要がある。グルタルアルデヒドなどは毒性を示す可能性があり,蒸気による曝露を最小限にするために空気交換機器を必要とする。化学的滅菌剤や高水準消毒薬が,許容上限の室内蒸気濃度を超えてはならない。
液体滅菌剤・高水準消毒薬は,有効成分の最小有効濃度が確保されていることを日常的に試験する。毎日,化学的インジケータで溶液を確認し,試験結果を記録する必要がある。化学的インジケータが最小有効濃度を下回る濃度となった場合には溶液を廃棄する。製造元の推奨する使用期限を越えて,液体滅菌剤や高水準消毒薬を使用してもいけない。
内視鏡管理部署には,適切な洗浄法,高水準消毒法,滅菌処理に対する教育を受けた内視鏡再処理担当者を配置する必要がある。内視鏡の再処理を行うものには,定期的な能力試験を行う必要がある。消毒薬の危険性などについても,教育が必要となる。
個人防護具(手袋,ガウン,メガネ類,フェイスマスク・フェイスシールド,呼吸器防護具など)を利用できる状態とし,化学物質および微生物の曝露から作業者を防御するために,これらの用具を適切に使用する。 内視鏡自動洗浄機を使用する場合には,取り扱い説明書に従ってすべてのチャンネルコネクターを取り付ける。内視鏡自動洗浄機で効果的な再処理ができるように確保する。また,いくつかの必要な用手洗浄・消毒を行うことも確保する。
8. 歯科領域における器具と表面の管理
軟部組織や骨を貫通する歯科器具(例えば抜歯用鉗子,外科用メスの刃,骨用ノミ,歯周歯石取り器,手術用バー)はクリティカルに分類され,各使用後は滅菌,あるいは廃棄とするべきである。口腔の軟部組織や骨を貫通する目的でなく,口腔組織に接触する可能性があるアマルガム凝縮装置,エアーウォーターシリンジなどの歯科器具は,セミクリティカルに分類されるため,熱に耐性のあるものでは各使用後に滅菌処置とする必要がある。熱変性の可能性があるセミクリティカル器具は,洗浄の後に,高水準消毒とする。
カウンター,スイッチ,ライトのハンドル部などの治療室表面のノンクリティカル表面は,患者間でバリア保護するか,中水準消毒薬あるいは低水準消毒薬で消毒とする。バリア保護カバーは,治療中に手袋をした手で頻繁に接触する環境表面や,血液・体液で汚染される可能性のある環境表面,または洗浄が困難な所に使用しても良い。バリア保護カバーは患者ごとに交換し,見た目が汚れている時,損傷を受けた時にも交換する。また,1日の終わり,または見た目に汚れている場合には保護した表面も消毒する。
9. 血液媒介病原体(HBV,HCV,HIV),抗生物質耐性菌(VRE,MRSA,多剤耐性結核菌など)または新興病原体(クリプトスポリジウム,ヘリコバクター・ピロリ,大腸菌O157:H7,クロストリジウム・ディフィシレ,結核菌,SARSコロナウイルスなど),バイオテロで汚染された患者ケア用器具の再処理
患者ケア用器具に対しては,通常の滅菌および消毒法を使用する。プリオン以外の病原体を除去するためにこれらの消毒法を変更する必要はない。
10. 他のセミクリティカル器具のための消毒
プローブカバーが利用できる際には,汚染水準を減少させるために,プローブカバーなどを使用する。プローブカバーが不意の損傷等で有効ではない可能性を考慮し,プローブカバーを使用する場合でも,器具は適切な消毒薬で事前消毒を必要とする。上気道粘膜に接触するおそれのあるセミクリティカル器具に対しては滅菌水,ろ過水または水道水後にアルコールリンスを使用する。直腸や膣に接触するセミクリティカル器具の洗浄は,水道水,滅菌水,ろ過水のどれを用いるべきかのエビデンスは薄い。
眼圧計チップはきれいに拭き取り,その後5000ppm塩素または70%エチルアルコールで,5~10分間の浸漬による消毒を行う。
11. 外来診療および在宅医療における医療提供者による消毒
外来診療や在宅医療においても,感染制御のために院内管理と同様の消毒法を行う。クリティカル器具は滅菌,セミクリティカル器具は高水準消毒,ノンクリティカル器具は低水準消毒が必要となる。在宅環境ではヒト-ヒト伝播は生じにくいため,医療行為に際しては5.25~6.15%次亜塩素酸ナトリウム(家庭用ブリーチ)の1:50希釈液に3分間,70%イソプロピルアルコールでは5分間,3%過酸化水素では30分間浸漬を行い,気管切開チューブや吸引チューブなどの粘膜に触れる機器の消毒と洗浄を行う。 在宅環境での血圧計や聴診器などのノンクリティカル器具は,市販の家庭用消毒薬や洗浄剤で消毒する。
12. 消毒薬の微生物汚染
汚染された消毒薬の発生を減少するために製造元が推奨した使用時の希釈に基づいて消毒薬を適切に使用し,機器や環境表面からの環境汚染を防止する。
講義 敗血症管理における血糖コントロール 2008
京都大学大学院医学研究科 初期診療・救急医学分野
准教授
松田直之
はじめに
Surviving Sepsis Campaign guidelines(SSCG)が米国集中治療医学会および欧州集中治療医学会により2008年に改定された。敗血症(sepsis)の管理では,血糖コントロールを厳密に行うことが,2008年改訂版Surviving Sepsis Campaign guidelines(SSCG)1)でも,推奨されている。本稿では,敗血症病態における血糖コントロールについて,2008年改訂版SSCG1)の2004年初版2)との変更点をまとめ,近年の臨床知見を紹介する。本邦で2008年改訂版SSCGを利用する際の問題点を,血糖コントロールの観点より論じる。
2008年改訂版Surviving Sepsis Campaign guidelines(SSCG)の変更点
2008年改訂版SSCG1)では,推奨度を1(強い),2(弱い)の2つに分類し,エビデンスグレードをA(高)-D(低)の4つとして,敗血症における血糖コントロールに対して4つの推奨がまとめられている。1. 重症敗血症や高血糖を伴うICU患者には血糖値を下げる目的でインスリンの持続静注を行う(Grade 1B)。2. インスリン持続静注による血糖値調節は,150 mg/dL未満を目標とする(Grade 2C)。3. インスリン持続静注を受ける患者のすべてにグルコース負荷を行い,血糖値とインスリン投与速度が安定するまでは1-2時間毎,血糖値やインスリン投与速度安定後は4時間毎に血糖値測定を行う(Grade 1C)。4. 毛細血管からの採血による血糖値測定は,動脈血や血漿グルコース濃度と解離しやすく,注意が必要である(Grade 1B)。2008年改訂版SSCG1)においても2004年版SSCG2)と同様にインスリン持続静注を推奨し,血糖値150 mg/dL未満を目標にする点には変更は認めない。しかし,2008年改訂版SSCG1)では初期の血糖測定時間は0.5-1時間毎が1-2時間毎に変更された点,経腸栄養を併用する記載が消去された点,毛細血管からの採血による血糖値測定に対する注意を加えた点の3点に変更が認められた。
集中治療における血糖コントロールのエビデンス
2008年改訂版SSCG1)においても,2004年初版SSCG2)と同様に,敗血症における血糖値を150 mg/dL(8.3mmol/L)未満に管理することが推奨されている。2004年初版SSCG2)における血糖管理指針は,Van den Bergheら3, 4)とFinneyら5)の臨床研究を基盤としていたが,2008年改訂版SSCG1)ではさらにいくつかの研究が引用されている。
ベルギーのルーバン大学のVan den Bergheらの2001年のN Engl J Medの報告 3)は,Acute Physiology and Chronic Health Evaluation II score(APACHE IIスコア)9レベルの重症度の低い外科術後患者1,548名を対象とし,集中治療室(ICU)での維持血糖値を80~110 mg/dLレベル,180~200 mg/dLレベルの2群に分類し,死亡率を解析したものである。ICU管理の初病日より1日量200~300 gのグルコースを投与し,1日あたり約71単位(3単位/h)の速効型インスリンを用いて,血糖値を80~110 mg/dLレベルに維持している。結果として,intensive insulin therapyで血糖値を80~110 mg/dLレベルに維持した群では180~200 mg/dLレベルに維持した群と比較して,ICUにおける死亡率を8.0%から4.6%,5日以上ICUに滞在した患者群のICU死亡率を20.1%から10.6%,院内死亡率を10.9%から7.2%に減じている。
Van den Berghe ら4)はさらに,2003年のCrit Care Medにおいて,先のN Engl J Med 3)に報告した解析に血糖値110~150 mg/dLの調節群を併設し,累積院内死亡率が血糖値150 mg/dL以上で約40%,血糖値110~150 mg/dLで約26%,血糖値110 mg/dLで約15%と報告している。この報告では,多変量解析により,血糖値20 mg/dLの増加により急性腎不全や感染症の合併率が高まることが示されている。一方,インスリン10 IU/日の増加は3日以上持続するCRP 15 mg/dL以上の発生を有意に減少させるが,インスリン投与量の増加自体が,急性腎不全や感染症の合併率を低下させないことが確認されている。Van den Berghe ら4)により,血糖値20 mg/dLの上昇で死亡率が30%上昇し,血糖値200 mg/dLでは血糖値100 mg/dLの2.5倍に死亡率が高まると見積もられた。
ロンドンのFinney5)らの報告は,2002年1月から6月までのRoyal Brompton病院ICUでのAPACHE-IIスコア16-17レベルの外科および内科患者523名を対象としたものである。この患者群の85.1%は心血管術後患者であり,全体の16.4%に糖尿病罹患患者が含まれている。彼らのデータの多変量解析では,患者重症度やICU死亡率はインスリン投与量の増加と正の相関を示すことが確認できる。患者重症度を同等とした解析からは,血糖値144 mg/dL以下の管理で,血糖値145~200 mg/dL の管理よりICU死亡率が有意に低下している。
以上のVan den Bergheら3, 4)とFinneyら5)の臨床研究より,血糖値管理はインスリンとは独立した因子として,死亡率低下に重要と考えられるようになり,2004年初版SSCG2)では血糖値150 mg/dL未満を目標に敗血症病態の血糖コントロールを行うことが推奨された。
Van den Bergheら6)は,さらに,2002年3月から2005年5月までの内科系ICUで, APACHE II スコアが23レベルの1,200名を対象とした臨床研究を報告している。この患者重症度を高めた内科系ICUにおける検討でも,血糖値180-200 mg/dLに比較して,血糖値を80-110 mg/dLに管理することで,急性腎不全の合併率,人工呼吸管理期間,ICU管理期間を有意に減少させている。特に,ICUに3日以上滞在した767名のサブグループ解析では,院内死亡率が52.5%から43%に減少している。このようにVan den Bergheらは,APACHE IIスコアが23レベルの患者群においても,血糖値80-110 mg/dLレベルに管理するintensive insulin therapyの重要性を追認しているが,本報告におけるインスリン投与のルーバンプロトコールにより,低血糖発症率が6.2%から18%の約3倍に上昇していることには留意が必要である。
Van den Berghe Gら7)は,さらに2006年に,既に報告した外科ICU患者1,548名3,4)と内科ICU患者1,200名6)を合わせたサブグループ解析として,非糖尿病患者2,341名と糖尿病罹患患者407名の解析を加えた。Finneyらの報告5)をはじめ,高血糖管理データには糖尿病合併症患者がさまざまな比率で混入されている。Van den Berghe Gら7)の非糖尿病患者群では,これまでの彼女らの結果と同様に,血糖値150 mg/dL以上,110~150 mg/dL,80~110 mg/dLの血糖値管理の順に,有意に院内死亡率を低下させている。しかし,ICU入室前に糖尿病を罹患していた患者群のサブグループ解析では,院内死亡率は血糖値150 mg/dLを超える管理で21.2%,血糖値110~150 mg/dLで21.6%,血糖値110 mg/dL未満で26.2%と有意差は認めないものの,血糖値110 mg/dL未満の強化インスリン療法で院内死亡率がむしろ増加する傾向が認められた。これは,Egiら8)によるオーストラリアにおける臨床研究でも追認できる。
Egiら8)によるオーストラリアの4つのICUにおける2000年1月より2004年10月までの7,049患者を対象とした血糖値の解析調査は,血糖値の平均値のみならず,同一患者における血糖値のばらつきが小さいことが院内死亡率低下に重要であることを示した貴重なデータである。Egiら8)の報告はAPACHE IIスコア17レベルの患者群を対象としており,解析に用いた168,337血液検体の血糖値の平均は8.0 mM(144 mg/dL),同一患者における血糖値の標準偏差の平均は1.7 mM(30.6 mg/dL),変動係数は21%である。このうち,ICU生存患者群6,213名(88.1%)の血糖値平均は7.9 mM(142 mg/dL),血糖値標準偏差の平均は1.7 mM(30.6 mg/dL),変動係数は20%であり,ICU死亡患者群836名(11.9%)の平均血糖値8.8 mM(158 mg/dL),標準偏差平均2.3 mM(41.4 mg/dL),変動係数26%に比較して,それぞれがICU生存患者群で有意差に低いことが示されている。また,ICU生存患者群とICU死亡患者群の最大血糖値の平均は,それぞれ11.5 mM(207 mg/dL)と13.6 mM(245 mg/dL)であり,最大血糖値はICU生存患者群で有意に低いことが示されている。さらに,ICUにおける平均血糖値6.8 mM(122 mg/dL)未満と6.8 – 7.9 mM(122-142 mg/dL)の2群では,ICU死亡率と院内死亡率に差を認めないものの,平均血糖値7.9-8.9 mM(142-160 mg/dL)および9 mM(160 mg/dL)以上では,濃度依存的にICU死亡率と院内死亡率が増加している。これらのデータは,2008年改訂版SSCG1)における血糖値管理指針に合致する。さらに,ICUにおける血糖値の標準偏差は,1.2 mM(21.6mg/dL)未満,1.2-1.7 mM(21.6-30.6 mg/dL),1.7-2.4 mM(30.6-43.2 mg/dL),2.5 mM(43.2 mg/dL)以上の4群で,この増加に依存してICU死亡率と院内死亡率を高めている。このように,同一患者において血糖値平均を150 mg/dL未満に維持する重要性が示される一方で,同一患者において血糖値変動の少なさが予後を規定する可能性が示唆される。Aliら9)は,2005年に施行した1,599名の単一のICU施設での後向きコフォート研究で,glycemic lability index(GLI:Σ〔血糖値の差2/測定間隔時間〕)10)が敗血症患者の院内死亡に影響を与える因子であることを提示している。このような同一患者内での血糖値変動は,炎症性サイトカン産生による敗血症罹患患者の病態の不安定さや重症度を示す可能性はあるが,血糖値150 mg/dL未満での血糖値変動自体が敗血症自体に悪影響を及ぼすか否かの病態生理学的解釈は未だ定かでない。
Egiら8)はさらに,728名の糖尿病罹患暦を持つ患者群のサブグループ解析を行っている。これらの糖尿病罹患患者解析では,8.1 mM(145 mg/dL)未満,8.1-9.1 mM(145-164 mg/dL),9.1-10.3 mM(164-185 mg/dL),10.4 mM(186 mg/dL)以上の4群において,各郡間に院内死亡率とICU死亡率に差を認めていない。しかし,同一患者内の血糖値の標準偏差においては1.7 mM(30.6 mg/dL)未満と2.5-3.5 mM(45-63 mg/dL)においてのみ院内死亡率とICU死亡率に統計学的有意差を認めている。このように,糖尿病罹患患者では,急性期管理における血糖値変動の少なさが予後を改善する可能性が示唆される。
2003年4月から2005年6月までにドイツの18施設の大学病院ICUで検討されたVISEPトライアル(the Efficacy of Volume Substitution and Insulin Therapy in Severe Sepsis trial)11)では,APACHE IIスコア20レベルの重症敗血症患者群を対象に,血糖値を110 mg/dLレベルで管理するintensive insulin therapy群(n=247)と,180 mg/dLレベルで管理するconventional therapy群(n=290)が比較された。これらの患者群には,両群ともに糖尿病罹患患者を約30%含んでいるのが特徴である。ICU初日の投与カロリーは600 kcalレベル,第2病日で900 kcalレベルであり,経腸栄養が初病日より約40%の比率で併用されている。このような群間比較において,intensive insulin therapy群の28日死亡率は24.7%,conventional therapy群の28日死亡率は26.0%であり,intensive insulin therapy群に死亡率減少傾向を認めるものの有意差は認められていない。このVISEPトライアル11)では,intensive insulin therapy群で17%の低血糖合併を認め,conventional therapy群の4.1%と比較して,有意に高い低血糖合併の危険性が示唆された。このように,VISEPトライアル11)は,糖尿病群を個別解析していないことが特徴である一方で,intensive insulin therapyによる低血糖合併の危険性を提示している。
続く

















