講座 救急・集中治療領域における抗菌薬使用の留意点
名古屋大学大学院医学系研究科
救急・集中治療医学分野
松田直之
【1】重症患者における抗菌薬投与で気を付けること
1. PK/PDの変化
感染症を伴う重症症例は,重症敗血症として臓器障害や血管内皮細胞傷害を併発した病態となりやすく,抗微生物薬の投与においては,ドレナージを含めた感染源の除去と迅速かつ適切な抗菌薬治療を念頭におきます。また,重症病態の制酸剤としてプロトンポンプ阻害薬を併用している場合には,十二指腸に存在する菌の口腔内や気道,また,ベッドサイドへの移動に注意が必要となります。このような状況において,ショックを合併している際には,循環と組織還流の低下により抗微生物薬の組織移行性が低下している可能性が高まり,十分な投与量を必要あします。抗菌薬,抗真菌薬,抗ウイルス薬などの抗微生物薬の使用にあたっては,薬物動態(PK:pharmacokinetics)と薬力学(PD:pharmacodynamics)を重症病態に合わせて考慮するようにしています。重症敗血症などの重症患者では,血流分布異常や血管透過性亢進などにより水溶性の抗微生物薬の分布容積(Vd)が増大する一方で,腎機能低下により水溶性抗微生物薬のクリアランス(CL)が低下するため,PK/PDが変化していることにも注意します(図1)。また,脂溶性薬物では,分布容積は脂肪の異化により減少傾向を示し,さらに肝機能低下により血中濃度が高まる可能性があります。このように,肝腎機能の評価の下で,水溶性か脂溶性の種類によって,抗微生物薬のPK/PDを評価しています(表1)。
メモ 分布容積とクリアランス
薬物の排出半減期(T1/2)は,分布容積とクリアランスで決定でき,次の式であらわされる。
T1/2=(0.693×Vd)/CL
分布容積が増えれば排出半減期は延長し,クリアランスが増加すれば排泄半減期は短縮する。
2. De-escalation
敗血症における治療には,起炎菌の同定を前提として,抗菌薬の適正使用を意識することが不可欠です。抗菌薬投与を始める前に,まず細胞培養検査を2セット提出し,敗血症診断の1時間以内に,広域の抗菌薬の投与を開始するのが一般的です。抗菌薬は,細菌培養検査結果に基づいて狭域スペクトルの抗菌薬へ変更するという「de-escalation:ディ・エスカレーション」が重症病態の感染症の治療的抗菌薬投与の基本です。その上で,さらにPK/PDを考慮して,抗菌薬の特性を最大に引き出すように工夫します。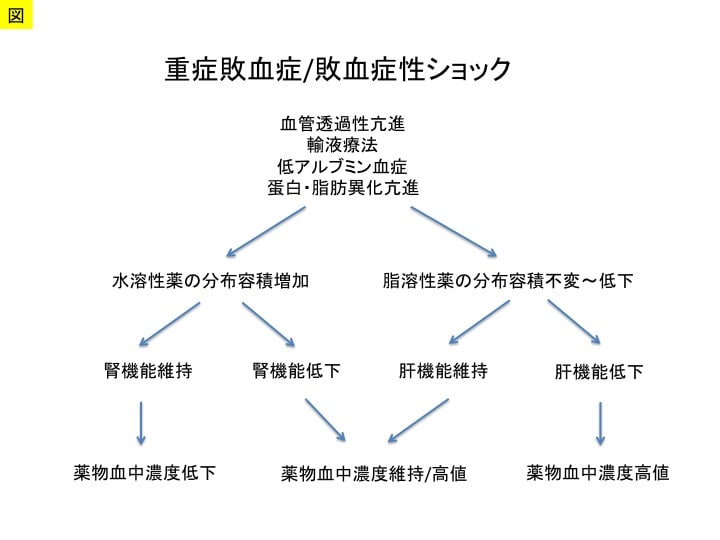

【2】重症病態における腎機能を考える
1. 感染症における腎傷害
感染症管理に難じていると,尿量が低下してくる傾向があります。これにより,水溶性薬剤の排泄量は減少しますが,輸液量増加による分布容積増加を同時に評価するようにします。このような感染病態では,初期にToll-like受容体(TLR)を介して,tumor necrosis factor-α(TNF-α)やinterleukin-1β(IL-1β)などの炎症性サイトカイン,IL-8などのケモカインや接着分子の転写段階からの産生が高まり,炎症局所だけではなくTLR,TNF受容体などの炎症性受容体の存在する細胞近傍に,好中球などの白血球系細胞が集積するようになります1)。組織因子の産生を介してトロンビンの産生が高まり,トロンビン受容体を持つ血管内皮細胞では細胞障害や血小板沈着が進行します。糸球体の有窓性血管内皮細胞も感染症における炎症のターゲットであり,さらに尿細管障害を合併するようになります。 このような重症化を抑制するために,適切な輸液管理や循環管理が不可欠となります。
2. 腎機能維持のための輸液と血圧管理
利尿を得るためには,適切な輸液と血圧管理が必要です。感染症初期の血圧は,腎血流の自動調節の下限である平均血圧65 mmHg以上を維持することが大切ですし,血管拡張に伴うショックを併発している場合はノルエピネフリン(> 0.05μg/kg/分)の持続投与が有効です。輸液はearly goal-directed therapy(EGDT)2)に準じる必要がありませんが,その中では平均血圧65 mmHg以上を目標とし,尿量0.5 mL/kg/時以上を維持できるように,ノルエピネフリンと並行して行うとよいです。ヘモグロビン濃度は,心血管系合併症のない場合には最低でも7g/dL以上,心血管系合併症のある場合は10 g/dL以上を目標とし,赤血球輸血を併用するのが一般的です。このような状況において,フロセミドを頻回に用いて利尿を得ることは望ましくありません。フロセミドは尿量が得られ,循環が安定化した後の炎症の回復期において循環血液量を減少させる目的で使用する場合があります。
3. 腎機能低下時の抗菌薬の使用方法
重症患者では,初期には血管拡張に伴う血流分布異常や血管透過性亢進のために,水溶性の抗微生物薬では分布容積が増加するため,水溶抗菌薬は初期に十分量を投与する必要があります。腎機能障害が軽度であれば,重症患者の腎血流量は輸液や血管作動薬の影響により増加している場合が多く,クリアランスが増加し,水溶性抗菌薬の排泄が亢進している可能性があります。重症患者では,血清クレアチニン濃度が正常でもクレアチニンクリアランスが上昇している場合があることが明らかとされています3)。この場合,腎排泄性薬剤のクリアランスが上昇し,半減期が短縮する可能性があります。重症患者では,クレアチニンクリアランスを指標として水溶性抗菌薬の投与量を適切に調節することができます4)。
【追記 コメント】 腎機能低下でもクリアランスが変わらないことがあるのでしょうか?
腎機能によって投与量を調節しなくてよい抗微生物薬があります。代表的なものは,アジスロマイシン,クリンダマイシン,セフトリアキソン,リネゾリド,アンフォテリシンB,ミカファンギン,ボリコナゾールです。また,ピペラシリンは,腎機能低下時に胆汁排泄が増加し,クリアランスが維持されることが知られています。ペニシリン系薬などのβ-ラクタム系薬が腎障害を起こす場合は,アレルギー性間質性腎炎を特徴としており,この可能性がある場合は減量ではなく,中止とします。また,キノロン系薬であるシプロフロキサシンは,腎機能が低下しても腸管クリアランスが増加し,クリアランスが低下しにくい可能性があります。
4. 維持透析中の患者ではどうしますか?
持続濾過透析を併用し,腎機能を代償する。持続濾過透析を併用した際の,抗菌薬使用量5)は表2を参考とするとよいですが,施設により持続濾過透析の方法が異なるために,PK/PDに対しての独自のデータを持つことが期待されます。一時的に,尿量が減少し,持続濾過透析を併用している場合は患者の腎機能に相当する抗菌薬量を追加します。
【3】重症病態における肝機能を考える
1. 重症病態における肝機能を維持するためには?
抗微生物薬の副作用として,肝障害をきたす症例は消化器障害に次いで多く,トランスアミラーゼ(AST,ALT),アルカリフォスファターゼ(ALP),ビリルビンの血中濃度上昇で評価します。βーラクタム系薬の使用でみられるAST,AST,ALPの上昇した際の肝機能障害は過敏反応が主体であり,用量調節ではなく,中止や変更が必要です。また,抗微生物薬による肝障害は,一般に胆汁うっ滞型を呈する場合が多く,ASTやALTの上昇に比べてALPなどの胆道系酵素の上昇が特徴となりやすいです。抗微生物薬による薬疹症例では,肝機能異常が生じやすいことにも注意します。
2. 肝機能低下における脂溶性薬物のクリアランス低下
レボフロキサシン,パズフロキサシンなどのキノロン系,アジスロマイシンなどのマクロライド系,クリンダマイシンなどのリンコマイシン系抗菌薬,ミカファンギン,キャスポファンギンなどのキャンディン系抗真菌薬,メトロニダゾール,スルファメトキサゾールなどは脂溶性抗微生物薬であり,肝機能低下時にクリアランスが低下する可能性があります。用量調節に注意します。
3. 重症病態における低アルブミン血症の影響を考えましょう
重症患者の急性期では,蛋白異化亢進,血管透過性亢進,肝機能低下の影響により,血中アルブミン濃度が低下しやすい特徴があります。抗微生物薬を含めた多くの薬物の分布容積とクリアランスは,タンパク結合率に影響を受けることに注意します。私が注意しているアルブミンとの結合率の高い抗菌薬は,セフトリアキソン(約95%),テイコプラニン(約90%),ダプトマイシン(約90%),イトラコナゾール(約99%)です。蛋白結合率の高い薬剤は,総じて重度の低アルブミン血症(Alb<2.2 mg/dL)において血中濃度が増加しやすいことになります。集中治療領域でよくde-escalationで使用するセフトリアキソンは,低アルブミン血症の際には,1日1回の投与量を3分割して投与するとよいのかもしれません。セフトリアキソン(注射用セフトリアキソンナトリウム水和物)は,1バイアルが0.5 gと1 gですので0.5 gを1日3回投与にするなどの方法があります。一方,タンパク結合率が低いメロペネム(約2%)などは,低アルブミン血症に血中濃度が影響されにくいため,腎機能が維持されている際には分布容積増大に対して増量する必要があることに注意しています。
【4】多剤耐性菌への対策と治療
1. 薬剤耐性菌に対する注意
重症患者は,好中球やリンパ球などの白血球の機能低下を特徴とします。このような免疫低下病態では,2次性侵害刺激として院内感染を合併しやすく,敗血症として全身性炎症が再燃する傾向があります。現在,院内感染の起炎菌として,メチシリン耐性黄色ブドウ球菌(MRSA: Methicillin-resistant Staphylococcus aureus),基質特異性拡張型βラクタマーゼ(ESBL: extended-spectrum β-lactamase)産生菌,バンコマイシン耐性腸球菌(VRE: Vancomycin Resistant Enterococci),多剤耐性緑膿菌(MDRP: multi-drug resistant Pseudomonas aeruginosa),そして多剤耐性アシネトバクター(MDRA: multi-drug resistant Acinetobacter baumannii)やNew Delli Metallo-β-Lactamase-1(NDM-1)産生腸球菌などに注意が必要です。
Klebsiella pneumoniae や Escherichia coli など菌種は,β-ラクタマーゼ産生遺伝子を突然変位させ,ESBLを産生することにより,β-ラクタム系抗菌薬のβ-ラクタム構造を加水分解する能力があります。このようなESBLは第三世代セフェム系抗菌薬を分解するものとして知られてきましたが,ESBLは伝達性プラスミドでコードされるため,同一菌種間だけではなく,異なる菌種間にも伝達される特徴に注意します。ESBL産生菌はK.pneumoniae,E.coliに加えてSerratia marcessense,Enterobacter cloacae,Proteus mirabirisなどの菌種に拡大しています。また, NDM-1産生腸球菌やKlebsiella pneumoniaecar bapenemase(KPC)産生肺炎桿菌は,免疫低下病態に対する日和見感染だけではなく,健常成人にも発症する。NDM-1やKPCは,カルバペネム系薬を分解するばかりではなく,キノロン系薬やアミノグリコシド系抗菌薬にも薬剤耐性を示す可能性があります。
一方,バンコマイシンに耐性を獲得したVREが検出されています。VREに対する抗菌薬としてリネゾリドが本邦でも臨床使用されていますが,リネゾリドはMRSAにも抗菌活性を持つためにMRSA治療にも用いられています。しかし,2008年には,スペインでリネゾリド耐性MRSA(LRSA: Linezolid-resistant Staphylococcus aureus)が院内感染の原因菌となり,本邦におけるリネゾリド使用に対してもより一層の注意が必要とされています。
このような多くの多剤耐性菌に対する対応の背景の中で,MDRPの管理に注意します。2008年以降,本邦でも,アモキシシリンおよびクラブラン酸,第3セフェム系,キノロン系,カルバペネム系,アミノグリコシド系などの抗菌薬に耐性を獲得したMDRAが院内感染の起炎菌として注意喚起されました。
2. 多剤耐性グラム陰性菌に対する治療
カルバペネム系,フルオロキノロン系,アミノグリコシド系のすべての抗菌薬に感受性が認められない場合,多剤耐性菌と定義されます。このうち,MDRPやMDRAに対して,アンピシリン/スルバクタムが効果的となる可能性があります。カルバペネムに耐性を持つMDRPやMDRAの検討では,アンピシリンではなく,スルバクタムをカルバペネムに併用することに有効性が認められています。このような観点より,アンピシリン/スルバクタムをカルバペネム系抗菌薬に併用する治療が,MDRPやMDRAに効果を示す可能性に留意します。
一方,多剤耐性菌はポリミキシン感受性を維持する傾向があり,ポリミキシンBやコリスチン(ポリミキシンE)が有効となる可能性があります。しかし,コリスチンは,日本で開発されましたが,吸入で用いると急性肺傷害,さらに静脈内投与で用いても容量依存性に腎毒性や神経毒性など臓器毒性に注意が必要とされました。また,チゲサイクリンにもMDRPやMDRAにおける感受性がありますが,使用動向の評価が必要となります。
以上のように現状としては,MDRPやMDRAの治療には,カルバペネム系抗菌薬とアンピシリン/スルバクタムを併用療法があります。その上で,コリスチンやチゲサイクリンの日本での導入が期待されていますが,MDRPやMDRAや薬剤耐性菌に対する新しい抗菌薬の開発・治験が進んでいます。
文 献
1. 松田直之. 敗血症の病態生理学. Intensivist 2009;1:203-16.
Lipman J, Gous AG, Mathivha LR, et al, Ciprofloxacin pharmacokinetic profiles in paediatric sepsis: How much ciprofloxacin is enough? Intensive Care Med 2002; 28:493–500
2. Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001;345:1368-77.
3. Lipman J, Gous AG, Mathivha LR, et al. Ciprofloxacin pharmacokinetic profiles in paediatric sepsis: How much ciprofloxacin is enough? Intensive Care Med 2002; 28:493–500.
4. Herrera-Gutierrez ME, Seller-Perez G, Banderas-Bravo E, et al. Replacement of 24-h creatinine
clearance by 2-h creatinine clearance in intensive care unit patients: A single-center study. Intensive Care Med 2007; 33:1900–6.
5. Trotman RL, Williamson JC, Shoemaker DM, et al. Antibiotic dosing in critically ill adult patients receiving continuous renal replacement therapy. Clin Infect Dis 2005;41:1159-66.